Известия РАН. Серия биологическая, 2023, № 2, стр. 198-210
Размерная структура (размерно-таксономические и размерно-трофические спектры) одноклеточного планктона гипертрофного водоема
М. В. Уманская 1, С. В. Быкова 1, *, Н. Г. Тарасова 1
1 Самарский федеральный исследовательский центр РАН, Институт экологии Волжского бассейна РАН
445003 Самарская обл., Тольятти, ул. Комзина, 10, Россия
* E-mail: svbykova514@gmail.com
Поступила в редакцию 14.01.2022
После доработки 15.02.2022
Принята к публикации 16.02.2022
- EDN: HJXAGN
- DOI: 10.31857/S102634702270010X
Аннотация
Представлены результаты анализа размерных спектров одноклеточного планктона (бактерии, водоросли, инфузории) в пресноводном гипертрофном городском озере (оз. Большое Васильевское, Тольятти, Россия). В сезонном цикле выделены два основных типа размерных спектров. Нанопланктонный максимум, образованный преимущественно фототрофными цианобактериями и зелеными водорослями, регистрируется в период открытой воды; максимум/максимумы пикопланктона (преимущественно гетеротрофные бактерии) и повышенная доля микропланктона (гетеротрофные и миксотрофные инфузории) – в подледный период. Особенностью исследуемого озера, в отличие от менее продуктивных, является стабильность размерной структуры планктона на протяжении последних 25 лет.
Известно, что состояние водных экосистем во всем мире ухудшается вследствие техногенных изменений (Vitousek et al., 1997; Wetzel, 2001). Кроме того, в условиях глобального изменения климата (Brohan et al., 2006) происходит увеличение продуктивности водных экосистем, выражающееся в эвтрофировании пресных водоемов и переходе их в состояние гиперпродуктивности (Moss et al., 2011; O’neil et al., 2012). Таксономическая принадлежность и размер организмов одноклеточного планктона являются важнейшими показателями при анализе особенностей структуры и функционирования водных экосистем. С размерами клеток напрямую связан тип трофической стратегии тех или иных планктонных организмов (Chakraborty et al., 2017). Поскольку размер организмов часто рассматривается как “главный признак” для их описания (Litchman, Klausmeier, 2008; Andersen et al., 2016), то анализ их размерного спектра является одним из существенных инструментов, позволяющих охарактеризовать планктонное сообщество целиком, выявить определенные особенности его развития и провести анализ пространственно-временных изменений водных экосистем. Наиболее эффективным является комплексный подход, заключающийся в одновременном анализе размерного, таксономического и трофического спектров планктонного сообщества или его отдельных компонентов (Kamenir et al., 2006; Chakraborty et al., 2017).
В большинстве исследований размерного спектра проводят анализ преимущественно фитопланктона, реже вместе с зоопланктоном (Kamenir, Morabito, 2009; Kamenir, 2017; Chakraborty et al., 2017). Крайне редко предметом подобного исследования становится бактериопланктон (Кузнецова и др., 2020). Однако, без учета бактерио- и протозоопланктона, анализ состояния пресноводных экосистем и, тем более, создание моделей структуры планктонных сообществ (Banas, 2011; Ward et al., 2012) будет недостаточно полным. Изучение размерных спектров одноклеточного планктонного сообщества в условиях глобального изменения климата и вызываемого им эвтрофирования пресноводных экосистем (Moss et al., 2011; O’neil et al., 2012) приобретает особое значение и будет весьма полезно как для анализа особенностей их развития, так и для прогнозирования изменений в состоянии водных экосистем.
Цель работы – исследовать размерно-таксономическую и размерно-трофическую структуру одноклеточного планктонного сообщества в высокопродуктивном водоеме и оценить ее изменения в кратко- и долгосрочной перспективе.
МАТЕРИАЛЫ И МЕТОДЫ
В озере Большое Васильевское (г. Тольятти, Самарская обл., Россия) в июне–октябре 1991 г. и в мае 1992 г. пробы воды отбирали на всей акватории, как описано в работах (Жариков и др., 2009; Иватин, 2012). С июня 2013 г. по ноябрь 2014 г. пробы воды отбирали из поверхностного слоя воды на мелководных (ст. 1, (53.548873; 49.545014) и ст. 2 (53.543506; 49.529179)) и глубоководных (ст. 3 (53.536907; 49.519969)) участках озера. В 2013 г. были проанализированы пробы, взятые на мелководных и глубоководной станциях, а в 2014 г. – только на глубоководной станции. Для анализа размерно-таксономической и размерно-трофической структуры одноклеточного планктона оз. Б. Васильевское были использованы опубликованные данные о количественном развитии фитопланктона, бактериопланктона и инфузорий оз. Б. Васильевское (Жариков и др., 2009; Иватин, 2012; Кривина, 2018; Кривина, Тарасова, 2019; Шерышева и др., 2021), а также ранее не публиковавшиеся данные авторов о развитии планктонных инфузорий и бактериопланктона в 2014 г.
Все клетки исследованных компонентов одноклеточного планктона (фитопланктон, включая пикофитопланктон, гетеротрофный бактериопланктон и инфузории) были разделены на несколько размерных классов в зависимости от их объема, как было описано ранее (Уманская, 2004). Размерные классы были сформированы путем удвоения объема клеток; в наименьший размерный класс входят клетки объемом 0.001563–0.003125 мкм3 (LgV: –2.81… –2.51, включая минимальный объем). В табл. 1 приведены нижние границы классовых интервалов и таксоны, входящие в соответствующий класс; границы между пико-, нано- и микропланктоном проведены в соответствии с работами (Sieburth et al., 1978; Kamenir et al., 2006). Для анализа размерной структуры сообщества учитывали вклад клеток каждого класса в суммарную биомассу. Для анализа размерно-таксономической и размерно-трофической структуры сообщества раздельно учитывали вклады клеток различных таксономических групп и групп с разными трофическими стратегиями в каждом размерном классе.
Таблица 1.
Параметры размерных классов: минимальный объем класса (V, мкм3), его логарифм (LgV) и входящие в него таксоны
| Класс | V | LgV | Таксон | Класс | V | LgV | Таксон |
|---|---|---|---|---|---|---|---|
| 1 | 0.001563 | –2.81 | HB | 16 | 51 | 1.71 | Cy; Cr; Chl; Bc |
| 2 | 0.003125 | –2.51 | HB | 17 | 102 | 2.01 | Cy; Eu; Chl; Bc |
| 3 | 0.00625 | –2.20 | HB | 18 | 205 | 2.31 | Cil; Cy; Cr; Chl; Bc |
| 4 | 0.0125 | –1.90 | HB | 19 | 410 | 2.61 | Cil; X; Eu; Cr; Chl; Chr; Bc |
| 5 | 0.025 | –1.60 | HB | 20 | 819 | 2.91 | Cil; Eu; Chl; Chr; Bc |
| 6 | 0.05 | –1.30 | HB; Cy | 21 | 1638 | 3.21 | Cil; Cr; Eu; Chl; Bc |
| 7 | 0.1 | –1.00 | HB; Cy | 22 | 3277 | 3.52 | Cil; Cr; D; Eu; Chl; Bc |
| 8 | 0.2 | –0.70 | HB; Cy | 23 | 6554 | 3.82 | Cil; Cr; D; Eu; Bc |
| 9 | 0.4 | –0.40 | HB; Cy | 24 | 13 107 | 4.12 | Cil; D; Chl; Bc |
| 10 | 0.8 | –0.10 | HB; Cy | 25 | 26 214 | 4.42 | Cil; X; Bc |
| 11 | 1.6 | 0.20 | HB; Cy; Chl | 26 | 52 429 | 4.72 | Cil; Eu |
| 12 | 3.2 | 0.51 | HB; Cy; Chl | 27 | 104 858 | 5.02 | Cil |
| 13 | 6.4 | 0.81 | HB; Cy; Chl | 28 | 209 715 | 5.32 | Cil |
| 14 | 12.8 | 1.11 | HB; Cy; Chl | 29 | 419 430 | 5.62 | Cil |
| 15 | 25.6 | 1.41 | Cy; Chl | 30 | 838 861 | 5.92 | – |
При анализе многолетних изменений структуры планктона для более корректного сравнения все клетки гетеротрофных бактерий в 2013/2014 гг. были сведены в один размерный класс, соответствующий среднему объему клеток, поскольку в 1991 г. размерную структуру бактериопланктона не определяли и есть данные только о среднем объеме клеток (Иватин, 2012).
Статистический анализ проводили в стандартных программах Statistica 12, Excel 2017, SigmaPlot 12.5, Canoco for Windows v. 4.51.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Общая характеристика оз. Б. Васильевское. Озеро расположено в лесостепной зоне на северо-восточной границе г. Тольятти (Самарская обл., Россия) и представляет собой вытянутый в меридиональном направлении водоем, площадью 72.5 га. Большая часть акватории мелководна с глубинами ~1–1.5 м, в южной части глубина достигает 3.5–4 м. В течение большей части XX в. наблюдений за состоянием озера не проводили, однако, по крайней мере, с начала 1990-х гг. и до настоящего времени, для экосистемы озера характерны низкая прозрачность воды, щелочная pH и высокое содержание общего фосфора (табл. 2). За исследованный период в озере увеличилась общая минерализация воды, а ее тип изменился с гидрокарбонатно-кальциевого (1991/1992 гг.) на гидрокарбонатно-натриевый к 2013/2014 гг. (Горбунов и др., 2014; Шерышева и др., 2021). Несмотря на то, что средняя температура воды для безледных периодов практически не изменилась с 1991 г. (табл. 2), в период отбора проб четверть века назад вода максимально прогревалась до 24.3°С, а в 2013/2014 – до 27.5°С. Кроме того, за прошедшие годы в озере выявлено небольшое уменьшение средней прозрачности воды, содержания общего фосфора при стабильной концентрации минерального, и более чем двукратное увеличение концентрации Хл а (табл. 2). Несмотря на незначительное снижение, концентрация общего фосфора в озере остается высокой и не выходит за пределы значений, характерных для гипертрофных вод. В целом, по совокупности всех показателей трофности, в течение последних 25–30 лет озеро находится в гипертрофном состоянии со слабо выраженной тенденцией к дальнейшему росту продуктивности (Уманская и др., 2018; Шерышева и др., 2021). Обнаруженные изменения физико-химических показателей могут быть, хотя бы отчасти, связаны с процессами глобального изменения климата и их влиянием на водные экосистемы (Rogora et al., 2003; Moss et al., 2011).
Таблица 2.
Среднее значение ± стандартное отклонение некоторых факторов среды в поверхностном слое воды озера в 1991/1992 гг. и в 2013/2014 гг. (по: Номоконова и др., 2001; Горбунов и др., 2017; Уманская и др., 2018; Шерышева и др., 2021; с изменениями)
| Показатель | 2013/2014 | Безледные периоды (V–X) | ||||
|---|---|---|---|---|---|---|
| весна (IV–V) |
лето VI–IX |
осень X–XI |
зима II–III |
2013/2014 | 1991/1992 | |
| T, °С | 16.7 ± 6.5 | 22.8 ± 2.5 | 7.0 ± 3.3 | 0.6 ± 0.3 | 20.7 | 20.8 |
| Прозрачность, м | 0.55 ± 0.06 | 0.20 ± 0.05 | 0.47 ± 0.21 | отс. | 0.24 | 0.35 |
| pH | 9.08 ± 0.37 | 9.5 ± 0.83 | 9.0 ± 0.58 | 7.1 ± 0.1 | 9.6 | 9.1 |
| О2, мг/л | 7.89 ± 0.54 | 10.47 ± 2.31 | 13.86 ± 7.95 | 0.01 ± 0.02 | 11.1 | 9.6 |
| Σ ионов, мг/л | 373 ± 31 | 374 ± 140 | 393 ± 30 | 418 ± 9 | 385 | 209 |
| Pобщ, мкгР/л | 132 ± 85.1 | 371 ± 114 | 199 ± 47.5 | 64.6 ± 9.1 | 334 | 451 |
| Хл а, мкг/л | 101 ± 55.0 | 234 ± 111 | 107 ± 14.7 | 18.2 ± 5.2 | 176 | 85.9 |
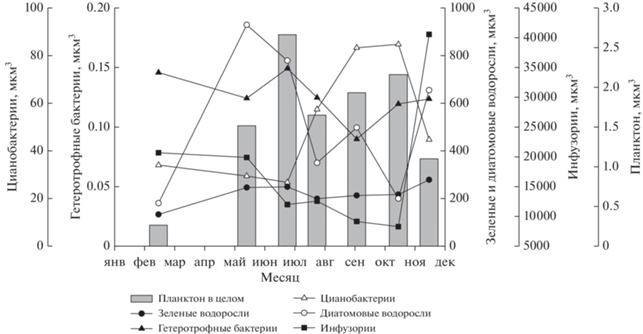
Общая характеристика одноклеточного планктона в 2013/2014 гг. Биомасса одноклеточного планктона в целом и его отдельных компонентов в поверхностном слое оз. Б. Васильевское в 2013–2014 гг. изменялась в широких пределах (табл. 3). Минимальные значения общей биомассы (1.4 мг/л) были зафиксированы в подледный период, а максимальные (32.9 мг/л) – в сентябре 2013 г. В течение всего периода открытой воды основу биомассы одноклеточного планктонного сообщества в озере формировали цианобактерии и зеленые водоросли, тогда как в подледный период – гетеротрофные бактерии и цианобактерии (табл. 3).
Таблица 3.
Средняя биомасса (± стандартное отклонение, мг/л) компонентов одноклеточного планктонного сообщества оз. Б. Васильевское (2013/2014 гг.)
| Группы | Весна | Лето | Осень | Зима |
|---|---|---|---|---|
| Гетеротрофные бактерии | 1.4 ± 0.3 | 1.6 ± 0.7 | 0.8 ± 0.2 | 0.8 ± 0.4 |
| Пикофитопланктон | 0.3 ± 0.2 | 0.3 ± 0.1 | 0.08 ± 0.06 | 0.12 ± 0.10 |
| Цианобактерии | 1.71 ± 0.48 | 17.1 ± 5.2 | 3.63 ± 2.91 | 0.45 ± 0.57 |
| Зеленые водоросли | 4.4 ± 2.2 | 4.6 ± 3.2 | 3.98 ± 0.95 | 0.11 ± 0.04 |
| Диатомовые водоросли | 2.6 ± 0.8 | 2.1 ± 1.3 | 0.86 ± 0.45 | 0.02 ± 0.01 |
| Прочие водоросли | 2.1 ± 0.5 | 0.9 ± 0.6 | 0.67 ± 0.41 | 0.16 ± 0.2 |
| Инфузории | 0.48 ± 0.15 | 0.054 ± 0.053 | 0.067 ± 0.065 | 0.08 ± 0.01 |
| Планктон в целом | 12.6 ± 3.9 | 26.5 ± 4.0 | 10.1 ± 3.1 | 2.0 ± 0.8 |
В отличие от абсолютных значений биомассы, доли отдельных групп в общей биомассе точнее характеризует структуру и позволяют проводить сравнение сообществ, поскольку не зависят от общего количественного развития всего планктона. Кроме того, поддаются учету “минорные” компоненты планктона. Поэтому в основе размерных спектров лежат вклады (доли) отдельных компонентов одноклеточного планктона.
Почти все характеристики организмов, особенности структуры и функционирования их сообществ, начиная от молекулярного, клеточного и общеорганизменного уровня до экологического и эволюционного, коррелирует с размерами тела. С размерами напрямую связаны такие физиологические свойства организмов планктона, как диффузионное поглощение растворенных неорганических питательных веществ, эффективность фотосинтеза, скорость метаболизма, биотические взаимоотношения и т.д. (Brown et al., 2007; Chakraborty et al., 2017).
Одноклеточный планктон сильно вариабелен в размерном отношении, а объемы клеток различных таксономических и функциональных групп планктона, хотя и перекрываются между собой, но в целом довольно существенно различаются (Sieburth et al., 1978; Andersen et al., 2016; Кузнецова и др., 2020 и др.). В оз. Б. Васильевское в 2013/2014 гг. индивидуальные размеры клеток гетеротрофных бактерий изменялись в пределах 0.001–25.6 мкм3 (1–14 классы), цианобактерий – 0.05–409.6 мкм3 (6–18 классы), эукариотических водорослей – 6.4 мкм3 – 1.05 × 105 мкм3 (13–26 классы), инфузорий 204.8 мкм3 – 8.39 × 105 мкм3 (18–29 классы) (табл. 1). Средние объемы клеток различных групп планктона являются важной размерной характеристикой сообществ. Данный показатель (средний объем клетки в планктонном сообществе) и его сезонные изменения косвенно отражают видовые структурные перестройки внутри отдельных групп: так, крупноклеточные виды диатомовых развивались в основном весной, цианобактерий – осенью, а инфузорий – поздней осенью и зимой (рис. 1).
Размерно-таксономический спектр одноклеточного планктона: сезонные изменения. В литературе много примеров исследования размерно-таксономической структуры, в основном, фитопланктона (Kamenir et al., 2004, 2006; Kamenir, Morabito, 2009; Chakraborty et al., 2017; Kamenir, 2017; Zohary et al., 2021 и др.). С другой стороны, начинают появляться работы по размерной структуре, затрагивающие сразу все планктонное сообщество, но только в морских экосистемах (Zaraus et al., 2009; Ward et al., 2012; Anderson et al., 2016; Lampe et al., 2021). Оценив сразу несколько компонентов пресноводного одноклеточного планктона (водоросли, бактерии и инфузории) и, соответственно, расширив размерный диапазон от пико- до микропланктонной области, мы получили более подробную и полную характеристику его размерной структуры. Поскольку фитопланктон играет определяющую роль в суммарной биомассе исследованного нами гипертрофного озера (табл. 3), полученные нами размерные спектры вполне можно сравнивать с таковыми, полученными для фитопланктона в других пресных водоемах (Kamenir et al., 2004, 2006; Kamenir, Morabito, 2009; Chakraborty et al., 2017; Kamenir, 2017).
В оз. Б. Васильевское в летне-осенний период размерные спектры планктона на всех станциях очень близки и практически не зависят от глубины станции (рис. 2). Основной вклад в биомассу в этот период вносят клетки нанопланктона, причем главный максимум все время находится в области 16–18 классов (рис. 2), а разные даты отличаются только соотношением величин основного и минорных пиков.
Рис. 2.
Сезонные изменения размерно-таксономической структуры (по биомассе) одноклеточного планктонного сообщества в глубоководном (а) и мелководном (б) участках озера в 2013/2014 гг. На врезках: структура микропланктонной фракции. Обозначения: п – пико-, н – нано-, м – микропланктонная фракция.
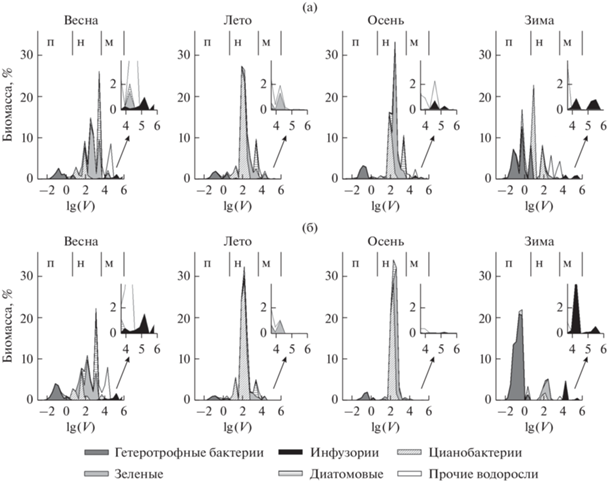
Летом главный максимум регистрируется в области 16–17 классов (рис. 2; номера классов см. табл. 1). Его основу составляют цианобактерии, чей вклад в течение лета увеличивается от 42 до 73% общей биомассы планктона. При этом на долю двух колониальных видов, Microcystis aeruginosa (Kütz.) Kütz. и Microcystis wesenbergii Komarek (Cyanobacteria: Chroococcales) приходится 41 ± 15% общей биомассы. Также здесь велика доля Chlorophyta (Scenedesmus acuminatus (Lagerh.) Chod., Scenedesmus quadricauda (Turp.) Bréb., Oocystis borgei Snow, Golenkinia radiata Chod.), хотя их суммарный вклад снижается с 21% в июне до 12% в сентябре. Второй по величине пик в наноразмерной фракции (21 класс) формируется в основном за счет Bacillariophyta (Cyclotella meneghiniana Kütz., Stephanodiscus hantzschii Grun.) и Chlorophyta (Scenedesmus magnus Meyen, Chlamydomonas simplex Pasсh., Pediastrum duplex Meyen, Geminellopsis fragilis Korsch.). Вклад микропланктонной фракции также снижается к концу лета (рис. 2), а ее основу составляют представители Streptophyta (Staurastrum gracile Ralfs., Staurastrum chaetoceros (Schrod.) G.M. Smith).
Осенью главный максимум несколько смещается в сторону 17–18 класса (рис. 2) и до 42% возрастает вклад Chlorophyta, среди которых преобладают следующие виды: S. quadricauda, Scenedesmus protuberans Fritsch, G. radiata. При этом вклад цианобактерий составляет 27.6%, в том числе 23.8% – два вида M. aeruginosa и M. wesenbergii (Chroococcales) и 3.8% – нитчатые Anabaenopsis elenkinii V. Miller (Nostocales) и Geitlerinema amphibium (Ag. ex Gom.) Anag. (Oscillatoriales). В крупноклеточной части размерного спектра (21 класс) преобладают Bacillariophyta (C. meneghiniana), которые формируют довольно выраженный пик в ноябре (рис. 1, 2). В микропланктонной области (рис. 2) осенью основной вклад вносят Cryptophyta (Cryptomonas borealis Skuja), Euglenophyta (Euglena spp.), Dinophyta (Peridiniopsis oculatum (Stein) Bourrelly) и Ciliata (Linostomella vorticella (Ehrenberg, 1833) Aescht, 1999, Phascolodon vorticella Stein, 1859, Pelagovorticella natans (Faure-Fremiet, 1924) Jankowski, 1985, Coleps hirtus viridis Ehrenberg, 1831).
В подледный период размерно-таксономический спектр заметно меняется, а различия между глубоководной (рис. 2а) и мелководной (рис. 2б) частями озера весьма существенны. Пикопланктонный максимум (максимумы) на мелководной станции образованы гетеротрофными бактериями (6–9 классы, рис. 2б), а на глубоководной к ним добавляются пикоцианобактерии (12–13 классы, на границе между пико- и нанопланктоном) (рис. 2а). В наноразмерной фракции спектра на мелководной станции преобладают Chlorophyta (Scenedesmus falcatus Chod., S. quadricauda, Scenedesmus spinosus Chod.), а на глубоководной – цианобактерии (M. aeruginosa, Planktolyngbia limnetica (Lemmermann) Komárková-Legnerová et Cronberg, Aphanizomenon flos-aquae (L.) Ralfs) и Cryptophyta (Cryptomonas erosa Ehr., Cryptomonas ovata Ehr.). В микропланктонной фракции на всей акватории доминируют инфузории – 5.8% общей биомассы планктона на мелководье и 2.5% – на глубоководной станции (рис. 2). На мелководье на долю Coleps hirtus и C. hirtus viridis приходится 4.7% биомассы, на глубоководной станции вклад этих видов уменьшается до 0.8%, и преобладание переходит к другим видам: Frontonia leucas (Ehrenberg, 1833) Ehrenberg, 1838 и Pelagothrix plancticola Foissner, Berger & Schaumburg, 1999 (1.3%).
Весной основной пик биомассы снова смещается в сторону наноразмерной области спектра (21 класс), дополнительные пики образуют клетки 16 и 18 классов (рис. 2). Основу нанопланктонной фракции составляют Chlorophyta (38.5% общей биомассы планктона, 14–21 классы, преимущественно Oocystis spp., Scenedesmus spp., Nephrochlamys spp., Tetraedron spp.) с заметным вкладом Bacillariophyta (19.5%, 16–21 классы, Stephanodiscus hantzschii, Cyclotella spp., Synedra spp., Fragilaria atomus Hust.). Доля цианобактерий невелика (13%), причем, в отличие от осени, вклады нитчатых (P. limnetica, Aph. flos-aquae) и Chrooccocales (M. aeruginosa) сравнимы. Меньший по величине пик зарегистрирован в микропланктонной области (25 класс). Здесь основной вклад вносят Dinophyta (около 11%, Sphaerodinium cinctum (Her.) Wolosz. и Gymnodinium lacustre Schill. in Rabenh.), Bacillariophyta (Actinocyclus normanii (Greg.) Hust.) и инфузории (Nassula sp., Epistylis procumbens Zacharias, 1897, Monodinium balbiani Fabre-Domergue, 1888). Кроме того, доминирование какого-либо размерного класса менее выражено, по сравнению с летне-осенним периодом.
В целом, размерно-таксономическая структура на всей акватории более гетерогенна в подледный период (средние величины индекса разнообразия Шеннона Hb = 3.74; индекса выравненности Пиелу Eb = 0.80), по сравнению с периодом открытой воды (Hb = 3.16; Eb = 0.66). При этом наибольшая гетерогенность наблюдается на глубоководной станции (Hb = 3.60; Eb = 0.51). Соответствующие величины на мелководной станции составляют Hb = 2.30 и Eb = 0.78.
Таким образом, сезонные различия структуры одноклеточного планктона в основном проявляются при сравнении двух “полярных” периодов: периода открытой воды и подледного периода. Так, в течение практически всего безледного периода на всей акватории озера Б. Васильевское в размерной структуре одноклеточного планктона преобладали клетки нанопланктона, с выраженным доминированием цианобактерий, причем размерно-таксономические спектры практически идентичны на всей акватории озера и не зависят от глубины станции. В подледный период основной максимум размерного спектра смещался в пикопланктонную область (преимущественно гетеротрофные бактерии), с одновременным увеличением доли микропланктона (инфузории) (рис. 1, 2). В подледный период пространственная гетерогенность размерных спектров выражена намного сильнее. В целом, в исследованном нами гипертрофном оз. Б. Васильевское наибольший вклад в суммарную биомассу вносят клетки тех же (или близких) размерных групп, что и в пресноводных озерах разного уровня трофности: морфометрии и химического состава (Kamenir et. al., 2006; Kamenir, 2017; Chakraborty et al., 2017; Zohary et al., 2021 и др.).
Размерно-трофический спектр. Основные физиологические свойства планктонных организмов (поглощение питательных веществ, эффективность фотосинтеза, скорость погружения и т.д.) напрямую зависят от их размеров. Поэтому, тип трофической стратегии планктонных организмов – автотрофия, гетеротрофия, миксотрофия – во многом определяется размерными характеристиками организма, а не только концентрацией доступных ресурсов (Chakraborty et al., 2017). В оз. Б. Васильевское в период открытой воды в 2013/14 гг. (табл. 4.) гетеротрофы составляют только 6.9% суммарной биомассы планктона и представлены в основном бактериями (6.3%, 3–14 размерные классы, с максимумом – 6–8 классы), с очень небольшим вкладом инфузорий (0.6%, 20–29 классы, пики в 25 и 27 классах), преимущественно крупных колоний E. procumbens. Фотоавтотрофные водоросли составляют 83% суммарной биомассы планктона, причем 80% относятся к нанопланктонной фракции (табл. 4). Фото-осмотрофные виды фитопланктона представлены, преимущественно, цианобактериями (5.2% общей биомассы; 13–16 классы) и зелеными водорослями (0.8%; 16–21 классы). Фото-фаготрофные виды водорослей составляют 5.1% (17–29 классы), причем среди них преобладают Dynophyta, Cryptophyta, Chrysophyta (в сумме дают 3.9%, 17–26 классы). Миксотрофные инфузории (в данном исследовании условно включены в фотоавто-фаготрофную группу) слабо развиваются в этот период, и их вклад составляет всего 0.1% суммарной биомассы планктона (23–29 классы).
Таблица 4.
Трофическая структура разных размерных фракций планктона в 2013 и 2014 гг.
| Размерная группа | Трофическая стратегия | Доля общей биомассы планктона (%) | |
|---|---|---|---|
| период открытой воды | подледный период | ||
| 2013/14 гг. | 2014 г. | ||
| Пико- | Гетеротрофный | 6.3 | 52.4 |
| Фото-осмотрофный | 0 | 0 | |
| Фото-фаготрофный | 0 | 0 | |
| Фотоавтотрофный | 1.8 | 7.4 | |
| Нано- | Гетеротрофный | 0.1 | 0.04 |
| Фотоавто-осмотрофный | 6.0 | 14.8 | |
| Фотоавто-фаготрофный | 2.1 | 8.0 | |
| Фотоавтотрофный | 80.1 | 13.7 | |
| Микро- | Гетеротрофный | 0.5 | 1.6 |
| Фотоавто-осмотрофный | 0 | 0 | |
| Фотоавто-фаготрофный | 1.8 | 2.0 | |
| Фотоавтотрофный | 1.1 | 0 | |
В подледный период в условиях пониженных освещенности и температуры, дефицита кислорода и т.д., как и следовало ожидать, соотношение клеток с различными трофическими стратегиями существенно изменилось (табл. 2–4). Вклад гетеротрофных бактерий вырос с 7% до 54% общей биомассы планктона (табл. 4), при этом с 0.2 до 5% увеличился вклад крупной фракции гетеротрофных бактерий (12–13 классы). В эту фракцию входят Lampropedia hyalina (Ehrenberg 1832) Schroeter 1886 и Planctomyces bekefii Gimesi 1924, которые хотя и регистрируются в течение всего года, но наиболее интенсивно развиваются в подледный период. Также увеличилась доля осмотрофных цианобактерий (до 14.8%; 13–16 классы), фаготрофных водорослей (8%, 17–22 классы) и миксотрофных инфузорий (2%, 24–28 классы). В целом, вклад фотоавтотрофных водорослей в суммарную биомассу планктона снизился в подледный период почти в 4 раза, по сравнению с периодом открытой воды. Особенно заметно это снижение в наноразмерной фракции, однако, одновременно с этим существенно возрос вклад фототрофного пикопланктона (табл. 4).
Полученные результаты до некоторой степени соответствуют литературным данным. В общем, в эвтрофных условиях, характеризующихся высоким обилием питательных веществ и достаточно невысоким из-за затенения уровнем освещенности преимущество получают мелкие фотоавтотрофы (Chakraborty et al., 2017). Фотоавтотрофия является оптимальной трофической стратегией для клеток пико- и, преимущественно, нано-размерных фракций, как в нашем случае летом (табл. 4). При возникновении неблагоприятных условий по какому-либо параметру преимущество получают миксотрофные организмы, гетеротрофы и фаготрофы (хищники) (Chakraborty et al., 2017). Гетеротрофы могут быть как мелкими (в нашем случае – бактерии), так и крупными (в нашем случае, инфузории).
Размерная структура в пространстве факторов среды. Использование кластерного анализа (метод Варда, расстояние Хеллингера) позволило четко выделить подледный кластер и группу кластеров открытой воды. В последней группе отделяется позднеосенний кластер, две группы летних кластеров и весенний (рис. 3а). Ординация планктонного сообщества на основе его размерной структуры методом главных компонент также подтверждает его относительную пространственную однородность в период открытой воды (рис. 3б). Результаты ординации показали, что первая главная компонента объясняет 72% вариабельности размерной структуры в исследованном гипертрофном водоеме, вторая и третья – 9 и 7% соответственно (рис. 3б). Можно предположить, что первая главная компонента отражает комплекс таких факторов, как температура, освещенность и кислородное насыщение; вторая главная компонента – комплекс факторов, так или иначе связанных с трофностью водоема: прозрачность, содержание общего фосфора, Хл а. Это подтверждается и расположением станций в пространстве факторов при каноническом анализе ССА (рис. 3в). Из-за относительно небольшого диапазона изменений всех исследованных нами абиотических факторов оказалось невозможно выявить наиболее значимые из них. Тем не менее, вполне очевидно, что сообщества в феврале отделились от других сообществ по вектору температуры, содержания кислорода, и, отчасти, фосфора (рис. 3в). Все остальные сообщества выстроились по вектору минерализации и векторам, отражающим трофическое состояние водоема (Хл а, фосфор и прозрачность). Подобные, но более четко выраженные зависимости размерной структуры планктона и его отдельных компонентов от факторов среды (температура, световой режим, концентрация фосфора и некоторые другие) выявлены и в менее продуктивных водоемах (Kamenir et al., 2006; Banas, 2011; Ward et al., 2012; Rasconi et al., 2015; Zohary et al., 2021 и др.).
Рис. 3.
Дендрограмма различий размерной структуры планктонного сообщества оз. Б. Васильевское в 2013–2014 гг. (а) и результаты ординации размерной структуры методом главных компонент (б) и канонического анализа (в). Обозначения: S – прозрачность, м; Mineral – минерализация, мг/л; Т – температура, °С; Ox – содержание кислорода, мг/л; Pt – общий фосфор, мкгР/л; Chl a – Хл а, мкг/л; арабскими цифрами обозначены месяцы отбора проб; римскими – станции; * – пробы 2014 г.

По-видимому, в исследованном гипертрофном водоеме важные экологические факторы (температура, освещенность, газовый режим и т.д.) и их сочетания меняются в узком диапазоне на всем протяжении периода открытой воды и, очевидно, клетки только определенных размерных классов, независимо от их таксономической принадлежности (рис. 2), получают максимальное экологическое преимущество. При резкой смене жизненных условий (резкое снижение температуры, освещенности, концентрации кислорода и т.д.) (Zohary et al., 2021), что в нашем случае происходит после установления ледового покрова, размерно-таксономическая структура планктонного сообщества резко меняется (рис. 1–3).
Многолетние изменения структуры планктона озера. Суммарная биомасса одноклеточного планктона за прошедшие 25 лет увеличилась в 1.2 раза с 16.5 до 20.3 мг/л. Основу ee в оба периода составлял фитопланктон, но к 2013/2014 гг. его биомасса увеличилась в 1.6 раза, тогда как биомасса бактерий, напротив, уменьшилась в 2.6 раза (рис. 4а). В общей структуре планктона наиболее заметно увеличилась роль цианобактерий за счет снижения вклада гетеротрофных бактерий. Вклад эукариотических водорослей остался прежним. Среди эукариот наиболее выраженным было увеличение на порядок как биомассы инфузорий, так и ее доли в общей биомассе.
Рис. 4.
Макротаксономический состав одноклеточного планктона (а) и его размерный спектр (б) в безледные периоды 1991/1992 и 2013/2014 гг.

Подобное увеличение биомассы цианобактерий (как в абсолютных, так и в относительных величинах) было отмечено и в ряде озер Нидерландов, сходных с оз. Б. Васильевское по морфологии и уровню продуктивности (Mooij et al., 2005). Авторы высказывают предположение, что подобное изменение может быть вызвано региональными факторами, но может быть и следствием процессов глобального изменения климата.
Основной нанопланктонный максимум биомассы в оба периода формировали цианобактерии и зеленые водоросли 16–18 классов (рис. 4б, 5а). Основу данного максимума составляли хроококковые цианобактерии (Chroococcales), с выраженным доминированием M. aeruginosa и M. wesenbergii. Заметное увеличение вклада Chroococcales в суммарную биомассу в 2013/2014 гг. (40.1%), по сравнению с 1991/1992 гг. (26.8%) (рис. 5а), произошло почти исключительно за счет M. wesenbergii (3.7% в 1991/1992 и 17% 2013/2014 гг.), при этом M. aeruginosa в оба периода формировал 20% биомассы. Кроме хроококковых, в этот максимум входили и нитчатые цианобактерии, которые формировали около 16% суммарной биомассы планктона в оба периода (рис. 5а). В 1991/1992 гг. среди нитчатых цианобактерий преобладали Aph. flos-aquae (5%), Anabaena flos-aquae (2.9%) и A. planctonica Brunnth. (3.2%), размеры клеток которых соответствовали 16–18 классам. В 2013/2014 гг. состав преобладающих видов несколько изменился – Anabaenopsis elenkinii (3.4%, 17 класс) и A. flos-aquae (3.5%, 18 класс), Phormidium molle f. tenue (3.1%, 14 класс) и P. limnetica (1.3%, 14 класс). Таким образом, в 2013/2014 гг. наблюдалось более четкое разделение крупно- и мелкоклеточных фракций нитчатых цианобактерий с заметным увеличением доли мелкоклеточной фракции, по сравнению с 1991/92 гг. (рис. 5а).
Рис. 5.
Размерно-твксономическая (а) и размерно-трофическая (б) структуры планктона в 1991/1992 и 2013/2014 гг.

Пик биомассы на границе нано- и микропланктона, соответствующий 21–22 классам и сформированный преимущественно диатомовыми водорослями (с доминированием нескольких видов родов Cyclotella и Stephanodiscus), практически не изменился за прошедшие 25 лет (рис. 4б, 5а).
Вклад гетеротрофных бактерий в суммарную биомассу планктона снизился с 20 до 6.5%, а положение пика сместилось от 7 к 6 классу (рис. 4а, 5а). Возможно, действительно за прошедшие годы произошло некоторое “измельчание” бактериальных клеток в озере, при остающейся относительно стабильной численности. Однако нельзя исключать и того, что выявленные различия (хотя бы до некоторой степени) являются артефактом и объясняются различными методами анализа бактерий в разные годы (с использованием DAPI (наши данные) в 2013/2014 гг. и карболового эритрозина (Иватин, 2012) в 1991/1992 гг.). Напротив, вклад инфузорий в суммарную биомассу увеличился более чем в 2 раза, и их размерная структура стала более разнообразной, а размерный диапазон расширился (рис. 5а). Однако средний вес особи в сообществе инфузорий уменьшился из-за увеличения вклада видов мелких размерных классов. Возможно, частично это связано с недоучетом мелких инфузорий в пробах конца 20 века, но полностью произошедшие изменения не объясняет.
Распределение организмов планктона с разными трофическими стратегиями по размерных фракциям в период открытой воды тоже в целом сохранилось (рис. 5б). В настоящее время, как и четверть века назад, в планктоне оз. Б. Васильевское преобладают фотоавтотрофы. Однако вклад их в суммарную биомассу сообщества увеличился на 15% (с 74 до 89%), в то время как вклад гетеротрофов и миксотрофов снизился (с 20 до 7% и с 5.8 до 4% соответственно). При этом в составе гетеротрофов появились клетки микропланктонной фракции (8% суммарной биомассы) (колониальные инфузории), а в составе фотоавтотрофов, напротив, вклад крупных (микропланктонных) клеток уменьшился (с 8.6 до 2.3%). В целом, характер распределения организмов разных стратегий по размерным фракциям сохранился: биомасса пикопланктона на 99% в 1991/1992 гг. и 91% в 2013/2014 гг. состоит из гетеротрофных организмов (бактерии), биомасса нанопланктона – соответственно, на 90 и 96% из фотоавтотрофных (цианобактерии, зеленые и диатомовые водоросли), а биомасса микропланктона – на 88 и 82% из организмов с миксотрофной стратегией (инфузории, криптофитовые и динофитовые водоросли).
В целом, несмотря на изменения таксономического состава планктона за более чем 25-летний период, его размерный спектр остался почти неизменным (рис. 4б) с очень незначительными отличиями: уменьшился вклад клеток пико- и микропланктонной фракций и увеличился вклад клеток нанопланктонной фракции. Об этом свидетельствует и средний объем клетки в сообществе: он практически не изменился: 1.9 мкм3 – в 1991/1992 гг. и 2.0 мкм3 – в 2013/2014 гг., что косвенно подтверждает относительную многолетнюю стабильность размерной структуры одноклеточного планктона в гипертрофном озере, несмотря на таксономические и трофические различия (рис. 5). Возможно, малая вариабельность размерной структуры одноклеточного планктона и есть особенность стабильно гипертрофных водоемов с отсутствием резких и сильных изменений факторов на протяжении многих лет, что отличает их сообщества от таковых в менее продуктивных водоемах (Zohary et al., 2021; Rasconi et al., 2015).
На фоне практически стабильной размерной структуры планктона произошли незначительные видовые перестройки: в 2013/2014 гг. снизился вклад гетеротрофных бактерий и вырос вклад цианобактерий; в состав доминирующих видов вошли виды рр. Phormidium и Planktolyngbia, которые ранее, в 1991/1992 г., были минорными; в составе доминирующего комплекса инфузорий появились мелкие скутикоцилиаты рр. Cyclidium, Cinetochilum и Ctedoctema, предпочитающие повышенное содержание органических веществ. Вполне вероятно, что все эти изменения отражают продолжающийся процесс эвтрофирования оз. Б. Васильевское. Но, возможно, они укладываются в пределы межгодовых и сезонных варьирований размерного спектра. То, как практически идентично накладываются друг на друга размерные спектры в 1991/1992 и 2013/2014 гг. (рис. 4б), свидетельствует в пользу того, что уже довольно продолжительное время экосистема стабильно и устойчиво находится на уровне высокоэвтрофного водоема, переходя лишь из весенне-летне-осеннего состояния в зимнее (подледное) и обратно. И, вероятно, требуется значительное изменение условий для перевода ее на другой уровень.
ЗАКЛЮЧЕНИЕ
Таким образом, в гипертрофных условиях (при продолжающемся незначительном увеличении трофности), в которых водоем находится, как минимум четверть века, формируется стабильный размерно-таксономический и размерно-трофический комплекс планктонных организмов, и для значимых изменений в нем необходимо очень резкое изменений экологического состояния. Вероятно, на уровне планктонного сообщества в целом, существует компенсаторный механизм, при котором происходит “заполнение” определенной размерной фракции разными таксономическими группами. В сезонном цикле выделены два основных типа размерных спектров. Нанопланктонный максимум, образованный преимущественно фототрофными цианобактериями и зелеными водорослями, регистрируется в период открытой воды; максимум/максимумы пикопланктона (преимущественно гетеротрофные бактерии) и повышенная доля микропланктона (гетеротрофные и миксотрофные инфузории) – в подледный период. Продолжающиеся увеличение внутренней и внешней биогенной нагрузки, рост уровня продуктивности и изменения видового состава одноклеточного планктона на данном этапе развития экосистемы озера недостаточны для существенного изменения его размерного спектра. Полученные нами данные по размерно-таксономической структуре одноклеточного планктона могут быть использованы для создания моделей функционирования и прогноза состояния пресноводных экосистем, а также экологического менеджмента и управления природными ресурсами.
Благодарности. Авторы выражают признательность всем коллегам, принимавшим участие в отборе проб, обсуждении данной рукописи и отдельно – Кривиной Е.С. за обработку части проб фитопланктона озера.
Финансирование. Работа выполнена в рамках государственного задания по теме №122032500063-0.
Список литературы
Горбунов М.Ю., Уманская М.В., Краснова Е.С. Современное экологическое состояние озера Большое Васильевское // Известия СНЦ РАН. 2014. Т. 16. № 1. С. 183–187.
Горбунов М.Ю., Уманская М.В., Краснова Е.С. Современное экологическое состояние некоторых пригородных озер системы Васильевских озер. г. Тольятти: Гидрохимический режим озер в 2013–2015 гг. // Самарская Лука: проблемы региональной и глобальной экологии. 2017. Т. 26. № 1. С. 28–40.
Жариков В.В., Горбунов М.Ю., Быкова С.В., Уманская М.В., Тарасова Н.Г., Буркова Т.Н., Шерышева Н.Г., Ротарь Ю.М. Протисты и бактерии озер Самарской области. Тольятти: Кассандра. 2009. 240 с.
Иватин А.В. Бактериопланктон и бактериобентос Куйбышевского водохранилища. Тольятти: Кассандра. 2012. 183 с.
Кривина Е.С. Трансформация малых водоемов урбанизированных территорий в условиях изменения антропогенной нагрузки: Дис. … канд. биол. наук. Тольятти. 2018. 186 с.
Кривина Е.С., Тарасова Н.Г. Фитопланктон малых естественных водоемов антропогенно трансформированного ландшафта Самарской области: флористический состав, показатели количественного развития и структурные характеристики. Свидетельство о регистрации БД RU № 2019620111. 18.01.2019. Заявка № 2018621953 от 26.12.2018.
Кузнецова Е.В., Косолапов Д.Б., Косолапова Н.Г. Таксономическая и размерно-морфологическая структура бактериопланктона двух водохранилищ Монголии // Изв. РАН. Сер. биол. 2020. №1. С. 22–29.
Номоконова В.И., Выxристюк Л.А., Тарасова Н.Г. Трофический статус Васильевскиx озер в окрестностяx г. Тольятти // Известия СамНЦ РАН. 2001. Т. 3. № 2. С. 274–283.
Уманская М.В. Экологические особенности развития бактериопланктона малых эвтрофных озер Самарской Луки: Дис. … канд. биол. наук. Тольятти. 2004. 148 с.
Уманская М.В., Горбунов М.Ю., Краснова Е.С., Жариков В.В. Трофический статус некоторых пригородных озер г. Тольятти (Васильевские озера) в 2013–2015 гг. // Самарская лука: проблемы региональной и глобальной экологии. 2018. Т. 27. № 2. С. 183–188.
Шерышева Н.Г., Уманская М.В., Быкова С.В., Горбунов М.Ю., Тарасова Н.Г., Кривина Е.С., Мухортова О.В., Краснова Е.С. Экологическое состояние урбанизированного высокопродуктивного водоема (озеро Большое Васильевское). Тольятти: Анна. 2021. 187 с.
Andersen K.H., Berge T., Goncalves R.J., Hartvig M., Heuschele J., Hylander S., Jacobsen N.S., Lindemann C., Martens E.A., Neuheimer A.B., Olsson K., Palacz A., Prowe F., Sainmont J., Traving S.J., Visser A.W., Wadhwa N., Kiørboe T. Characteristic sizes of life in the oceans, from bacteria to whales // Ann. Rev. Marine Sci. 2016. V. 8. № 3. P. 1–25.
Banas N.S. Adding complex trophic interactions to a size-spectral plankton model: Emergent diversity patterns and limits on predictability // Ecol. Modelling. 2011. V. 222. P. 2663–2675.
Brohan P., Kennedy J.J., Harris I., Tett S.F., Jones P.D. Uncertainty estimates in regional and global observed temperature changes: A new data set from 1850 // J. Geophys. Res.: Atmospheres. 2006. V. 111. № D12.
Brown J.H., Allen A.P., Gillooly J.F. The metabolic theory of ecology and the role of body size in marine and freshwater ecosystems // Body size: the structure and function of aquatic ecosystems. Cambridge: University Press. 2007. P. 1–15.
Chakraborty S., Nielsen L.T., Andersen K.H. Trophic strategies of unicellular plankton // Amer. Naturalist. 2017. V. 189. № 4. P. 77–90.
Kamenir Y. The living whirl self-maintenance of stable size structure patterns of aquatic communities // Int. J. Environ.rotection. 2017. V. 7. Iss. 1. P. 46–52
Kamenir Y., Dubinsky Z., Zohary T. Phytoplankton size structure stability in a meso-eutrophic subtropical lake // Hydrobiologia. 2004. V. 520. № 1. C. 89–104.
Kamenir Y., Dubinsky Z., Zohary T. The long-term patterns of phytoplankton taxonomic size-structure and their sensitivity to perturbation: A Lake Kinneret case study // Aquat. Sci. 2006. V. 68. P. 490–501.
Kamenir Y., Morabito G. Lago Maggiore oligotrophication as seen from the long-term evolution of its phytoplankton taxonomic size structure // J. Limnology. 2009. V. 68. № 1. C. 146–161.
Lampe V., Nöthig E.-M., Schartau M. Spatio-temporal variations in community size structure of arctic protist plankton in the Fram Strait // Front. Mar. Sci. 2021. V. 7. P. 579880.
Litchman E., Klausmeier C.A. Trait-based community ecology of phytoplankton // Ann. Rev, of Ecology, Evolution, and Systematics. 2008. V. 39. P. 615–639.
Mooij W.M., lsmann S.H., De Senerpont Domis L.N., Nolet B.A., P.L.E. Bodelier. Boers P.C.M., Pires L.M.D., Gons H.J., Ibelings B.W., Noordhuis R., Portielje R., Wolfstein K., Lammens E.H.R.R. The impact of climate change on lakes in the Netherlands: a review // Aquatic Ecology. 2005. V. 39. P. 381–400.
Moss B., Kosten S., Meerhoff V., Battarbee R.W., Jeppesen E., Mazzeo N., Karl Havens. Lacerot G., Liu Z., De Meester L., Paerl H., Scheffer M. Allied attack: climate change and eutrophication // Inland Waters. 2011. V.1. № 2. P. 101–105.
O’neil J.M., Davis T.W., Burford M.A., Gobler C.J. The rise of harmful cyanobacteria blooms: the potential roles of eutrophication and climate change // Harmful algae. 2012. V. 14. P. 313–334.
Rasconi S., Gall A., Winter K., Kainz M.J. Increasing water temperature triggers dominance of small freshwater plankton // PLoS ONE. 2015. V. 10. № 10. P. e0140449.
Rogora M., Mosello R., Arisci S. The effect of climate warming on the hydrochemistry of alpine lakes // Water. Air. and Soil Pollution. 2003. V. 148. №. 1. P. 347–361.
Sieburth J.M., Smetacec V., Lenz J. Pelagic ecosystem structure: heterotrophic compartments and their relationship to plankton size fractions // Limnol. Oceanogr. 1978. V. 23. P. 1256–1263.
Vitousek P.M., Mooney H.A., Lubchenco J., Melillo J.M. Human domination of earth’s ecosystems // Science 1997. V. 277. P. 494–499.
Ward B.A., Dutkiewicz S., Jahn O., Follows M.J. A size-structured foodweb model for the global ocean // Limnology and Oceanography. 2012. V. 57. P. 1877–1891.
Wetzel R.G. Limnology: Lake and River Ecosystems. 3rd Edition. San Diego: Academic Press. 2001. 1006 p.
Zarauz L., Irigoien X., Fernandes J.A. Changes in plankton size structure and composition, during the generation of a phytoplankton bloom, in the central Cantabrian Sea // J. plankton research. 2009. V. 31. № 2. P. 193–207.
Zohary T., Flaim G., Sommer U. Temperature and the size of freshwater phytoplankton // Hydrobiologia. 2021. V. 848. P. 143–155.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая