Известия РАН. Серия физическая, 2019, T. 83, № 12, стр. 1664-1669
Исследование смещения антистоксовой полосы в спектрах ВРМБ-усиления в коллоидных растворах, содержащих патогенные организмы и наночастицы
Т. Ю. Могильная 1, 2, *, В. И. Томилин 2, А. Г. Ботиков 3
1 Общество с ограниченной ответственностью “СЭРВЭТ”
Москва, Россия
2 Федеральное государственное бюджетное образовательное учреждение высшего образования
“Московский авиационный институт (национальный исследовательский университет)”
Москва, Россия
3 Федеральное государственное бюджетное учреждение “Национальный исследовательский центр эпидемиологии
и микробиологии имени почeтного академика Н.Ф. Гамалеи” Министерства здравоохранения
Российской Федерации
Москва, Россия
* E-mail: mogilnay@mail.ru
Поступила в редакцию 20.06.2019
После доработки 20.07.2019
Принята к публикации 27.08.2019
Аннотация
Рассматривается возможность разработки ВРМБ-метода для определения концентраций наноструктур, для которых информацию о составе несет распределение антистоксовой составляющей спектра. Проведены экспериментальные исследования динамики спектров взвеси вакцинных штаммов E. coli и спектров биологических структур. Проведены оценочные расчеты и экспериментально подобраны интенсивности излучения накачки, при которой логарифм интенсивности антистоксовой составляющей вплоть до концентраций 106 микробных клеток · мл–1 является гладкой возрастающей функцией концентрации.
ВВЕДЕНИЕ
Разработанный ранее метод, основанный на исследованиях спектров молекулярного рассеяния света, дает возможность определять наличие патогенных микроорганизмов и наночастиц в коллоидных растворах, в т.ч. в воде, спирте, моче и т.д. [1]. Методика распознания патогенных микроорганизмов основана на сравнении эталонных параметров с параметрами образца в пределах погрешности с достоверностью, определяемой критерием Стьюдента и Фишера. Коллоидный раствор, содержащий ДНК или наночастицы серебра и золота подвергается воздействию лазерного излучения с близкой к порогу ВРМБ мощностью. За счет разрыва связи в случае ДНК, либо за счет дополнительной поверхностной энергии в случае наночастиц, возникает люминесценция, которая имеет ту же степень поляризации и когерентности что и возбуждающее лазерное излучение. Это приводит к увеличению общей плотности излучения, превышению порога и, как следствие, появлению в спектре составляющих, соответствующих исследуемым объектам. Интенсивность этих составляющих является функцией концентрации исследуемого объекта, а смещение максимума лоренцевой составляющей зависит только от длины волны возбуждающего лазерного излучения и типа объекта [2].
В случае наличия нескольких нанообъектов (например, смеси вирусов или вирусов с наносеребром и т.п.) в спектре появляется несколько отдельных распределений интенсивности, причем, в каждом из них отчетливо выделяется пик, интенсивность которого в максимуме является функцией концентрации. Если объект не дает дополнительной люминесценции, то он не дает также и дополнительного пика в общем спектральном распределении [3]. Подобные спектральные распределения дают возможность разработки достаточно простых алгоритмов для диагностики наличия исследуемых объектов в коллоидных растворах и, как следствие, появляется возможность создания автоматических приборов для определения их наличия даже в потоке, например, воды [4].
Часто возникает необходимость определять не только наличие, но и концентрацию веществ. В случае малых концентраций и для достаточно простых веществ, например, вирусов (гепатит С, грипп А, Б и т.д.), разработка алгоритма определения этого параметра не представляет трудностей и была успешно реализована в [4], поскольку в спектре наблюдается стоксова или антистоксова компонента в виде одиночного пика. Известно [3], что спектр усиления ВРМБ является линейной функцией гауссовой и лоренцевой составляющих, при этом если гауссова составляющая представляет в основном шум, то для построения оценочной кривой интенсивности используется логарифм максимума лоренцевой составляющей, выделенной из спектрального распределения стоксовой или антистоксовой компоненты. Лоренцеву составляющую спектра выделяли в программном пакете “Origin”.
Для стоксовых компонент интенсивность в максимуме является линейной или гладкой функцией концентрации данного вещества и увеличивается с увеличением концентрации. При увеличении концентрации выше определенного значения, интенсивность составляющей начинает уменьшаться и наблюдается смещение пика в противоположную область (стоксову, если он до этого был в антистоксовой, или в антистоксову, если он до этого обнаруживался в стоксовой. Именно это ограничивает применение метода и возможность создания автоматизированного определения данного параметра [4].
Для вирусов (гепатит С, грипп А, Б и т.д.) или отдельных наночастиц равномерное увеличение интенсивности стоксовой составляющей спектра происходит вплоть до концентрации 106 мк/мл. При увеличении концентрации до 109 мк/мл интенсивность начинает уменьшаться [4], однако, столь высокие концентрации патогенов хорошо диагностируются другими методами. Для более сложных систем патогенных организмов, таких как, например Е. coli, золотистый стафилококк, нанокластеры серебра, наномаркеры, раковые клететки и т.д., спектральные распределения имеют более сложный характер. Часто переход спектрального распределения в антистоксову область осуществляется уже при концентрации 101–102 микробных клеток · мл–1 (м. к./мл) или наблюдается только антистоксова составляющая. Обычно можно выделить частоту интенсивности логарифма, которая является линейной функцией исследуемого вещества, однако, с ростом интенсивности возбуждающего излучения эта зависимость перестает быть гладкой и автоматизированное определение концентрации становится проблематичным. Поэтому для расширения возможностей метода представляет интерес как теоретическое исследование динамики процесса поведения антистоксовой области, так и экспериментальное определение спектральных параметров от параметров возбуждающего излучения.
МАТЕРИАЛЫ И МЕТОДЫ
Схема установки для проведения экспериментальных исследований приведена в работе [1]. Дополнительно варьировали мощность источника излучения. Для исследования были выбраны лазеры с длинами волн 810 нм и 1017 нм. В качестве объектов исследования были выбраны взвеси вакцинных штаммов E. coli и Shigella flexneri с контрольными концентрациями: от 102 –109 м. к./мл. Штаммы микроорганизмов выращивали на твердых питательных средах (агаре Хоттингера, рН 7.2) 48 ч при температуре 37°С. Бактериальные взвеси клеток готовили в 2 мл 0.9% раствора хлорида натрия по отраслевому стандартному образцу мутности – 10МЕ, что соответствует 109 м. к./мл E. coli и Sh. flexneri. Затем готовили разведения взвесей в дистиллированной воде начиная с 108 м. к./мл до конечной концентрации 102 м. к./мл. Количество клеток в приготовленных разведенных растворах проверяли путем высева 0.1 мл микробной взвеси каждого тест-штамма из разведений 103 м. к./мл на соответствующие плотные питательные среды. Через 48 ч инкубации в термостате при температуре 37 ± 1°С подсчитывали количество колоний выросших на поверхности агара. На агаровых пластинках должно вырасти не менее 30–50 колоний. Также дополнительно исследовали антистоксовы составляющие спектров золотистого стафилококка, клетки Сarcinoma HT29, гепатита С, полученные нами ранее. Поскольку метод основан на диагностике нелинейных эффектов (ВРМБ), связанных с взаимодействием вынужденной люминесценции ДНК под воздействием излучения лазера и самого лазерного излучения, то для идентификации были выбраны следующие типовые параметры: количество максимумов спектральных распределений, соответствующих патогену, разница между интенсивностью лоренцевой составляющей накачки и максимумами интенсивности лоренцевых распределений, выделенных из спектра стоксовой или антистоксовой составляющих спектра ВРМБ, положение относительно лазерной моды (стоксово или антистоксово распределение). Однако эти параметры являются статическими и их недостаточно для определения концентраций в антистоксовой области. Для измерения концентрации дополнительно исследовали динамический режим основанный на видео-записи спектров и последующем анализе спектральных характеристик.
АНАЛИЗ РЕЗУЛЬТАТОВ
В табл. 1 приведены значения ВРМБ-смещения для некоторых исследуемых нами объектов. Результаты показывают, что некоторых объектов, например, для стафилококка и шигеллы смещение в антистоксовой области больше чем для других, что приводит к улучшению разрешимости метода. Для сравнения приведены данные из работы [6].
Таблица 1.
Смещение частоты в антистоксовой области при рассеянии МБ в водных растворах
| № | Растворенный компонент | Смещение спектра, нм | λвозб, нм |
|---|---|---|---|
| 1 | Вода | 0.1 | 630 |
| 3 | Бензол | 0.2 | 630 |
| 4 | E.coli (живые) | 3.01 | 810 |
| 5 | Золотистый стафилококк | 3.8 | 810 |
| 5 | Гепатит С | 2.5 | 810 |
| 6 | E.coli (инактивированные) | 5.97 | 1017 |
| 7 | Шигелла | 7.0 | 1017 |
| 8 | клетки Сarcinoma HT29 | 5.1 | 1017 |
На рис. 1 представлено типовое распределение интенсивности моды соответствующей ВРМБ для E. coli на частоте центрального максимума (λ = 810 нм) в стоксовой (814.1 нм) и антистоксовой (λ = 806.9 нм) областях. Интенсивность в максимуме моды накачки в водном растворе составляла 12.11 дБм. При этом наблюдали только один пик в стоксовой или антистоксовой области, форма которого была близка к лоренцевой. Неравномерность распределения интенсивности усложняет алгоритм оценки концентрации исследуемого объекта.
Рис. 1.
1 – Зависимость относительного логарифмического распределения интенсивности лоренцевой составляющей ВРМБ от концентрации E. coli на частоте центрального максимума (λс = 806.9 нм) в антистоксовой области (логарифм интенсивности накачки в воде I0 = –12.11 дБм, λ = 810.0 нм); 2 – зависимость относительного логарифмического распределения интенсивности порога ВРМБ от концентрации.

Для определения оптимальной мощности накачки оценим динамику явления. При превышении порога значительная часть интенсивности волны, распространяющейся вперед, и представляющей собой волну накачки ВРМБ, может быть представлена как трехволновое взаимодействие между падающей волной (накачкой), сигнальной волной (стоксовой или мандельштам-бриллюэновской) и звуковой волной [5]. Если мощность накачки не вызывает ВРМБ в растворителе (воде), то сигнальная волна зависит только от параметров исследуемого объекта. В результате такого взаимодействия часть энергии, которая вначале содержится в волне накачки, постепенно преобразуется в сигнальную волну. Рост интенсивности стоксовой (или антистоксовой волны) волны характеризуется коэффициентом усиления при ВРМБ.
(1)
${{g}_{{\text{в}}}}\left( \nu \right) = \frac{{{{{\left( {{{\Delta {{\upsilon }_{{\text{в}}}}} \mathord{\left/ {\vphantom {{\Delta {{\upsilon }_{{\text{в}}}}} 2}} \right. \kern-0em} 2}} \right)}}^{2}}}}{{{{{\left( {\nu - {{\upsilon }_{{\text{в}}}}} \right)}}^{2}} + {{{\left( {{{\Delta {{\upsilon }_{{\text{в}}}}} \mathord{\left/ {\vphantom {{\Delta {{\upsilon }_{{\text{в}}}}} 2}} \right. \kern-0em} 2}} \right)}}^{2}}}}{{g}_{{\text{в}}}}\left( {{{\upsilon }_{{\text{в}}}}} \right),$Пороговые условия ВРМБ [9 ] , при которых эффективная связь термоупругой и электромагнитной волн приводит к возбуждению в среде мощных гиперзвуковых волн, а также компонентов рассеянной волны, приведены в [6]. Поляризация среды $\mu ,$ вызванная изменением давления, равна
(2)
$\mu = \frac{E}{{4\pi }}\left( {\rho \frac{{\partial \varepsilon }}{{\partial \rho }}} \right)\frac{p}{B},$Энергия поля волн накачки и люминесценции в силу когерентности обеих составляющих [5], благодаря электрострикции, питает акустическое поле. И наоборот, изменения поляризации, вызванные упругой волной, могут питать электромагнитную волну. Увеличение мощности электромагнитной волны на единицу объема диэлектрика равно [5]:
(3)
$~E\frac{{d\mu }}{{dt}} = - \frac{1}{{4\pi }}\frac{{\left( {\rho \frac{{\partial \varepsilon }}{{\partial \rho }}} \right)}}{B}E\frac{d}{{dt}}\left( {E\Delta p} \right).$С другой стороны, мощность, передаваемая акустической волне, выражается формулой:
(4)
$ - \frac{{{{\Delta }_{{{\rho }E}}}}}{V}\frac{{dV}}{{dt}} = \frac{{\left( {\rho \frac{{\partial \varepsilon }}{{\partial \rho }}} \right){{E}^{2}}}}{{8\pi B}}\frac{{dp}}{{dt}}.$Для бегущей волны порог возбуждения определяется выражением:
(5)
$\frac{{E_{0}^{2}}}{{~~~8\pi }} \geqslant \frac{{2{{\varepsilon }_{0}}B}}{{{{{\left( {\rho \frac{{\partial \varepsilon }}{{\partial \rho }}} \right)}}^{2}}}}\frac{{{{{\left( {L_{q}^{{ - 1}} + L_{k}^{{ - 1}}} \right)}}^{2}}~~}}{{qk}},$Приравнивая выражения (3) и (4) можно получить условия, при которых начинает спадать интенсивность антистоксовой составляющей. Очевидно, если работать в режимах, близких к рассчитанному, то будет образовываться только один пик и, как следствие, можно применить разработанный нами алгоритм обработки спектров. Данные для расчетов приведены в табл. 2 и 3. Коэффициент усиления определяли для каждой концентрации с использованием экспериментальных значений $\Delta {{\upsilon }_{{\text{в}}}}.$
Таблица 2.
Данные, использованные при расчетах
| Диэлектрик | ρ, г/см3 | n | ${\rho }\frac{{\partial {\varepsilon }}}{{\partial {\rho }}}$ | ${{\upsilon }_{0}},$ м/с | ${{\nu }_{{{\text{МБ}}}}},$ ГГц | ${\tau }{\kern 1pt} {\text{'}} \cdot {{10}^{{10}}}$ c | ${\alpha } \cdot {{10}^{{ - 3}}}$ cм–1 | $g \cdot {{10}^{8}}$ cм/Вт |
|---|---|---|---|---|---|---|---|---|
| Вода | 0.997 | 1.330 | 0.87 | 1486 | 5.69 | – | 8.1 | 0.64 |
| Сероуглерод | 1.262 | 1.616 | 2.37 | 1158 | 5.80 | 22 | 1.6 | 15 |
Таблица 3.
Расчетные параметры
| Диэлектрик | ${\rho }$, г/см3 | ${\rho }\frac{{\partial {\varepsilon }}}{{\partial {\rho }}}$ | n0 | $\beta \cdot {{10}^{{12}}}$ ед. СГС | $\Delta {{{\varepsilon }}_{{{\text{опт}}}}}$ | $\Delta n$ |
|---|---|---|---|---|---|---|
| H2O | 0.997 | 0.82 | 1.334 | 45.7 | 1.02 · 10–6 | 3.82 · 10–7 |
| CS2 | 1.262 | 2.39 | 1.674 | 49.5 | 0.97 · 10–5 | 2.91 · 10–6 |
| C2NG | 0.879 | 1.56 | 1.522 | 52.6 | 1.35 · 10–6 | 0.44 · 10–7 |
На рис. 1 (кривая 2) представлено расчетное распределение для пороговых значений интенсивности. Кривая 2 представляет собой зависимость интенсивности от концентрации при постоянном коэффициенте усиления, рассчитанную для режима, представленного на кривой 1. При этом анализ динамики спектра люминесценции от времени для этого режима показал, что интенсивность люминесценции не стабильна, общее поле иногда падает ниже порогового, что очевидно и приводит к нестабильности коэффициента усиления. С увеличением энергии накачки энергия поля в среде превышает энергию порога ВРМБ.
На рис. 2 представлен типичный спектр антистоксовой составляющей раствора с содержанием вируса E. coli 1057 – 104 м. к./мл для длины волны накачки λ = 810.0 нм, при этом длина волны антистоксовой составляющей в максимуме составляла λc = 806.9 нм, а логарифм интенсивности в максимуме интенсивности при распространении излучения в воде I0 = –3.22 дБм. В антистоксовой составляющей появляется несколько пиков. Интенсивность только одного из них (λc = 806.9 нм) является гладкой функцией концентрации. Очевидно, это можно объяснить появлением дополнительной люминесценции за счет разрыва дополнительных молекулярных связей ДНК, интенсивность которой неустойчива и коэффициент усиления не является постоянной величиной.
Рис. 2.
Типичный спектр антистоксовой составляющей от раствора с содержанием вируса E. coli 1057 – 104 м. к./мл (λ = 810.0 нм, I0 = –3.2 дБм).

Путем расчетов была определена интенсивность накачки (I0 = –8.3 дБм), при которой, с одной стороны, при всех концентрациях объектов антистоксова составляющая представляет собой один пик (рис. 3), с другой стороны, интенсивность является гладкой функцией концентрации. На рис. 4 представлены графики для логарифма интенсивности в максимуме лоренцевской кривой антистоксовой составляющей спектра I0 = = ‒3.2 дБм для чистой воды и для I0 = –8.3 дБм. Кривые 3, 4 показывают уменьшение интенсивности возбуждающего лазерного излучения. Кривая 3 соответствует логарифму интенсивности в максимуме I0 = –3.2 дБм, а кривая 4 – I0 = 8.3 дБм, соответственно. “Избыточное” перераспределение энергии из волны накачки в антистоксову волну приводит к появлению дополнительных максимумов. Таким образом, видно, что рост интенсивности антистоксовой составляющей обусловлен не только увеличением концентраций, но и перекачкой энергии из моды накачки. Исследования показали, что падение интенсивности накачки для всех типов исследуемых патогенов происходили при концентрации 106 м. к./мл, а именно, при этой концентрации перенос энергии из световой волны равняется переносу энергии в акустическую волну.
Рис. 3.
Типичный спектр антистоксовой составляющей от раствора с содержанием вируса E. coli 1057 – 104 м. к./мл (λ = 810.0 нм, I0 = –8.3 дБм).

Рис. 4.
Логарифм интенсивности лоренцевской кривой антистоксовой составляющей спектра от концентрации: 1 – для логарифма интенсивности накачки в воде в максимуме I0 = –3.2 дБм; 2 – I0 = –8.3 дБм.
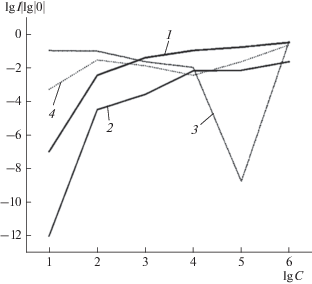
Подобные результаты получены и при длине волны накачки λ = 1017 нм, однако, минимальная концентрация исследуемого объекта становится больше – 102 м. к./мл, что позволяет проводить диагностику на двух длинах волн и таким образом повышает вероятность распознавания.
ВЫВОДЫ
Проведен анализ поведения антистоксовой ВРМБ-составляющей спектра водных растворов, содержащих патогенные организмы. Показано, что рост интенсивности антистоксовой составляющей обусловлен не только увеличением люминесценции концентраций, но и перераспределением энергии из моды накачки. Избыточный перенос энергии приводит к появлению дополнительных максимумов в спектрах изучаемых объектов. Исследования показали, что уменьшение интенсивности лазерного излучения для всех типов исследуемых патогенов происходило при концентрации 106 м. к./мл, т.е. при этой концентрации перенос энергии из световой волны равняется переносу энергии в акустическую, что предъявляет дополнительные требования к параметрам спектроанализатора и программному обеспечению обработки спектров. Можно добиться таких параметров установки, при которых вплоть до значений 106 м. к./мл, интенсивность пика в максимуме является линейной функцией концентрации в антистоксовой области.
Список литературы
Moguilnaya T. Sheryshev A. In the book Poisoning – from specific toxic agents to novel rapid and simplified techniques for analysis. Ch. 10. Zagreb: INTECH, 2017. 173 p.
Moguilnaya T.Yu., Bobkov P.V., Tomilin V.I., Kononenko A.B. // J. Phys. Conf. Ser. 2015. V. 594. Art. № 012026.
Томилин В.И., Могильная Т.Ю. // Вест. МГТУ им. Баумана. Сер. приборостр. 2015. № 2. С. 83.
Жуков Е.А., Самарцев И.Э., Слепов Д.Г. // ЖТФ. 2004. Т. 74. № 7. С. 66.
Агравал Г. Нелинейная волоконная оптика. М.: Мир, 1996. 323 с.
Фабелинский И.Л. Молекулярное рассеяние света. М.: Наука, 1965. 512 с.
Качмарек Ф. Введение в физику лазеров. М.: Мир, 1980. 540 с.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая


