Известия РАН. Серия физическая, 2019, T. 83, № 2, стр. 181-186
Результаты исследований камней желчного пузыря методом рентгеновской микротомографии
В. Е. Асадчиков 1, А. В. Бузмаков 1, И. Г. Дьячкова 1, Д. А. Золотов 1, А. Г. Иванова 1, Ю. С. Кривоносов 1, *, В. В. Пантюшов 2, Р. Г. Сайфутдинов 3, А. Э. Волошин 1
1 Институт кристаллографии им. А.В. Шубникова ФНИЦ “Кристаллография и фотоника” РАН
Москва, Россия
2 Городская клиническая больница № 1 им. Н.И. Пирогова
Москва, Россия
3 Кафедра госпитальной и поликлинической терапии КГМА – филиала ФГБОУ ДПО РМАНПО Минздрава России
Казань, Россия
* E-mail: Yuri.S.Krivonosov@yandex.ru
Аннотация
Представлены результаты исследований in-vitro камней желчного пузыря методом рентгеновской микротомографии с энергией излучения 17.5 кэВ. Результаты восстановления линейных коэффициентов поглощения камней, полученные из эксперимента, сравниваются с расчетом на основе табличных данных для чистого холестерина. Продемонстрирована возможность метода рентгеновской микротомографии в изучении морфологического строения конкрементов. Обнаружены полости и слоистые образования в камнях. Произведено определение фазового состава камней методом порошковой дифракции.
ВВЕДЕНИЕ
В связи с общей тенденций развития органосохраняющих технологий в мировой гастроэнтерологии интенсивно стали применяться методы лечения желчнокаменной болезни (ЖКБ), основанные на растворении камней в желчном пузыре с сохранением его естественной функции как анатомического органа. Это методы пероральной литолитической терапии [1, 2] и контактного химического литолиза (КХЛ) [3]. В медицинской практике метод КХЛ применяется в Германии [4], Италии [5, 6], США [7, 8], Англии [9], Швейцарии [10], Тайване [11, 12], в России [13–17]. Важно отметить, что литолитическими методами можно растворять только холестериновые камни [18]. На сегодняшний день основной проблемой, резко ограничивающей применение литолитических методов лечения ЖКБ, является отсутствие достоверной методики прижизненной диагностики холестериновых камней. В контексте данного вопроса, использование методов рентгеновской томографии для определения типа камней представляется наиболее перспективным.
В настоящей работе нами проводились исследования конкрементов желчного пузыря с целью поиска возможности дифференциации холестериновых камней из анализа данных рентгеновской абсорбционной томографии. Томограммы конкрементов были измерены с использованием монохроматического рентгеновского излучения, что позволило восстановить трехмерное распределение истинного значения линейного коэффициента поглощения μ. Эта величина зависит лишь от плотности изучаемого материала и его химического состава, и для гомогенного объекта может быть получена из соотношения:
(1)
$\mu d = \ln \left( {{{{{I}_{0}}} \mathord{\left/ {\vphantom {{{{I}_{0}}} I}} \right. \kern-0em} I}} \right),$По имеющимся литературным данным в большинстве случаев основной фазой в составе камней желчного пузыря является холестерин (C27H46O, C27H48O2, плотность 1.07 г ⋅ см–3) [19, 20]. Предварительные расчеты показали, что наиболее удобным для измерений будет диапазон энергий рентгеновского излучения от 5 до 30 кэВ, в котором различие поглощений между холестерином и водой меняется от 55 до 22%.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Томограммы конкрементов были измерены на экспериментальном рентгеновском микротомографе, созданном в ФНИЦ “Кристаллография и фотоника” РАН. Принципиальная схема прибора дана на рис. 1. В качестве источника использовалась стандартная рентгеновская трубка с характеристической линией MoKα (энергия 17.5 кэВ), выделяемой монохроматором. Излучение регистрировалось ПЗС-детектором высокого разрешения с размером пикселя 9 мкм. Автоматизация выполнена с помощью программного модуля, установленного на сервере сетевого порта, данная схема позволяет осуществлять удаленное управление томографом, не обращаясь непосредственно к его аппаратным компонентам. Аппаратные модули прибора интегрированы программным образом с системой Tango. Обработка томографических данных проводилась алгебраическим методом реконструкции, что позволило уменьшить дисперсию восстанавливаемого значения линейного коэффициента поглощения [21].
Рис. 1.
Экспериментальный рентгеновский микротомограф. 1 – стандартная рентгеновская трубка; 2 – кристалл-монохроматор; 3 – вакуумный объем; 4 – форвакуумный насос; 5 – координатный стол с гониометрическим устройством для крепления образца; 6 – рентгеновский детектор XIMEA xiRAY11; 7 – биологическая защита; расстояние между монохроматором и образцом 1.2 м; между образцом и детектором – 0.05 м.

Для исследования методом рентгенофазового анализа (РФА) образцы конкрементов желчного пузыря истирались в порошки и наносились на стеклянную кювету. Рентгенограммы были измерены на дифрактометре Rigaku MiniFlex600 (CuKα-излучение, NiKβ-фильтр), оснащенном высокоскоростным детектором D/teX Ultra (Rigaku Corporation, Япония) в угловом диапазоне 2θ = = 3°–90° с шагом сканирования 0.02°. Размер пучка, падающего на образец, задавался горизонтальной и вертикальной щелями: 10 мм и 0.625° соответственно. Рентгенофазовый анализ выполнялся в программе PDXL (Rigaku Corporation, Япония) с использованием базы данных порошковых дифрактограмм ICDD PDF-2 (2014).
Объект исследований
Для исследований были взяты камни желчного пузыря в количестве 23 шт., удаленные у пациентов с желчнокаменной болезнью. Камни GS‑8,9,..16 хранились в желчи непосредственно до начала томографических измерений и были измерены без предварительной просушки. После этого образцы GS-14,15,16, были промыты и просушены в течении 90 ч при температуре 50–60 градусов, и далее эксперимент с ними проводился повторно. Желчные камни GS-7, 23–25 имели исходные размеры 15–20 мм, и для измерений из них были вырезаны секторы размерами 6‒12 мм, охватывающие как центральную часть камня, так и его поверхность. Кроме этого были измерены томограммы желчи и чистой воды.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Фазовый состав желчных камней был определен методом порошковой дифракции. Результаты измерений представлены на рис. 2. и в табл. 1. Основную массу вещества всех конкрементов составляет холестерин, который присутствует в двух кристаллических формах: C27H46O – безводный холестерин (cholesterol anhydrous PDF № 07-0742: a = 14.10 Å, b = 33.75 Å, c = 10.46 Å, α = 94.6°, β = = 90.0°, γ = 95.72° [22]) и C27H48O2 – одноводный холестерин (cholesterol monohydrate: a = 12.39(3) Å, b = 12.41(3) Å, c = 34.36(6) Å, α = 91.9(1)°, β = = 98.1(1)°, γ = 100.8(1)° [23]). Конкременты GS-3, 4, 5, 6 и GS-8, 9,..16 практически полностью состоят из одноводного холестерина, о чем свидетельствует практически полное отсутствие рефлексов в области 2θ = 6°–14° и наличие интенсивных характеристических рефлексов на углах 2θ = 23° и 14.5° Конкременты GS-7, GS-19 и GS‑20, 21, 22 содержат холестерин в двух формах, но в более плотных и темных образцах GS-7 и GS‑19 преобладает безводная форма холестерина. Билирубинат кальция (PDF № 40-1886) имеет наиболее интенсивные пики на углах 2θ = 8.7°, 18.8° (Int = 100), 20.5°, 21.5°, 26.2°, 28.3°.
Рис. 2.
Дифрактограммы конкрементов желчного пузыря. Положения основных рефлексов идентифицированных фаз отмечены пунктирными линиями. Пики карбонатных фаз подписаны как Vtr – ватерит СaCO3, Cal – кальцит СaCO3, Arg – арагонит СaCO3.

Таблица 1.
Данные экспериментальных измерений линейных коэффициентов поглощения (для энергии излучения 17.5 кэВ) и фазового состава камней желчного пузыря
| Образец | Размер камня, мм | Фазовый состав | Подготовка образца | μa, мм–1 |
|---|---|---|---|---|
| BL-1 | Желчь | 0.106 | ||
| W-2 | Вода | 0.103 | ||
| GS-3 | 4–6 | Моногидрат холестерина – C27H48O2 | В физрастворе | 0.051 |
| GS-4 | 4–6 | Моногидрат холестерина – C27H48O2 | В физрастворе | 0.050 |
| GS-5 | 4–6 | Моногидрат холестерина – C27H48O2 | В физрастворе | 0.053 |
| GS-6 | 4–6 | Моногидрат холестерина – C27H48O2 | В физрастворе | 0.049 |
| Безводный холестерин – C27H46O | ||||
| Моногидрат холестерина – C27H48O2 | 0.059 | |||
| GS-7 | 20–26 | Ватерит, Кальцит, Арагонит – CaCO3 | Просушен | (0.37*) |
| GS-8 | 4–7 | Моногидрат холестерина – C27H48O2 | В желчи | 0.073 |
| GS-9 | 4–7 | Моногидрат холестерина – C27H48O2 | В желчи | 0.074 |
| GS-10 | 4–7 | Моногидрат холестерина – C27H48O2 | В желчи | 0.072 |
| GS-11 | 4–7 | Моногидрат холестерина – C27H48O2 | В желчи | 0.068 |
| GS-12 | 4–7 | Моногидрат холестерина – C27H48O2 | В желчи | 0.069 |
| GS-13 | 4–7 | Моногидрат холестерина – C27H48O2 | В желчи | 0.070 |
| В желчи – | 0.069 | |||
| GS-14 | 4–7 | Моногидрат холестерина – C27H48O2 | Просушен – | 0.055 |
| В желчи – | 0.070 | |||
| GS-15 | 4–7 | Моногидрат холестерина – C27H48O2 | Просушен – | 0.053 |
| В желчи – | 0.068 | |||
| GS-16 | 4–7 | Моногидрат холестерина – C27H48O2 | Просушен – | 0.051 |
| GS-17 | 6–9 | Холестериновый | Просушен | 0.050 |
| GS-18 | 6–9 | Холестериновый | Просушен | 0.049 |
| Безводный холестерин – C27H46O | ||||
| Моногидрат холестерина – C27H48O2 | 0.052 | |||
| GS-19 | 6–12 | Ватерит – CaCO3 | Просушен | (0.152*) |
| GS-20 | 6–9 | Моногидрат холестерина – C27H48O2 | Просушен | 0.055 |
| Безводный холестерин – C27H46O | ||||
| GS-21 | 6–9 | Моногидрат холестерина – C27H48O2 | Просушен | 0.054 |
| Безводный холестерин – C27H46O | ||||
| GS-22 | 6–9 | Моногидрат холестерина – C27H48O2 | Просушен | 0.054 |
| GS-23 | 12–17 | Холестериновый | Просушен | 0.058 |
| GS-24 | 12–17 | Холестериновый | Просушен | 0.063 |
| GS-25 | 12–17 | Холестериновый | Просушен | 0.059 |
Из анализа дифрактограмм исследованных образцов можно допустить присутствие в них небольшого количества билирубиновых солей, однако слабая интенсивность их рефлексов и наложения на рефлексы холестерина не позволяют надежно идентифицировать билирубинаты. В образце GS-7 в заметном количестве присутствуют полиморфные модификации карбоната кальция CaCO3. Преобладающей карбонатной фазой является ватерит, который идентифицируется по его наиболее интенсивным рефлексам на углах 2θ = 24.87°, 27.03°, 32.71°, 43.81°. Кальцита и арагонита в образце значительно меньше, их рефлексы регистрируются на углах 2θ = 29.48°, 35.95°, 48.61° и 2θ = 38.10°, 45.79° соответственно. На дифрактограммах остальных конкрементов пики, характерные для неорганических фаз, практически не наблюдаются, хотя можно допустить наличие фосфатов Сa, K в образцах GS-3, 4, 5, 6, GS-8, 9,..16, GS-20, 21, 22.
Экспериментальные значения линейных коэффициентов поглощения, восстановленные из томографических измерений, представлены в табл. 1 и на рис. 3. По результатам этих экспериментов было установлено, что величины коэффициентов поглощения для большинства измеренных образцов лежат в узких диапазонах значений от 0.049 до 0.063 мм–1 для предварительно “просушенных” конкрементов и от 0.068 до 0.074 мм–1 для конкрементов, хранившихся в желчи до начала эксперимента. При этом существенные различия между коэффициентами поглощения исследуемых конкрементов не наблюдаются. В то же время выявлено небольшое количество образцов с большим поглощением. Доля желчных камней, у которых линейный коэффициент поглощения не превышает 0.08 мм–1, составила более 90% среди образцов, взятых для исследований. Конкременты с выявленными слоистыми образованиями, внутри которых линейный коэффициент поглощения превысил 0.15 мм–1, составили менее 10%.
Рис. 3.
Значения линейных коэффициентов поглощения μa конкрементов желчного пузыря, полученные из проведенных томографических экспериментов (энергия излучения 17.5 кэВ). Нижняя и верхняя линии показывают значения теоретического расчета μ для холестерина и воды, выполненные по табличным данным.

Образцы конкрементов GS-8, 9,..16, которые до начала эксперимента находились в желчи, демонстрируют более высокий усредненный по объему коэффициент поглощения в сравнении с образцами, просушенными до начала исследований (см. рис. 3). Данные различия вероятно можно объяснить тем, что внутри конкрементов есть полости, заполненные желчью, поглощение которой в данном диапазоне длин волн оказывается выше чем у камня. Чтобы подтвердить данное предположение, образцы GS-14, 15, 16 были просушены и измерялись повторно. Результаты повторных измерений представлены в табл. 1, и на рис. 3, значения коэффициентов поглощения составили 0.05–0.055 мм–1, что соответствует диапазону поглощения у измеренных нами “сухих” камней.
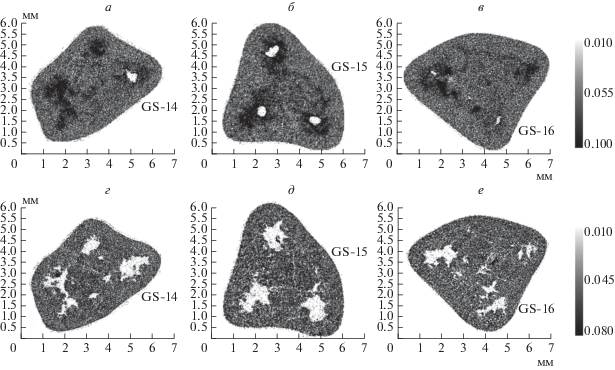
На рис. 4 представлены изображения поперечного среза образцов GS-14, 15, 16, измеренные сразу после извлечения из желчи (а, б, в) и после просушки (г, д, е). На изображениях отчетливо видны полости, которые проявились после выпаривания желчи. Данные полости образовались в процессе роста конкремента и не являются следствием усушки, поскольку поглощение в тех же областях конкрементов, находивших в желчи, соответствует именно ее коэффициенту поглощения.
Рис. 4.
Срезы томографических реконструкций конкрементов GS-14, 15, 16. а, б, в – измерения произведены сразу после извлечения образцов из желчи; г, д, е – измерения произведены после просушки образцов в течение 90 ч при температуре 50–60°С.
Изображения трехмерных реконструкций для образцов GS-7 и GS-19 представлены на рис. 5. Наблюдаются многочисленные слоистые образования. Линейный коэффициент поглощения, измеренный внутри данных образований (см. табл. 1) в 3–7 раз выше, чем у остальных конкрементов в наших исследованиях. Данные слоистые образования являются различными модификациями карбоната кальция, что подтверждается результатами фазового анализа. Характерно, что внутренняя структура данных конкрементов отчетливо разделена на зоны, являющиеся основой камня с поглощением на уровне, соответствующему холестерину (0.052–0.06 мм–1), и зоны сосредоточения более плотных отложений, расположенные в центральной части конкремента.
На рис. 6. представлено изображение поперечного среза конкрементов GS-3, GS-17, GS-21, которые были получены от разных пациентов. На всех снимках отмечены проекции V-образных плоских трещин, образовавшихся в объеме конкремента. В образце GS-3 V-образные полости выражены сильно, их линейные размеры сопоставимы с диаметром образца. В настоящий момент происхождение трещин V-образной формы и их связь со структурой конкремента остаются не изученными и требуют дополнительных исследований.
ЗАКЛЮЧЕНИЕ
Экспериментально измеренные значения линейных коэффициентов поглощения μa для всех камней находятся на уровне значения теоретического расчета поглощения холестерина (μ = = 0.061 мм–1) и отличаются от него не более чем на 20% (см. рис. 3 и табл. 1). Данное обстоятельство позволяет предполагать, что результаты томографических измерений позволяют косвенным образом отличать чисто холестериновые конкременты от конкрементов другого фазового состава. Однако для уточнения данного предположения требуется четкое знание об исчерпывающем перечне типов конкрементов, а также дополнительный набор статистики экспериментов. Отметим, что полученное нами значение μa для воды практически совпадает с теоретическим значением. Важно, что измеренное поглощение желчи несколько больше поглощения воды, что соответствует данным, полученным в медицинских томографах при больших энергиях зондирующего излучения.
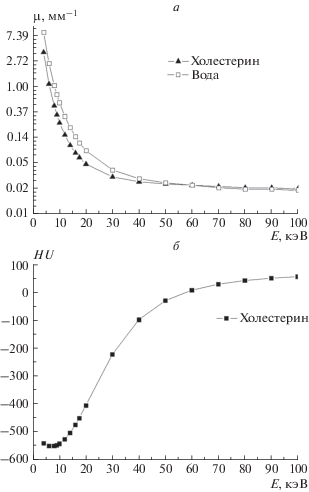
Нами установлено, что величина поглощения измеренных холестериновых конкрементов в 1.5–2 раза меньше, чем у желчи для энергии излучения E = 17.5 кэВ. Данные различия значений поглощения позволяют экспериментально наблюдать необходимый контраст камня на фоне желчи. Однако следует учитывать, что в диапазоне рабочих энергий рентгеновских медицинских томографов (от 50 до 100 кэВ) величины линейных коэффициентов поглощения воды и холестерина становятся малоразличимы друг от друга. Это продемонстрировано на рис. 7а и 7б, где приведены данные расчета, выполненного исходя из химического состава холестерина и его плотности в твердом состоянии по табличным значениям.
Рис. 7.
Теоретически расcчитанные: а – линейные коэффициенты поглощения (μ) воды и холестерина; б – коэффициент ослабления HU для холестерина (C27H46O) по шкале Хаунсфилда, в зависимости от энергии рентгеновского излучения E.
Работа выполнена при поддержке Министерства науки и высшего образования в рамках выполнения работ по Государственному заданию ФНИЦ “Кристаллография и фотоника” РАН.
Список литературы
Barbara L. // MTP Press, Lancaster, UK. 1983. P. 367.
Roda E., Liva S., Ferrara F. et al. // Eur. J. Gastroenterol. Hepatol. 2002. V. 14(3). P. 213.
Bouchifr I.A.D. // Gut. 1988. V. 29. P. 137.
Helmstadter A. // Lancet 1999. V. 354. P. 1376.
Padova C., Padova F., Montorsi W., Tritapepe R. // Gastroenterol. 1986. V. 91. P. 1296.
Tritapepe R., Rovagnati P., Da Pozzo L.F. et al. // Minerva Med. 1986. V. 77(12). P. 483.
Nelson P.E., Moyer T.P., Thistle J.L. // Gastroenterol. 1990. V. 98. P. 1345.
Kelly E., Williams J.D., Organ C.H. // Am. J. Surg. 2000. V. 180(2). P. 86.
Petroni M.L., Jazrawi R.P., Pazzi P. et al. // Eur. J. Gastroenterol. Hepatol. 2000. V. 12(6). P. 695.
Hetzer F.H., Baumann M., Simmen H.P. // Swiss Surg. 2001. V. 7(1). P. 39.
Lim M.Y., Chou T.C., Lin X.Z. et al. // Hepatogastroenterol. 1999. V. 46(26). P. 758.
Cheng J.S., Lai K.H., Lo G.H. et al. // Zhonghua Yi // Xue Za Zhi (Taipei) (China). 2000. V. 63(9). P. 667.
Тюрюмин Я.Л., Мальцев А.Б., Шантуров В.А. и др. // Акт. вопр. совр. клинич. мед.: Материалы, посв. 75-летию ИГМУ и факульт. клиник ИГМУ. Иркутск, 1995. С. 191.
Тюрюмин Я.Л., Шантуров В.А., Мальцев А.Б. и др. // Акт. вопр. реконструкт. и восстан. хирургии: Тез. итог. работ. Иркутск. 1995. С. 185.
Сайфутдинов Р.Г., Рыжкова О.В., Шантуров В.А. и др. Методич. пособие для врачей, Казань, 2003. 29 с.
Рыжкова О.В. Тез. Докл. Научно-практ. конф. мол. ученых. Казань, 2003. С. 69.
Рыжкова О.В., Сайфутдинов Р.Г. // Сиб. журн. гастроэнтерол. и гепатол. 2003. № 16, 17. С. 129.
Downling R.H. // Clinics Gastroenterol. 1983. V. 12. P. 125.
Schafmayer C., Hartleb J., Tepel J. et al. // BMC Gastroenterol. 2006.V. 6. P. 36.
Chowdhury A.H., Lobo D.N. // Surgery. 2011. V. 29. № 12. P. 610.
Prun V.E., Nikolaev D.P., Buzmakov A.V. et al. // Crystallog. Rep. December. 2013. V. 58. Is. 7. P. 1063.
Shien H.S., Hoard L.G., Nordman C.E. // Acta Crystallogr. Sec. B. Struct. Crystallogr. and Cryst. Chem. 1981. T. 37. № 8. P. 1538.
Craven B.M. // Acta Crystallogr. Sec. B. Struct. Crystallogr. and Cryst. Chem. 1979. T. 35. № 5. P. 1123.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая




