Известия РАН. Серия физическая, 2019, T. 83, № 2, стр. 282-286
Морфологические изменения скелетной мышцы млекопитающих под воздействием мощного терагерцового лазерного излучения
Е. Л. Зеленцов 1, Т. В. Сажина 2, А. С. Козлов 3, *, А. К. Петров 3, О. А. Шевченко 4
1 ОАО “МЦ Интегральная медицина”
Новосибирск, Россия
2 Новосибирский государственный медицинский университет
Новосибирск, Россия
3 Институт химической кинетики и горения СО РАН
Новосибирск, Россия
4 Институт ядерной физики им. Г.И. Будкера СО РАН
Новосибирск, Россия
* E-mail: kozlov@kinetics.nsc.ru
Аннотация
В работе рассматриваются морфологические изменения в скелетной мускулатуре M. Wistar, сформировавшиеся в результате повреждения тканей сфокусированным излучением первой очереди Новосибирского лазера на свободных электронах. Исследования подготовленных образцов проводились при помощи оптической и электронной микроскопии. Работа проводилась в целях определения особенностей воздействия мощного терагерцевого излучения, наличия специфических повреждений, в сравнении с СО2 лазером. Приводится подробное морфологическое описание, рассматриваются возможные причины повреждений.
ВВЕДЕНИЕ
Вскоре после изобретения импульсного рубинового лазера Maiman в 1960 [1] исследователи стремились исследовать потенциал импульсного лазерного излучения для медицинского применения. Однако о клиническом применении импульсной лазерной абляции не сообщали до начала 1970-х годов. В начале 1980-х лазеры использовались для разрезания структур глаза и процедур абляции [2]. В других медицинских областях использование лазеров не встречалось до середины 1980-х годов. Но в этом отношении были сделаны большие успехи, и теперь, в начале 21-ого столетия, медицинские процедуры, в которых используются импульсные лазеры, присутствуют в почти каждой медицинской отрасли. Исследования воздействия относительно терагерцевого излучения на культуры клеток ранее проводилось [3] преимущественно с целью визуализации и выявления генотоксических эффектов, но не установления характера повреждений.
ИСПОЛЬЗУЕМЫЕ В МЕДИЦИНЕ ДИАПАЗОНЫ ЭЛЕКТРОМАГНИТНОГО ИЗЛУЧЕНИЯ
Ультрафиолетовое излучение (=180–400 нм)
Видимый свет (=400–780 нм)
Инфракрасное Излучение (=780–1500 нм)
Использование лазеров терагерцевого (ТГц) диапазона сдерживалось отсутствием мощных источников излучения, но на протяжении последних лет эти источники были разработаны.
В Сибирском центре фотохимических исследований СО РАН проводились исследования взаимодействия терагерцевого лазерного излучения со скелетной мышцей млекопитающего (крыса, корова) на первой очереди Новосибирского лазера на свободных электронах (ЛСЭ) [4], который генерирует излучение с плавной перестройкой длин волн 100–200 мкм, в виде 50-пикосекундных импульсов, следующих с частотой повторения 5.6 МГц, при средней плотности мощности 20 Вт ⋅ см2 и пиковой мощности 0.8 МВт.
ЦЕЛИ И ЗАДАЧИ
Целью исследования являлось изучение последствий взаимодействия излучения ЛСЭ в “окне прозрачности” 130 ± 2 мкм с сильно структурированной биологической тканью, изучение специфических, для данных длин волн и мощности излучения, повреждений мышечной ткани. Кроме этого в качестве контроля было исследовано взаимодействие СО2-лазере (10 мкм, 1 Дж) с мышечной тканью. В этой работе мы исследуем взаимодействие ТГц-излучения с нормальной мышечной тканью, соединительной тканью млекопитающих (корова, крыса) “in vivo” для электронной микроскопии, “in vitro” для оптической микроскопии. Мы проводим самое первое (по нашим данным) систематическое “in vivo”, “in vitro” исследование взаимодействия ТГц-излучения с тканями при облучении ТГц-лазером большой мощности.
Еще одна цель этой работы состоит в возможном обнаружении новых эффектов взаимодействия ТГц-излучения с тканью, учитывая специфику, как ТГц-излучения, так и значительной мощности лазера.
Существует значительное различие между поглощением ТГц-излучения в ткани и при ее облучении импульсными лазерами другого электромагнитного диапазона. Поскольку вода имеет сильное поглощение во всем ТГц-диапазоне, то различия поглощения водой являются источником различия взаимодействия между излучением и различными тканями организма.
Мы в данной работе исследуем эффекты ограниченного выкипания, коллатеральные эффекты [2]. Мы не ограничиваем исследования, выполненными на уровне ткани, но и рассматриваем изменения клеточных и субклеточных объектов.
СТРУКТУРА ПОПЕРЕЧНОПОЛОСАТОЙ СКЕЛЕТНОЙ МЫШЕЧНОЙ ТКАНИ
Поперечная исчерченность скелетного мышечного волокна определяется регулярным чередованием в миофибриллах, различно преломляющих поляризованный свет, участков (дисков) изотропных и анизотропных: светлые (Isotropic, I-диски) и темные (anisotropic, А-диски) диски. Разное светопреломление дисков определяется упорядоченным расположением по длине саркомера тонких и толстых нитей. Каждый светлый диск пересекает Z-линия Участок миофибриллы между соседними Z-линиями определяют как саркомер [5].
ЭКСПОЗИЦИЯ И ПРОБОПОДГОТОВКА
Излучение выведено из ускорительного зала на экспериментальные станции, где при помощи системы зеркал излучение направляют в вертикальной плоскости перпендикулярно образцу. Для фокусировки излучения на поверхности образца использовался сектор параболического зеркала с фокусным расстоянием 8 см и диаметром фокального пятна 1 мм. Облучение проводилось как вдоль, так и поперек мышечных волокон.
Образцы поперечнополосатых мышц предварительно изымались у животных под общим (эфирным наркозом) из мышц бедра. После этого образцам придавали кубическую форму размерами, примерно – 5 × 5 × 5 см, либо 1.5 × 1.5 × 1.5 см для коров и крыс соответственно. Облучение проводили в кратчайшие сроки после забора образцов, для того чтобы структуры миоцитов не изменились с течением времени. Для электронной микроскопии проводилось облучение живого объекта (крыса) под эфирным наркозом.
После этого фрагменты образцов забирали на расстоянии 1–4 см от фокуса, образцы ткани, расположенные непосредственно рядом с фокусом излучения, не забирали, так как в фокусе наблюдалось выраженное термическое повреждение (обугливание) тканей.
МЕТОДИКА ПРОВЕДЕНИЯ МИКРОСКОПИИ
Образцы фиксировали в растворе 70% спирта для дальнейшего изучения методами оптической микроскопии. Оптическую микроскопию проводили при помощи микроскопа Carl Zeiss AxioObserver D1 с увеличением 300–600 раз. Для электронно-микроскопического исследования образцы мышечной ткани фиксировали в 4% растворе параформальдегида, приготовленном на среде Хенкса, дофиксировали в течение 1 ч в 1% растворе ОsO4 (осмий тетроксид) (Sigma, США) на фосфатном буфере (pH 7.4), дегидратировали в этиловом спирте возрастающей концентрации и заключали в эпон (Serva, Германия). Полутонкие срезы толщиной 1 мкм получали на ультрамикротоме Leica EM UC7 (Германия/Швейцария), окрашивали толуидиновым синим, изучали под световым микроскопом “LEICA DME” (Германия), фотографировали с помощью компьютерной программы “Аvigion”. Ультратонкие срезы толщиной 70–100 нм контрастировали насыщенным водным раствором уранилацетата и цитратом свинца и изучали в электронном микроскопе JEM 1010 (Japan). Электронную микроскопию проводили при помощи микроскопа JEМ 1010 при увеличении 8000–12 000 раз.
ОПИСАНИЕ МИКРОСКОПИИ
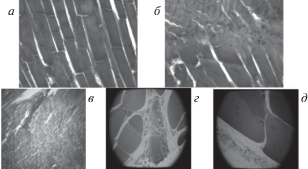
При оптическом исследовании состояния поперечно полосатой мышечной ткани скелетного типа после воздействия лазерного излучения отмечается поперечные периодические линии разрывов мышечных волокон, которые повторяются по длине волокон на расстоянии, примерно 5–15 мкм друг от друга, местами со сдвигом и частичным наложением фрагментов друг на друга (эффект черепицы). Также на отдельных изображениях отмечено наличие кавитационных полостей округлой и овальной формы, заполненных содержимым, на некоторых изображениях видны отчетливые периодические линии разрывов соединительной ткани. При всей тяжести поражения соединительной и мышечной ткани, разрыва стенки сосудов выявлено не было, также не отмечено повреждение эритроцитов, рис. 1.
Рис. 1.
Различные варианты окраски препаратов и различное увеличение при оптической микроскопии. Отмечен сдвиг тканей, очаги неравномерного прокрашивания мышцы. Окраска гематоксилин и эозин. Увеличение 10 × 30. Окраска толуидиновым голубым. Увеличение 10 × 40 и 10 × 60.
При исследовании с помощью электронного микроскопа после воздействия лазера на мышечную ткань, взятую на расстоянии 5 и 10 мм от фокуса, были отмечены следующие изменения в структуре миофибрилл. На расстоянии 5 мм, от фокуса выявлено расширение (увеличение) I-дисков, исчезновение М-линий, и H-зон, что, вероятно, связано с нарушением взаимодействия актиновых и миозиновых нитей; увеличение ширины Z-линий (рис. 2а, 2б).
Рис. 2.
Изображения мышцы, электронная микроскопия (увеличение 12000) после воздействия лазера на мышечную ткань, взятую на расстоянии 5 мм, от фокуса: а – выявлено расширение (увеличение) I-дисков, исчезновение М-линий, и H-зон, что связано с нарушением взаимодействия актиновых и миозиновых нитей; увеличение ширины Z-линий; б – в одних местах отмечено смещение z-линий и структурных компонентов саркомера относительно друг друга, что обусловлено нарушением поперечной пространственной сети, образованной белком десмином, соединяющим между собой z-линии соседних миофибрилл; в других местах отмечено более сильное смещение z-линий под углом до 90° с их пространственным разрушением; в – увеличение 8000 раз. Видны множественные сгруппированные кавитационные полости.

В одних местах отмечено смещение z-линий и структурных компонентов саркомера относительно друг друга, что обусловлено нарушением поперечной пространственной сети, образованной белком десмином, соединяющим между собой z-линии соседних миофибрилл. В других местах отмечено более сильное смещение z-линий под углом до 90° с их пространственным разрушением, что может свидетельствовать о нарушении связей между филаментозными белками в z-линии и нарушении тетрагональной структуры, к которой прикрепляются актиновые нити (рис. 2б).
На расстоянии 10 мм от фокуса облучения отмечен разрыв миофибрилл по ходу действия волны. С одной стороны от разрыва миофибриллы сохраняют свою структуру, отмечено лишь расширение отдельных канальцев саркоплазматического ретикулюма, с другой стороны от разрыва более выражены нарушения структуры ткани, такие как расширение z-линий. Ясно видна их структура, но нарушена структурная целостность саркомеров миофибрилл, нарушены связи между актиновыми и миозиновыми нитями (может быть из за разрушения белка коннектина).
В основном на расстоянии 10 мм от очага воздействия сохраняются структура z-линий и пространственные связи между актиновыми и миозиновыми нитями, но отмечается исчезновение h-зон, увеличение диаметра канальцев саркоплазматического ретикулюма, М-линии слабо контурированы, вероятно, за счет поражения титина (рис. 3).
Рис. 3.
Изображения мышцы, электронная микроскопия (увеличение 8000 и 12 000 раз) после воздействия лазера на мышечную ткань, взятую на расстоянии 10 мм, от фокуса. а – отмечен разрыв миофибрилл по ходу действия волны; с одной стороны от разрыва миофибриллы сохраняют свою структуру, отмечено лишь расширение отдельных канальцев саркоплазматического ретикулюма, с другой стороны от разрыва более выраженные нарушения структуры ткани, такие как, расширение z-линий, но ясно видна их структура, но нарушена структурная целостность саркомеров миофибрилл, нарушение связей между актиновыми и миозиновыми нитями, может быть из за разрушения белка коннектина; б – в основном на расстоянии 10 мм от очага воздействия сохраняется структура z-линий и пространственные связи между актиновыми и миозиновыми нитями, но отмечается исчезновение h-зон, увеличение диаметра канальцев саркоплазматического ретикулюма, М-линии слабо контурированы за счет поражения белка титина.

При сравнении воздействия СО2-лазера на мышечную ткань видны радикальные отличия в морфологических изменениях миофибрилл, на представленных изображениях с различным увеличением видна спиралевидная скрученность волокон с длиной витка спирали около 100 мкм. Кроме того, отмечена тенденция к продольному разволокнению волокон со спиралевидным же скручиванием фрагментов. Нами не отмечены периодические поперечные разрывы миофибрилл на изображениях нигде не встречаются кавитационные полости, также не отмечены явления сдвига волокон. Но в то же время мы видим и некоторое сходство при воздействии ТГц- и CO2-лазеров, выражающееся в уплотнении мышечных волокон с исчезновением интерстициальных пространств, в гетерогенном разволокнении мышечных волокон, исчезновении поперечной исчерченности (рис. 4). Возможно это связано с типом мышечного волокна (АТФ или СДГ-активностью, т.е. с преобладанием аэробного, либо анаэробного типа обмена).
Рис. 4.
Изображения мышцы, оптическая микроскопия: а – СО2-лазер увеличение 10 × 30; б – СО2-лазер, увеличение 10 × 50; в – контроль, после воздействия лазера на мышечную ткань, взятую на расстоянии 10 мм, от фокуса. При сравнении воздействия СО2-лазера на мышечную ткань видны радикальные отличия в морфологических изменениях миофибрилл, на представленных изображениях с различным увеличением отмечена спиралевидная скрученность. Кроме этого отмечена тенденция к продольному разволокнению волокон со спиралевидным же скручиванием фрагментов. Нами не отмечены периодические поперечные разрывы миофибрилл, нигде не встречаются кавитационные полости, также не отмечены явления сдвига волокон. Но в то же время мы видим и некоторое сходство при воздействии ТГц и CO2-лазеров, выражающееся в уплотнении мышечных волокон с исчезновением интерстициальных пространств, в гетерогенном разволокнении мышечных волокон, исчезновении поперечной исчерченности.

Исследования, проведенные с помощью импульсного терагерцевого и СО2-лазеров, выявили значительную разницу между их воздействием на мышечную и соединительную ткань.
При электронной и оптической микроскопии нами было выявлено несколько видов разрывов мышц. Разрывы, видимые при оптической микроскопии, располагающиеся на расстоянии 5–12 мкм друг от друга, распространялись, в основном, поперек мышечных волокон. При электронной микроскопии выявлено несколько видов разрывов. В первом виде с периодичностью в 1 мкм разрывы распространялись в различных направлениях без учета ориентации мышечных волокон. Второй вид – разрыв саркомеров в области прикрепления к Z-линии, проявляющийся в увеличении расстояния между Z-линией и миофибриллами. Кроме того, отмечено значительное увеличение расстояния между саркомерами. Любопытным является тот факт, что вышеописанные изменения происходят, по нашему мнению, параллельно и, вероятнее всего, не оказывают воздействия друг на друга. Иными словами мы видим 3 параллельно протекающих процесса, обусловленные различными физическими и биологическими факторами, отражение которых мы наблюдаем в виде разрывов мышц.
Кроме этого нами были выявлены кавитационные полости размерами от 0.5 до 2 мкм, расположенные также периодично вдоль хода мышечных волокон. Исходя из значительной разницы размеров кавитационных полостей, наблюдаемых при оптической и электронной микроскопии, можно предположить, что каждый вид этих полостей обусловлен разными физическими процессами.
На представленных изображениях (снимках) оптической микроскопии поперечно-полосатого мышечного волокна млекопитающего (крысы) при вышеописанном воздействии определяются, кроме разрывов мышечных волокон, кавитационные полости смещения тканей. При окраске толуидиновым голубым с различным увеличением (10 × 40, 10 × 60) мы обнаружили значительные изменения в структуре мышечного волокна, не характерные для разрывов мышцы либо кавитационных полостей. Нами отмечены очаги измененного прокрашивания тканей овальной формы, как более, так и менее окрашенные размерами до 5 микрон. Кроме того, определяются структуры малой оптической плотности периодически расположенные на мембране клетки, размерами 3–10 мкм, вероятно это пролабирования (выпячивания) мембраны при воздействии излучения (рис. 1). На одной серии рисунков видны разные феномены.
ЗАКЛЮЧЕНИЕ
Происходит гетерогенное разволокнение мышечных волокон. Наблюдается уплотнение мышечных волокон с исчезновением интерстициальных пространств и плотным расположением сосудов и нервов рядом с волокнами.
Образуются поперечные разрывы мышечных волокон в пределах тонких линий I-дисков.
Образуются продольные разрывы мышечных волокон вдоль миофибрилл по расположению саркоплазматического ретикулума.
Происходит одновременное образование продольных и поперечных разрывов.
Характер происходящих изменений в структуре мышечного волокна определяется расстоянием от места лазерного воздействия.
Существенного различия в степени воздействия ТГц-лазера на мышцу при использовании длин волн от 149 и 205 мкм при оптической микроскопии выявлено не было, определяющий характер носит мощность излучения.
Были выявлены единичные линии разрывов мышцы в периферических отделах блока мышцы размерами 5 × 5 × 5 см. Таким образом можно считать доказанным, что воздействие на мышечную ткань для данных длин волн и данной мощности излучения составляет, приблизительно 125 см3. Поскольку характерная глубина проникновения ТГц-импульсов значительно меньше размера зоны “поражения”, существует предположение, что воздействие вызвано прохождением мощных ударных волн давления.
Работы по определению и достижению требуемых параметров работы Новосибирского ЛСЭ выполнены при поддержке гранта РНФ № 14-50-00080.
Список литературы
Maiman T.H. // Nature. 1960. V. 187. P. 493.
Vogel A., Venugopalan V. // Chem. Rev. 2003. V. 103. № 2. P. 577.
Gallerano G.P. THz-BRIDGE. Final report QLK4-CT-2000-00129. 2004. P. 72.
Knyazev B.A., Bagryanskaya E.G., Chesnokov E.N. et al. // Phys. Proc. 2016. V. 84. P. 27.
Gartner L.P., Hiatt J.L. BRS Cell Biology and Histology. 6th Edition. Lippincott Williams Wilkins, 2011. 374 p.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая


