Известия РАН. Серия физическая, 2020, T. 84, № 11, стр. 1643-1647
Иттербиевые комплексы порфиринов в люминесцентной диагностике и тераностике рака
И. П. Шилов 1, В. Д. Румянцева 1, 2, Ю. В. Алексеев 3, А. В. Иванов 3, 4, *
1 Федеральное государственное бюджетное учреждение науки
Институт радиотехники и электроники имени В.А. Котельникова Российской академии наук,
Фрязинский филиал
Фрязино, Россия
2 Федеральное государственное бюджетное образовательное учреждение высшего образования
МИРЭА – Российский технологический университет
Москва, Россия
3 Федеральное государственное бюджетное учреждение
“Государственный научный центр лазерной медицины имени О.К. Скобелкина
Федерального медико-биологического агенства России”
Москва, Россия
4 Федеральное государственное бюджетное учреждение
“Национальный медицинский исследовательский центр онкологии имени Н.Н. Блохина”
Министерства здравоохранения Российской Федерации
Москва, Россия
* E-mail: ivavi@yandex.ru
Поступила в редакцию 18.06.2020
После доработки 10.07.2020
Принята к публикации 27.07.2020
Аннотация
Представлены разработки новых методов люминесцентной диагностики в ближнем ИК диапазоне и тераностики рака на базе наноразмерных Yb-комплексов порфиринов: а) люминесцентная диагностика опухолей в сочетании с плазмонно-резонансной фототермотерапией; б) люминесцентная диагностика опухолей в сочетании с локальной ферромагнитной гипертермией; в) люминесцентная диагностика опухолей в сочетании с фотодинамической терапией в полосе поглощения порфирина.
ВВЕДЕНИЕ
Ранняя диагностика онкологических заболеваний является одной из основных задач клинической онкологии. Для ее решения привлекаются самые передовые аппаратура и методики, в том числе спектрально-оптические как наиболее чувствительные [1–3]. Для различных биомедицинских применений, включая люминесцентную диагностику (ЛД) новообразований, предлагаются малотоксичные фотосенсибилизаторы на основе иттербиевых комплексов порфиринов (ИКП) [4, 5]. Введение иона иттербия в центр порфириновой матрицы приводит к резкому снижению фотохимической активности, сохраняя при этом свойственную большинству порфиринов тропность к злокачественным опухолям [6]. Ионы иттербия, введенные в соответствующие производные порфирина, в значительной степени снижают квантовый выход генерации синглетного кислорода, а при возбуждении π-электронной системы порфирина наблюдается люминесценция, обусловленная переходами 4f электронов иона Yb3+: 2F5/2 → 4F7/2.
ИКП характеризуются люминесцентным сигналом повышенной интенсивности в ближнем инфракрасном (БИК) спектральном диапазоне 900–1100 нм, в так называемом “окне прозрачности” биотканей. ИКП обладают высоким коэффициентом экстинкции ~105 М–1 см–1 и временем жизни люминесценции до 20 мкс [7, 8]. Кроме того, некоторые из них относятся к природным порфиринам и, следовательно, малотоксичны [6]. Результаты по исследованию биораспределения, селективности накопления и токсичности, полученные в экспериментах на животных, и по изучению спектрально-кинетических свойств ИКП, подтвердили их перспективность для ЛД оптически доступных новообразований. На основе ИКП разработана фармакологическая композиция для БИК-люминесцентной диагностики заболеваний кожи и слизистых оболочек [9].
Объединение диагностических и терапевтических функций в одной наноструктуре является базовым принципом нового направления биомедицинской фотоники – тераностики. Нанокомпозиты для диагностики и терапии рака, состоящие из наноносителей и инкапсулированных в них наночастиц, имеют большие перспективы в онкологии [10, 11]. Разработанные ИКП могут быть использованы в качестве одного из основных компонентов создаваемых нанокомпозитов для тераностики рака.
Целью данной работы явилась разработка базовых принципов новых методов люминесцентной диагностики и тераностики рака с использованием наноразмерных ИКП: а) люминесцентная диагностика опухолей в ближнем ИК (БИК) диапазоне в сочетании с плазмонно-резонансной фототермотерапией; б) люминесцентная диагностика опухолей в БИК диапазоне в сочетании с локальной ферромагнитной гипертермией; в) люминесцентная диагностика опухолей в БИК диапазоне в сочетании с фотодинамической терапией в полосе поглощения порфирина.
ЛЮМИНЕСЦЕНТНАЯ ДИАГНОСТИКА В СОЧЕТАНИИ С ПЛАЗМОННО-РЕЗОНАНСНОЙ ФОТОТЕРМОТЕРАПИЕЙ
Иттербиевый комплекс дикалиевой соли 2,4-диметоксигематопорфирина IX впервые был использован для функционализации композитных наночастиц, состоящих из золото-серебряных наноклеток, покрытых мезопористой оболочкой из двуокиси кремния [12]. Такие наноструктуры обладают рядом важных свойств, включая легко настраиваемый плазмонный резонанс наноклеток (в оболасти 650–950 нм) и удобство функционализации пористой оболочки двуокиси кремния.
Размер нанокомпозитов играет ключевую роль в их доставке и накоплении в опухоли. Размер данного нанокомпозита составил 100–150 нм, что близко к дефектам эндотелиального слоя новообразованных сосудов опухоли 100–200 нм. Вследствие этого разработанные нанокомпозиты обладают повышенной селективностью накопления в опухоли.
Данный метод тераностики может быть представлен как БИК-люминесцентная диагностика в сочетании с плазмонно-резонансной фототермотерапией. Синтез таких нанокомпозитов был осуществлен совместно с Институтом биохимии и физиологии растений и микроорганизмов РАН [12]. Были исследованы токсичность, биораспределение и фармакокинетика субстанции ИКП для здоровых мышей и мышей с привитой карциномой Эрлиха. Оказалось, что разработанные нанокомпозиты имеют хороший контраст накопления в опухоли по сравнению со здоровой соседней тканью. Разработанные наноструктуры позволяют после проведения процедуры ЛД новообразований осуществлять одновременно и плазмонно-резонансную фототермотерапию, которая является одной из относительно новых и многообещающих методик лечения опухолей. Она базируется на лазерном нагреве металлических наночастиц, главным образом золотых, в области их плазмонного резонанса. Как было показано в [12], в добавок к длинноволновому плазмонному резонансу вблизи 750–800 нм (лазерный фототермолиз), разработанные нанокомпозиты проявляют и пики поглощения вблизи 405 нм, а также БИК-люминесценцию в области 900–1100 нм, что присуще ИКП и используется для ЛД новообразований.
ЛЮМИНЕСЦЕНТНАЯ ДИАГНОСТИКА ОПУХОЛЕЙ В СОЧЕТАНИИ С ЛОКАЛЬНОЙ ФЕРРОМАГНИТНОЙ ГИПЕРТЕРМИЕЙ
Для тераностики опухолей глубокой тканевой локализации проведен синтез наночастиц, содержащих ядро оксидов железа и полимерную оболочку типа Лексан, включающую ИКП [13, 14]. При этом предполагалось, что наночастицы оксидов железа в накопившей их опухолевой ткани будут ответственны за проведение процедуры локальной ферромагнитной гипертермии в радиочастотном диапазоне, где практически отсутствует поглощение самих биотканей. Получены данные, свидетельствующие о перспективности применения синтезированных наночастиц со структурой Лексан-полимерная матрица (ЛПМ) + ИКП + + FeOx, для разработки методов тераностики опухолей. Разрабатываемый метод тераностики позиционирован нами как магнито-люминесцентная тераностика (МЛТ).
Следует отметить, что к настоящему времени весьма развиты и продолжают совершенствоваться методы, использующие магнитные наночастицы (МНЧ) и греющие радиочастотные электромагнитные поля (ЭМП). В их число выходит и магнитная гипертермия (МГТ), при этом частота ЭМП составляет 200–1000 кГц. В последнее время развитие получили также и не тепловые механизмы магнитной тераностики (механизм магнитомеханической актуации), использующие негреющие ЭМП (1–1000 Гц) [15]. Использование МНЧ позволяет локально повысить интенсивность воздействия и снизить частоту и величину необходимой индукции переменного ЭМП, а следовательно, уменьшить вероятность нежелательных побочных эффектов со стороны поля [16].
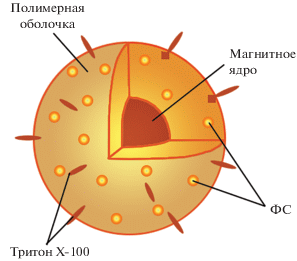
В большинстве биомедицинских приложений в качестве материала магнитного ядра используют магнетит Fe3O4 (Js ≈ 80 A · м2/кг – намагниченность насыщения магнетита), имеющий существенно меньшую токсичность, чем чистые магнитные металлы и многие магнитные сплавы. Структурная схема синтезированного нанокомпозита ЛПМ + ИКП + FeOx для МЛТ представлена на рис. 1.
Рис. 1.
Структурная схема нанокомпозита ЛПМ + + ИКП + FeOx, где ФС – иттербиевый комплекс диметилового эфира протопорфирина IX.
Иттербиевый комплекс диметилового эфира протопорфирина IX (Yb-ДМЭ ПП) в виде ацетилацетонатного комплекса был получен в соответствии с методом, описанным в [17]. Для придания поверхности частиц гидрофильности, а следовательно, меньшей агрегируемости и более длительной циркуляции в организме, в органическую фазу вводили неионогенный детергент Тритон Х-100. При образовании частиц гидрофобная часть детергента встраивалась в частицу, а гидрофильная (полиэтиленгликолевая) оставалась на поверхности. Для большей стабилизации иттербиевого комплекса использовали дополнительный комплексообразователь – триоктилфосфиноксид (ТОФО). Спектрально-кинетические характеристики (спектры в диапазоне 800–1060 нм и времена жизни люминесценции) получали с помощью измерительного стробоскопического стенда с возбуждением в видимом диапазоне спектра [8]. Источником излучения служил импульсный лазер LS-2132 фирмы Lotis-TII на кристалле алюмоиттриевого граната с ионами неодима с длиной волны излучения 532 нм. Параметры лазерного излучения: частота следования импульсов 10 Гц, энергия в одиночном импульсе 100 мДж, длительность импульса по уровню 0.5–10 нc. Времена жизни люминесценции для всех образцов измерены на длине волны эмиссии 976 нм.
Размер наночастиц в суспензии определяли методом динамического рассеяния света на лазерном корреляционном спектрометре “Курс-3”, позволяющем проводить измерения в диапазоне от 0.5 до 104 нм. Исследование биораспределения и фармакокинетики нанокомпозита в органах и тканях животных (30 мышей-самок линии Bulb/c с перевитой карциномой Эрлиха) проводили на макетном лазерно-волоконном флуориметре. По истечении определенных промежутков времени в интервале от 0.5 до 72 ч после введения препарата группы мышей по три особи выводили из опыта, после чего у них забирали биопсию органов и тканей: легкое, сердце, печень, селезенка, почки, мышцу, кожу и опухоль для спектрального исследования. Синтез лексановых наночастиц, нагруженных Yb-ДМЭ ПП, осуществляли по аналогии с методом, предложенным в [18], в нашей модификации, приводящей к получению частиц большего диаметра [17].
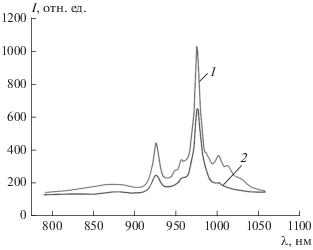
Представленные на рис. 2 спектры эмиссии водных суспензий синтезированных наночастиц в БИК-диапазоне подтверждают, что в них сохраняется типичный для люминесценции ионов Yb3+ характер: наличие наиболее интенсивной полосы в области 980 нм, обусловленной основным переходом, и появление дополнительных полос в области 925 и 1010 нм, обусловленных внутримультиплетными переходами. Было показано, что включение ядра FeOx в наночастицы приводит к приблизительно двукратному снижению интенсивности люминесценции Yb-ДМЭ ПП в синтезированных вариантах наночастиц, несколько большему в случае меньшей толщины полимерной оболочки и несколько меньшему при увеличении ее толщины. В отсутствие ТОФО люминесценции практически не наблюдается. При этом основная доля люминесценции приходится на самую мелкодисперсную (надосадочную) фракцию, что свидетельствует о том, что грубодисперсная суспензия, содержащая “крупные” ядра FeOx, практически не люминесцирует. Представленные данные свидетельствуют о том, что для получения более качественных люминесцирующих наночастиц с ядром оксидов железа, содержащих ИКП, необходимо использовать более монодисперсную исходную суспензию FeOx диаметром не более 10 нм.
ЛЮМИНЕСЦЕНТНАЯ ДИАГНОСТИКА В СОЧЕТАНИИ С ФОТОДИНАМИЧЕСКОЙ ТЕРАПИЕЙ
Новый способ тераностики злокачественных новообразований кожи и слизистых оболочек основан на использовании фармацевтической композиции (ФК) “Флюроскан”, состоящей из Yb-комплекса 2,4-ди(α-метоксиэтил)дейтеропорфирина IX (Yb-ДМДП), люминесцирующего в БИК-области спектра (900–1100 нм) и различных гелей, обеспечивающих хорошую проницаемость в кожу и слизистые оболочки. При аппликационном введении ФК проводится фотодиагностика с выявлением области патологии, после чего область обрабатывается раствором аскорбиновой кислоты. При этом наблюдается интенсивный исход иона иттербия из порфиринового макроцикла и в ткани остается только безметальная форма порфиринового комплекса, после чего возможно проведение процедуры фотодинамической терапии (ФДТ) выявленных участков патологии в полосе поглощения 2,4-ди(α-метоксиэтил)дейтеропорфирина IX 635 нм.
Тераностику злокачественных новообразований кожи и слизистых оболочек с использованием данной ФК осуществляют следующим образом. Вначале проводится ЛД, при которой обрабатываются гелем ФК подозрительные участки кожи и слизистых оболочек. Вследствие того, что ИКП практически не обладают световой токсичностью, при нанесении этих гелей на кожу и слизистые оболочки не происходит отрицательного воздействия на живой организм в виде появления побочных дерматологических реакций. По истечении 30–40 мин после обработки кожных новообразований и близкорасположенных здоровых тканей данным препаратом измеряется диагностический контрастный индекс – отношение интенсивности люминесценции тканей (новообразование/норма), который может составлять от 2.5 до 15.0 в зависимости от типа кожного повреждения и концентрации ИКП в ФК. Далее перед стадией ФДТ проводится процедура обработки патологически измененных участков биоткани насыщенным раствором аскорбиновой кислоты (1 г в 3 мл 0.9% NaCl).
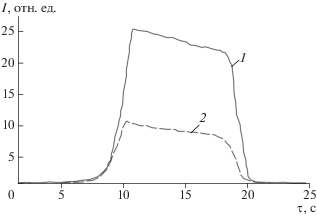
Ее накопление в биоткани происходит в течение 10–15 мин. По истечении данного времени измеряется интегральная интенсивность люминесценции в БИК-диапазоне на различных участках биотканей. При этом интегральная интенсивность БИК-люминесценции уменьшается почти в 3 раза по сравнению с необработанной аскорбиновой кислотой биотканью (рис. 3), что подтверждает интенсивный выход иона иттербия из порфиринового макроцикла. Таким образом, в накопленной биотканью ФК в основном присутствует безметальная форма порфиринового комплекса. На следующем этапе тераностики проводится процедура ФДТ выявленных ранее пораженных участков биоткани посредством обработки их терапевтическим лазером на длине волны 635 нм. При этом экспозиционная доза составляет ~300 Дж/см2.
Рис. 3.
Интегральная интенсивность ИК-люминесценции иона иттербия (гель “Флюроскан”) при импульсном лазерном воздействии на длине волны 405 нм: 1 – через 40 мин после обработки поверхности опухоли гелем, 2 – после 15 мин обработки поверхности опухоли аскорбиновой кислотой.
Для проведения процедуры тераностики были подготовлены 3 группы мышей линии С57ВL с внутрикожно перевитой аденокарциномой легкого LLC (опухоль Льюиса) по 6 особей в каждой: 1 группа – контрольная (без проведения ФДТ), 2 группа – для проведения ФДТ с дозой 300 Дж/см2, 3 группа – для проведения ФДТ с дозой 150 Дж/см2. Размер поверхности опухоли у всех мышей составлял примерно 1 см2. После процедуры ЛД во всех группах мышей при одинаковых условиях проводился сеанс ФДТ с заданной дозировкой.
До, во время и после воздействия лазерным излучением регистрировалась термограмма опухолевого узла (рис. 4). Для термографии зоны злокачественного роста использовался специально созданный многоканальный аппаратно-программный комплекс (МАПК) для неинвазивного выявления температурных аномалий внутренних тканей лабораторных животных на глубине нескольких сантиметров [19]. МАПК производит измерение температуры внутренних тканей путем измерения собственного электромагнитного излучения лабораторных животных в микроволновом диапазоне, рабочий диапазон частот приемного канала от 3150 до 3800 МГц. Усредненная термограмма, характерная для 2 группы мышей, представлена на рис. 4. Видно, что колебания температуры в зоне роста первичного узла опухоли после воздействия лазерным излучением составили около 5°С, не достигая 40°С. После прекращения воздействия лазером фоновые температурные флуктуации в опухолевой ткани становятся малоамплитудными (менее 0.5°С). Данный факт свидетельствует о нарушении ее биоэнергетики и микроциркуляции кровотока вследствие деструктивных изменений, вызванных проведенной ФДТ. Видимо, можно говорить о частичном некрозе опухолевой ткани. Средняя выживаемость 2 группы мышей оказалась максимальной среди всех групп и составила 2 мес. Как видно из рис. 4, терапевтический эффект достигнут целиком благодаря ФДТ, без участия процесса гипертермии, которая осуществляется при температурах выше 42°С.
ЗАКЛЮЧЕНИЕ
Полученные данные свидетельствуют о перспективности применения синтезированных наночастиц на основе ИКП для разработки чувствительных люминесцентных методов диагностики опухолей визуально и эндоскопически доступной локализации.
Синтезированная структура типа ЛПМ + + ИКП + FeOx может быть востребована для целей МЛТ. Включение ядра FeOx в наночастицы позволяет проводить контролируемую локальную высокочастотную гипертермию патологических участков глубокой тканевой локализации, накопивших нанокомпозит, хотя и приводит к незначительному уменьшению его диагностического потенциала (к приблизительно двукратному снижению интенсивности люминесценции ИКП). Однако этот недостаток может быть компенсирован некоторым увеличением терапевтической дозы нанокомпозита.
Люминесцентная диагностика опухолей в сочетании с фотодинамической терапией в полосе поглощения порфирина может быть весьма перспективна при злокачественных новообразованиях кожи и слизистых оболочек с использованием ФК типа “Флюроскан”.
Работа выполнена в рамках Государственного задания № 0030-2019-0009 и поддержана Министерством науки и высшего образования Российской Федерации (проект № 0706-2020-0019).
Список литературы
Турчин И.В. // УФН. 2016. Т. 186. № 5. С. 550; Turchin I.V. // Phys. Usp. 2016. V. 59. № 5. P. 487.
Могильная Т.Ю., Ботиков А.Г., Агибалов А.А. // Изв. РАН. Сер. физ. 2018. Т. 82. № 8. С. 1158; Moguilnaya T.Yu., Botikov A.G., Agibalov A.A. // Bull. Russ. Acad. Sci. Phys. 2018. V. 82. № 8. P. 1052.
Хайдуков Е.В., Болдырев К.Н., Хайдуков К.В. // Опт. и спектроск. 2019. Т. 126. № 1. С. 90; Khaydukov E.V., Boldyrev K.N., Khaydukov K.V. et al. // Opt. Spectrosс. 2019. V. 126. № 1. P. 95.
Койфман О.И., Трифонова И.П., Бурмистров В.А. // Изв. АН. Сер. хим. 2015. № 11. С. 2562; Koifman O.I., Trifonova I.P., Burmistrov V.A. // Russ. Chem. Bull. 2015. V. 64. № 11. P. 2562.
Зуев М.Г., Ильвес В.Г., Соковнин С.Ю. и др. // Изв. АН. Сер. хим. 2020. № 5. С. 952.
Ivanov A.V., Rumyantseva V.D., Shchamkhalov K.S., Shilov I.P. // Laser Phys. 2010. V. 20. № 12. P. 2056.
Stasheuski A.S., Knyukshto V.N., Ivanov A.V. et al. // J. Appl. Spectrosc. 2015. V. 81. № 6. P. 938.
Ivanov A.V., Rumyantseva V.D., Shilov I.P. et al. // Photon. Las. Med. 2013. V. 2. № 3. P. 175.
Румянцева В.Д., Миронов А.Ф., Алексеев Ю.В. и др. Пат. РФ № 2617045, кл. A61K 31/40, 2017.
Евдокимова М.Г., Конев А.С., Поволоцкая А.В. и др. // Изв. РАН. Сер. физ. 2017. Т. 81. № 12. С. 1576; Evdokimova M.G., Konev A.S., Povolotckaia A.V. et al. // Bull. Russ. Acad. Sci. Phys. 2017. V. 81. № 12. P. 1391.
Savelyev A.G., Semchishen V.A., Nechaev A.V. et al. // EPJ Web Conf. 2018. V. 190. Art. № 04018.
Khlebtsov B., Panfilova E., Khanadeev V. et al. // ACS Nano. 2011. V. 5. № 9. P. 7077.
Шилов И.П., Иванов А.В., Ивановская Н.П. и др. // Мед. физ. 2017. № 2. С. 29.
Ивановская Н.П., Шилов И.П., Иванов А.В. и др. // Рос. нанотехнол. 2019. Т. 14. № 5-6. С. 87; Ivanovskaya N.P., Shilov I.P., Ivanov A.V. et al. // Nanotechnol. Russ. 2019. V. 14. № 5–6. P. 263.
Головин Ю.И., Клячко Н.Л., Мажуга А.Г. и др. // Рос. нанотехнол. 2018. Т. 13. № 5-6. С. 3. Golovin Yu.I., Klyachko N.L., Mazhuga A.G. et al. // Nanotechnol. Russ. 2018. V. 13. № 5–6. P. 3.
Dutz S., Hergt R. // Nanotechnol. 2014. V. 25. Art. № 452001.
Ivanovskaya N.P., Shilov I.P., Shchamkhalov K.S. et al. // Macroheterocycles. 2015. V. 8. № 1. P. 50.
Wu C., Bull B., Christensen K., McNeill J. // Angew. Chem. Int. Ed. 2009. V. 48. P. 2741.
Зиновьев С.В., Иванов А.В. // Мед. физ. 2017. № 4(76). С. 52.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая