Известия РАН. Серия физическая, 2020, T. 84, № 12, стр. 1696-1701
Синтез и апробация наночастиц YVO4:Yb,Er на виноградных улитках для задач биовизуализации
А. Г. Шмелев 1, *, В. Г. Никифоров 1, Д. К. Жарков 1, В. В. Андрианов 1, 2, Л. Н. Муранова 1, 2, А. В. Леонтьев 1, Х. Л. Гайнутдинов 1, 2, В. С. Лобков 1, М. Х. Алькатани 3, Ф. Р. Хеммер 1, 4
1 Казанский физико-технический институт имени Е.К. Завойского – обособленное структурное подразделение Федерального государственного бюджетного учреждения науки “Федеральный исследовательский центр
“Казанский научный центр Российской академии наук”
Казань, Россия
2 Федеральное государственное автономное образовательное учреждение высшего образования
“Казанский (Приволжский) федеральный университет”
Казань, Россия
3 Город науки и техники Короля Абдулазиза, Национальный центр лазерных технологий и оптоэлектроники
Эр-Рияд, Саудовская Аравия
4 Техасский университет A&M, Институт квантовой науки и инжиниринга (IQSE),
отделение физики и астрономии
Колледж-Стейшен, США
* E-mail: sgartjom@gmail.com
Поступила в редакцию 15.07.2020
После доработки 10.08.2020
Принята к публикации 26.08.2020
Аннотация
Вновь синтезированные наночастицы YVO4:Yb,Er были введены в организмы виноградных улиток путем инъекции водных коллоидных растворов. При облучении препаратов из органов животных непрерывным лазером на длине волны 980 нм наблюдалась люминесценция в области 520–560 нм, вызванная излучательными переходами в ионах Er3+. Сравнительный анализ поведенческой активности животных с введенными наночастицами и контрольных животных без наночастиц не выявил признаков токсичности. Показана перспективность использования наночастиц в роли люминесцентных нанозондов в биологических задачах.
ВВЕДЕНИЕ
Техника люминесцентной визуализации с высоким пространственным разрешением, основанная на применении наноразмерных люминесцентных биозондов, приобретает все большую популярность в широкой области задач биологии и биомедицины [1–3]. Традиционно в качестве биозондов выступают молекулы органических красителей, квантовые точки, флюоресцентные протеины и люминесцентные комплексы переходных металлов [4–9]. Однако их применение затруднено рядом существенных ограничений, вызванных, в первую очередь, необходимостью использования УФ излучения, которое активно рассеивается и поглощается биологическими тканями, приводя к их фотодеструкции и вызывая автофлюоресценцию, что сильно ограничивает чувствительность метода. Также следует отметить низкую фотостабильность органических флюорофоров, нежелательно широкий спектр эмиссии флюоресцентных протеинов, мерцание и токсичность квантовых точек [10–19].
Нанокристаллы, допированные ионами редкоземельных металлов, имеют ярко выраженные апконверсионные свойства, которые позволяют применять ближнее ИК излучение, находящееся в “окне прозрачности” биологических тканей, для возбуждения люминесценции в видимом диапазоне. Это дает неоспоримые преимущества при их использовании в качестве люминесцентных биозондов: большая глубина проникновения ближнего ИК излучения в биоткани [20], отсутствие паразитного сигнала автофлюоресценции [21–23], фотостабильность [21, 24, 25] и низкая фотодеструкция биологических молекул [26]. Также следует отметить низкую токсичность апконверсионных наночастиц (АКНЧ) [20, 24, 27, 28].
Особый интерес представляют наночастицы, допированные ионами Yb3+ и Er3+. Данный выбор допантов обусловлен тем, что ионы Yb3+ имеют большое сечение поглощения на длине волны 980 нм и способны эффективно передавать энергию на резонансные уровни ионов Er3+. Апконверсия является результатом последовательности процессов поглощения и переноса энергии через метастабильные состояния ионов, что обеспечивает большую вероятность двухквантовых процессов [29, 30]. Для реализации высокого квантового выхода апконверсионной люминесценции требуются матрицы с низкоэнергетичными фононами [31]. Одной из наиболее широко используемых матриц является кристалл β-NaYF4, энергия фонона которого составляет 350 см–1 [32, 33]. Однако применение данных нанокристаллов в роли биозондов затруднено из-за их токсичности и высокой чувствительности к тушителям люминесценции в водных растворах [34]. В данной работе мы используем в качестве матрицы нанокристаллы YVO4. Несмотря на сравнительно большую энергию фононов 880 см–1, наночастицы YVO4:Yb,Er размером несколько десятков нанометров оказываются слабо чувствительными к воздействию поверхностных тушителей в водных биологических средах. Помимо этого, они считаются малотоксичными [35], что делает их перспективными для применения в качестве нанобиозондов.
Для оценки пригодности АКНЧ в роли бионанозондов были выбраны наземные легочные моллюски – виноградные улитки Helix lucorum крымской популяции. Они, наряду с некоторыми другими видами моллюсков, в настоящее время является популярным объектом биологических исследований, в частности при исследовании нервной системы и поведения [36–38]. Эти экспериментальные животные активно используются для исследования механизмов обучения и памяти благодаря относительно простой нервной системе при богатом разнообразии поведенческих реакций, которые обусловлены сложным взаимодействием безусловных рефлексов, модулируемых процессами привыкания, сенситизации и ассоциативного обучения. Относительная простота нервной системы существенно сужает ансамбль нейронов, обеспечивающих ту или иную поведенческую реакцию. Крупные размеры тел нейронов (до 200–300 мкм в диаметре) позволяют идентифицировать одни и те же клетки у всех особей данного вида, что может быть полезным в экспериментах по визуализации. Большим плюсом для экспериментаторов является также поверхностный характер расположения нейронов в ганглиях, что удобно для регистрации люминесценции АКНЧ.
ЭКСПЕРИМЕНТ
АКНЧ были синтезированы в соответствии со процедурой, описанной в [39–42]. Водный раствор Y(NO3)3, Er(NO3)3, и Yb(NO3)3 (c = 0.1, 0.002 и 0.02 моль/л, соответственно) был медленно добавлен в водный раствор Na3VO4 (c = 0.1 моль/л) при постоянном перемешивании при комнатной температуре. В результате образовался белый осадок, указывающий на наличие наночастиц YVO4:Yb,Er; после этого раствор был высушен до состояния порошка. Коллоидный диоксид кремния был приготовлен путем нагревания тетраэтоксисилана, этанола и дистиллированной воды при pH 1.25, T = 60°C в течение 1 ч. Затем наночастицы были покрыты коллоидным диоксидом кремния и диспергированным полимером (PE6800) (молярное соотношение V : Si : PE6800 = = 1 : 5 : 0.05). После высыхания получилась мезопористая кремневая сетчатая структура, содержащая наночастицы. Кальцинирование проводилось при 500°C в течение 1 ч, а затем наночастицы отжигались 10 мин при температуре 1000°C. После этого кремневая матрица была удалена с помощью трехчасовой обработки в плавиковой кислоте с молярным отношением HF : Si = 9 : 1. Изображение АКНЧ на рис. 1а, полученное на электронном микроскопе, показывает, что размер наночастиц лежит в диапазоне 10–700 нм. На рис. 1б видно, что облучение АКНЧ непрерывным лазером приводит к яркой люминесценции в области 520–560 нм, которую видно невооруженным глазом.
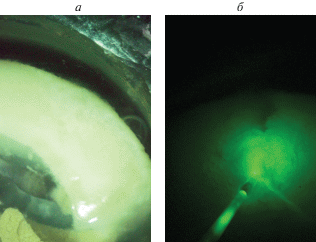
Рис. 1.
Изображение наночастиц YVO4:Yb,Er, полученное на сканирующем электронном микроскопе (а). Апконверсионная люминесценция наночастиц YVO4: Yb, Er, помещенных на дно ячейки с физиологическим раствором, при облучении непрерывным лазером на длине волны 980 нм (б).

В эксперименте использовались виноградные улитки весом 25 г (рис. 2). Перед началом экспериментов животные не менее 2 недель находились в активном состоянии во влажной атмосфере при комнатной температуре (18–22°С) и избытке пищи. Для экспериментов выбирались здоровые на вид, подвижные животные. Инъекции коллоидных растворов АКНЧ проводились за сутки до проведения операций по извлечению биологических тканей. Инъекции были выполнены во внутреннюю полость животных через район синусного узла улитки (где отсутствуют болевые рецепторы), для достижения максимальной безболезненности. Коллоидный раствор АКНЧ готовили в дистиллированной воде с дополнительной процедурой диспергирования в водном ультразвуковом диспергаторе на протяжении 10 мин непосредственно перед инъекцией животным. Животному № 1 ввели коллоидный раствор, содержащий 0.4 мг АКНЧ в 0.2 мл H2O (дозировка 16 мг на 1 кг веса животного). Коллоидный раствор для животного № 2 содержал 5 мг АКНЧ в 0.25 мл H2O (200 мг/кг). Животному № 3 в качестве контроля ввели 0.2 мл H2O.
После проведения инъекций животные содержались совместно в общем террариуме в одинаковых условиях. На протяжении суток от момента инъекций до извлечения тканей и приготовления препаратов проводились визуальные наблюдения за поведением животных, которые не выявили каких-либо различий между контрольной особью и животными, получившими инъекции АКНЧ.
Для исследования особенностей люминесценции АКНЧ в организмах животных были приготовлены изолированные препараты биологических тканей – нервной системы, печени, кожи, сердца. Перед препарированием улитки в целях анестезии помещались в смесь воды со льдом на 15–20 мин. Препарат нервной системы представлял собой изолированный подглоточный комплекс ганглиев, куда входили плевральные, париетальные, педальные и висцеральный ганглии. Препарат кожи (размером 7 × 7 мм толщиной около 2 мм) включал в себя верхний слой кожи и более глубокие слои соединительной и мышечной тканей. Препарат сердца состоял из цельного органа, образец печени был фрагментом цельного органа длиной около 7 мм. Все ткани помещались в физиологический раствор Helix lucorum (солевой раствор) следующего состава: NaCl – 80 мM, KCl – 4 мM, CaCl2 – 7 мM, MgCl2 – 5 мM, NaHCO3 – 5 мM (или Tris – 5 мM); pH –7.6–7.8.
Изолированные препараты тканей улитки помещались на стол микроскопа MEIJI EMZ-5TR (тринокуляр с фотонасадкой), куда излучение полупроводникового лазера мощностью 50 мВт подводилось по одномодовому оптоволокну. Перед объективом помещался абсорбционный светофильтр, отсекающий накачку и пропускающий свет сине-зеленого диапазона. Для регистрации изображений использовалась зеркальная камера Canon EOS 650D в режиме ручной фокусировки и подбора экспозиции, матрица которой была защищена интерференционным светофильтром отсекающим ИК излучение. Типичный набор параметров экспозиции использованных при регистрации изображений был следующим – ISO 1600, f/4, 20 с. Для подавления засветок лаборатория затемнялась.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В работе [43] нами было показано, что синтезированные наночастицы YVO4:Yb,Er сохраняют яркую люминесценцию в водном коллоидном растворе. На рис. 1б показана люминесценция (яркий зеленый свет) АКНЧ, помещенных в ячейку с физиологическим раствором, в которых готовятся препараты животных. Нами не было выявлено изменение яркости люминесценции АКНЧ в течение нескольких суток, что указывает на факт их низкой чувствительности к тушителям люминесценции в водных растворах.
Важно также отметить, что проникновение и накопление наночастиц в различных биологических тканях зависит от их размеров и формы [44‒47]. В связи с этим мы использовали АКНЧ, размер которых варьируется в широком диапазоне 10–700 нм, с целью задействовать все возможные зависящие от размеров сценарии их распределения в тканях животных.
Визуальное наблюдение за животными в течение суток после инъекции наночастиц не выявило различий в их поведении. Данный факт является важным для данного эксперимента, так как прямо указывает на низкую токсичность созданных нами АКНЧ, что открывает перспективы для их применения в качестве люминесцентных биозондов, в том числе в живых системах.
Эксперименты с препаратами тканей животного № 1 показали отсутствие сигнала в области 520–560 нм, обусловленного люминесценцией АКНЧ при излучательных переходах с уровней 2H11/2 и 4S3/2 на основной уровень 4I15/2 иона Er3+. На рис. 3а показана фотография препарата печени, сделанная с подсветкой. Люминесценция АКНЧ во время сканировании поверхности препарата оптоволокном, по которому подводилось излучение непрерывного лазера с длиной волны 980 нм, не задетектирована.
Рис. 3.
Фотография препарата печени животного № 1 (а). Интенсивная люминесценции АКНЧ, находящихся в препарате печени животного № 1 после дополнительной прямой инъекции коллоидного раствора (0.4 мг АКНЧ и 0.2 мл H2O). Лазерное излучение на длине волны 980 нм подавалось по оптоволокну (б).
Чтобы убедиться в возможности регистрации люминесценции АКНЧ, находящихся в тканях животного, была сделана дополнительная инъекция коллоидного раствора, состоящего из 0.4 мг АКНЧ и 0.2 мл H2O, непосредственно в препарат печени животного № 1. Результаты исследования образца после инъекции показаны на рис. 3б, где видна очень яркая зеленая люминесценция тканей при накачке на длине волны 980 нм. Отметим, что этот люминесцентный сигнал наблюдался во время эксперимента невооруженным глазом. На рис. 3б так же хорошо видны блики на оптоволокне, по которому подводилось лазерная накачка.
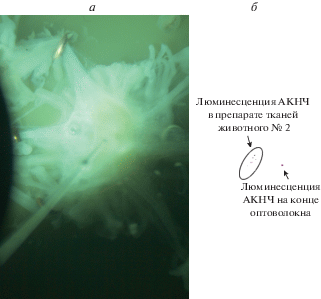
Доза инъекции, сделанной животному № 2, на порядок превышала дозу для животного № 1. Эксперименты показали либо полное отсутствие сигнала люминесценции АКНЧ (как в препаратах животного № 1), либо слабый сигнал, слегка превышающий уровень шума. Именно такой сигнал показан на рис. 4, где приведена фотография подсвеченных тканей нервной системы улитки (а) и люминесцирующий образец (б). Для точного позиционирования оптоволокна, на его конец, выводящий лазерное излучение, были помещены АКНЧ, люминесценция которых отчетливо видна на рис. 4б. Овалом обведена область, где наблюдался слабый сигнал люминесценции, возможно от одиночных АКНЧ, находящихся в тканях препарата.
Рис. 4.
Фотография препарата нервной системы животного № 2 (а). Слабая люминесценция АКНЧ, находящихся на выводящем конце оптоволокна и в тканях препарата. Лазерное излучение на длине волны 980 нм подавалось по оптоволокну. Цвета инвертированы (б).
Отсутствие сигнала в препаратах животного № 1 и наличие слабого сигнала в препаратах животного № 2 указывают на то, что, по всей видимости, АКНЧ были успешно выведены животными за сутки. Детальная информация о скорости их выведения из живых организмов требует дополнительных исследований, однако полученные данные позволяют сделать предварительное заключение о возможности безопасного применения АКНЧЧ YVO4:Yb,Er в области биомедицины.
ВЫВОДЫ
Были синтезированы наночастицы YVO4:Yb,Er, которые обладают эффективной апконверсией: в водном коллоидном растворе этих наночастиц наблюдается яркая люминесценция в области 520–560 нм, вызванная излучательными переходами с уровней 2H11/2 и 4S3/2 на основной уровень 4I15/2 иона Er3+ при облучении непрерывным диодным лазером на длине волны 980 нм. АКНЧ вводились виноградным улиткам в виде инъекций водных коллоидных растворов, что не приводило к изменениям в поведении животных и морфологии их внутренних органов в течении суток, по сравнению с контрольными животными. Отсутствие интенсивного сигнала люминесценции АКНЧ в исследованных препаратах и его появление после дополнительной инъекции коллоидного раствора АКНЧ в препарат печени может указывать на то, что АКНЧ были выведены животными в течение одних суток. Однако данный вопрос требует дополнительных исследований.
Таким образом, перечисленные факты позволяют заключить, что синтезированные нами АКНЧ YVO4:Yb,Er являются перспективными низкотоксичными высоколюминесцентными бионанозондами, пригодными для использования в широкой области биологических приложений.
Работы по синтезу АКНЧ были выполнены при финансовой поддержке гранта Правительства РФ по постановлению № 220, договор № 14.W03.31.0028 с ведущей организацией КФТИ ФИЦ КазНЦ РАН; спектроскопические исследования проводились в рамках работ по грантам РФФИ (проекты №№ 19-02-00569 и 20-02-00545). Работы с животными выполнялись в рамках выполнения государственного задания.
Список литературы
Berezin M.Y., Achilefu S. // Chem. Rev. 2010. V. 110. P. 2641.
Kobayashi H., Ogawa M., Alford R. et al. // Chem. Rev. 2010. V. 110. P. 2620.
Louie A. // Chem. Rev. 2010. V. 110. P. 3146.
Lau J.S.Y., Lee P.K., Tsang K.H.K. et al. // Inorg. Chem. 2009. V. 48. P. 708.
Malkani N., Schmid J.A. // PLoS One. 2011. V. 6. Art. № e18586.
Medintz L., Uyeda H.T., Goldman E.R., Mattoussi H. // Nat. Mater. 2005. V. 4. P. 435.
Wang C., Ma Q., Dou W.C. et al. // Talanta. 2009. V. 77. P. 1358.
Yu M.X., Zhao Q., Shi L.X. et al. // Chem. Commun. 2008. P. 2115.
Zhao Q., Yu M.X., Shi L.X. et al. // Organometal. 2010. V. 29. P. 1085.
Hilderbrand S.A., Shao F.W., Salthouse C. et al. // Chem. Commun. 2009. P. 4188.
Karimullin K.R., Arzhanov A.I., Eremchev I.Yu. et al. // Laser Phys. 2019. V. 29. № 12. Art. № 124009.
Karimullin K.R., Knyazev M.V., Arzhanov A.I. et al. // J. Phys. Conf. Ser. 2017. V. 859. Art. № 012010.
Каримуллин К.Р., Аржанов А.И., Наумов А.В. // Изв. РАН. Сер. физ. 2018. Т. 82. № 11. С. 1620; Karimullin K.R., Arzhanov A.I., Naumov A.V. // Bull. Russ. Acad. Sci. Phys. 2018. V. 82. № 11. P. 1478.
Аржанов А.И., Каримуллин К.Р., Наумов А.В. // Кр. cообщ. по физ. ФИАН. 2018. Т. 45. № 3. С. 39; Arzhanov A.I., Karimullin K.R., Naumov A.V. // Bull. Lebedev Phys. Inst. 2018. V. 45. № 3. P. 91.
Larson D.R., Zipfel W.R., Williams R.M. et al. // Science. 2003. V. 300. P. 1434.
van de Rijke F., Zijlmans H., Li S. et al. // Nat. Biotechnol. 2001. V. 19. P. 273.
Nikiforov V.G., Leontyev A.V., Shmelev A.G. et al. // Laser Phys. Lett. 2019. V. 16. № 6. Art. № 065901.
Leontyev A.V., Shmelev A.G., Zharkov D.K. et al. // Laser Phys. Lett. 2019. V. 16. № 1. Art. № 015901.
Михайлов А.Н., Костюк А.Б., Королев Д.С. и др. // Изв. РАН. Сер. физ. 2012. Т. 76. № 2. С. 243; Mikhaylov A.N., Kostyuk A.B., Korolev D.S. et al. // Bull. Russ. Acad. Sci. Phys. 2012. V. 76. № 2. P. 214.
Chatterjee D.K., Rufaihah A.J., Zhang Y. // Biomat. 2008. V. 29. P. 937.
Idris N.M., Li Z.Q., Ye L. et al. // Biomat. 2009. V. 30. P. 5104.
Johnson N.J.J., Sangeetha N.M., Boye J.C., van Veggel F.C.J.M. // Nanoscale. 2010. V. 2. P. 771.
Wu X.J., Zhang Q.B., Wang X. et al. // Eur. J. Inorg. Chem. 2011. P. 2158.
Park Y. I., Kim J.H., Lee K.T. et al. // Adv. Mater. 2009 V. 21. P. 4467.
Sudhagar S., Sathya S., Pandian K., Lakshmi B. // Biotech. Lett. 2011. V. 33 P. 1891.
Jiang S., Zhang Y. // Langmuir. 2010. V. 26. P. 6689.
Jalil A.R., Zhang Y. // Biomat. 2008. V. 29. P. 4122.
Xiong L.Q., Yang T.S., Yang Y. et al. // Biomat. 2010. V. 31. P. 7078.
Gamelin D.R., del Gu H.U. // Top. Curr. Chem. 2001. V. 214. P. 1.
Auzel F. // Chem. Rev. 2004. V. 104. P. 139.
Баженов А.В., Фурсова Т.Н., Кедров В.В. и др. // Изв. РАН. Сер. физ. 2008. Т. 72. № 8. С. 1180; Bazhenov A.V., Fursova T.N., Kedrov V.V. et al. // Bull. Russ. Acad. Sci. Phys. 2008. V. 72. № 8. P. 1114.
Joubert M.F. // Opt. Mater. 1999. V. 11. P. 181.
Goldner P., Pellé F. // J. Lumin. 1993. V. 55. P. 197.
Рочева В.В., Хоченков Д.А., Генералова А.Н. и др. // Изв. РАН. Сер. физ. 2016. Т. 80. № 4. С. 513; Roc-heva V.V., Generalova A.N., Nechaev A.V. et al. // Bull. Russ. Acad. Sci. Phys. 2016. V. 80. № 4. P. 467.
Petrochenko P.E., Zhang Q., Wildt B. et al. // Int. J. Appl. Ceram. Technol. 2012. P. 1.
Balaban P.M. // Neurosci. Biobehav. Rev. 2002. V. 26. № 5. P. 597.
Kiss T., Pirger Z., Kemenes G. // Neurobiol. Learn. Mem. 2009. V. 92. P. 114.
Andrianov V.V., Bogodvid T.Kh., Deryabina I.B. et al. // Front. Behav. Neurosci. 2015. V. 9. P. 1.
Mialon G., Turkcan S., Alexandrou A. et al. // J. Phys. Chem. C. 2009. V. 113. P. 18699.
Mialon G., Turkcan S., Dantelle G. et al. // J. Phys. Chem. C. 2010. V. 114. P. 22449.
Alkahtani M.H., Alghannam F.S., Sanchez C. et al. // Nanotech. 2016. V. 27. P. 485501.
Жарков Д.К., Шмелев А.Г., Леонтьев А.В. и др. // Изв. РАН. Сер. физ. 2020. Т. 84. № 3. С. 317; Zharkov D.K., Shmelev A.G., Leontyev A.V. et al. // Bull. Russ. Acad. Sci. Phys. 2020. V. 84. № 3. P. 241.
Zharkov D.K., Shmelev A.G., Leontyev A.V. et al. // Laser Phys. Lett. 2020. V. 17. № 7. Art. № 075901.
Etame A.B., Smith C.A., Chan W.C., Rutka J.T. // Nanomed. 2011. V. 7. P. 992.
Hanada S., Fujioka K., Inoue Y. et al. // Int. J. Mol. Sci. 2014. V. 15. P. 1812.
Decuzzi P., Godin B., Tanaka T. et al. // Contr. Release. 2010. V. 141. P. 320.
Kolhar P., Anselmo A.C., Gupta V. et al. // Proc. Nat. Acad. Sci. USA. 2013. V. 110. P. 10753.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая



