Известия РАН. Серия физическая, 2020, T. 84, № 6, стр. 799-802
Развитие методов акустической микроскопии для наблюдения процессов остеогенеза в регенеративной медицине
Ю. С. Петронюк 1, 2, *, Е. А. Храмцова 1, В. М. Левин 1, А. П. Бонарцев 3, 4, В. В. Воинова 3, Г. А. Бонарцева 4, А. А. Мураев 5, Т. Ф. Асфаров 5, Н. А. Гусейнов 5
1 Федеральное государственное бюджетное учреждение науки “Институт биохимической физики
имени Н.М. Эмануэля Российской академии наук”
Москва, Россия
2 Федеральное государственное бюджетное учреждение науки “Научно-технологический центр
уникального приборостроения Российской академии наук”
Москва, Россия
3 Федеральное государственное бюджетное образовательное учреждение высшего образования
“Московский государственный университет имени М.В. Ломоносова”, биологический факультет
Москва, Россия
4 Федеральный исследовательский центр “Фундаментальные основы биотехнологии” Российской академии наук, Институт биохимии имени А.Н. Баха
Москва, Россия
5 Федеральное государственное автономное образовательное учреждение высшего образования
“Российский университет дружбы народов”, медицинский институт
Москва, Россия
* E-mail: jps7@mail.ru
Поступила в редакцию 16.12.2019
После доработки 20.01.2020
Принята к публикации 26.02.2020
Аннотация
Ультразвуковые методы визуализации высокого разрешения необходимы для неинвазивной диагностики искусственных клеточно-матричных систем. Результаты экспериментальных исследований показывают, что метод чувствителен к вариациям упругих свойств биополимерных образцов, эффективен для обнаружения микро- и макропустот и наблюдения за процессами биодеградации в тканеинженерных конструкциях (ТИК).
ВВЕДЕНИЕ
В регенеративной медицине формирование тканеинженерной конструкции выполняется путем заполнения биоразлагаемого полимерного матрикса клеточной составляющей [1]. Наблюдение за состоянием такого изделия включает в себя несколько этапов: мониторинг в процессе разработки биосовместимого матрикса, подготовку культуры клеток, этап соединения этих компонентов в тканеинженерный продукт и обеспечение условий для реконструкции тканей или органа. Оценка состояния имплантов, оптимизация их биоинженерных свойств является основой для их применения в хирургии человека. В настоящее время для оценки объемной микроструктуры матриксов используется электронная и оптическая микроскопии [2], которые требуют гистологической подготовки образцов, связанной с нарушениями их целостности. В этой связи пристальное внимание уделяется разработке новых неинвазивных, прижизненных методов исследования искусственных тканеинженерных систем с помощью высокочастотного ультразвука [3, 4]. В работе показана возможность применения методов ультразвуковой визуализации для тканевой инженерии. Высокочастотный ультразвук (50–200 МГц) проникает на достаточную глубину в объем используемых в тканевой инженерии материалов, не повреждая их за счет невысокой интенсивности излучения и короткой длительности импульсов (несколько мВт ⋅ см–2) [5–7].
На данный момент существует множество работ, посвященных изучению клеток, тканей и даже отдельных органов человека и животных в нормальном состоянии, при патологии и возрастных изменениях методами акустической микроскопии [8, 9]. Однако работы по использованию высокочастотной ультразвуковой диагностики в регенеративной медицине все еще единичны [10–15].
Целью данной работы было исследование методами акустической микроскопии микроструктуры и упругих свойств синтетического полимерного костного матрикса (импланта), применяемого для замещения костных дефектов. Исследование проводилось в процессе создания в нем пористой структуры и для наблюдения процессов биодеградации полимерного костного импланта в живой системе.
ЭКСПЕРИМЕНТАЛЬНОЕ НАБЛЮДЕНИЕ И ОБСУЖДЕНИЕ
Материалы и методы исследования
Исследование включало в себя наблюдение микроструктуры образцов костного матрикса из биополимерного материала (поли-3-оксибутирата, ПОБ) на этапе разработки и в процессе регенерации критических дефектов на черепах крыс с применением образцов, засеянных мезенхимальными стволовыми клетками (МСК). Процедура изготовления пористых матриксов детально описана в работах [16–20].
Для эксперимента было изготовлено три типа пористых матриксов: на основе чистого ПОБ, заполненного альгинатным гелем, композита из ПОБ с гидроксиапатитом (ГА), заполненного альгинатным гелем, и на основе композита ПОБ с ГА, заполненного альгинатным гидрогелем и предварительно засеянного МСК.
По центру теменной кости черепа крысы был смоделирован костный дефект цилиндрической формы диаметром 8 мм и толщиной 1.5 мм. Для придания матриксу необходимой формы была выполнена компьютерная томография головы крысы, моделирование и 3D-печать форм для изготовления костных имплантов [20].
Исследование морфологии и структуры полученных матриксов проводили с использованием сканирующего электронного микроскопа JSM-6380LA (СЭМ). С этой целью образцы напыляли золотом 15 мин при силе тока 15 мА.
Методами импульсной акустической микроскопии исследовали объемную структуру матриксов in vitro, до и после их применения для регенерации костной ткани. Для экспериментов применяли иммерсионные акустические объективы с рабочей частотой 50 и 100 МГц. Генератор импульсов формировал короткий зондирующий сигнал длительностью 30–40 нс и амплитудой 30 В. Перемещение акустической линзы осуществляли прецизионными двигателями с шагом 30 мкм. Акустические изображения формировались в виде сечений в плоскости сканирования (С-скан) или сечения по глубине (В-скан), традиционного в медицинской практике. Режим динамического фокусирования позволил получить контрастные изображения по всей глубине сканирования (B/D-скан). Эксперимент был выполнен в соответствии с “Правилами проведения работ с использованием экспериментальных животных”, приказами МЗ СССР № 755 от 12.08.1977 г., № 701 от 24.07.1978 г. и “Правилами лабораторной практики в Российской Федерации” от 19.06.2003 г. Методика операции по регенерации костной ткани была описана ранее в [20].
Пористость матриксов оценивали путем взвешивания и измерения его объема. С учетом плотности биополимера (1.25 г ⋅ см–3) рассчитывали пористость по формуле: П = (1 – m1/m2) × 100%, где m1 – измеренная масса пористого образца, m2 – расчетная масса монолитного образца без пор, объем которого совпадает с объемом пористого образца. Наличие открытых пор наблюдали методами акустической микроскопии на образцах пропитанных альгинатным гелем и с помощью СЭМ на окрашенных чернилами образцах.
Результаты и обсуждение
Внешний вид образов костного импланта из ПОБ показан на рис. 1. Изучение образцов полимерных подложек методом сканирующей электронной микроскопии (рис. 1б) показало, что матриксы имеют трехмерную пористую структуру с размером пор от 23 ± 8 до 410 ± 75 мкм. Размер микропор более 300 мкм считается оптимальным для проникновения питательных веществ и клеток во всем объеме материала [21]. Путем окрашивания было установлено, что матриксы имеют сообщающуюся систему пор. В среднем пористость матриксов составила 93%.
Рис. 1.
Микроструктура образцакостного каркаса из биополимерного материала (поли-3-оксибутирата, ПОБ): а – фото образца, пропитанного альгинатом натрия, б – сканирующая электронная микроскопия пористой структуры.

Методами импульсной акустической микроскопии было показано, что матрикс имеет высокопористую микроструктуру (рис. 2а). Максимальная величина амплитуды эхо-сигнала 1 характерна для воздушных полостей (рис. 2б). Неоднородное распределение акустического контраста на изображениях свидетельствует о степени пропитки пористых образцов жидкой составляющей (альгинат). Наличие на В-скане образца (рис. 2б) эхо-сигнала от подложки 2 обусловлено высокой степенью пропитки, что делает пористый образец толщиной 1.5 мм проницаемым для ультразвука (f = 100 МГц).
Рис. 2.
Акустические изображения образца костного матрикса из поли-3-оксибутирата: а – С-скан на глубине 200–400 мкм; б – поперечное сечение образца (В/D-скан). 1 – образец, 2 – подложка, 3 – пузырек воздуха внутри пропитанной альгинатом структуры.

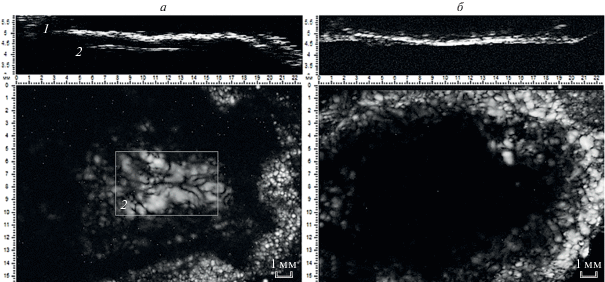
Методом импульсной акустической микроскопии исследовали процесс регенерации костной ткани и биодеградации импланта в живой системе. На рис. 3 представлены акустические изображения (С- и В/D-сканы) черепа крысы через 1 месяц после имплантации. В одном случае имплант в виде полимерного матрикса на основе ПОБ был заполнен только альгинатным гидрогелем, в другом случае матрикс был выполнен на основе композита ПОБ с ГА, а в альгинатном гидрогеле содержались МСК. На изображениях видно, что в первом случае определяется область дефекта под поверхностью черепа (рис. 3а); зона имеет размытые очертания, ее размер составляет приблизительно 5 × 8 мм. Во втором случае (рис. 3б) область дефекта не удалось обнаружить.
Рис. 3.
Акустические изображения (В/D-сканы вверху и С-сканы, внизу) имплантированных образцов костного каркаса из поли-3-оксибутирата в черепе крысы через месяц после операции: а – матрикс, пропитанный альгинатом; б – матрикс с альгинатом, частицами гидроксиапатита и мезенхимальными стволовыми клеткам: 1 – поверхность черепа, 2 – область дефекта.
ЗАКЛЮЧЕНИЕ
Приведены результаты исследования искусственных тканеинженерных конструкций методами импульсной акустической микроскопии. Получены предварительные данные о возможности применения методов ультразвуковой визуализации в регенеративной медицине. Экспериментально исследовались гибридные полимерные 3D‑матриксы заданной формы и микроструктуры из биосовместимых поли-3-оксибутирата и альгината натрия. Ультразвуковая визуализация применялась на этапе формирования тканеинженерной конструкции и для оценки ее терапевтической эффективности на критическом дефекте костной ткани на лабораторных крысах.
Показано, что матрикс обладает высокопористой микроструктурой, однородность которой можно наблюдать на акустических изображениях. Сравнительный анализ акустических изображений тканеинженерной конструкции трех видов – ПОБ с АГ, ПОБ/ГА с АГ, ПОБ/ГА с АГ и МСК, полученных в процессе их имплантации и последующей регенерации костной ткани, показало, что наличие клеточной культуры способствовало выраженной стимуляции репаративного остеогенеза, что согласуется с данными гистологичиеского исследования.
Работа выполнена в рамках государственного задания. Подготовка образцов для настоящего исследования выполнена при поддержке Российского научного фонда (проект № 15-15-10014). Авторы благодарят организаторов научного семинара “Успехи акустики-2019”.
Список литературы
Bonartsev A.P., Zharkova I.I., Yakovlev S.G. et al. // J. Biomater. Tissue Engin. 2016. V. 6. № 1. P. 42.
Polak J.M., Bishop A.E. // Ann. N.Y. Acad. Sci. 2006. V. 1068. P. 352.
Gelse K., Olk A., Eichhorn S. et al. // Eur. Cells Mater. 2010. V. 19. P. 58.
Tanaka Y., Saijo Y., Fujihara Y. et al. // J. Biosci. Bioengin. 2012. V. 113. № 2. P. 252.
Zakutailov K.V., Levin V.M., Petronyuk Y.S. // Inorg. Mater. 2010. V. 46. P. 1655.
Khramtsova E., Morokov E., Lukanina K. et al. // Polymer Engin. Sci. 2017. V. 57. № 7. P. 697.
Субочев П.В., Орлова А.Г., Турчин И.В. и др. // Изв. РАН. Сер. физ. 2018. Т. 82. № 5. С. 572; Subochev P.V., Orlova A.G., Turchin I.V. et al. // Bull. Russ. Acad. Sci. Phys. 2018. V. 82. № 5. P. 502.
Foster F.S., Zhang M.Y., Zhou Y.Q. et al. // Ultrasound Med. Biol. 2002. V. 28. № 9. P. 1165.
Greco A., Mancini M., Gargiulo S. et al. // J. Biomed. Biotech. 2012. Art. № 519238.
Saijo Y., Okawai H., Sasaki H. et al. // Artific. Organs. 2000. V. 24. P. 64.
Yu J., Takanari K., Hong Y. et al. // Biomater. 2013. V. 34. № 11. P. 2701.
Kheirallah M., Almeshaly H. // Int. J. Dentistry Oral Sci. 2016. V. 03. № 5. P. 247.
Gudur M.S.R., Rao R.R., Peterson A.W. et al. // PLOS One. 2014. V. 9. № 1. P. 1.
Jardini A.L., Larosa M.A., Maciel Filho R. // J. Cranio Maxillofac. Surg. 2014. V. 42. № 8. P. 1877.
Francois E.L., Yaszemski M.J. // Principles of regenerative medicine. Academic Press, 2019. P. 761.
Бонарцев А.П., Бонарцева Г.А., Шайтан К.В. и др. // Биомед. хим. 2011. Т. 57. № 4. С. 374.
Гажва Ю.В., Бонарцев А.П., Мухаметшин Р.Ф. и др. // Совр. технол. в мед. 2014. Т. 6. № 1. С. 6.
Иванов С.Ю., Бонарцев А.П., Гажва Ю.В. и др. // Биомед. хим. 2015. Т. 61. № 6. С. 717.
Bai H. Y., Chen G.A., Mao G.H. et al. // J. Biomed. Mater. Res. A. 2010. V. 94. № 2. P. 539.
Мураев А.А., Бонарцев А.П., Гажва Ю.В. и др. // Совр. технол. в мед. 2016. Т. 8. № 4. С. 42.
Karageorgiou V., Kaplan D. // Biomater. 2005. V. 26. № 27. P. 5474.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая


