Известия РАН. Серия физическая, 2020, T. 84, № 9, стр. 1313-1316
Смешанные медно-никелевые комплексы нитрило-трис-метиленфосфоновой кислоты: синтез, структурные особенности, влияние на коррозионно-электрохимическое поведение углеродистой стали
Ф. Ф. Чаусов 1, *, Н. В. Ломова 1, Н. В. Сомов 2, С. М. Решетников 1, В. Л. Воробьёв 1, И. С. Казанцева 1
1 Федеральное государственное бюджетное учреждение науки
“Удмуртский федеральный исследовательский центр Уральского отделения Российской академии наук”
Ижевск, Россия
2 Федеральное государственное автономное образовательное учреждение высшего образования
“Национальный исследовательский Нижегородский государственный университет имени Н.И. Лобачевского”
Нижний Новгород, Россия
* E-mail: chaus@udman.ru
Поступила в редакцию 19.03.2020
После доработки 10.04.2020
Принята к публикации 27.05.2020
Аннотация
Описаны синтез и кристаллохимические закономерности формирования смешанных нитрило-трис-метиленфосфонатных комплексов в системе [CuxNi(1 –x){N(CH2PO3)3}]Na4 · nH2O (x = 0–1). Взаимодействие полученных комплексных соединений с поверхностью стали 20 исследовано методом РФЭС. Влияние адсорбированных слоев комплексов на коррозионно-электрохимическое поведение поверхности стали в водной среде исследовано потенциодинамическим методом. Показано, что взаимодействие медно-никелевых комплексов с поверхностью стали сопровождается обменными процессами и приводит к формированию поверхностных слоев с различным составом и противокоррозионными свойствами.
ВВЕДЕНИЕ
В последнее время большое внимание уделяется изучению комплексов нитрило-трис-метиленфосфоновой кислоты H6{N(CH2PO3)3} (H6NTP) с металлами [1, 2]. Металлокомплексы NTP успешно применяются в качестве ингибиторов коррозии стали в водных средах [3, 4]. Ранее были обстоятельно изучены комплексы NTP с медью [5] и никелем [6], однако смешанные медно-никелевые комплексы не были исследованы.
В настоящей работе описывается синтез и особенности структуры медно-никелевых комплексов NTP [CuxNi(1 –x){N(CH2PO3)3}]Na4 · nH2O (x = = 0–1) и их влияние на коррозионно-электрохимическое поведение стали в водных средах.
МЕТОДИКА ПРОВЕДЕНИЯ ИССЛЕДОВАНИЙ
Смешанные комплексы получали, растворяя навески гидроксокарбонатов в водном растворе 1 моль NTP (предварительно дважды перекристаллизованной, не более 0.3% ${\text{PO}}_{{\text{4}}}^{{{\text{3}}--}}$) и 4 моль NaOH (х. ч., ГОСТ 4328-77). Кристаллы смешанных комплексов выращивали при комнатной температуре при медленном испарении растворителя.
Рентгеноструктурный анализ проводили на дифрактометрах Rigaku XtaLAB Pro: Kappa single Xcalibur и Oxford Diffraction Sapphire3 Gemini S. Первичные фрагменты структур были найдены прямым методом. Положения атомов определили из разностного синтеза электронной плотности и уточнили в анизотропном (для атомов водорода – в изотропном) приближении методом наименьших квадратов (МНК) по |F|2.
Определение атомной доли меди и никеля в полученных кристаллах проводили параллельно и независимо тремя методами – рентгенофлуоресцентным (спектрометр “Innov-X Alpha-2000”, США), спектрофотометрическим (безреагентная спектрофотометрия ионов аквакомплексов [Cu(H2O)6]2+ и [Ni(H2O)6]2+, спектрофотометр СФ-56) и титриметрическим (по ГОСТ 10398-76, титрование никеля после осаждения меди дитионитом натрия Na2S2O4, определение содержания меди по разности).
Рентгенофазовый анализ (РФА) полученных кристаллов проводили на дифрактометре ДРОН-6 в Fe-Kα излучении. Определение содержания триклинной и моноклинной кристаллических фаз проводили методом Ритвельда.
РЭС валентной полосы полученных комплексов и их адсорбционных слоев на поверхности стали проводили при помощи отечественного рентгеноэлектронного спектрометра, разработанного Физико-техническим институтом УрО РАН [7] с Al-Kα возбуждением (hν = 1486.6 эВ). Образцы полученных комплексов наносили в виде концентрированных растворов на графитовую подложку. Спектры электронов остовных уровней получали на спектрометре SPECS с полусферическим электростатическим энергоанализатором Phoibos-150 (Deutschland), при возбуждении излучением Mg-Kα (hν = 1253.6 эВ). Образцы измельченных кристаллических продуктов впрессовывали в подложку из индия (99.9%).
Коррозионно-электрохимическое поведение образцов в среде боратного буферного раствора Холмса [8] с pH = 7.6 в условиях естественной аэрации исследовали в потенциодинамическом режиме при помощи потенциостата Ecolab-2a-500 (ООО “Эковектор”, г. Ижевск). Перед испытаниями каждый из образцов стали 20 с полученными адсорбционными слоями, высушивали при заданной температуре (100, 200, 300 и 400°С), охлаждали и помещали в электрохимическую ячейку. Измерения проводили при 25 ± 2°C по трехэлектродной схеме, используя платиновый вспомогательный электрод и электрод сравнения Ag, AgCl|KCl (нас.)
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
При кристаллизации смешанных комплексных соединений меди и никеля с нитрило-трис-метиленфосфоновой кислотой [CuxNi(1 – x) {N(CH2PO3)3}]Na4 · nH2O (x = 0–1) из водных растворов происходит конкурентное образование двух фаз. Если атомная доля меди в растворе превышает 1/4, то образуется в основном триклинная фаза [(Cu,Ni){N(CH2PO3)3}]Na4 · 13H2O. Атомы меди и никеля координированы в окружении тригональной бипирамиды, в плоскости основания которой лежат атомы кислорода трех различных PO3-групп молекулы лиганда, в одной вершине – атом азота, в противоположной вершине – атом кислорода соседней молекулы лиганда (рис. 1а). Если же атомная доля меди в растворе меньше 1/4, то образуется в основном моноклинная никельсодержащая фаза [Ni(H2O){N(CH2PO3)3}]Na4 · · 11H2O. Координационный полиэдр никеля – октаэдр, в трех меридионально расположенных вершинах которого находятся атомы кислорода различных PO3-групп молекулы лиганда, а в трех других вершинах – атом азота, молекула воды и атом кислорода соседней молекулы лиганда (рис. 1б). Атомы меди в триклинной фазе легко замещаются атомами никеля с образованием кристаллов гетерометаллических комплексов, содержащих до 32.8% Ni. Возможность замещения атомов меди в моноклинной фазе на атомы никеля незначительна, поэтому моноклинная фаза содержит лишь следовые количества меди. В широкой области значений состава раствора образуются кристаллические продукты, содержащие обе фазы.
Рис. 1.
Молекулярная структура медно-никелевых комплексов нитрило-трис-метиленфосфоновой кислоты: а – фаза с преобладанием меди, б – фаза с преобладанием никеля.
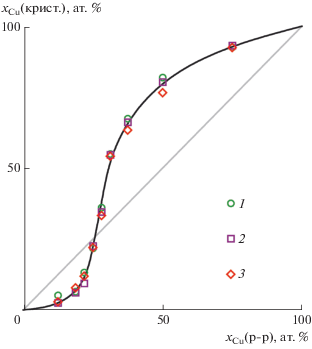
Зависимость общей атомной доли меди в полученных кристаллических фракциях xCu(крист.) от атомной доли меди в растворе xCu(р-р) (рис. 2) имеет нелинейный характер, указывающий на наличие энергетического барьера для замещения атомов металла в кристаллической фазе. Кристаллы с xCu (крист.) = xCu (р-р), образуются при xCu (р-р) = 27 ат. %.
Рис. 2.
Зависимость атомной доли меди в кристаллическом продукте xCu(крист) от атомной доли меди в растворе xCu(р-р) по данным спектрофотометрического (1), рентгенофлуоресцентного (2) и комплексонометрического (3) анализа.
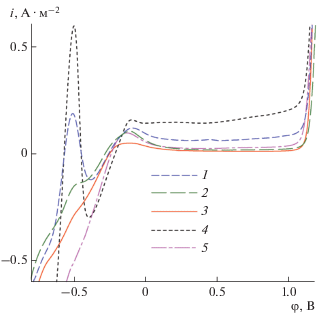
На рис. 3 представлены потенциодинамические кривые в боратном буферном растворе Холмса образцов стали 20 в свободном состоянии (4) и с адсорбированными слоями комплексов CuNTP (1), NiNTP (2), (Cu,Ni)NTP (3) и свободной NTP (5), термообработанными при 400°C. Наименьшей величиной тока коррозии как в области активного растворения, так и в области пассивного состояния металла обладает образец, обработанный (Cu,Ni)NTP. Это свидетельствует о синергетическом эффекте продуктов обменного взаимодействия NTP-комплексов меди и никеля с поверхностью стали, которое приводит к формированию прочного защитного слоя при термической обработке адсорбированного слоя смешанного комплекса.
Рис. 3.
Анодные поляризационные кривые образцов стали 20 в исходном состоянии (4) и с адсорбционными слоями CuNTP (1), NiNTP (2), (Cu,Ni)NTP (3) и свободной NTP (5). Плотность тока анодного растворения стали i как функция потенциала φ рабочего электрода относительно электрода сравнения Ag, AgCl|KCl(нас.)
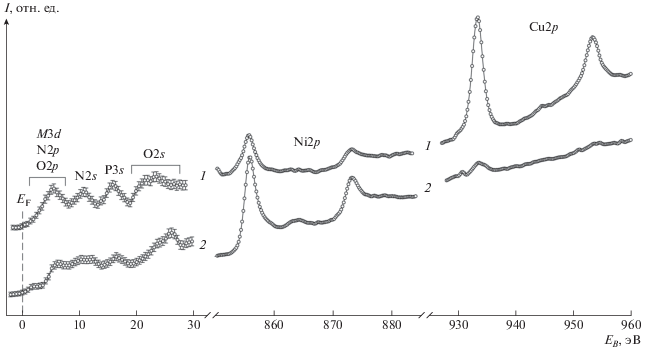
На рис. 4 представлены РФЭ-спектры триклинной (кривая 1) и моноклинной (кривая 2) фаз. В области спектра слабосвязанных электронов при EB = 0–8 eV наблюдаются занятые сильно делокализованные электронные состояния, которые могут рассматриваться как комбинация, преимущественно, M3d, N2p и O2p. При EB = 10–13 eV наблюдается вклад N2s-состояний, в области EB = 15–18 eV – вклад P3s-состояний. Спектр O2s-состояний (EB = 20–28 eV) заметно различается для триклинной (1) и моноклинной (2) фаз. Для триклинной фазы со средней длиной связи M–O = 2.02 Å существенное перекрывание электронных состояний атомов металла и кислорода приводит к возникновению плеча в области EB = = 20–22 эВ. В структуре моноклинной фазы со средней длиной связи M–O = 2.08 Å заметное перекрывание электронных состояний отсутствует, что приводит к смещению спектра O2s в область EB = 25–28 эВ. Спектр Ni2p обеих фаз представлен спин-орбитальным дублетом с составляющими Ni2p3/2 (EB = 855.9 эВ) и Ni2p1/2 (EB = 873.4 эВ), ΔNi2p = 17.5 эВ, что характерно для координационных соединений Ni(II). В спектре Ni2p моноклинной фазы (2) наблюдается shake-up сателлит с максимумом при EB = 864.3 эВ, а в спектре триклинной фазы (1) заметная сателлитная структура не наблюдается. Спектр Cu2p триклинной фазы (1) содержит спин-орбитальный дублет с составляющими Cu2p3/2 (EB = 933.4 эВ) и Cu2p1/2 (EB = 953.3 эВ), ΔCu2p = 19.9 эВ, что типично для координационных соединений Cu(II). Shake-up сателлит наблюдается в спектре Cu2p триклинной фазы (1) при EB = 944.4 эВ. В спектре моноклинной фазы (2) прослеживается лишь следовое присутствие меди.
ВЫВОДЫ
1. Исследовано поведение гетерометаллических комплексов NTP [CuxNi(1 – x) {N(CH2PO3)3}]Na4 · · nH2O (x = 0–1) при росте кристаллов из водных растворов. Выделены две фазы, образующиеся при росте кристаллов. Фаза, богатая медью, имеет тригональную структуру и близка к ранее изученному NTP-комплексу меди. Фаза, богатая никелем – моноклинная и по структуре близка к ранее изученному NTP-комплексу никеля.
2. Атомы меди в триклинной фазе легко замещаются атомами никеля с образованием кристаллов гетерометаллических комплексов, содержащих до 32.8% Ni. Возможность замещения атомов меди в моноклинной фазе на атомы никеля незначительна, поэтому моноклинная фаза содержит лишь следовые количества меди. В широкой области значений состава раствора образуются кристаллические продукты, содержащие обе фазы. При содержании меди в растворе свыше 1/4 преобладает триклинная фаза, а при содержании меди в растворе менее 1/4 – моноклинная.
3. Различия в структуре триклинной и моноклинной фаз приводят к тому, что для моноклинной фазы межатомные расстояния M–L больше, чем для триклинной, вследствие чего характер перекрывания электронных оболочек атомов отличается и вклад ковалентной составляющей в химическую связь M–L для моноклинной фазы меньше, чем для триклинной.
Список литературы
Cabeza A., Ouyang X., Sharma C.V.K. et al. // Inorg. Chem. 2002. V. 41. P. 2325.
Сомов Н.В., Чаусов Ф.Ф. // Кристаллогр. 2014. Т. 59. № 1. С. 71; Somov N.V., Chausov F.F. // Crystallogr. Rep. 2014. V. 59. № 1. P. 66.
Кузнецов Ю.И. // Усп. хим. 2004. Т. 73. № 1. С. 79; Kuznetsov Yu.I. // Russ. Chem. Rev. 2004. V. 73. № 1. P. 75.
Ломова Н.В., Чаусов Ф.Ф., Шабанова И.Н. // Изв. РАН. Сер. физ. 2018. Т. 82. № 7. С. 975; Lomova N.V., Chausov F.F., Shabanova I.N. // Bull. Russ. Acad. Sci. Phys. 2018. V. 82. № 7. P. 884.
Сомов Н.В., Чаусов Ф.Ф. // Кристаллогр. 2015. Т. 60. № 2. С. 233; Somov N.V., Chausov F.F. // Crystallogr. Rep. 2015. V. 60. № 2. P. 210.
Сомов Н.В., Чаусов Ф.Ф., Закирова Р.М., Федотова И.В. // Кристаллогр. 2016. Т. 61. № 2. С. 238; Somov N.V., Chausov F.F., Zakirova R.M., Fedotova I.V. // Crystallogr. Rep. 2016. V. 61. № 2. P. 216.
Trapeznikov V.A., Shabanova I.N., Kholzakov A.V., Ponomaryov A.G. // J. Electron Spectrosc. 2004. V. 137. P. 383.
Holmes W. // Anat. Rec. 1943. V. 86. № 2. P. 157.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая