Известия РАН. Серия физическая, 2021, T. 85, № 1, стр. 140-144
Измерение скорости звука в тканях эмбрионов костистых рыб
С. А. Титов 1, *, А. Б. Бурлаков 2, П. В. Зинин 1, А. Н. Богаченков 3
1 Федеральное государственное бюджетное учреждение науки Научно-технологический центр уникального приборостроения Российской академии наук
Москва, Россия
2 Федеральное государственное бюджетное образовательное учреждение высшего образования
“Московский государственный университет имени М.В. Ломоносова”
Москва, Россия
3 Федеральное государственное бюджетное образовательное учреждение высшего образования
“МИРЭА – Российский технологический университет”
Москва, Россия
* E-mail: sergetitov@mail.ru
Поступила в редакцию 20.07.2020
После доработки 28.08.2020
Принята к публикации 28.09.2020
Аннотация
Разработана неинвазивная методика ультразвуковой визуализации структуры эмбрионов рыб и измерения скорости звука в их тканях. С помощью акустического микроскопа с центральной частотой 50 МГц проведено исследование икры вьюна (Misgurnus fossilis), развивающегося в иммерсионной ячейке прибора, на 6–8 стадиях развития измерена скорость звука в желтке и клеточном слое (бластуле) эмбриона.
ВВЕДЕНИЕ
В настоящее время эмбрионы рыб представляются популярным и перспективным объектом исследований в биологии развития, генетике, регенеративной медицине, экологии и др. благодаря краткому периоду эмбрионального развития, сравнительно большому размеру и возможности развития вне родительского организма [1]. Основным инструментом исследований эмбриогенеза рыб является оптическая микроскопия, позволяющая с достаточно высоким разрешением наблюдать структурные изменения [2, 3]. Вместе с тем, оптические изображения часто имеют низкий контраст и малую глубину резко изображаемых элементов, а использование высокоэнергетического излучения в течение длительного времени негативно сказывается на живой организм. Недавно было показано [4, 5], что эффективным методом исследования эмбриогенеза рыб является ультразвуковая визуализация. Ультразвуковые волны оказывают незначительное воздействие на организм, что позволяет проводить наблюдение одного эмбриона на протяжении всего цикла его развития. Этот метод дает высокий контраст, обусловленный вариациями упруго-вязкостных свойств тканей и позволяет визуализировать структурные изменения глубоко расположенных органов и их движение.
Известны работы, посвященные ультразвуковым исследованиям эмбрионов мышей и цыплят [6, 7]. Эмбрион рыбы являлся объектом исследований в единственной известной авторам работе [8], причем в большей степени он использовался для демонстрации возможностей разработанной аппаратуры и метода визуализации. Таким образом, акустические свойства основных органов эмбриона рыб неизвестны в настоящее время. В данной работе разрабатывается методика измерения скорости звука в желтке и клеточном слое (бластуле) эмбриона и проводятся измерения на стадиях развития средней и поздней бластулы.
МАТЕРИАЛЫ И МЕТОДЫ
В работе использовалась икра вьюна (Misgurnus fossilis), которая часто используется в биологических исследованиях. Оплодотворение икры, получаемой после гормональной стимуляции самок, проводилось в отдельном сосуде непосредственно перед ультразвуковыми исследованиями. Работа с данными биологическими объектами выполнялась в соответствии с этическими стандартами учреждения, в котором проводились исследования, и утвержденными правовыми актами РФ и международных организаций.
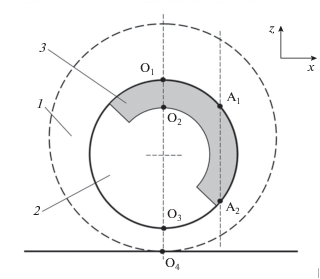
Упрощенная схема строения икринки костистой рыбы на стадиях развития 6–8 представлена на рис. 1. Общий размер икринки вьюна составляет приблизительно 2 мм, самого эмбриона – 1.2 мм. Она имеет наружную оболочку округлой формы (хорион), заполненную перивителлиновой жидкостью 1. Внутри икринки располагается желток 2, к которому примыкает бластула 3, образованная слоем делящихся клеток. Бластула по мере развития эмбриона распространяется вдоль поверхности желтка, становясь тоньше и охватывая все большую площадь. Размер клеток в бластуле на данных стадиях развития колеблется в пределах 10–20 мкм [1]. Эмбрион располагается приблизительно симметрично по отношению к вертикальной оси икринки и, обладая некоторой свободой передвижения в перивителлиновой жидкости, несколько смещается из центра вниз под действием силы тяжести.
Ультразвуковые измерения проводились с помощью сканирующего импульсного акустического микроскопа [5]. В нем использовался одиночный сфокусированный преобразователь с центральной частотой 50 МГц и относительной полосой частот 50%. Фокусное расстояние и угловая апертура преобразователя при использовании воды в качестве иммерсионной жидкости составляли 5 мм и 30°, соответственно, обеспечивая пространственное поперечное разрешение 30 мкм. В приборе использовалось механическое сканирование преобразователя, позволяющее формировать трехмерный пространственно–временной сигнал s(x, y, t), где x, y – поперечные координаты, t – время. Икринка помещалась в иммерсионной среде на стеклянную подложку. Снизу от подложки располагался видеомикроскоп, позволяющий получать изображение эмбриона с умеренным разрешением, достаточным для контроля состояния и ориентации эмбриона. В качестве иммерсионной среды использовалась вода, взятая из природного источника, ее температура находилась в пределах 22 ± 2°C на протяжении всего эксперимента.
УЛЬТРАЗВУКОВАЯ ВИЗУАЛИЗАЦИЯ ЭМБРИОНА
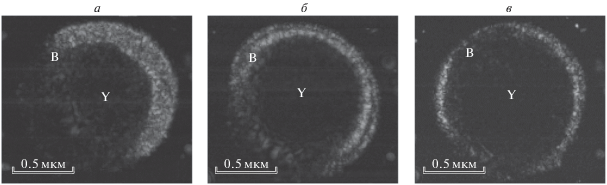
Измерение скорости звука в желтке и бластуле проводилось по акустическим данным, записанным в течение 5 часов развития одного эмбриона на стадиях 6–8. В качестве примера ультразвуковые изображения I(x, y) (С-сканы), полученные в начале, середине и конце этой серии измерений приведены на рис. 2а–2в, соответственно. Фокальная плоскость преобразователя, располагаемая на расстоянии 0.8 мм от подложки, проходила приблизительно через середину эмбриона. На изображениях представлено двумерное распределение максимального значения огибающей сигнала, принятого во временном окне длительностью 0.6 мкс. Середина этого окна была настроена на прием сигналов, отраженных из фокальной плоскости. Таким образом, полученные сканы отображают акустические неоднородности, находящиеся в фокальной области в слое толщиной 0.45 мм.
В изображениях эмбриона различаются темный желток Y, расположенный в центре, и более яркая бластула B, охватывающая желток. Как видно, отражательная способность клеточного слоя бластулы существенно выше, чем у желтка. Характерные размеры клеток в этом слое (10–20 мкм) существенно меньше разрешающей способности микроскопа на используемой частоте ультразвука (30 мкм), поэтому изображение бластулы имеет ярко выраженную спекл структуру. Отражение в области желтка существенно более слабое, хотя и превышает уровень шума. Вокруг эмбриона наблюдаются отдельные яркие отражатели, расположенные вдоль окружности с диаметром 1.8–1.9 мм. По-видимому, эти эхо-сигналы производятся небольшими пузырьками и посторонними частицами, прилипшими к наружной оболочке икринки. Ультразвуковые изображения показывают, что с течением времени слой бластулы становится тоньше и покрывает все большую область на поверхности желтка. Такое поведение является характерным для развития эмбриона на данных стадиях [1, 9].
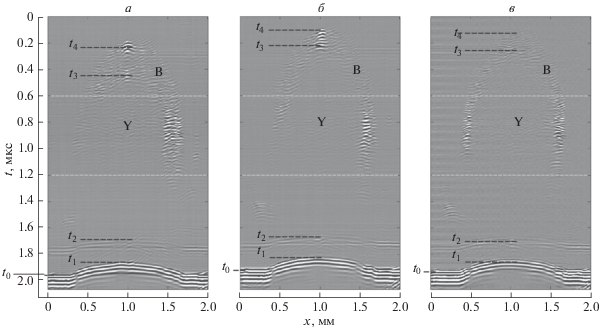
Структуру исследуемого эмбриона в продольном направлении отображают пространственно-временные сигналы s(x, t) (B-сканы), представленные для начала, середины и конца 5-часовой серии измерений на рис. 3а–3в, соответственно. В данном формате регистрируемый знакопеременный сигнал s отображается на изображениях оттенками серого в зависимости от времени t и координаты сканирования x. Поперечная координата y в таком представлении выбрана постоянной, соответствующей середине эмбриона. Положение временного окна, используемого при генерации изображений I(x, y) (рис. 2), показано на B-сканах пунктирными линиями.
На B-сканах выделяется клеточный слой B, охватывающий область желтка Y. Амплитуда сигнала, отраженного слоем, выше в верхней области бластулы (точки O1 и O2, рис. 1), где ее граница перпендикулярна акустический оси преобразователя, и в области фокуса при 0.8 < t < 1 мкс. В области фокуса для желтка также различимы слабые отражения. Ниже выделенного временного окна сигналы от эмбриона практически не обнаруживаются вследствие расфокусировки и ослабления ультразвука при прохождении через эмбрион. Исключение составляет слабый отклик от нижней поверхности желтка со временем прихода t2, лежащий на оси в области O3 (рис. 1). Отклик от подложки, расположенный внизу B-сканов, несмотря на расфокусировку имеет большую амплитуду вследствие значительного различия акустических импедансов жидкости и подложки. Вне области эмбриона этот отклик имеет постоянные амплитуду и время прихода. Под эмбрионом амплитуда отклика от подложки становится меньше вследствие затухания волн в тканях, а время его прихода укорачивается из-за большей скорости звука в эмбрионе по сравнению с иммерсией.
ИЗМЕРЕНИЕ СКОРОСТИ ЗВУКА
По 11 наборам ультразвуковых данных s(x, y, t), записанных в ходе эксперимента на протяжении 5 ч, были проведены измерения среднего поперечного размера эмбриона d и его продольного размера d0. Поперечный размер d определялся для каждого С-скана (рис. 2) по положению внешней границы бластулы или желтка в нескольких направлениях. Точность таких измерений ограничивается размытостью границы и разрешающей способностью микроскопа. Однако можно отметить, что наблюдается тенденция уменьшения за время измерений среднего диаметра d с 1.31 до 1.29 мм. Продольный размер ${{d}_{0}} = {{l}_{2}} + {{l}_{3}}$ рассчитывался как разность расстояний O1O4 и O3O4:
(1)
$2{{d}_{0}} = \left[ {\left( {{{t}_{0}} - {{t}_{4}}} \right) - \left( {{{t}_{1}} - {{t}_{2}}} \right)} \right]{{C}_{0}},$Расчет скоростей ультразвука в бластуле и желтке был проведен в приближении геометрической акустики с помощью метода замещения, модифицированного в соответствии с особенностями исследуемого объекта [11, 12]. Допустимость данного приближения обосновывается тем, что характерные размеры эмбриона значительно превышают длину волны. Для измерения скорости в желтке использовался луч O1O4, проходящий через центр эмбриона и падающий перпендикулярно на подложку. Кроме того, учитывался опорный сигнал со временем прихода t0, который отразился от подложки вне эмбриона. Расстояние от вершины эмбриона до подложки определяется временем распространения опорного сигнала в иммерсионной жидкости:
где переменные l1, l2, l3 равны длинам отрезков O1O2, O2O3, O3O4, соответственно. Разность времен распространения опорной и измерительной волн равно:(3)
$\begin{gathered} dt = {{t}_{1}} - {{t}_{0}} = \\ = \,\,2\,\left[ {\left( {{{l}_{1}} + {{l}_{2}} + {{l}_{3}}} \right)C_{0}^{{ - 1}} - {{l}_{1}}C_{0}^{{ - 1}} - {{l}_{2}}C_{y}^{{ - 1}} - {{l}_{3}}C_{b}^{{ - 1}}} \right], \\ \end{gathered} $(5)
${{l}_{3}} = \left( {{{t}_{3}} - {{t}_{4}}} \right){{C}_{b}},\,\,\,\,{{l}_{2}} = \left( {{{t}_{2}} - {{t}_{3}}} \right){{C}_{y}},$(6)
$dt = \left[ {\left( {{{t}_{2}} - {{t}_{3}}} \right)\Delta {{C}_{y}} + \left( {{{t}_{3}} - {{t}_{4}}} \right)\Delta {{C}_{b}}} \right]C_{0}^{{ - 1}}.$Таким образом, зная скорости звука в иммерсионной среде и бластуле, скорость в желтке можно определить, измеряя задержки dt, (t2–t3), (t3–t4). Скорость в воде C0 известна априорно, а скорость звука в бластуле может быть оценена следующим образом.
Скорость в бластуле можно оценить, рассматривая время прохождения волны вдоль луча А1А2, проходящей только через клеточный слой перпендикулярно подложке (рис. 1). На B-сканах границы бластулы в точках пересечения с лучом не являются четкими (рис. 3), так как они не находятся вне фокальной плоскости и луч пересекает их под большим углом. Поэтому путь l(x), проходимый волной в клеточном слое, можно оценить, считая, что сечение поверхности бластулы плоскостью (x, z) в области измерения является окружностью:
где радиус кривизны R и положение центра поверхности бластулы x0 определяются по С-сканам. Разность времен прихода волны, прошедшей через бластулу, и опорной волны, отраженной от подложки, можно записать аналогично (6), полагая малость приращения скорости в бластуле по сравнению со скоростью в воде:Искомую величину ΔCb можно оценить методом линейной регрессии, располагая измеренной зависимостью dt(l).
РЕЗУЛЬТАТЫ ИЗМЕРЕНИЙ
Для оценки скорости ультразвука в бластуле использовались данные, полученные в начале эксперимента, для которых толщина клеточного слоя в поперечном направлении имеет достаточную величину. По мере развития эмбриона толщина бластулы уменьшается, и предложенная выше методика расчета скорости дает неустойчивые результаты. Используя данные первого B‑скана (рис. 3) в диапазоне x 1.44–1.65 мм, была построена зависимость dt(l) и найдено в соответствии с (8) значение ΔCb = 41 м/с. Погрешность коэффициента пропорциональности этого линейного модельного уравнения, оцененная путем расчета остаточной дисперсии задержки dt относительно линии регрессии, составила ±16%.
Полученное значение скорости звука в бластуле было использовано при нахождении скорости в желтке ΔCy по формуле (6). Значение, найденное по всем записанным на протяжении эксперимента 11 сканам, составляет ΔCy = 90 ± 8 м/с.
Следует отметить, что на результат измерения ΔCy влияет величина скорости в бластуле, которая определена со сравнительно большой погрешностью. Кроме того, она оценена только для начального периода эксперимента и может меняться по мере развития организма. Однако зависимость скорости в желтке от скорости звука в бластуле является слабой вследствие малости толщины бластулы по сравнению с размером желтка. Так уменьшение ΔCb на 10 м/с вызывает в соответствии с (6) увеличение ΔCy только на 1 м/с.
Сравнивая результаты измерений с опубликованными данными [10], можно отметить, что полученное значение скорости звука в желтке эмбриона меньше, чем скорость в таких плотных тканях, как хрящи или хрусталик глаза. Однако она больше скорости звука в тканях мозга или почек и сравнима с тканями печени и мышц.
ЗАКЛЮЧЕНИЕ
Разработана методика измерения in vivo скорости звука в желтке и клеточном слое (бластуле) эмбрионов рыб. Для 6 стадии развития икры вьюна (Misgurnus fossilis) получена оценка скорости в бластуле, которая составила 1526 ± 7 м/с. Найдено, что при развитии эмбриона в течение 5 ч с 6 до 8 стадий скорость звука в желтке находится в пределах 1575 ± 8 м/с.
Список литературы
Gilbert S.F., Barresi M.J.F. Developmental Biology. N.Y.: Oxford Univ. Press, 2017. 810 p.
Greer C.J., Holy T.E. // Nat. Commun. 2019. V. 10. Art. No 4483.
Abu-Siniyeh A., Al-Zyoud W. // Lab. Anim. Res. 2020. V. 36. Art. No 12.
Бурлаков А.Б., Хохлов Д.Д., Мачихин А.С. и др. // Радиотехн. и электрон. 2020. Т. 65. № 7. С. 1; Burlakov A.B., Khokhlov D.D., Machihin A.S. et al. // J. Commun. Tech. Electron. 2020. Т. 65. No 7. P. 851.
Burlakov A.B., Khokhlov D.D., Domanskiy V.L., Titov S.A. // J. Phys. Conf. Ser. 2019. V. 1421. Art. No 012050.
Ho S., Tan G.X.Y., Foo T.J. et al. // Ann. Biomed. Eng. 2017. V. 45. No 10. P. 2309.
Greco A., Mancini M., Gargiulo S. et al. // J. Biomed. Biotechnol. 2012. Art. No 519238.
Park J., Lee J., Lau S.T. et al. // Ann. Biomed. Eng. 2012. V. 40. No 4. P. 907.
Костомарова А.А. // в кн.: Объекты биологии развития. М.: Наука, 1975. С. 309.
Hill C.R., Bamber J.C. Haar. G.R. Physical principles of medical ultrasonics. Chichester: John Wiley and Sons, 2004. 528 p.
Weiss E.C., Anastasiadis P., Pilarczyk G. et al. // IEEE Trans. UFFC. 2007. V. 54. No 11. P. 2257.
Anastasiadis P., Zinin P. // Op. Neuroimag. J. 2018. V. 12. No 1. P. 69.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая