Известия РАН. Серия физическая, 2021, T. 85, № 12, стр. 1807-1813
Исследование накопление гадолиния в глиомных опухолях головного мозга человека для гадолиний-нейтрон-захватной терапии
Г. А. Кулабдуллаев 1, *, А. А. Ким 1, Г. А. Абдуллаева 1, Г. Т. Джураева 1, И. И. Садыков 1, Б. Х. Ярматов 1, М. И. Салимов 1, Р. Т. Кадырбеков 2, Н. Р. Кадырбеков 2, И. Р. Мавлянов 3
1 Институт ядерной физики Академии наук Республики Узбекистан
Tашкент, Узбекистан
2 Республиканский научный центр нейрохирургии
Tашкент, Узбекистан
3 Tашкентская медицинская академия
Ташкент, Узбекистан
* E-mail: kulabdullaev@inp.uz
Поступила в редакцию 05.07.2021
После доработки 26.07.2021
Принята к публикации 27.08.2021
Аннотация
Определено накопление гадолиния в глиомных опухолях мозга человека после однократного внутривенного введения магневиста. Исследование выполнено на образцах, удаленных во время стандартных операций глиомных опухолей головного мозга человека. Во всех пяти исследованных образцах гадолиний присутствовал в концентрации от 0.0093 до 0.2384 нг · мг–1 (ppm) опухолевой ткани.
ВВЕДЕНИЕ
Гадолиний является одним из перспективных элементов для применения в современных бинарных технологиях лучевой терапии злокачественных опухолей. Одной из бинарных технологий лучевой терапии является гадолиний-нейтрон-захватная терапия (Gd-НЗТ). Gd-НЗТ является одним из направлений нейтрон-захватной терапии (НЗТ), которая показала благоприятные результаты при лечении злокачественных опухолей высокой степени [1–6]. Пока Gd-НЗТ не применяется в клинической практике из-за нерешенных технических проблем, одной из которых является определение поглощенной дозы. B Gd-НЗТ терапевтический эффект обусловлен действием вторичных частиц, возникающих при облучении ядер natGd эпитепловыми нейтронами. Природный Gd состоит из шести стабильных нуклидов. Среди них, 155Gd и 157Gd обладают отличными нейтрон-захватными свойствами, т.е. с сечениями захвата тепловых нейтронов 60 800 и 255 000 барн, соответственно, который примерно в 15.84 и 66.4 раз больше, чем сечение захвата 10B. Содержание этих изотопов в natGd составляют 155Gd – 15.10% и 157Gd – 15.70%. Сечения ядерных реакций для других изотопов небольшие в сравнении с этими изотопами, поэтому ими можно пренебречь при вычислениях поглощенной дозы. При захвате нейтронов этими изотопами образуется возбужденные ядра 156Gd и 158Gd, при распаде которых испускается мгновенное гамма-излучение с энергиями 0.08–7.8 МэВ. Это гамма-излучение сопровождается эмиссией электронов внутренней конверсии в диапазоне энергий от 79 кэВ до 6.9 МэВ [7]. После вылета электронов внутренной конверсии (ЭВК) при перестройке электронных орбит возникают рентгеновское излучение или конкурентные низкоэнергетические оже-электроны. С помощью моделирования было показано, что при реакции захвата одного нейтрона в 157Gd происходит выход 5.0 оже-электронов, 1.8 гамма-квантов, 0.69 ЭВК, 0.84 рентгеновских фотонов, 5.5 свободносвязанных рентгеновских лучей и 1.0 ядро отдачи [7]. Проведенные нами и другими авторами исследования по оценке возникающих излучений при Gd-НЗТ показали чрезвычайную сложность точного определения поглощенной дозы [8]. Терапевтическая эффективность Gd-НЗТ также зависит еще от накопления достаточной концентрации Gd в опухолевых клетках. Использование natGd в качестве внутривенного контрастного вещества для магнитно-резонансной томографии злокачественных опухолей показывает наличие большой концентрации гадолиния в некоторых опухолях головного мозга и в окружающих их отеках мозга. Но как показывают исследования [9, 10], эти соединения плохо удерживается в опухолевых клетках. Несмотря на разработку биосовместимых макромолекулярных соединений и наночастиц [11–15] для устранения этих недостатков, эта проблема еще не решена. В терапевтический эффект GdНЗТ основной вклад вносят оже-электроны, которые имеют малые энергии и высокую линейную передачу энергии (ЛПЭ). Поэтому радиобиологическая эффективность для оже-электронов зависит от местоположения их излучателя по отношению к ДНК и ее значение может составлять больше единицы, если атомы Gd связаны с ДНК. Оже-электроны вызывают биологическое повреждение прямым путем через ионизацию, а также непрямым путем за счет образования свободных радикалов в ДНК [7, 17]. Поэтому используемые соединения с Gd должны эффективно попадать во внутриклеточный объем и мигрировать как можно ближе к ядру клетки. По мнению некоторых авторов [18–20] коммерческие хелатные соединения Gd (такие как Gd-DTPA) не подходят в качестве эффективного агента для GdНЗТ. Недостаточно изучен вклад мгновенного гамма-излучения в поглощенную дозу, который обычно считается незначительным. В работе [21] было отмечено, что для правильной дозиметрии GdНЗТ должны учитываться как микроскопическая часть дозы, доставляемая низкочастотными электронами малого радиуса действия, так и макроскопическая часть, доставляемая мгновенными γ-излучениями. Проведенные нами ранее исследования [8, 22] показали, что выход γ-квантов с энергиями от 1–400 кэВ в спектрах распада в изотопах 156Gd и 158Gd почти одинаковый и вносит заметный вклад в поглощенную дозу. Также было показано, что для вызывания некроза опухолей при GdНЗТ необязательно связывание атомов Gd с ДНК [22]. Этот результат можно также объяснить свойствами и характеристиками нашего пучка эпитепловых нейтронов [23]. Сложность спектров излучения нейтрон-захватной реакции гадолиния требует проведения тщательных исследований как in vitro, так и in vivo до введения GdНЗТ в клиническую практику. Оценка терапевтической дозы, доставляемая микроскопически (в соседние клетки) короткодействующими электронами с низкой энергией и макроскопически, γ-лучами на длинных расстояниях от участка эмиссии излучения, является задачей, который лежит в основе дальнейших исследований GdНЗТ. Как показывают наши расчеты поглощенной дозы с помощью кермы – аналога поглощенной дозы, в поглощенную дозу основной вклад вносят вторичные частицы, возникающие в Gd при реакции захвата нейтронов, число которых зависит от концентрации Gd в биологической ткани [23]. Поэтому от точного определения концентрации Gd зависит терапевтическая эффективность GdНЗТ. Пациенты с опухолями головного мозга могут проходить процедуру МРТ несколько раз. Обычно такие пациенты проходят 2–3 процедуры МРТ с контрастными Gd-содержащими веществами до лечения. Поэтому вызывает интерес исследование накопление Gd в глиомных опухолях пациентов для проведение успешной GdНЗТ. Целью настоящей работы является исследование накопление Gd в глиомных опухолях головного мозга человека.
МАТЕРИАЛЫ И МЕТОДЫ
Нами было проведено предварительное исследование для того, чтобы точно установить количество накопленного гадолиния в опухолях головного мозга человека после однократного стандартного введения магневиста при МРТ-диагностировании опухолей. Исследование проводились с использованием опухолевого материала, удаленного во время хирургической операции. У всех пациентов, включенных в исследование, было получено письменное информированное согласие. Операции по удалению опухолей проводили под общим интубационным наркозом. После краниотомии черепа производили энцефалотомию. Затем производился доступ к опухоли. С применением микрохирургической техники производилась диссекция опухоли от мозговой ткани и удаление кускованием. Часть удаленной опухоли фиксировали в 10% формалине для стандартного гистологического анализа. Из удаленных фрагментов опухолей вырезали образцы и помещали в чистые стеклянные флаконы и замораживали в холодильнике при –18°С без добавления физраствора или любой другой жидкости. Эти образцы взвешивали, затем лиофилизировали и снова взвешивали, чтобы определить сухой вес образцов. Затем эти образцы были высушены для анализа. Лиофилизированные образцы отбирали по 100 мг и помещали в полиэтиленовые пакетики, герметично запаивали и заворачивали в алюминиевую фольгу. Образец сравнения готовили добавлением известного количества гадолиния в образец ткани, не содержащей гадолиния изначально. Для этого использовали раствор препарата “магневист” с известной концентрацией гадолиния.
Для исследования 5 пациентам с операционными опухолями головного мозга была проведена одна процедура МРТ с усилением магневиста в течение различного времени до операции. Для контрольной группы 2 больных с операбельными опухолями головного мозга была выбрана процедура МРТ без усиления препаратами, содержащими гадолиний. У выбранных пациентов не было клинических симптомов почечной или печеночной недостаточности. Для всех пациентов были собраны изображения МРТ. Для определения следовых количеств гадолиния на уровне ppm и ниже мы использовали нейтронно-активационный метод анализа, который по количеству определяемых элементов и чувствительности не уступает обычно широко используемому масс-спектрометрическому методу, а по некоторым параметрам даже превосходит его. Подготовленные образцы вместе с образцом сравнения, помещенные в кварцевую ампулу, облучали в вертикальном канале ядерного реактора ВВР-СМ (ИЯФ, Ташкент). Плотность потока нейтронов составляла 5 ⋅ 1013 н ⋅ см–2 ⋅ с–1. Образцы облучали в течение 2 ч.
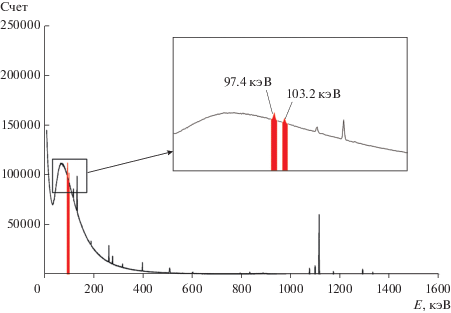
После облучения образцы выдерживали в течение 3 нед., после чего измеряли гамма-активность радионуклидов с помощью гамма-спектрометра Canberra, состоящего из полупроводникового детектора из высокочистого германия GC2018 и многоканального анализатора DSA1000. Измерение и обработку спектров проводили с помощью программного пакета Genie2000. Для идентификации и расчета содержания гадолиния использовали гамма линии 153Gd с энергией 94.7 и 103.2 кэВ (рис. 1 ). Исследуемые образцы и образец сравнения измеряли в идентичной геометрии. Для расчета содержания гадолиния использовали относительный метод.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В исследуемую группу было включено 5 пациентов мужского пола в возрасте от 30 до 58 лет, а в контрольную группу было включено 2 пациента мужского пола в возрасте от 37 до 39 лет. В табл. 1 приведены данные отобранных для исследования пациентов.
Как мы отмечали выше, для определения содержания гадолиния в исследованных образцах использовали относительный инструментальный нейтронно-активационный метод. Естественный гадолиний состоит из смеси шести стабильных изотопов, три из которых вступают в реакцию (n,γ) и образуют радиоактивные изотопы гадолиния [24].
Таблица 2.
Ядерно-физические характеристики гадолиния
| Изотоп | Содержание, % | Реакция | Радионуклид | Сечение активации σ, барн | Резонансный интеграл активации I, барн |
|---|---|---|---|---|---|
| Gd-152 | 0.2031 | (n,γ) | Gd-153 | 735 | 2020 |
| Gd-158 | 24.835 | (n,γ) | Gd-159 | 2.2 | 73 |
| Gd-160 | 21.863 | (n,γ) | Gd-161 | 0.79 | 7.2 |
Как видно из табл. 2 и 3, с учетом периода полураспада и выхода гамма-излучения наиболее удобным в качестве аналитического радионуклида на первый взгляд является 159Gd с периодом полураспада 18 ч. Однако из-за высокого содержания фосфора в анализируемых образцах ткани, повышенный фон гамма-излучения, обусловленный образованием 32P, делает практически невозможным определение гадолиния по радионуклиду 159Gd. Поэтому в качестве аналитического радионуклида для идентификации и количественного определения гадолиния использовали радионуклид 153Gd (T1/2 = 242 сут), который образуется по реакции 152Gd(n,γ)153Gd с высоким сечением активации и имеет гамма-линии с энергией 97.4 и 103.2 кэВ (рис. 1).
Полученные данные по концентрации гадолиния в образцах опухолей мозга человека представлены в табл. 4.
Нами было обнаружено, что во всех пяти исследованных образцах было обнаружено присутствие гадолиния в концентрации от 0.0093 до 0.2384 нг · мг–1 (ppm) опухолевой ткани. При этом в контрольных образцах гадолиний не был обнаружен.
Таблица 3.
Периоды полураспада и энергии гамма-излучения
| Радионуклид | Период полураспада | Основные гамма линии, кэВ | Выход, % |
|---|---|---|---|
| Gd-153 | 240.4 сут | 69.7 | 2.4 |
| 97.4 | 29.0 | ||
| 103.2 | 21.1 | ||
| Gd-159 | 18.5 ч | 58.0 | 2.5 |
| 363.5 | 11.8 | ||
| Gd-161 | 3.66 мин | 102.3 | 13.9 |
| 283.5 | 6.0 | ||
| 314.9 | 22.7 | ||
| 360.9 | 60.1 |
Таблица 4.
Результаты определения концентрации гадолиния в образцах глиомных опухолей головного мозга человека методом нейтронно-активационного анализа
| Номер пациента | Сырой вес образца опухолевой ткани, мг | Вес сухого образца, мг (% от сырого веса) | Концентрация Gd (в сухом образце), (нг · мг–1) ppm | Количество Gd в опухоли (в сухом образце), нг | Концентрация Gd в опухоли
(в пересчете
на сырой вес), (нг · мг–1) ppm |
Время между МРТ и операцией, сут |
|---|---|---|---|---|---|---|
| 1 | 1088 | 392 (36.03) | 0.0259 ± 0.0006 | 10.1528 | 0.0093 | 6 |
| 2 | 971 | 169 (17.40) | 1.37 ± 0.23 | 231.53 | 0.2384 | 6 |
| 3 | 2075 | 364 (17.54) | 0.174 ± 0.035 | 63.336 | 0.0305 | 9 |
| 4 | 348 | 40 (11.49) | 0.366 ± 0.140 | 14.64 | 0.0421 | 13 |
| 5 | 1176 | 157 (13.35) | 0.387 ± 0.070 | 60.759 | 0.0517 | 189 |
| Контроль без гадолиния | ||||||
| 6 | 1864 | 287 (15.40) | Ниже предела детектирования | – | – | 5 суток |
| 7 | 660 | 111 (16.82) | Ниже предела детектирования | – | – | 13 суток |
Полученные данные показывают, что после внутривенной инъекции магневиста в опухолях головного мозга остаются следовые количества гадолиния в различных концентрациях. Можно предположить, что гадолиний в опухолях присутствует в связанном виде, поскольку он обнаруживается в интервале от 5 до 189 суток после инъекции. Полученные нами данные согласуются с данными литературы [27, 28], согласно которым накопление гадолиния в различных разделах головного мозга остается постоянным в течение длительного периода времени жизни. Этот эффект необходимо учитывать при точных дозиметрических расчетах поглощенной дозы в GdНЗТ.
Природа механизма накопления гадолиния в тканях головного мозга и в опухолях головного мозга (в нашем случае) пока не изучена досконально. В целом, в проведенных ранее исследованиях не обнаруживалось никаких явлений метаболизма магневиста [28]. Но нельзя полностью исключить вероятность того, что обнаруживаемый гадолиний аккумулируется за счет появления свободного гадолиния при биодеградации хелатных соединений гадолиния. Кроме того, есть вероятность частичной диссоциации хелатного соединения гадолиния in vivo и высвобождения свободного гадолиния за счет трансметаллирования [29]. В случае с магневистом биодеградация или диссоциация предотвращается добавлением дополнительного количества свободного лиганда, поэтому появление большого количества свободного гадолиния в целом исключено. Тем не менее, достаточно незначительной биодеградации или диссоциации препарата, чтобы высвободившийся гадолиний мог быть захвачен тканями опухоли мозга.
В настоящее время не совсем ясна клиническая значимость обнаруженного эффекта накопления гадолиния в опухолях головного мозга при внутривенном введении фармакологических хелатных соединений гадолиния. В 2006 г. была обнаружена и доказана причинно-следственная связь введения гадолиния с развитием нефрогенного системного фиброза у пациентов с ранее существующей почечной дисфункцией [30]. В последующих исследованиях было доказано, что почечные заболевания являются причиной накопления гадолиния в коже у пациентов с нефрогенным системным фиброзом [31]. Эти полученные данные вызвали вопросы о стабильности GBCAs in vivo и их склонности к трансметаллированию (обмен металла гадолиния с эндогенным катионом). Однако в течение следующих нескольких лет нефрогенный системный фиброз был фактически искоренен разумным использованием GBCAs у пациентов с нарушенной почечной функцией, что увеличило доверие к безопасности использования GBCA у пациентов с сохраненной почечной функцией [32–34].
Недавно появилось непрямое доказательство, которое предполагает, что отложение гадолиния может происходить у пациентов с нормальной почечной функцией. Несколько исследований продемонстрировало прогрессивные увеличения в T1-взвешенном МР сигнале в различных структурах центральной нервной системы (ЦНС) после повторного введения гадолиния [35, 36].
Поскольку сам свободный гадолиний обладает токсичностью, то в любом случае, констатация самого факта накопления гадолиния в опухолях мозга может в дальнейшем оказаться значимой для интерпретации различных неожиданных клинических эффектов в будущем.
ЗАКЛЮЧЕНИЕ
На основании полученных данных можно сделать вывод о том, что после однократной внутривенной инъекции магневиста в глиомных опухолях головного мозга остаются следовые количества гадолиния в различных концентрациях. Так как для Gd-НЗТ достаточной считается концентрация natGd в опухолях <1000 ppm (200 ppm 157Gd) [38], то можно считать, что такие количества Gd в опухолях после однократного введения магневиста недостаточны для существенного влияния на поглощенную дозу, но значимы для интерпретации различных неожиданных клинических эффектов. Но у пациентов с наследственными опухолевыми синдромами, которые проходят периодический МРТ скрининг с гадолиниевым контрастом (16 МРТ) [39], эти концентрации нужно учитывать при GdНЗТ.
Работа была выполнена в рамках проектов ФА-Атех-2018-168 “Разработка метода индивидуальной оценки радиорезистентности глиомных опухолей головного мозга человека для клинической нейроонкологии” и ОТ-Ф2-24 “Изучение характеристик вторичных частиц возникающих при взаимодействии фотонов с элементами Sm, Gd, Au, Bi” Республики Узбекистан.
Список литературы
Barth R.F., Soloway A.H., Fairchild R.G // Cancer Res. 1990. V. 50. P. 1061.
Barth R.F., Vicente M.G.H., Harling O.K. et al. // Radiat. Oncol. 2012. V. 7. Art. No. 146.
Miyatake S., Kawabata S., Hiramatsu R. et al. // Proc. ICNCT17. (Missouri, 2016). P. 63.
Takeuchi K., Kawabata S., Hiramatsu R. et al. // Proc. ICNCT17. (Missouri, 2016). P. 74.
Shiba H., Futamura G., Kawabata Sh. et al. // Proc. ICNCT17. (Missouri, 2016). P. 73.
Kondo N., Barth R. F., Miyatake S.-I. et al. // Proc. ICNCT17. (Missouri, 2016). P. 71.
Stepanek J. // Med. Phys. 2003. V. 30. P. 41.
Kulabdullaev G.A., Abdullaeva G.A., Kim A.A. et al. // J. Health Sci. 2016. V. 4. P. 35.
De Stasio G., Casalbore P., PalliniR. et al. // Cancer Res. 2001. V. 61. P. 4272.
De Stasio G., Rajesh D., Casalbore P. et al. // Neurol. Res. 2005. V. 27. P. 387.
Shikata F., Tokumitsu H., Ichikawa H., Fukumori Y. // Eur. J. Pharm. Biopharm. 2002. V. 53. P. 57.
Tokumitsu H., Hiratsuka J., Sakurai Y. et al. // Cancer Lett. 2000. V. 150. P. 177.
Watanabe T., Ichikawa H., Fukumori Y. // Eur. J. Pharm. Biopharm. 2002. V. 54. P. 119.
Le U.M., Cui Z. // Int. J. Pharm. 2006. V. 312. P. 105.
Le U.M., Cui Z. // Int. J. Pharm. 2006. V. 320. P. 96.
Oyewumi M.O., Mumper R.J. // Int. J. Pharm. 2003. V. 251. P. 85.
Salt C., Lennox A.J., Takagaki M. et al. // Russ. Chem. Bull. 2004. V. 53. V. 1871.
Franken N.A.P., Bergs J.W.J., Kok T.T. et al. // Oncol. Rep. 2006. V. 15. P. 715.
Martin R.F., D’Cunha G., Pardee M., Allen B.J. // Int. J. Radiat. Biol. 1988. V. 54. P. 205.
Martin R.F., D’Cunha G., Pardee M., Allen B.J. // Pigment Cell Res. 1989. V. 2. P. 330.
Enger S.A., Giusti V., Fortin M.-A. et al. // Radiat. Meas. 2013. V. 59. P. 233.
Наврузов С.Н., Ходжаева Н.Х., Кулабдуллаев Г.А. и др. // Злокач. опухоли. 2015. № 1. С. 10.
Кулабдуллаев Г.А., Коблик Ю.Н., Абдуллаева Г.А. и др. // Мед. физ. 2011. № 3(51). С. 31.
Abdullaeva G.A., Djuraeva G.T., Kim A.A. et al. // Open Phys. 2015. V. 13. P. 183.
Mednis I.V. Gamma-radiation of radionuclides, used in neutron activation analysis. Reference book. Riga: Zinatne, 1987.
https://nds.iaea.org.
McDonald R.J., McDonald J.S., Kallmes D.F. et al. // Radiology. 2015. V. 275. P. 772.
Kanda T., Ishii K., Kawaguchi H. et al. // Radiology. 2014. V. 270. P. 834.
SPC Magnevist. Summary of product characteristics. Bayer Limited, 2010.
White G.W., Gibby W.A., Tweedle M.F. // Invest. Radiol. 2006. V. 41. P. 272.
Grobner T. // Nephrol. Dial. Transplant. 2006. V. 21. P. 1104.
High W.A., Ayers R.A., Chandler J. et al. // J. Amer. Acad. Dermatol. 2007. V. 56. P. 21.
Amet S., Launay-Vacher V., Clement O. et al. // Invest. Radiol. 2014. V. 49. P. 109.
ACR Committee on Drugs and Contrast Media. ACR manual on contrast media. Reston: ACR, 2013.
Moreau J.F., Droz D., Sabto J. et al. // Radiology. 1975. V. 115. P. 329.
Errante Y., Cirimele V., Mallio C.A. et al. // Invest. Radiol. 2014. V. 49. P. 685.
Kanda T., Ishii K., Kawaguchi H. et al. // Radiology. 2014. V. 270. P. 834.
Shih J.L., Brugger R.M. // Med. Phys. 1992. V. 19. P. 733.
Vergauwen E., Vanbinst A.-M. et al. // Cancer Clin. Pract. 2018. V. 16. P. 2.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая