Известия РАН. Серия физическая, 2022, T. 86, № 2, стр. 210-214
Влияние малых добавок гелия на теплофизические свойства алканов и инертных газов
В. Н. Андбаева 1, *, М. Н. Хотиенкова 1
1 Федеральное государственное бюджетное учреждение науки
Институт теплофизики Уральского отделения Российской академии наук
Екатеринбург, Россия
* E-mail: andbaeva@mail.ru
Поступила в редакцию 20.09.2021
После доработки 11.10.2021
Принята к публикации 22.10.2021
- EDN: KFPBON
- DOI: 10.31857/S0367676522020041
Аннотация
Исследовано влияние гелия на теплофизические свойства алканов и инертных газов. Представлены новые данные по капиллярной постоянной растворов н-бутан–гелий и изобутан–гелий. Показано, что гелий может выступать как поверхностно-активное или инактивное вещество. Предложены уравнения, описывающие барические и концентрационные зависимости капиллярной постоянной и поверхностного натяжения.
ВВЕДЕНИЕ
Поверхностное натяжение является важнейшей термодинамической характеристикой границы раздела жидкой и газовой фаз, которая наиболее доступна для измерения. На сегодняшний день поверхностное натяжение чистых веществ изучено достаточно хорошо [1]. Однако в природе и различных технологических процессах наиболее часто приходится иметь дело с растворами. Небольшое количество раствоeнного вещества может приводить к существенным изменениям поверхностного натяжения (как уменьшать его значение, так и увеличивать) [2, 3].
В работе исследуется влияние гелия на капиллярную постоянную ${{a}^{2}}$ и поверхностное натяжение $\sigma $ алканов (пропан (С3Н8), нормальный бутан (n-C4H10), изобутан (i-C4H10)) и инертных газов (ксенон (Xe), аргон (Ar)). Растворимость гелия (He) при давлениях ниже критического давления растворителя не превышает 1–3%, поэтому гелий можно назвать одним из малорастворимых в жидкости газов. В работе приводятся новые данные по капиллярной постоянной растворов н-бутан–гелий и изобутан–гелий. Данные по ${{a}^{2}}$ и $\sigma ,$ необходимые для анализа и построения уравнений, взяты из ранних работ [3–5].
Статья состоит из введения, двух разделов и заключения. Во втором разделе описана методика проведения опытов. В третьем разделе приводятся экспериментальные результаты и обсуждения.
ЭКСПЕРИМЕНТ
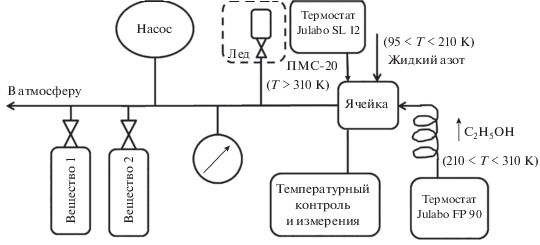
Измерения капиллярной постоянной растворов н-бутан–гелий и изобутан–гелий выполнены дифференциальным вариантом метода капиллярного поднятия. На рис. 1 показана схема экспериментальной установки.
Измерительная ячейка содержала сборку стеклянных капилляров, прокалиброванных ртутью. Ячейка со сборкой капилляров помещалась в стеклянную колбу. Внутренние радиусы капилляров равны: ${{r}_{1}} = 0.6393$ мм, ${{r}_{2}} = 0.2297$ мм, ${{r}_{3}} = 0.09607$ мм. По всей длине капилляра отклонения внутреннего радиуса от его среднего значения ${{\Delta r} \mathord{\left/ {\vphantom {{\Delta r} r}} \right. \kern-0em} r}$ не превышают 0.001. Давление измерялось пружинным манометром. Неопределенность измерения давления $u\left( p \right) = 0.006$ МПа. Температуру измеряли платиновым термометром на 100 Ом. Неопределенность определения температуры $u\left( T \right) = 0.02$ К. Термостатирование производилось прокачкой полиметилсилоксановой жидкости (ПМС-20) от термостата Julabo SL 12. Опыты проводились с высокочистыми газами. Паспортная чистота изобутана – 99.8%, н-бутана – 99.999%, гелия – 99.995%.
Эксперимент начинался с конденсации растворителя (изобутана/н-бутана) в ячейку. По окончании конденсации в ячейке устанавливалась необходимая температура и проводились измерения ${{a}^{2}}$ растворителя. Далее в ячейку подавался гелий, устанавливалось давление, большее давления насыщения растворителя ${{p}_{s}}.$ Процесс растворения гелия ускорялся перемешиванием жидкости.
В опытах измерялась разность высот поднятия жидкости ${{h}_{{ij}}}$ в капиллярах i и j. Неопределенность определения высот составляла $u\left( {{{h}_{{ij}}}} \right) = 0.03$ мм. Капиллярная постоянная рассчитывалась в предположении полной смачиваемости жидкостью стенок капилляров по уравнению
(1)
${{a}^{2}} = {{{{h}_{{ij}}}} \mathord{\left/ {\vphantom {{{{h}_{{ij}}}} {\left( {b_{i}^{{ - 1}} - b_{j}^{{ - 1}}} \right)}}} \right. \kern-0em} {\left( {b_{i}^{{ - 1}} - b_{j}^{{ - 1}}} \right)}},$Ввиду отсутствия экспериментальных данных и уравнений состояний растворов н-бутан–гелий и изобутан–гелий возникают трудности с определением ортобарических плотностей и поверхностного натяжения указанных растворов.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Капиллярная постоянная растворов н-бутан–гелий и изобутан–гелий
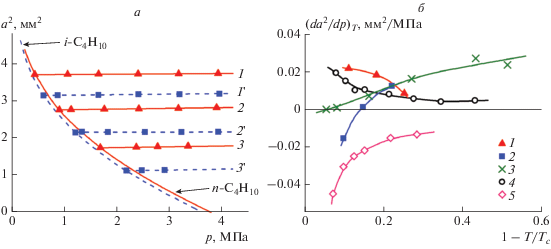
Капиллярная постоянная растворов н-бутан–гелий и изобутан–гелий измерена на трех изотермах 318.15, 348.15 и 378.15 К при давлениях от давления насыщения растворителя до 4 МПа.
Рисунок 2а иллюстрирует барическую зависимость капиллярной постоянной указанных растворов. Видно, что увеличение количества гелия в растворе приводит к увеличению капиллярной постоянной растворов н-бутан–гелий и изобутан–гелий.
Рис. 2.
Барическая зависимость капиллярной постоянной по изотермам (а); температурная зависимость производной ${{\left( {{{\partial {{a}^{2}}} \mathord{\left/ {\vphantom {{\partial {{a}^{2}}} {\partial p}}} \right. \kern-0em} {\partial p}}} \right)}_{T}}$ (б): 1 – н-бутан–гелий, 2 – изобутан–гелий, 3 – пропан–гелий, 4 – ксенон–гелий, 5 – аргон–гелий, 1, 1 ' – $T = 318.15$ K; 2, 2 ' – 348.15 K; 3, 3 ' – 378.15 K.
Барическая зависимость капиллярной постоянной
В исследованном диапазоне параметров состояния зависимость капиллярной постоянной от давления близка к линейной и в пределах погрешности эксперимента описывается уравнением вида:
Здесь ${{A}_{p}} = {{\left( {{{\partial {{a}^{2}}} \mathord{\left/ {\vphantom {{\partial {{a}^{2}}} {\partial p}}} \right. \kern-0em} {\partial p}}} \right)}_{T}},$ ${{p}_{s}}$ – давление насыщенных паров растворителя. Капиллярная постоянная чистого растворителя $a_{0}^{2}$ выбрана в виде:(2)
$a_{0}^{2} = a_{*}^{2}{{\varepsilon }^{n}}\left( {1 + {{a}_{1}}\varepsilon + {{a}_{2}}{{\varepsilon }^{{12}}}} \right),$Таблица 1.
Значения коэффициентов уравнения (2)
| Вещество | ${{T}_{с}}$, K | $a_{*}^{2}$, мм2 | $n$ | ${{a}_{1}}$ | ${{a}_{2}}$ |
|---|---|---|---|---|---|
| Пропан | 369.89 [8] | 13.584 | 0.910 | $ - 3.42 \cdot {{10}^{{ - 3}}}$ | $4.0202 \cdot {{10}^{{ - 1}}}$ |
| Аргон | 150.687 [6] | 4.028 | 0.908 | $6.8 \cdot {{10}^{{ - 4}}}$ | $ - 2.1321 \cdot {{10}^{3}}$ |
| Изобутан | 407.81 [7] | 13.100 | 0.937 | $ - 1.219 \cdot {{10}^{{ - 2}}}$ | $8.1625 \cdot {{10}^{3}}$ |
| н-бутан | 425.125 [7] | 13.176 | 0.920 | $5.099 \cdot {{10}^{{ - 2}}}$ | $ - 1.819897 \cdot {{10}^{5}}$ |
| Ксенон | 289.76 [6] | 2.731 | 0.913 | $1.062 \cdot {{10}^{{ - 2}}}$ | $ - 1.197 \cdot {{10}^{2}}$ |
Параметр, отвечающий за наклон капиллярной постоянной, аппроксимирован в виде:
(3)
${{\left( {{{\partial {{a}^{2}}} \mathord{\left/ {\vphantom {{\partial {{a}^{2}}} {\partial p}}} \right. \kern-0em} {\partial p}}} \right)}_{T}} = A + B\varepsilon + C{{\varepsilon }^{2}} + D{{\varepsilon }^{E}}.$Значения коэффициентов, входящих в уравнение (3), представлены в табл. 2.
Таблица 2.
Значения коэффициентов уравнения (3)
| Вещество | A | B | C | D | E |
|---|---|---|---|---|---|
| Пропан | $ - 3.12 \cdot {{10}^{{ - 3}}}$ | $ - 5.646 \cdot {{10}^{{ - 2}}}$ | – | – | – |
| Аргон | $ - 5.11 \cdot {{10}^{{ - 2}}}$ | $ - 2.6681 \cdot {{10}^{{ - 1}}}$ | $ - 4.7219 \cdot {{10}^{{ - 1}}}$ | $ - 9.6451 \cdot {{10}^{{ - 11}}}$ | –7 |
| Изобутан | $ - 4.563 \cdot {{10}^{{ - 2}}}$ | $4.3897 \cdot {{10}^{{ - 1}}}$ | $ - 7.9828 \cdot {{10}^{{ - 1}}}$ | – | – |
| н-бутан | $2.99 \cdot {{10}^{{ - 2}}}$ | $ - 4.37 \cdot {{10}^{{ - 3}}}$ | $ - 3.223 \cdot {{10}^{{ - 1}}}$ | – | – |
| Ксенон | – | – | – | $1.8 \cdot {{10}^{{ - 3}}}$ | $ - 9.2846 \cdot {{10}^{{ - 1}}}$ |
На рис. 2б представлена температурная зависимость производной ${{\left( {{{\partial {{a}^{2}}} \mathord{\left/ {\vphantom {{\partial {{a}^{2}}} {\partial p}}} \right. \kern-0em} {\partial p}}} \right)}_{T}}$ рассматриваемых растворов. Исследуемые растворы имеют качественно разные барические зависимости капиллярной постоянной. Как показывают расчеты, знак и значение производной ${{A}_{p}} = {{\left( {{{\partial {{a}^{2}}} \mathord{\left/ {\vphantom {{\partial {{a}^{2}}} {\partial p}}} \right. \kern-0em} {\partial p}}} \right)}_{T}}$ как функции температуры зависит от природы растворителя. При растворении гелия в аргоне значение производной ${{A}_{p}}$ отрицательно и наклон изотерм ${{a}^{2}}$ возрастает при приближении к критической точке аргона [5]. Качественно иной характер наблюдается в системе ксенон–гелий, где ${{A}_{p}} > 0$ [4], и это значение увеличивается при приближении к критической точке ксенона. В системе пропан–гелий производная ${{A}_{p}}$ принимает положительные значения и уменьшается до нуля от тройной точки растворителя до $T \approx 340$ К [3]. При $T > 340$ К производная ${{A}_{p}}$ меняет знак и становится отрицательной. Аналогично системе пропан–гелий, знак производной меняется в системе изобутан–гелий. При $Т < 348$ К значение производной положительно и принимает отрицательные значения при $Т > 348$ К. В исследованном диапазоне температур 318–378 К производная ${{\left( {{{\partial {{a}^{2}}} \mathord{\left/ {\vphantom {{\partial {{a}^{2}}} {\partial p}}} \right. \kern-0em} {\partial p}}} \right)}_{T}}$ системы н-бутан–гелий положительна и возрастает при приближении к критической точке н-бутана. Мы полагаем, что при $T < 318$ К производная сменит знак и станет отрицательной.
Растворы пропан–гелий, н-бутан–гелий и изобутан–гелий характеризуются более сильным межмолекулярным взаимодействием, чем растворы гелия в аргоне и ксеноне. Это приводит к различию критических кривых вблизи критической точки растворителя и барической зависимости капиллярной постоянной [9]. Согласно данным работы [9], производная ${{\left( {{{dp} \mathord{\left/ {\vphantom {{dp} {dT}}} \right. \kern-0em} {dT}}} \right)}_{c}}$ на критической линии раствора ксенон–гелий положительна [10], тогда как для раствора аргон–гелий она отрицательна. Проводя аналогию с этими данными, можно предположить, что для растворов гелия в пропане, н-бутане и изобутане будет менять знак не только производная ${{\left( {{{\partial {{a}^{2}}} \mathord{\left/ {\vphantom {{\partial {{a}^{2}}} {\partial p}}} \right. \kern-0em} {\partial p}}} \right)}_{T}},$ но и производная ${{\left( {{{dp} \mathord{\left/ {\vphantom {{dp} {dT}}} \right. \kern-0em} {dT}}} \right)}_{c}}$ на критической линии.
Барическая зависимость поверхностного натяжения
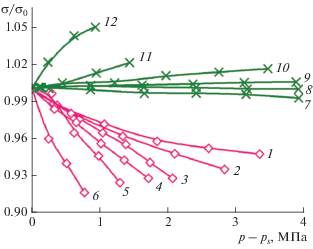
На рис. 3 показаны зависимости безразмерного поверхностного натяжения ${\sigma \mathord{\left/ {\vphantom {\sigma {{{\sigma }_{0}}}}} \right. \kern-0em} {{{\sigma }_{0}}}}$ от давления $\left( {p - {{p}_{s}}} \right)$ растворов пропан–гелий [3] и аргон–гелий [5]. Во всeм исследованном интервале температур, от тройной точки до критической, поверхностное натяжение аргона уменьшается с увеличением давления, в отличие от пропана, где первоначальный рост $\sigma ,$ сменяется его слабым уменьшением при температурах близких к ${{T}_{c}}$ пропана.
Рис. 3.
Зависимость приведенного поверхностного натяжения от давления. 1–6 – раствор аргон–гелий, 7–12 – раствор пропан–гелий. 1 – $T = 108;$ 2 – 118; 3 – 128; 4 – 132; 5 – 136; 6 – 140; 7 – 120; 8 – 180; 9 – 210; 10 – 270; 11 – 340; 12 – 350 K.
Поверхностное натяжение чистых аргона и пропана ${{\sigma }_{0}}$ аппроксимировано нами в виде:
(3)
${{\sigma }_{0}} = {{\sigma }_{*}}{{\varepsilon }^{\mu }}\left( {1 + {{\sigma }_{1}}\varepsilon + {{\sigma }_{2}}{{\varepsilon }^{6}}} \right).$Здесь коэффициенты ${{\sigma }_{*}},$ $\mu ,$ ${{\sigma }_{1}}$ и ${{\sigma }_{2}}$ найдены с помощью регрессионного анализа, погрешность аппроксимации не превышает неопределенность экспериментальных данных: ${{\sigma }_{*}} = 3.9106 \cdot {{10}^{1}}$ мН/м, $\mu = 1.264,$ ${{\sigma }_{1}} = - 8.414 \cdot {{10}^{{ - 2}}},$ ${{\sigma }_{2}} = - 7.27845$ (для аргона); ${{\sigma }_{*}} = 5.8839 \cdot {{10}^{1}}$ мН/м, $\mu = 1.271,$ σ1 = = ‒1.7543 · 10–1,${{\sigma }_{2}} = 3.2165 \cdot {{10}^{{ - 1}}}$ (для пропана).
ЗАКЛЮЧЕНИЕ
Впервые получены данные по капиллярной постоянной растворов изобутан–гелий и н-бутан–гелий при $318 < T < 378$ K и давлениях от давления насыщения растворителя до 4 МПа. Получены аппроксимационные уравнения для капиллярной постоянной и поверхностного натяжения. Погрешность аппроксимации не превышает неопределeнность экспериментальных данных.
Растворимость гелия в жидких углеводородах очень мала, увеличение его содержания в растворе качественно по-разному влияет на капиллярную постоянную и поверхностное натяжение растворов при низких и высоких температурах. В зависимости от температуры и типа растворителя увеличение концентрации гелия в двухфазной системе может приводить как к уменьшению, так и к увеличению капиллярной постоянной и поверхностного натяжения.
Список литературы
Байдаков В.Г. Межфазная граница простых классических и квантовых жидкостей. Екатеринбург: УИФ “Наука”, 1994.
Andbaeva V.N., Baidakov V.G. // Fuel. 2021. V. 287. Art. No. 119546.
Baidakov V.G., Khotienkova M.N. // Int. J. Refrig. 2019. V. 98. P. 261.
Baidakov V.G., Kaverin A.M., Andbaeva V.N. et al. // J. Chem. Eng. Data. 2011. V. 56. P. 4123.
Каверин А.М., Андбаева В.Н., Байдаков В.Г. // ЖФХ. 2006. Т. 80. № 3. С. 495; Kaverin A.M., Andbaeva V.N., Baidakov V.G. // Russ. J. Phys. Chem. 2006. V. 80. No. 3. P. 413.
Baidakov V.G. // Sov. Tech. Rev. B. 1994. V. 5. No. 4. P. 1.
Bücker D., Wagner W. // J. Phys. Chem. Ref. Data. 2006. V. 35. No. 2. P. 929.
Lemmon E.W., McLinden M.O., Wagner W. // J. Chem. Eng. Data. 2009. V. 54. P. 3141.
Streett W.B. // Trans. Faraday Soc. 1969. V. 65. P. 696.
de Swaan Arons J., Diepen G.A. // J. Chem. Phys. 1966. V. 44. P. 2322.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая