Известия РАН. Серия физическая, 2022, T. 86, № 2, стр. 287-292
Синхронизация во взаимодействующих сетях нейронов Ходжкина–Хаксли
А. В. Андреев 1, *, В. А. Максименко 1, А. А. Бадарин 1, В. В. Грубов 1, 2, А. Е. Храмов 1
1 Федеральное государственное автономное образовательное учреждение высшего образования
“Балтийский федеральный университет имени Иммануила Канта”,
Центр нейротехнологий и машинного обучения
Калининград, Россия
2 Федеральное государственное бюджетное образовательное учреждение высшего образования
“Саратовский государственный медицинский университет имени В.И. Разумовского”
Министерства здравоохранения Российской Федерации
Саратов, Россия
* E-mail: andreevandrei1993@gmail.com
Поступила в редакцию 01.10.2021
После доработки 11.10.2021
Принята к публикации 22.10.2021
- EDN: FIMROM
- DOI: 10.31857/S0367676522020053
Аннотация
Разработана математическая модель “сети сетей”, состоящая из небольшой входной сети и четырех больших подсетей, взаимодействующих друг с другом через ингибирующие связи. Данная модель является попыткой смоделировать процессы, которые имеют место происходить в реальных нейронных сетях при аналогичном процессе обработки ими входной информации. Показано, что индексы синхронизации в подсетях меняются во времени по периодическому закону. В зависимости от силы связи индексы синхронизации нейронов в разных подсетях могут меняться как в фазе, так и в противофазе.
ВВЕДЕНИЕ
Применение методов радиофизики, нелинейной динамики и сетевого анализа в задачах нейрофизиологии является актуальной тенденцией в современной науке [1–4].
Различные методы теории сетей используются при анализе взаимодействия между отделами головного мозга при когнитивной деятельности [5, 6], основываясь как на анализе экспериментальных данных (например, многоканальных записей электрической и магнитной активности) [7–14], так и на численном моделировании взаимодействия отдельных нейронов и их групп путем построения математических моделей сетей нелинейных элементов [15–20]. В качестве моделей нейронов используются модели Ходжкина–Хаксли [21], ФитцХью–Нагумо [22, 23], Хиндмарш–Розе [24]. Модель Ходжкина–Хаксли является наиболее полной моделью, которая описывает инициирование и распространение потенциала действия с учетом ионных токов в мембране нейрона. Спайковая активность, генерируемая этой моделью, имитирует электрическую активность реального нейрона.
В настоящее время применение теории сложных сетей к нейронауке является очень многообещающим для анализа структурных и функциональных связей нейронов мозга. Коллективная нейронная активность играет важную роль в функционировании мозга [25]. Согласно исследованиям функциональной магнитно-резонансной томографии (ФМРТ), сетевая активность всего мозга генерируется посредством взаимодействия нескольких функциональных подсетей во время состояния покоя или выполнения задачи [26]. Коллективные процессы, возникающие в результате функционального взаимодействия между удаленными популяциями корковых нейронов, поддерживают когнитивные способности при выполнении сложных задач. Современное понимание нейронной коммуникации подчеркивает жизненно важную роль фазовой когерентности в функциональном взаимодействии между удаленными нейронными ансамблями.
Была разработана модель “сети сетей”, состоящей из 1 маленькой входной нейронной сети и 4 больших нейронных сетей. Внешний сигнал, полученный входной сетью, преобразовывался ею в последовательность спайков, которая затем передавалась на 4 подсети, взаимодействующих друг с другом через ингибирующую связь, которые взаимодействовали друг с другом для обработки сигнала. Данная модель является некоторым аналогом системы обработки информации в головном мозге человека, когда небольшая входная сеть получает информацию и передает ее дальше для последующей обработки, причем в зависимости от сложности входной информации она может подключать к работе разное число нейронных сетей. Одним из примеров такой работы в головном мозге служит зрительная система, когда сигналы от таламуса передаются в зрительную кору. Обнаружено, что индексы синхронизации в подсетях периодически колеблются во времени, при чем эти колебания демонстрируют либо синфазную, либо противофазную синхронизацию в зависимости от силы ингибирующей связи между подсетями.
ОПИСАНИЕ МОДЕЛИ
В качестве модели нейрона была выбрана модель нейрона Ходжкина–Хаксли, описываемая следующими уравнениями [21]:
(1)
$\begin{gathered} {{C}_{m}}\frac{{dV}}{{dt}} = - {{g}_{{{\text{Na}}}}}{{m}^{3}}h\left( {V - {{V}_{{{\text{Na}}}}}} \right) - {{g}_{{\text{K}}}}{{n}^{4}}\left( {V - {{V}_{{\text{K}}}}} \right) - \\ - \,\,{{g}_{{\text{L}}}}\left( {V - {{V}_{L}}} \right) + {{I}^{{ex}}} + {{I}^{{syn}}}, \\ \end{gathered} $(3)
$I_{i}^{{syn}} = \sum\limits_{j\, \in \,{\text{neight}}\left( i \right)} {{{g}_{c}}{{e}^{{{{ - \left( {t - t_{0}^{j}} \right)} \mathord{\left/ {\vphantom {{ - \left( {t - t_{0}^{j}} \right)} {{{\tau }_{{syn}}}}}} \right. \kern-0em} {{{\tau }_{{syn}}}}}~}}}\left( {{{E}_{{rev}}} - {{V}_{i}}} \right)} ,$Структура сети представлена на рис. 1. В разработанной модели внешний сигнал постоянной амплитуды A = 9 мкА/см2, соответствующий режиму непрерывной генерации спайков, подается на входную сеть, состоящую из 5 нейронов, связанных между собой со случайно выбранной силой связи в диапазоне 0–0.15 мСм/см2. Каждый нейрон входной сети однонаправленно связан с каждым из N1 = N2 = N3 = N4 = 50 нейронов четырех больших подсетей возбуждающими синапсами с силой связи gс = 0.05 мСм/см2 и вероятностью 30%. Все большие подсети двунаправленно связаны друг с другом ингибирующими связями с силой $g_{c}^{{ex}}$ и вероятностью 30%. Внутри каждой подсети все нейроны связаны друг с другом двунаправленными возбуждающими синапсами с силой $g_{c}^{{in}}.$ Для данных сетей была выбрана топология “малый мир”, сгенерированная с помощью модели Ватца и Строгаца [28] при значении параметров β = 0.3, K = 5. Выбор данной топологии сети обусловлен тем, что в данной работе делается попытка смоделировать обработку сигналов в головном мозге как на низком, так и на высоком уровне, т.е. на уровне отдельного нейрона и на уровне нейронных ансамблей. Свойства топологии “малый мир” в реальных нейронных ансамблях определяют связи между нейронами на анатомическом уровне [29, 30], что позволяет использовать данную топологию для моделирования отдельных групп нейронов. В настоящей работе сети предполагаются находящимися на достаточно близком друг от друга расстоянии, что позволяет связать их “все со всеми” при введение конечной вероятности установления связей. Непрерывный стимул, полученный небольшой входной сетью, преобразуется в последовательность нейронных спайков (преобразование амплитуды в частоту), передаваемых затем в большие сети для обработки сигнала. Аналогичный процесс происходит в головном мозге при восприятии визуальной информации. При увеличении потока информации увеличивается частота генерации нейронного ансамбля, участвующего в обработке. Нейроны внутри каждой подсети связаны друг с другом с силой связи $g_{c}^{{in}}.$
Рис. 1.
Модель “сети сетей”. Внешний сигнал постоянной амплитуды A подается на входную сеть, состоящую из 5 нейронов. Каждый нейрон входной сети однонаправленно связан с каждым из N1 = N2 = N3 = = N4 = 50 нейронов четырех подсетей возбуждающими синапсами с силой связи gc = 0.05 и вероятностью 30%. Все подсети двунаправленно связаны друг с другом подавляющими синапсами с силой связи $g_{c}^{{ex}}$ и вероятностью 30%. Нейроны внутри каждой подсети связаны друг с другом в соответствии с топологией “малый мир” с силой связи $g_{c}^{{in}}.$

РЕЗУЛЬТАТЫ
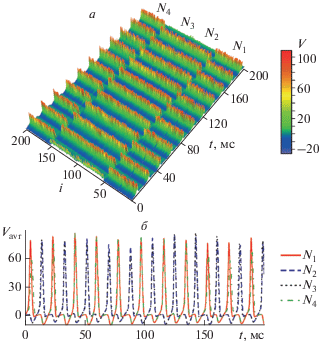
Для разработанной “сети сетей” был проведен анализ ее динамики. Пример характерной временной реализации всего нейронного ансамбля приведен на рис. 2а. Внутри каждой подсети все нейроны генерируют спайки практически в одинаковые моменты времени за счет возбуждающей связи между ними. Таким образом на усредненных по всем нейронам каждой подсети сигналах будут последовательности отдельных сконцентрированных спайков (рис. 2б). Видно, что 4 подсети под действием ингибирующей связи между ними разделяются на 2 кластера: первая сеть синхронизирована с четвертой, а вторая – с третьей. Синхронизированные между собой сети генерируют спайки синхронно в одинаковые промежутки времени, в то время как активность сетей из разных кластеров демонстрирует противофазную динамику. Таким образом, две группы подсетей находятся в постоянной противофазе друг с другом. Учитывая, что данные подсети занимаются обработкой сигнала, получаемого от малой входной сети, можно заключить, что для достижения оптимального процесса работы 2 группы сетей разделяют входную информацию между собой поровну, в каждой группе при этом сети должны быть синхронны для эффективной обработки входного сигнала.
Рис. 2.
Пространственно-временная диаграмма мембранного потенциала V нейронов в первой N1 (i = 1, …, 50), второй N2 (i = 51, …, 100), третьей N3 (i = 101, …, 150) и четвертой N4 (i = 151, …, 200) подсетях (а) и временные ряды усредненного по каждой подсети мембранного потенциала при $g_{c}^{{ex}} = 0.9,$ $g_{c}^{{in}} = - 0.03~$ (б).
Для анализа динамики были рассчитаны индексы синхронизации между всеми нейронами каждой большой подсети [31, 32]:
где t0 – время переходного процесса, и T – общее время, ${{\xi }_{n}}$ – среднеквадратичное отклонение, определяемое как(5)
${{\xi }_{n}} = \frac{1}{N}\sum\limits_{i = 1}^N {{{{\left( {x_{n}^{{\left( i \right)}}} \right)}}^{2}}} - {{\left( {\frac{1}{N}\sum\limits_{i = 1}^N {x_{n}^{{\left( i \right)}}} } \right)}^{2}},$Полученные временные ряды были затем отфильтрованы в полосе частот 0.004–0.015 Гц для визуализации медленных изменений. В зависимости от силы связи между подсетями и силы связи между элементами внутри подсетей эти индексы могут находиться в разной степени скоррелированности между собой. Для анализа корреляции был рассчитан линейный коэффициент корреляции Пирсона r для каждой пары подсетей:
(6)
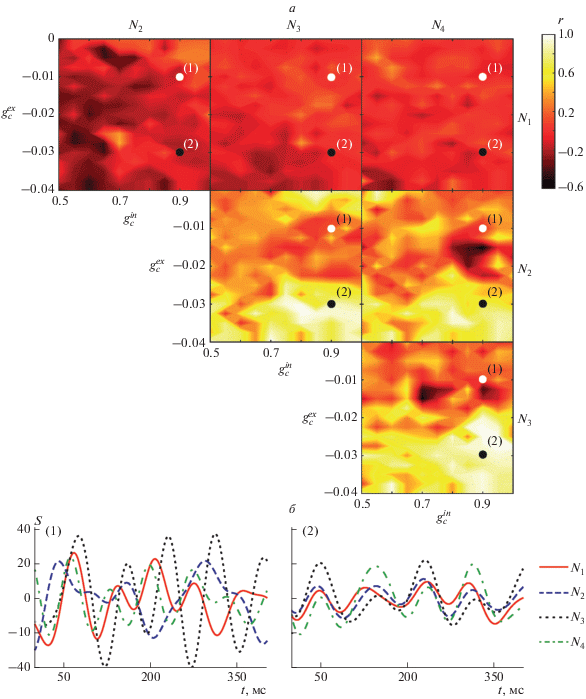
$r = \frac{{\int\limits_{{{t}_{0}}}^T {\left( {{{S}_{1}}\left( t \right) - {{{\bar {S}}}_{1}}} \right)\left( {{{S}_{2}}\left( t \right) - {{{\bar {S}}}_{2}}} \right)dt} }}{{\sqrt {\int\limits_{{{t}_{0}}}^T {{{{\left( {{{S}_{1}}\left( t \right) - {{{\bar {S}}}_{1}}} \right)}}^{2}}{{{\left( {{{S}_{2}}\left( t \right) - {{{\bar {S}}}_{2}}} \right)}}^{2}}dt} } }},$Обнаружено, что первая подсеть для всего диапазона рассматриваемых значений сил связи демонстрирует практически нулевую корреляцию со всеми остальными подсетями при низких значениях межсетевой силы связи, которая уменьшается до r = –0.2 с увеличением ингибирующих связей (рис. 3). При этом три другие подсети ведут себя совершенно иначе: при слабых межсетевых связях корреляция между их индексами синхронизации близка к 0, но при увеличении этой связи корреляция возрастает вплоть до 1.0. Также следует отметить, что увеличение силы внутрисетевых связей приводит к возрастанию корреляции между всеми сетями.
Рис. 3.
Двухпараметрические зависимости корреляции r между индексами синхронизации четырех подсетей в пространстве сил связи между подсетями $g_{c}^{{ex}}~$ и между элементами внутри подсетей $g_{c}^{{in}}$ (а) и временные зависимости индексов синхронизации SI для четырех подсетей, соответствующие точкам (1) $g_{c}^{{ex}} = 0.9,$ $g_{c}^{{in}} = - 0.01$ и (2) $g_{c}^{{ex}} = 0.9,$ $g_{c}^{{in}} = - 0.03$ на рис. 3а (б).
ЗАКЛЮЧЕНИЕ
Была разработана математическая модель “сети сетей”, состоящая из небольшой входной сети и двух больших подсетей. Внешний сигнал, полученный входной сетью, преобразовывался ею в последовательность спайков, которая затем передавалась на 2 подсети с топологией “малый мир”, взаимодействующих друг с другом через ингибирующую связь, которые взаимодействовали друг с другом для обработки сигнала.
Была проанализирована динамика разработанной модели сети и показано, что индексы синхронизации в подсетях периодически колеблются во времени, возникает низкочастотная модуляция нейронной активности. Согласно литературе, низкочастотная модуляция спайковой активности нейронов осуществляется за счет ритмов кортикальной активности (например, тета-, альфа- и бета-), которые регистрируются неинвазивно при помощи ЭЭГ. При регулировке силы тормозящей связи между сетями можно заметить, что индексы синхронизации этих сетей совершают синфазные или противофазные колебания. В первом случае между этими сетями возможно установление функциональной связи. Во втором случае сигналы, приходящие от одной сети на другую, будут блокироваться. Можно предположить, что тормозящие связи являются одним из возможных регуляторов перераспределения когнитивных ресурсов между нейронными ансамблями в головном мозге. Полученные теоретические результаты отражают один из возможных механизмов перераспределения когнитивного ресурса между нейронными ансамблями в головном мозге. Согласно нашей гипотезе в случае длительной активности мозг динамически перераспределяет нагрузку между различными нейронными ансамблями, подстраивая фазовые соотношения между сигналами их активности. При этом активность отдельных ансамблей меняется во времени по периодическому закону: интервалы активации чередуются с интервалами восстановления.
Продемонстрировано, что для поддержания нейронной сети в режимах синфазных или противофазных колебаний индексов синхронизации необходимо соблюдать баланс между внутрисетевыми и межсетевыми связями. Наблюдаемый механизм совместной обработки информации разными группами элементов может наблюдаться как в работе разных участков головного мозга, так и при коллективной работе группы людей над решением одной задачи.
Работа выполнена при поддержке Совета по грантам Президента Российской Федерации (проект НШ-589.2022.1.2). В.В. Грубов благодарит за поддержку Российский фонд фундаментальных исследований (проект № 19-32-60033).
Список литературы
Betzel R.S., Gu S., Medaglia J.D. et al. // Sci. Rep. 2016. V. 6. Art. No. 30770.
Hermundstad A.M., Bassett D.S., Brown K.S. et al. // Proc. Nat. Acad. Sci. USA. 2013. V. 110. P. 6169.
Hramov A.E., Koronovskii A.A., Makarov V.A. et al. Wavelets in neuroscience. Berlin-Heidelberg: Springer, 2015.
Atasoy S., Donnelly I., Pearson J. // Nature Commun. 2016. V. 7. No. 1. P. 1.
Thomas J.P., Gauthier I. // Nature Rev. Neurosci. 2004. V. 5. P. 291.
Haenschel C., Vernon D.J., Dwivedi P. et al. // J. Neurosci. 2005. V. 25. Art. No. 10494.
Campbell I.G. // Curr. Protoc. Neurosci. 2009. V. 49. No. 1. P. 10.
Buzsaki G. // Nature Neurosci. 2004. V. 7. No. 5. P. 446.
Badarin A.A., Skazkina V.V., Grubov V.V. // Proc. SPIE. 2020. V. 11459. Art. No. 114590D.
Buzsaki G., Draguhn A. // Science. 2004. V. 304. P. 1926.
Kurkin S., Badarin A., Grubov V. et al. // Eur. Phys. J. Plus. 2021. V. 136. No. 5. Art. No. 548.
Frolov N., Maksimenko V., Hramov A. // Chaos. 2020. V. 30. No. 12. Art. No. 121108.
Maksimenko V.A., Frolov N.S., Hramov A.E. et al. // Front. Behave. Neurosci. 2019. V. 13. P. 220.
Frolov N.S., Maksimenko V.A., Hramova M.V. et al. // Eur. Phys. J. Spec. Top. 2019. V. 228. No. 11. P. 2381.
Valencia M., Martinerie J., Dupont S. et al. // Phys. Rev. E. 2008. V. 77. № 5. Art. No. 050905.
Andreev A.V., Maksimenko V.A., Pisarchik A.N. et al. // Chaos Solit. Fractals. 2021. V. 146. Art. No. 110812.
Klinshov V., Shchapin D., Yanchuk S., Nekorkin V. // Phys. Rev. Lett. 2015. V. 114. No. 17. Art. No. 178103.
Andreev A., Maksimenko V. // Cybern. Phys. 2019. V. 8. No. 4. P. 199.
Klinshov V.V., Teramae J., Nekorkin V.I., Fukai T. // PloS One. 2014. V. 9. No. 4. Art. No. e94292.
Ponomarenko V.I., Kulminskiy D.D., Andreev A.V., Prokhorov M.D. // Tech. Phys. Lett. 2021. V. 47. No. 2. P. 162.
Hodgkin A.L., Huxley A.F. // J. Physiol. 1952. V. 117. No. 4. P. 500.
FitzHugh R. // Biophys. J. 1961. V. 1. No. 6. P. 445.
Nagumo J., Arimoto S., Yoshizawa S. // Proc. IRE. 1962. V. 50. No. 10. P. 2061.
Hindmarsh J.L., Rose R.M. // Proc. Royal Soc. Lond. Ser. B. 1984. V. 221. No. 1222. P. 87.
Bullmore E., Sporns O. // Nature Rev. Neurosci. 2009. V. 10. No. 3. P. 186.
Van Den Heuvel M.P., Pol H.E.H. // European Neuropsychopharm. 2010. V. 20. No. 8. P. 519.
White J.A., Rubinstein J.T., Kay A.R. // Trends Neurosci. 2000. V. 23. No. 3. P. 131.
Watts D.J., Strogatz S.H. // Nature. 1998. V. 393. No. 6684. P. 440.
Muldoon S.F., Bridgeford E.W., Bassett D.S. // Sci. Rep. 2016. V. 6. Art. No. 22057.
Bassett D.S., Bullmore E. // Neurosci. 2006. V. 12. P. 512.
Wang Q., Perc M., Duan Z., Chen G. // Phys. Rev. E. 2009. V. 80. No. 2. Art. No. 026206.
Sausedo-Solorio J.M., Pisarchik A.N. // Eur. Phys. J. Spec. Top. 2017. V. 226. No. 9. P. 1911.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая


