Известия РАН. Серия физическая, 2022, T. 86, № 4, стр. 510-515
Использование спектроскопии SERS и SEF для детектирования диад фуллерен–краситель в воде и в биологических структурах
Н. С. Горячев 1, 3, В. И. Кукушкин 2, А. Ю. Белик 1, А. Ю. Рыбкин 1, *, О. А. Краевая 1, П. А. Трошин 1, 4, А. И. Котельников 1, 3
1 Федеральное государственное бюджетное учреждение науки
Институт проблем химической физики Российской академии наук
Черноголовка, Россия
2 Федеральное государственное бюджетное учреждение науки
Институт физики твердого тела имени Ю.А. Осипьяна Российской академии наук
Черноголовка, Россия
3 Федеральное государственное бюджетное образовательное учреждение высшего образования
“Московский государственный университет имени М.В. Ломоносова”
Москва, Россия
4 Силезский технологический университет
Гливице, Польша
* E-mail: alryb@icp.ac.ru
Поступила в редакцию 15.11.2021
После доработки 06.12.2021
Принята к публикации 22.12.2021
- EDN: DILJNI
- DOI: 10.31857/S0367676522040111
Аннотация
При регистрации диад фуллерен–краситель PFD–Fl и PFD–Ce6 методом поверхностно-усиленного рамановского рассеяния (SERS) обнаружен эффект появления поверхностно-усиленной флуоресценции (SEF), который не наблюдается у индивидуальных красителей, что согласуется с теорией, предсказывающей обратную зависимость интенсивности флуоресценции SEF от квантового выхода обычной флуоресценции соединений в растворе. Это позволяет регистрировать такие гибридные молекулярные структуры по регистрации спектров SERS или SEF в диапазоне концентраций 10–7–10–5 М и открывает возможность широкого использования метода SERS и SEF для исследования взаимодействия данных производных фуллеренов с биологическими структурами различного уровня организации.
ВВЕДЕНИЕ
Известно, что водорастворимые производные фуллеренов С60 имеют широкий спектр биологической активности и являются перспективными с точки зрения создания на их основе эффективных лекарственных средств [1, 2]. В работах [3–6] была показана перспективность использования диад фуллерен–краситель в качестве высокоэффективных фотосенсибилизаторов для применения в фотодинамической терапии. Флуоресценция красителей в таких диадах потушена за счет переноса возбуждения или электрона с красителя на фуллерен [3–6]. В связи с этим актуальна разработка высокочувствительных экспериментальных методов, позволяющих эффективно детектировать подобные соединения в водных растворах и в биологических структурах.
В работах [7–9] было продемонстрировано, что метод поверхностно-усиленного рамановского рассеяния (SERS – surface-enhanced Raman scattering) позволяет детектировать водорастворимые производные фуллеренов в водных растворах в диапазоне концентраций до 10–6 М, а в случае диад фуллерен–краситель – в концентрациях до 10–8 М. Однако при введении производных фуллеренов и диад фуллерен–краситель в биологические структуры – в модельные биологические мембраны (липосомы) или в структуру белка альбумина чувствительность метода SERS резко снижается [8].
Согласно литературным данным, взаимодействие молекул с металлической поверхностью подложки может приводить к появлению не только сигнала SERS, но и к появлению сигнала поверхностно усиленной флуоресценции (SEF – surface-enhanced fluorescence), которая по своей интенсивности может значительно превосходить интенсивность обычной флуоресценции [10]. Причем коэффициенты усиления сигналов SERS и SEF нелинейно зависят от расстояния между флюорофором и подложкой [11–13]. Ранее было показано, что у используемых в настоящей работе подложек на основе наносеребра EnSpectr SERS коэффициент усиления сигнала SERS и SEF слабо зависит от расстояния между анализируемыми молекулами и подложкой в диапазоне до 30 нм, однако на больших расстояниях усиление падает [12, 13].
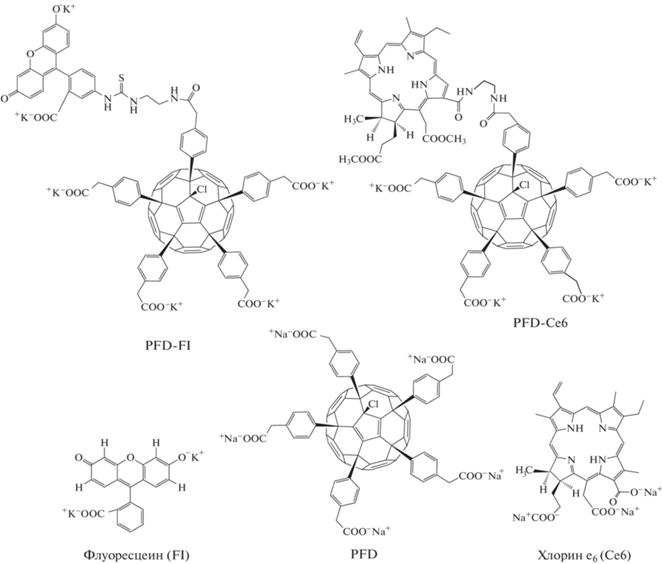
Так как интенсивность наблюдаемых сигналов SERS и SEF должна в значительной степени зависеть от природы анализируемых соединений, их концентрации и способа нанесения на подложку, в данной работе исследовалась возможность регистрации спектров SERS и SEF диад PFD–Flu и PFD–Ce6 – ковалентных конъюгатов полианионного производного фуллерена PFD и красителей флуоресцеина (Fl) и хлорина е6 (Ce6) (рис. 1) в водном растворе, в структуре липосом или белка альбумина.
МАТЕРИАЛЫ И МЕТОДЫ
Для исследований использовали полианионное производное фуллерена PFD, красители флуоресцеин (Fl), хлорин е6 (Ce6) и ковалентные диады PFD–Fl и PFD–Ce6 (рис. 1). Синтез соединений PFD, PFD–Fl и PFD–Ce6 был осуществлен как описано в [3, 4], и их структура была подтверждена методами оптической и ИК-спектроскопии, флуоресценции, 1H и 13C ЯМР-спектроскопии и электроспрей-масс спектрометрии. Для регистрации спектров SERS и SEF образцы соединений растворялись в воде, 1 мкл анализируемого раствора наносился на подожку и высушивался в течение нескольких минут при комнатной температуре, как описано в работе [9].
В работе использовались оригинальные подложки EnSpectr SERS (Enhanced Spectrometry, Inc., San Jose, CA 95110, USA) на основе наночастиц серебра, получаемых термическим испарением в вакуумной камере, как описано в работах [12–15].
Спектры SERS и SEF регистрировались на Рамановском микроскопе Raman Microscope R532 (TeraSense Group, Inc., San Jose, CA 95110, USA) при возбуждении на длине волны λex = 532 нм. Луч лазера мощностью 0.2 мВт фокусировался на поверхности образца с помощью 20-кратного объектива микроскопа. Размер лазерного пятна составлял ~5 мкм, что определяет пространственное разрешение установки. Сканирование поверхности образца выполнялось с помощью трехкоординатного столика Märzhäuser ECO-STEP Motorized stage system (Märzhäuser Wetzlar GmbH & Co. KG, Germany) в течение 1 с.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
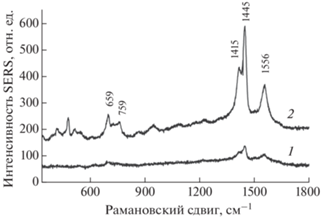
Исследования показали, что при нанесении на подложки водного раствора водорастворимого производного фуллерена PFD оно проявляет хорошо регистрируемые спектры SERS, который состоит из 3 интенсивных линий с максимумами при 1445, 1415 и 1556 см–1, что на 10–20 см–1 меньше по сравнению с литературными данными по спектроскопии SERS нативного фуллерена С60 [16, 17], а также из двух менее интенсивных линий при 695 и 759 см–1 (рис. 2). Сдвиг основных линий, а также расщепление мод Hg(3) и Hg(4) (650–750 см–1) является типичной характеристикой искаженной молекулы фуллерена. Как видно из рис. 2, хотя фуллерены практически не обладают обычной флуоресценцией, регистрация спектров SERS соединений PFD позволяет уверенно регистрировать их в диапазоне концентраций 10–5–10–6 М.
Рис. 2.
Спектры SERS водного раствора производного фуллерена PFD при различных концентрациях: 1 – 2 · 10–6 М; 2 – 10–5 М.
Ранее было показано, что при ковалентном присоединении флуоресцирующих красителей флуоресцеина или хлорина е6 к ядру фуллерена флуоресценция этих красителей в составе диад PFD–Fl и PFD–Ce6 сильно потушена вследствие эффективного переноса возбуждения или электрона с возбужденного красителя на сфероид фуллерена [3, 4]. Это значительно затрудняет использование стандартных флуоресцентных методов для детектирования таких диад в биологических структурах при проведении фармакокинетических исследований.
Исследования показали, что спектр SERS красителя флуоресцеина – Fl (рис. 3а) имеет четко выраженные линии в диапазоне 300–1700 см–1, в том числе три интенсивные линии (1629, 1540 и 1323 см–1), которые связаны с валентными колебаниями ароматической связи С–С в ксантеновом скелете красителя, что совпадает с литературными данными [18]. Спектр SERS индивидуального красителя Cе6 также состоит из большого количества линий в диапазоне 600–1600 см–1 (рис. 3а), что также совпадает с ранее опубликованными данными [19].
Рис. 3.
Спектры SERS водных растворов соединений Fl, PFD–Fl, Сe6 и PFD–Ce6. 1 – Fl (10–5 М), 2 – PFD–Fl (10–5 М), 3 – свободная флуоресценция красителя Fl (а). 1 – Ce6 (10–6 М); 2 – PFD–Ce6 (10–6 М), 3 – свободная флуоресценция красителя Ce6 (б).
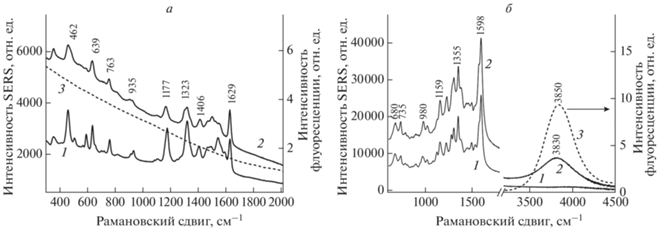
При регистрации спектров SERS диад PFD–Fl и PFD–Ce6 оказалось, что хотя флуоресценция красителей в структуре диад сильно потушена [3, 4], данные диады также обладают интенсивным спектром SERS, близким к спектру исходного красителя (рис. 3а и 3б). При этом линии сигнала SERS, характерные для производного фуллерена PFD – 1447 и 1556 см–1 – в спектрах диад не детектируются. Согласно электромагнитной теории SERS, наибольшее усиление излучательной активности наблюдается для колебаний, изменяющих поляризуемость молекул в направлении, перпендикулярном поверхности металла [20]. В связи с этим, возможно, наибольший эффект SERS в эксперименте наблюдается для плоских молекул флуоресцеина и хлорина, в том числе в структуре диад PFD–Fl и PFD–Ce6, сорбированных на подложках из наносеребра, а менее интенсивные линии для PFD связаны со слабой поляризуемостью сфероида фуллерена.
При анализе данных, приведенных на рис. 3а, следует отметить, что у спектра диады PFD–Fl появляется широкая полоса, возрастающая в диапазоне от 2000 до 400 см–1, что совпадает по форме с участком спектра стационарной флуоресценции водного раствора красителя Fl (рис. 3а, кривая 3). Этот эффект можно объяснить наложением спектра колебательно-вращательных (рамановских) мод диады PFD–Fl на широкую полосу спектра SEF-флуоресцении красителя Fl в составе данной диады.
Более явно эффект SEF выражен для диады PFD–Ce6. На рис. 3б представлены спектры SERS красителя Ce6 и диады PFD–Ce6. В этом случае в спектре SERS диады PFD–Ce6, наряду со спектром SERS красителя Ce6 в диапазоне 400–2000 см–1, наблюдается отдельный, отчетливо регистрируемый пик SEF на 3830 см–1. Для сравнения, на этом же рисунке пунктиром нанесен спектр стационарной флуоресценции водного раствора индивидуального красителя Ce6 (рис. 3б, кривая 3), имеющей максимум при 670 нм (что соответствует 3850 см–1 при регистрации в режиме SERS при возбуждении на длине волны 532 нм).
Важно отметить, что поверхностно-усиленную флуоресценцию SEF исходных красителей Fl и Ce6 в аналогичных условиях зарегистрировать не удается (рис. 3а и 3б).
Обнаруженные эффекты более выраженной SEF для диад PFD–Fl и PFD–Ce6 по сравнению со свободными красителями Fl и Ce6 можно объяснить тем, что, согласно теоретическим представлениям, степень усиления SEF обратно пропорциональна квантовому выходу свободной флуоресценции исследуемых веществ и зависит от параметров подложки [21, 22].
Характер изменения флуоресценции SEF MFluo зависит от нескольких независимых факторов [21]:
(1)
${{M}_{{Fluo}}} \approx {{M}_{{Abs}}}\eta _{{Rad}}^{{EM}}{{\left( {{{Q}_{0}}} \right)}^{{ - 1}}},$В соответствии с этими представлениями, для красителей Fl и Ce6, имеющих высокий квантовый выход флуоресценции (${{Q}_{0}}$ равны, соответственно, 0.37 для аниона флуоресцеина [23] и 0.22 для Ce6 [24]), наблюдаемая SEF выражена в меньшей степени, чем для диад PFD–Fl и PFD–Ce6, для которых значения ${{Q}_{0}}$ находятся в диапазоне 10–3–10–4 [3, 4].
Как отмечалось выше, коэффициент усиления сигналов SERS и SEF зависит от расстояния между анализируемым веществом и поверхностью подложки [10–13]. Этот эффект может иметь особенное значение при встраивании исследуемых соединений в биологические мембраны и в структуру белков. С целью моделирования спектров SERS и SEF диад PDF–Fl в биологических структурах исследовались спектры данных диад, встроенных в модельные биологические мембраны (липосомы) и в гидрофобную полость белка альбумина.
Спектры SERS и SEF PFD–Fl регистрировались в зависимости от концентрации PFD–Fl, которая изменялась соотношением PFD–Fl/липид при встраивании PFD–Fl в структуру липосом или в зависимости от концентрации белка альбумина при соотношении PFD–Fl/белок = 0.7.
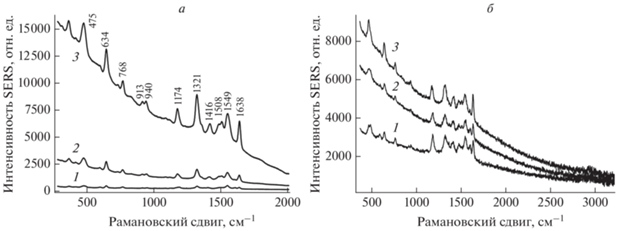
При анализе спектров SERS и SEF диады PFD–Fl в структуре лецитиновых липосом необходимо принять во внимание, что при встраивании диады в структуру модельных мембран интенсивность ее спектра SERS определяется локальной концентрацией молекул вблизи поверхности подложки. В структуре липосом анализируемые молекулы разбавлены молекулами липида пропорционально их молярному соотношению и молекулярному объему. Как видно из рис. 4а, интенсивности спектра SERS (амплитуда узких линий) и спектра SEF (амплитуда широкой составляющей спектра) изменяются с изменением соотношения PDF–Fl/липид.
Рис. 4.
Спектры SERS PFD–Fl в структуре липосом (а) и в структуре альбумина (б). PFD–Fl в структуре липосом при различных соотношениях PFD–Fl/липид: 1 – 1/1000; 2 – 1/100; 3 – 1/10. Концентрация липидов 10–4 М (а). PFD–Fl в структуре альбумина при различных концентрациях белка: 1 – 10–5, 2 – 3 · 10–5, 3 – 10–4 М (б).
При встраивании ковалентных диад PFD–Fl в гидрофобные сайты альбумина, имеющего молекулярный вес ~65 000 дальтон и диаметр макромолекулы ~5 нм, вероятность непосредственного контакта анализируемых соединений с поверхностью подложки также значительно уменьшается. При этом линейные размеры диады PFD–Fl примерно в 5 раз меньше размера молекулы альбумина, что приводит к снижению поверхностной концентрации PFD в одном монослое макромолекул альбумина на подложке в 25 раз. Последующий, второй монослой макромолекул белка будет находиться на расстоянии более 5 нм от поверхности подложки, а объемная концентрация в целом уменьшается в 125 раз. Эти факторы должны приводить к резкому снижению интенсивности сигнала SERS при встраивании PFD в структуру альбумина и нанесении макромолекул белка на поверхность подложки.
В эксперименте было обнаружено, что при введении диады PFD–Fl в структуру альбумина и нанесении их на подлодку спектры SERS и SEF удается регистрировать при концентрациях белка 10–4–10–5 М (рис. 4б). По мере роста концентрации комплекса белка с PFD–Fl наблюдается рост амплитуды спектра SEF красителя, при этом изменения амплитуды узких линий спектра SERS выражены значительно слабее. Это можно объяснить тем, что спектр SERS диады в структуре белка обусловлен в основном вкладом только первого монослоя белка на подложке, в то время как эффект SEF проявляется при наслоении последующих молекул белка на большем удалении от подложки.
ЗАКЛЮЧЕНИЕ
Продемонстрирована возможность уверенного детектирования методами SERS или SEF диад фуллерен–краситель PFD–Fl и PFD–Ce6, создаваемых в качестве перспективных фотодинамических соединений, даже в том случае, когда флуоресценция красителя, присоединенного к фуллерену, сильно потушена. При регистрации SERS у диад PFD–Fl и PFD–Ce6 наблюдается выраженный сигнал поверхностно-усиленной флуоресценции SEF, тогда как у индивидуальных красителей флуоресценция SEF не наблюдается, что согласуется с теорией, предсказывающей обратную зависимость интенсивности флуоресценции SEF от квантового выхода обычной флуоресценции соединений в растворе. Этот эффект позволяет регистрировать такие гибридные молекулярные структуры по высокоинтенсивному спектру SERS или SEF красителя в диапазоне концентраций 10–7–10–5 М и открывает возможность широкого использования метода SERS и SEF для исследования взаимодействия данных производных фуллеренов с биологическими структурами различного уровня организации.
Исследования финансировались Министерством науки и образования Российской федерации (тема государственного задания № АААА-А19-119112590105-7). Работы по синтезу производных фуллерена поддержаны Министерством науки и образования Российской федерации (тема государственного задания № AAAA-A19-119071190044-3).
Список литературы
Goodarzi S., Da Ros T., Conde J. et al. // Mater. Today 2017. V. 20. No. 8. P. 460.
Castro E., Garcia A.H., Zavala G. et al. // J. Mater. Chem. B 2017. V. 5. No. 32. P. 6523.
Rybkin A.Y., Belik A.Y., Goryachev N.S. et al. // Dye. Pigment. 2020. V. 180. Art. No. 108411.
Rybkin A.Y., Belik A.Y., Kraevaya O.A. et al. // Dye Pigment. 2019. V. 160. P. 457.
Рыбкин А.Ю., Белик А.Ю., Тарканов П.А. и др. // Макрогетероциклы. 2019. Т. 12. № 2. С. 181.
Belik A.Y., Rybkin A.Y., Voronov I.I. et al. // Dye. Pigment. 2017. V. 139. P. 65.
Белик А.Ю., Кукушкин В.И., Рыбкин А.Ю. и др. // Докл. РАН. 2018. Т. 481. № 3. С. 270; Belik A.Y., Kukushkin V.I., Rybkin A.Y. et al. // Dokl. Phys. Chem. 2018. V. 481. No. 1. P. 95.
Полетаева Д.А., Рыбкин А.Ю., Кукушкин В.И. и др. // Докл. РАН. 2016. Т. 466. № 3. С. 310; Poletaeva D.A., Rybkin A.Y., Kukushkin V.I. et al. // Dokl. Phys. Chem. 2016. V. 466. No. 1. P. 23.
Полетаева Д.А., Хакина Е.А., Кукушкин В.И. и др. // Докл. РАН. 2015. Т. 460. № 1. С. 52; Poletaeva D.A., Khakina E.A., Kukushkin V.I. et al. // Dokl. Phys. Chem. 2015. V. 460. No. 1. P. 1.
Kummerlen J., Leitner A., Brunner H. et al. // Mol. Phys. 1993. V. 80. No. 5. P. 1031.
Das P.C., Puri A. // Phys. Rev. B. 2002. V. 65. No. 15. Art. No. 1554161.
Кукушкин В.И., Ваньков А.Б., Кукушкин И.В. // Письма в ЖЭТФ. 2013. Т. 98. № 6. С. 383; Kukushkin V.I., Van’kov A.B., Kukushkin I.V. // JETP Lett. 2013. V. 98. No. 6. P. 342.
Кукушкин В.И., Ваньков А.Б., Кукушкин И.В. // Письма в ЖЭТФ. 2013. Т. 98. № 2. С. 72; Kukushkin V.I., Van’kov A.B., Kukushkin I.V. // JETP Lett. 2013. V. 98. No. 2. P. 64.
Кукушкин В.И, Гришина Я.В., Соловьев В.В. и др. // Письма в ЖЭТФ. 2017. Т. 105. № 10. С. 637; Kukushkin V.I., Grishina Y.V., Solov’ev V.V. et al. // JETP Lett. 2017. V. 105. No. 10. P. 677.
Кукушкин В.И, Гришина Я.В., Егоров С.В. и др. // Письма в ЖЭТФ. 2016. Т. 103. № 8. С. 572; Kukushkin V.I., Grishina Y.V., Egorov S.V. et al. // JETP Lett. 2016. V. 103. No. 8. P. 508.
Dresselhaus M.S., Dresselhaus G., Eklund P.C. // J. Raman Spectrosc. 1996. V. 27. No. 3–4. P. 351.
Zhang Y., Edens G., Weaver M.J. // J. Amer. Chem. Soc. 1991. V. 113. № 24. P. 9395.
Hildebrandt P., Stockburger M. // J. Raman Spectrosc. 1986. V. 17. No. 1. P. 55.
Терехов С.Н., Гладков Л.Л., Гладкова О.Л. и др. // Опт. и спектроск. 2009. Т. 106. № 6. С. 899; Terekhov S.N., Gladkov L.L., Gladkova O.L. et al. // Opt. Spectrosс. 2009. V. 106. No. 6. P. 813.
Bandy B.J., Lloyd D.R., Richardson N.V. // Surf. Sci. 1979. V. 89. No. 1–3. P. 344.
Le Ru E., Etchegoin P. Principles of surface enhanced Raman spectroscopy. V. 1. Elsevier Cambridge University Press, 2009. 663 p.
Weitz D.A., Garoff S., Gersten J.I. et al. // J. Electron. Spectrosc. Relat. Phenom. 1983. V. 29. No. 1. P. 363.
Sjöback R., Nygren J., Kubista M. // Spectrochim. Acta A. 1995. V. 51. No. 6. Art. No. L7.
Zenkevich E., Sagun E., Knyukshto V. et al. // J. Photochem. Photobiol. B. 1996. V. 33. No. 2. P. 171.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая