Известия РАН. Серия физическая, 2022, T. 86, № 4, стр. 527-531
Определение вирусов гриппа в биологических жидкостях с помощью биосенсора на основе гигантского комбинационного рассеяния света
Г. А. Жданов 1, Д. А. Грибанев 2, А. С. Гамбарян 3, В. И. Кукушкин 2, Е. Г. Завьялова 1, *
1 Федеральное государственное бюджетное образовательное учреждение высшего образования
“Московский государственный университет имени М.В. Ломоносова”
Москва, Россия
2 Федеральное государственное бюджетное учреждение науки
Институт физики твердого тела имени Ю.А. Осипьяна Российской академии наук
Черноголовка, Россия
3 Федеральное государственное автономное научное учреждение
Федеральный научный центр исследований и разработки иммунобиологических препаратов имени М.П. Чумакова Российской академии наук
Москва, Россия
* E-mail: zlenka2006@gmail.com
Поступила в редакцию 15.11.2021
После доработки 06.12.2021
Принята к публикации 22.12.2021
- EDN: UOIJVP
- DOI: 10.31857/S0367676522040299
Аннотация
Биосенсоры, работающие на основе эффекта гигантского комбинационного рассеяния света, реализованного на нанокластерах серебра, модифицированных ДНК-аптамерами, позволяют определять вирусы с высокой чувствительностью. Однако измерения в биологических средах затруднены из-за неспецифической сорбции биомолекул на серебре. Изучены условия пробоподготовки биологических жидкостей, позволяющих нивелировать неспецифическую сорбцию биомолекул.
ВВЕДЕНИЕ
Аптамеры на основе нуклеиновых кислот – перспективные молекулярные узнающие элементы для терапии и диагностики заболеваний, а также для создания аптасенсоров с целью детектирования субстанций различной природы. Аптамеры представляют собой олигонуклеотиды длиной в несколько десятков нуклеотидов с уникальной пространственной структурой. Структура аптамера топологически комплементарна участку поверхности мишени, что позволяет специфически и высокоаффинно (с константами диссоциации порядка 10–9 M) связывать всевозможные мишени в различных средах, например, вирусные частицы в биологических жидкостях [1]. По своему действию аптамеры аналогичны антителам, но низкая стоимость их химического синтеза, простота сборки активной структуры и низкая иммуногенность дают им дополнительные преимущества [2]. В настоящее время известны сотни последовательностей аптамеров к разным мишеням, включая клетки, вирусы, белки и низкомолекулярные соединения. Количество последовательностей аптамеров растет с развитием технологий in vitro селекции, а также применения секвенирования следующего поколения для идентификации кандидатов-лидеров [3]. Аптамеры в качестве узнающих элементов – более технологичное решение, чем широко используемые в рыночных тест-системах и биосенсорах моноклональные или поликлональные антитела, поскольку структура аптамеров может быть ренатурирована, и они могут быть разработаны к любой неимуногенной мишени, включая ионы тяжелых металлов [4], малые молекулы [5] и естественные метаболиты [6].
Развитие биосенсоров на основе аптамеров позволит создавать более стабильные и дешевые экспресс-системы, например, для диагностики возбудителей острых респираторных вирусных инфекций (ОРВИ). Низкая чувствительность современных методов экспресс-диагностики, в частности, иммунохроматографических (ИХА) тест-полосок ограничивает их применение, когда содержание патогенов в клиническом образце достаточно мало. Применение высокочувствительных методов диагностики, в частности, иммуноферментный анализ (ИФА) или полимеразная цепная реакция (ПЦР), возможно только для специально оборудованной лаборатории и требует вовлечение лабораторного персонала [7]. В последние годы наблюдается стремительное развитие методов детектирования молекулярных объектов химического или биологического происхождения, основанных на эффектах ГКР (гигантское комбинационное рассеяние или SERS, surface enhanced Raman scattering). Оно происходит при возбуждении лазерным излучением поверхностного плазмонного резонанса в металле, за счет чего многократно усиливается локальное электромагнитное поле вблизи анализируемой молекулы и, соответственно, увеличивается интенсивность сигнала рамановского рассеяния более чем на 5 порядков. На фоне успехов в сфере научного приборостроения получилось значительно уменьшить и удешевить все компоненты рамановских приборов, что способствовало современному развитию методов идентификации с помощью ГКР химических и биологических веществ для аналитических приложений в качестве альтернативы существующим методам [8]. Усиление рамановского сигнала в рядовых случаях достигает 106 раз, а для упорядоченных периодических металл-диэлектрических массивов – до 108 раз [9, 10]. Столь высокая чувствительность делает возможным детектирование считанного числа сорбированных молекул [11]. Сочетание SERS-спектроскопии как метода детекции и аптамеров в качестве узнающих элементов – новая область, которая только начинает развиваться. Именно поэтому для достижения высокой чувствительности и воспроизводимости тест-систем необходимо создание теоретических основ и проведение поэтапных работ по оптимизации SERS-систем на основе аптамеров.
В одной из прошлых работ мы использовали твердотельные кремниевые SERS-субстраты с напыленными наноостровками серебра для обнаружения вируса гриппа А в образцах. Получилось достичь предела обнаружения в 104 вирусных частиц в миллилитре при общей продолжительности анализа менее 15 мин. В качестве узнающей молекулы использовался ДНК-аптамер RHA-0385 к гемагглютинину вируса гриппа А (константа диссоциации комплекса аптамер-белок – 0.6–5 нM), имеющий широкую специфичность к гемагглютининам вируса гриппа А [12, 13]: первичный аптамер с тиольной группой для посадки на серебряную поверхность и вторичный аптамер с SERS-активным красителем. Этот подход позволил реализовать сборку по типу “сэндвича” и определять целые вирусные частицы, но результаты имели только качественный характер из-за отсутствия монотонной зависимости интенсивности сигнала от концентрации вируса [14]. Этот результат способствовал рассмотрению приложений методики к коллоидным растворам серебряных наночастиц, обладающих SERS-активностью при их агрегации с помощью повышения ионной силы. При воспроизведении “сэндвич”-методики для вирусов гриппа А на коллоидных частицах серебра при росте концентрации частиц вируса происходило монотонное уменьшение SERS-сигнала; диапазон определяемых концентраций оказался 2 · 105–2 · 106 частиц/мл [15]. В то время как при определении коронавируса SARS-CoV-2 была получена монотонная возрастающая интенсивности сигнала от концентрации вируса с диапазоном определения 5.5 · 104–1.4 · 106 TCID50/мл [16]. Различия в характере полученных зависимостей могут быть связаны с разным составом биологических жидкостей, в которых выращивали вирусы: в случае вируса гриппа А вирусы находились в аллантоисной жидкости, представляющей собой содержимое легочного мешочка куриного эмбриона, а в случае коронавируса – в культуральной среде для выращивания эукариотических клеток. Обе биологические среды имеют мало общего с реальными клиническими образцами от пациентов с симптомами ОРВИ.
Для моделирования применимости методики в диагностике вирусных заболеваний по образцам биологических жидкостей, в частности, по мазку из носа или плазме крови необходимо оценить влияние интерферирующих компонентов среды на зависимость интенсивности сигнала метки от концентрации аналита. В данной работе исследованы образцы вируса гриппа А в разных разбавлениях плазмы крови человека и смыве из носа человека. Оценивалось минимальное разбавление для сохранения функциональности методики, которое нивелирует влияние побочных компонентов (белков, солей, мембран, малых молекул, нуклеиновых кислот и др.) на производительность методики.
МАТЕРИАЛЫ И МЕТОДЫ
Неорганические соли и буферные растворы были приобретены в Sigma-Aldrich (США) и MP Biomedicals (Франция). Основной буферный раствор – так называемый PBS с добавлением хлорида калия; финальный состав буфера – pH 7.4, 8 мM Na2HPO4, 140 мM NaCl, 1.5 мM KH2PO4, 20 мM KCl. В качестве аптамеров использовались следующие модифицированные ДНК-олигонуклеотиды: тиомодифицированный аптамер – RHA0385-SH – (5'-HS-(CH2)6-TTGGGGTTA-TTTTGGGAGGGCGGGGGTT-3'), синтезированный Синтол (Россия) и аптамер с SERS-активной меткой BodipyFL-RHA0385-BDPFL (5'-BODIPY FL-TTGGGGTTATTTTGGGAGGGCGGGGGTT-3'), синтезированный Люмипроб (Россия).
Стандартная плазма крови человека от здоровых добровольцев была куплена в Siemens (Германия). Мазок из носа был взят у здорового добровольца введением тампона в носовую полость и последующим вымачиванием в 150 мМ KCl. Перед анализом образцы биологических жидкостей были разведены рабочим буфером.
Получение вирусов
Наращивание вирусов гриппа проводили в Федеральном научном центре исследований и разработки иммунобиологических препаратов имени М.П. Чумакова. Использовали аттенуированный вариант вируса A/chicken/Kurgan/3654-at/ 2005 (H5N1, вирус гриппа А) и B/Victoria/2/1987 (вирус гриппа В). Вирусы выращивали в аллантоисной полости 10-дневных оплодотворенных куриных яиц. Яйца инкубировали при 37°C, через 48 ч после инфицирования охлаждали при +4°C и через 16 ч собирали вируссодержащую аллантоисную жидкость и инактивировали 0.05% глутаровым альдегидом. Добавляли 0.03% NaN3 и хранили при +4°C. Гемагглютинирующую активность и концентрацию вируса в вирионах/мл определяли как описано ранее [15]. Дизайн исследования был одобрен Этическим Комитетом центра Чумакова (одобрение № 4 от 2 декабря 2014 г).
Получение серебряных наночастиц
Серебряные наночастицы были синтезированы в соответствии с методикой Леопольда и Лендла [17]. В коническую плоскодонную колбу на 50 мл с 18.7 мл деионизованной воды добавляли 30 мкл 1 М раствора NH2OH∙HCl и 60 мкл 1 М раствора NaOH. К смеси в колбе добавлялось 1 мл 20 мМ раствора AgNO3. Конечный раствор перемешивался с помощью магнитной мешалки в течение 1 ч при комнатной температуре.
Подготовка растворов аптамеров
Для сборки функциональной структуры аптамеры нагревали в концентрации 2 мкМ в рабочем буфере при 95°C в течение 5 мин и остужали при комнатной температуре перед использованием.
Измерение SERS-спектров
Для регистрации использовался прибор RaPort (Enhanced Spectrometry, Inc., SanJose, CA, USA) cдлиной волны лазерного излучения 532 нм и рабочей мощностью 30 мВт. Спектрометр имел спектральный диапазон 160–4000 см–1. Запись спектра проводилась с экспозицией 400 мс в 25 повторах. Фокус лазерного луча совпадал с центром стеклянной виалы объемом в 1.5 мл (Аквилон, Москва, Россия).
Определение вирусов гриппа с помощью SERS-аптасенсора
Серебряные наночастицы функционализировали тиомодифицированным аптамером добавлением аликвоты аптамера к раствору наночастиц до конечной концентрации 40 нМ с последующей инкубации при 37°С в течение 1 ч. Далее функционализированные наночастицы были использованы в течение 1–3 ч.
Разведение образцов плазмы крови делали в рабочем буфере с добавлением стокового раствора вируса гриппа. Аналогично был приготовлен образец с мазком из носа. 300 мкл вируса в биологической среде инкубировали с 4 мкл 2 мкМ аптамера, меченого BDP-FL в течение 4 мин, далее эту смесь приливали к 196 мкл раствора функционализированных наночастиц. SERS-спектры снимали через 4 мин.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
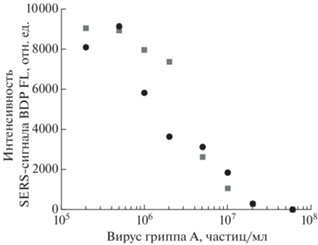
В качестве аналитического сигнала была выбрана интенсивность полосы при 585 см–1 SERS-активной метки, введенной в аптамер RHA0385. Сравнение аптасенсоров с вирусом гриппа в буфере и в мазке из слизистой носа показывает, что влияние биологической среды из мазка из носа минимально (рис. 1), есть лишь незначительные отличия в кривизне получаемой зависимости. Такой результат, вероятно, связан с низким содержанием биомолекул в образце.
Рис. 1.
Работоспособность аптасенсора для определения вируса гриппа А в мазке из носа (квадраты) в сравнении с буфером (круги). Сигнал SERS получен от аптамера, меченого красителем BDP FL.
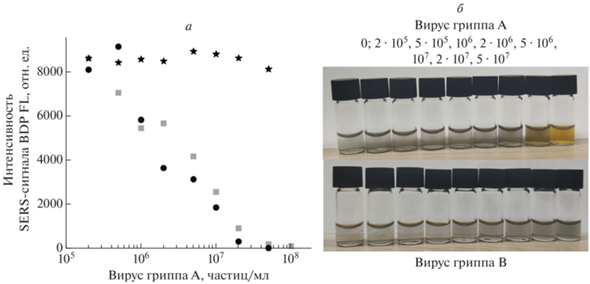
В 10% плазме крови человека аптасенсор не работает, поскольку отсутствует ГКР-эффект, что, вероятно, обусловлено высокой концентрацией белков в образце (около 1 мМ). Аптасенсор может работать в 1% плазме крови (рис. 2), но интенсивность SERS снижена в 4 раза по сравнению с буфером. Дальнейшее разбавление плазмы крови до 0.1% раствора дает сопоставимую эффективность сенсоров (рис. 3). Увеличение концентрации вируса гриппа А дает монотонное падение SERS-сигнала в диапазоне концентраций 5 · 105–5 · 107 частиц/мл. Контрольный вирус – вирус гриппа В – незначительно влияет на SERS-сигнал. Помимо изменения SERS, происходят цветовые переходы, связанные с нарушением агрегации наночастиц при высокой концентрации вируса гриппа А. Цветовой переход описан нами ранее в сходном аптасенсоре, где агрегация наночастиц происходила в пятикратном буфере, однако, в прошлой постановке эксперимента невозможно было отличить вирус гриппа А от контрольного вируса по изменению SERS [18].
Рис. 2.
Работоспособность аптасенсорадля определения вируса гриппа А в 1% плазме крови человека (квадраты) в сравнении с вирусом в буфере (круги). Сигнал SERS получен от аптамера, меченого красителем BDP FL.
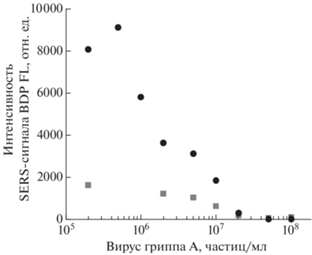
Рис. 3.
Работоспособность аптасенсорадля определения вируса гриппа А в 0.1% плазме крови человека (квадраты) в сравнении с вирусом в буфере (круги) и вирусом гриппа В в 0.1% плазме крови (звезды). Сигнал SERS получен от аптамера, меченого красителем BDP FL (а). Цветовой переход аптасенсора для вирусов гриппа А и В, концентрации вирусов в виалах (частиц/мл) приведены над фотографией (б).
Полученные данные указывают на необходимость разбавления биологических жидкостей с высоким содержанием биомолекул. Ранее было показано, что серебряные наночастицы способны неспецифически взаимодействовать с белками, что приводит к образованию белковой короны на поверхности наночастиц [19]. Вирус гриппа А способен адсорбировать немодифицированные наночастицы серебра [20]. Ранее нами было показано, что модификация наночастиц аптамером к определенному белку приводит к появлению специфической сорбции наравне с неспецифической [21]. Как показывает данная работа, тщательный подбор условий позволяет разделить специфическую и неспецифическую сорбцию на наночастицах.
ЗАКЛЮЧЕНИЕ
Способность определять в биологических жидкостях вирусы гриппа А с помощью SERS-аптасенсора на основе коллоидного серебра зависит от двух конкурирующих процессов – специфической сорбции вирусов и неспецифической сорбции биомолекул на наночастицах. Полученные результаты свидетельствуют о необходимости разбавления образцов плазмы крови в 1000 раз, что соответствует примерно 1 мкг/мл суммарного белка.
Исследование выполнено при поддержке Российского научного фонда (проект № 18-74-10019).
Список литературы
Kieboom C.H., Beek S.L., Mészáros T. et al. // TrAC. 2015. V. 74. P. 58.
Song K.-M., Lee S., Ban C. // Sensors (Basel). 2012. V. 12. P. 612.
Yoshitomi T., Wayama F., Kimura K. et al. // Analyt. Sci. 2019. V. 35. P. 113.
Qi Y., Ma J., Chen X., Xiu F.-R. et al. // Analyt. Bioanalyt. Chem. 2020. V. 412. P. 439.
Ho M.Y., D’Souza N., Migliorato P. // Analyt. Chem. 2012. V. 84. P. 4245.
Kumar P., Lambadi P.R., Navani N.K. // Biosens. Bioelectron. 2015. V. 72. P. 340.
Ribeiro B.V., Cordeiro T.A.R., Oliveira e Freitas G.R. et al. // Talanta Open. 2020. V. 2. Art. No. 100007.
Кукушкин В.И., Астраханцева А.С., Морозова Е.Н. // Изв. РАН. Сер. физ. 2021. Т. 85. № 2. С. 182; Kukushkin V.I., Astrakhantseva A.S., Morozova E.N. // Bull. Russ. Acad. Sci. Phys. 2021. V. 85. P. 133.
Kukushkin V.I., Grishina Y.V., Solov’ev V.V. et al. // JETP Lett. 2021. V. 105. P. 677.
Fedotova Ya.V., Kukushkin V.I., Solovyev V.V., Kukushkin I.V. // Opt. Expr. 2019. V. 27. Art. No. 32578.
Moore T.J., Moody A.S., Payne T.D. et al. // Biosensors. 2018. V. 8. P. 46.
Novoseltseva A.A., Ivanov N.M., Novikov R.A. et al. // Biomolecules. 2020. V. 10. P. 119.
Bizyaeva A.A., Bunin D.A., Moiseenko V.L. et al. // Int. J. Mol. Sci. 2021. V. 22. P. 2409.
Kukushkin V.I., Ivanov N.M., Novoseltseva A.A. et al. // PLOS One. 2019. V. 14. Art. No. e0216247.
Gribanyov D., Zhdanov G., Olenin A. et al. // Int. J. Mol. Sci. 2021. V. 22. P. 1842.
Zavyalova E., Ambartsumyan O., Zhdanov G. et al. // Nanomaterials. 2021. V. 11. P. 1394.
Leopold N., Lendl B. // J. Phys. Chem. B. 2003. V. 107. P. 5723.
Zavyalova E., Gribanyov D., Zhdanov G. et al. // 2021 International Conference on Information Technology and Nanotechnology (ITNT). 2021. P. 1.
Gorshkov V., Bubis J.A., Solovyeva E.M. et al. // Environ. Sci. Nano. 2019. V. 6. No. 4. P. 1089.
Sepunaru L., Plowman B.J., Sokolov S.V. et al. // Chem. Sci. 2016. V. 7. No. 6. P. 3892.
Грибанев Д.А., Завьялова Е.Г., Гамбарян А.С. и др. // Изв. РАН. Сер. физ. 2021. Т. 85. С. 175; Gribanev D.A., Zavyalova E.G., Gambaryan A.S. et al. // Bull. Russ. Acad. Sci. Phys. 2021. V. 85. No. 2. P. 127.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая


