Известия РАН. Серия физическая, 2022, T. 86, № 5, стр. 644-649
Моделирование термостимулированного газовыделения водорода из Ti, Zr, Pd, Ni
Чжан Хунжу 1, Н. Н. Никитенков 1, В. С. Сыпченко 1, Ма Сяоле 1, Ю. И. Тюрин 1, *
1 Федеральное государственное автономное образовательное учреждение высшего образования
“Национальный исследовательский Томский политехнический университет”
Томск, Россия
* E-mail: tyurin@tpu.ru
Поступила в редакцию 13.12.2021
После доработки 24.12.2021
Принята к публикации 21.01.2022
- EDN: IHQCJV
- DOI: 10.31857/S0367676522050118
Аннотация
Экспериментально исследован термостимулированный выход водорода в режиме линейного нагрева (1°C/с) из плоскопараллельных пластинок металлов Ti, Zr, Ni и Pd различной толщины (0.05–1 мм) предварительно насыщенных водородом электролитическим методом. Рассмотрены аналитические и численные модели нестационарных процессов диффузионного выхода водорода из образцов с учетом диффузионных и десорбционных процессов. Предложены, разработаны и освоены программы для численного моделирования процессов термогазовыделения.
ВВЕДЕНИЕ
Поведение водорода в металлах становится все более многоплановой междисциплинарной проблемой на стыке физики и химии твердого тела. Расширение круга изучаемых проблем обусловлено расширяющимся использованием систем металл-водород: накопление водорода в гидридах и его использование в качестве экологически чистого топлива [1–4], материаловедческие аспекты применения водорода в ядерной, термоядерной и водородной энергетике [5, 6], использование систем металл-водород в качестве сенсоров и катализаторов [7, 8], для получения новых материалов с особой микроструктурой и улучшенными механическими свойствами [9], управления пластическими свойствами металлов [10], для очистки водорода и разделения его изотопов [11, 12].
Внедрение водорода в металлы имеет и большой практический интерес. Это связано с изменением механических свойств металлов. Так водородная хрупкость металлов [13], одна из наиболее опасных причин коррозии изделий из сплавов, содержащих железо и никель. При избыточной катодной защите, возможен преждевременный выход из строя оборудования в нефтегазодобывающей и химической промышленности [14], а также стальных конструкций морских сооружений. Под действием водорода происходит катастрофическое растрескивание высокопрочных сталей [15]. В этом же ряду стоят задачи проектирования химических реакторов, повышения срока службы нефте- и газопроводов, ракетостроения, создания двигателей с высоким уровнем безопасности.
Поскольку взаимодействие водорода с металлом, в том числе диффузия водорода, определяет физические и физико-химические свойства материалов, то важно изучить кинетические процессы в системах металл–водород, включая решение диффузионных задач [16].
В наших исследованиях основное внимание уделяется процессу термостимулированного газовыделения (ТСГВ) водорода из Ti, Zr, Pd и Ni. Было проведено экспериментальное изучение и моделирование процессов диффузионного выхода водорода на поверхность металлических образцов и кинетических процессов формирования и десорбции с поверхности в вакуум молекулярного водорода. Использовались предварительно насыщенные водородом плоские металлические образцы различной толщины при линейном термическом нагреве. Проведено сопоставление результатов численного и аналитического моделирования с экспериментом.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
В серии экспериментов использовались металлы Ti (ВТ1-0), Zr (Э110), Pd (0.9999), Ni (0.99) различной толщины (0.05–1 мм). Образцы проходили предварительную шлифовку и полировку поверхности с использованием шлифовальных бумаг. Электролитическое насыщение проводилось в 0.1–1.0 М растворе Н2SO4 в течение 0.5–72 ч при плотности тока 20–200 мА/см2 и нормальных условиях. Образцы разной толщины насыщались водородом до одинаковой концентрации. Материал и размер образца, и параметры насыщения водородом приведены в табл. 1.
Таблица 1.
Материал образца, размеры, и параметры наводороживания
| Образец | Толщина, мм | Параметры наводороживания | Температура максимума спектра Tmax, °C | |
|---|---|---|---|---|
| Ti | 0.17 | H2SO4 (1 M), t = 6 ч, j = 200 мА/см2 | 600 | 604 |
| 0.29 | 612 | 622 | ||
| 0.50 | 640 | 650 | ||
| 0.89 | 660 | 670 | ||
| 1.05 | 670 | 682 | ||
| Zr | 0.05 | H2SO4 (0.1 M), t = 48 ч, j = 20 мА/см2 | 675 | |
| 0.27 | H2SO4 (0.5 M), t = 24 ч, j = 100 мА/см2 | 720 | ||
| 0.8 | H2SO4 (1 M), t = 21 ч, j = 200 мА/см2 | 771, 902 | ||
| Ni | 0.05 | H2SO4 (1 M), t = 20 ч, j = 120 мA/см2 | 237 | |
| 0.1 | 285 | |||
| 0.2 | 352 | |||
| Pd | 0.05 | H2SO4 (0.5 M), t = 0,5 ч, j = 100 мА/см2 | 356 | |
| 0.2 | H2SO4 (0.1 M), t = 20 ч, j = 90 мА/см2 | 461 | ||
Для изучения процессов диффузионного выхода водорода из плоских металлических пластин были выполнены эксперименты по термостимулированному газовыделению (ТСГВ) водорода из образцов различной толщины в вакуум (<10–5 Па) при нагреве со скоростью 1°C/с. Регистрация выхода водорода при ТСГВ осуществлялась квадрупольным масс-спектрометром.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
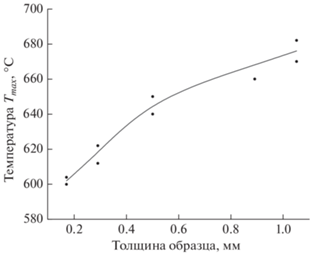
На рис. 1a представлены результаты по ТСГВ водорода из пластинки титана и аппроксимации экспериментальных кривых для образцов различной толщины. При длительном (>24 ч) катодном насыщении пластинки Ti (рис. 1б) в спектре ТСГВ появляется второй высокотемпературный пик, связанный с образованием гидридной фазы [17, 18]. На рис. 2 приведена зависимость положения низкотемпературных максимумов ТСГВ растворенного водорода из пластинок титана различной толщины.
Рис. 1.
Экспериментальные и расчетные зависимости плотности потока водорода термостимулированного газовыделения из пластинок Ti различной толщины. Катодное насыщение в H2O + H2SO4 (1М): d = 0.17–1.05 мм, t = 6 ч, j = = 200 мA/см2 (а); d = 0.2 мм, t = 24 ч, j = 40 мA/см2 (б). Скорость нагрева 1°C/с.
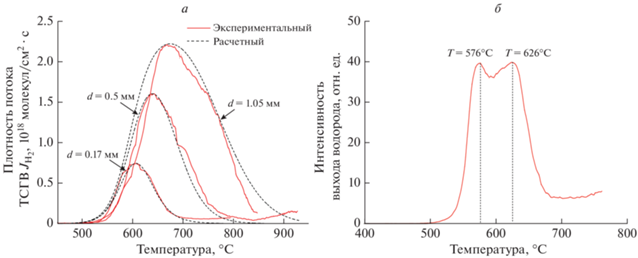
Рис. 2.
Зависимость температуры Tmax достижения максимума интенсивности термогазовыделения водорода от толщины образца титана (катодное насыщение водородом: H2O + H2SO4, t = 6 ч, j = 200 мA/см2).
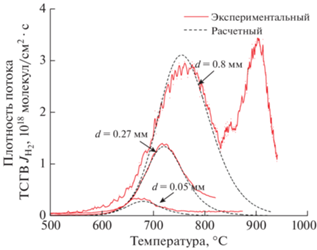
На рис. 3 представлены результаты по ТСГВ водорода из циркония (Э110) и аппроксимации экспериментальных кривых для образцов различной толщины. Второй, высокотемпературный пик, появляется у Zr при длительном (>20 ч) катодном насыщении образцов Zr водородом и также связан с образованием и накоплением гидридных фаз.
Рис. 3.
Экспериментальные и расчетные зависимости плотности потока водорода термостимулированного газовыделения из пластинок Zr различной толщины d = 0.05–0.8 мм. Катодное насыщение: t = 21–48 ч, j = = 20–200 мА/см2, H2O + H2SO4 (0.1–1 М). Скорость нагрева 1°C/с.
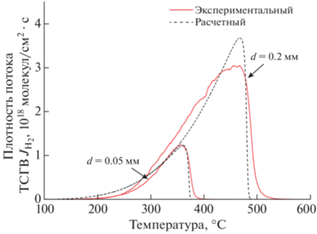
Графики ТСГВ водорода из Ni, Pd представлены на рис. 4 и 5. В данных образцах переходных металлов 4–5 периодов VIIIB группы водород может накапливаться в значительных количествах в виде твердых растворов, но второго высокотемпературного пика, связанного с разложением гидридных фаз, не наблюдается, даже при значительных временах насыщения их водородом. Температура максимума спектра приведены в табл. 1.
Рис. 4.
Экспериментальные и расчетные зависимости плотности потока водорода термостимулированного газовыделения из пластинок Ni различной толщины d = 0.05–0.2 мм. Катодное насыщение: t = 20 ч, j = = 120 мА/см2, H2O + H2SO4 (1 М). Скорость нагрева 1°C/с.
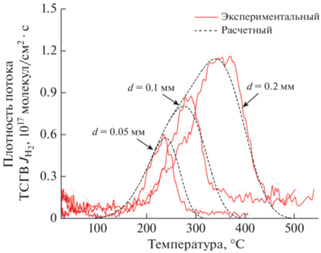
Рис. 5.
Экспериментальные и расчетные зависимости плотности потока водорода термостимулированного газовыделения из пластинок Pd различной толщины d = 0.05–0.2 мм. Катодное насыщение: t = 0.5–20 ч, j = 90–120 мА/см2, H2O + H2SO4 (0.1–0.5 М). Скорость нагрева 1°C/с.
Рассмотрим модель процесса термостимулированного выхода водорода из металлической пластины в режиме линейного нагрева с учетом рекомбинации атомов и десорбции молекул водорода с поверхности пластины.
Диффузионную составляющую процесса термостимулированного выхода водорода опишем одномерным уравнением диффузии. Координата х направлена перпендикулярно боковым граням пластины, начало координат х = 0 в центре пластины [17]:
(1)
$\begin{gathered} \frac{{\left. {\partial n(x,t} \right)}}{{\partial t}} = D\left( t \right)\frac{{\left. {{{\partial }^{2}}n(x,t} \right)}}{{\partial {{x}^{2}}}}, \\ D\left( t \right) = {{D}_{0}}{\text{exp}}\left[ { - \frac{{{{E}_{{dif}}}}}{{k\left( {{{T}_{0}} + \beta t} \right)}}} \right], \\ \end{gathered} $Выход водорода на поверхность не обязательно должен сопровождаться его десорбцией. Масс-спектрометрические измерения показывают, что водород десорбируется в молекулярной форме, в то время как в объеме металла водород преимущественно находится в атомарной форме или даже отдает свой электрон решетке. Десорбироваться с поверхности в атомарной форме водороду энергетически очень невыгодно. Существенный энергетический выигрыш достигается после рекомбинации атомов на поверхности в молекулу. Кинетический механизм, описывающий диффузионный выход атомов водорода на поверхность, ударную или диффузионную рекомбинацию атомов и десорбцию молекул включает следующие стадии [19, 20]:
1. Диффузионный выход атомов H из объема на поверхность:
2. Десорбция атомов H с поверхности:
3. Диффузионный уход атома H с поверхности в объем:
4. Ударная рекомбинация (механизм Или–Ридила) атомов H:
5. Диффузионная рекомбинация (механизм Лэнгмюра–Хиншельвуда) атомов H:
6. Десорбция молекулы H2:
где LS – места адсорбции водорода на поверхности. Над стрелками указаны относительные вероятности νi и скорости K (см2 · c–1) процессов. Введем обозначения для поверхностных концентраций:и запишем систему кинетических уравнений, описывающую процессы диффузионного выхода и рекомбинации атомов на поверхности, процессы десорбции атомов и молекул с поверхности в вакуум [21]:
(2)
$\left\{ \begin{gathered} \frac{{d{{N}_{1}}}}{{dt}} = {{\nu }_{1}}N(t) - {{\nu }_{2}}({{N}_{1}}(t) = \hfill \\ = \,\,2KN_{1}^{2}(t) - {{\nu }_{{ - 1}}}{{N}_{1}}(t) - {{\nu }_{{ - s}}}{{N}_{1}}(t) \hfill \\ \frac{{d{{N}_{2}}}}{{dt}} = {{\nu }_{2}}{{N}_{1}}(t) + KN_{1}^{2}(t) - {{\nu }_{{ - 3}}}{{N}_{2}}(t) \hfill \\ \end{gathered} \right.$Полное число мест адсорбции N0 на поверхности будем считать постоянным:
Из-за различных адсорбционных свойств водорода основные лимитирующие стадии десорбции водорода с поверхности металла для Ti, Zr и Ni, Pd различны. Для Ti и Zr наиболее важной стадией, ограничивающей десорбцию водорода на поверхности, является рекомбинация атомов водорода на поверхности, что было признано во многих исследованиях [22, 23]. Поэтому нет необходимости рассматривать все стадии процесса десорбции водорода на поверхности. Использование следующих граничных условий для описания поверхностной реорганизации водорода может хорошо моделировать процесс термодесорбции водорода в этих металлах:
(3)
$\begin{gathered} \pm D{{\left. {\frac{{\partial n}}{{\partial x}}} \right|}_{{x = \pm \frac{d}{2}}}} = \mp {{K}_{0}}\exp \left( { - \frac{{{{E}_{K}}}}{{kT}}} \right)N_{1}^{{~2}}\left( t \right); \\ \pm D{{\left. {\frac{{\partial n}}{{\partial x}}} \right|}_{{x = \pm \frac{d}{2}}}} = \mp K_{0}^{'}\exp \left( { - \frac{{E_{K}^{'}}}{{kT}}} \right)n_{H}^{2}\left( { \pm \frac{d}{2},t} \right). \\ \end{gathered} $Учет процессов рекомбинации атомов на поверхности в реакциях первого и второго порядка, десорбции молекул Н2 позволяет качественно и количественно верно описать кривые ТСГВ для Ti (рис. 1) и Zr (рис. 3) при значениях параметров и граничных условиях, приведенных в таблице 2.
Таблица 2.
Параметры в результатах моделирования диффузии водорода в Ti и Zr
| Образец | Ti | Zr |
|---|---|---|
| Граничное условие | $ \pm D{{\left. {\frac{{\partial n}}{{\partial x}}} \right|}_{{x = \pm \frac{d}{2}}}} = \mp {{K}_{0}}\exp \left( { - \frac{{{{E}_{K}}}}{{kT}}} \right){{N}^{~}}_{1}^{2}\left( t \right)$; $ \pm D{{\left. {\frac{{\partial n}}{{\partial x}}} \right|}_{{x = \pm \frac{d}{2}}}} = \mp K_{0}^{'}\exp \left( { - \frac{{E_{K}^{'}}}{{kT}}} \right)n_{H}^{2}\left( { \pm \frac{d}{2},t} \right).$ |
|
| n(H), см–3 | 8 · 1021 | 1 · 1022 |
| Edif, эВ | 0.55 | 0.43 |
| D0, 10–3 см2/с | 10 | 3.7 |
| $K_{0}^{'}$, см4/с | 8 · 10–9 | 2.8 · 10–8 |
| $E_{K}^{'}$, эВ | 3 | 3.3 |
Для Ni и Pd, с учетом диффузии, рекомбинации и десорбции водорода, через следующие сложные граничные условия и параметры (табл. 3), расчетные результаты показаны на рис. 4 и 5. Граничные условия выводятся из решения следующей системы уравнений:
(4)
$\begin{gathered} D{{\left. {\frac{{\partial n}}{{\partial x}}} \right|}_{{x = \pm \frac{d}{2}}}} = \mp {{\sigma }_{1}}{{\nu }_{{dif}}}n\left( { \pm \frac{d}{2},t} \right)N, \\ \left\{ \begin{gathered} \frac{{d{{N}_{1}}}}{{dt}} = {{\sigma }_{1}}{{\nu }_{{dif}}}n\left( { \pm \frac{d}{2},t} \right)N - 2KN_{1}^{2} \hfill \\ \frac{{d{{N}_{2}}}}{{dt}} = KN_{1}^{2} - {{\nu }_{{ - 3}}}{{N}_{2}} \hfill \\ {{N}_{0}} = N + {{N}_{1}} + {{N}_{2}} \hfill \\ \end{gathered} \right.. \\ \end{gathered} $Таблица 3.
Параметры в результатах моделирования диффузии водорода в Pd и Ni
| Образец | D0, 10–3см2/с | σ10, см2 | K0, см2/с | ν–30, с–1 | |
|---|---|---|---|---|---|
| Pd | 1.7 | 10–17 | 10–8 | 106 | |
| Ni | 8 | 6 · 10–14 | 5 · 10–6 | 2.5 · 108 | |
| n(H), см–3 | Edif, эВ | E1, эВ | EK, эВ | E–3, эВ | |
| Н–Pd | 8 · 1022 | 0.23 | 0.38 | 0.47 | 0.25 |
| Н–Ni | 4 · 1021 | 0.5 | 0.37 | 0.3 | 0.4 |
Видно, что 1) максимум газовыделения в образцах различной толщины достигается при тем больших температурах, чем толще образец; 2) результаты моделирования согласуются с результатами экспериментов при Ti (0.17–1.05 мм), Zr (0.05–0.8 мм), Ni (0.05–0.2 мм), Pd (0.05–0.2 мм). Выделение водорода в образцах разной толщины при низких температурах происходит примерно с одинаковой интенсивностью, что связано с одинаковой концентрацией водорода на поверхности образцов разной толщины при низких температурах. При повышении температуры из-за десорбции водорода концентрация водорода на поверхности тонкого материала быстро падает, поэтому пик десорбции появляется при относительно низкой температуре. В толстых материалах, поскольку водород в объеме непрерывно диффундирует к поверхности, концентрация водорода на поверхности поддерживается на более высоком уровне, поэтому пик десорбции появляется при более высокой температуре и имеет более высокую плотность потока.
Небольшое отклонение результатов моделирования и эксперимента в толстых образцах может быть связано с тем, что начальная концентрация водорода в толстых материалах несколько ниже, чем в тонких образцах, а при моделировании использовались одинаковые начальные условия для образцов разной толщины. Поэтому в экспериментальных результатах температура, при которой водород начинает десорбироваться, будет выше, чем в результатах моделирования, а кривая десорбции станет уже.
ЗАКЛЮЧЕНИЕ
Экспериментально исследован термостимулированный выход водорода в режиме линейного нагрева (1°C/с) из плоскопараллельных пластинок металлов Ti, Zr, Ni и Pd различной толщины (0.05–1 мм) предварительно насыщенных водородом электролитическим методом.
Предложена общая модель термогазовыделения водорода из Ti, Zr, Ni и Pd и смоделированы нестационарные процессы диффузионного выхода водорода из предварительно насыщенных водородом плоских образцов Ti, Zr, Ni, Pd. Предложены, разработаны и освоены программы для численного моделирования процессов термодесорбции.
С учетом рекомбинации атомов на поверхности в реакциях первого и второго порядка, десорбции молекул Н2 процесс термогазовыделения водорода из Ti, Zr, Ni, Pd при линейном нагреве (1°C/с) моделируется на основе уравнения диффузии и соответствующих граничных условий.
Учтены кинетические особенности процессов выхода и накопления атомов водорода на поверхности, образования молекул водорода и их десорбции при описании экспериментальных кривых ТСГВ. Получены корреляции между толщиной образца, скоростью нагрева и температурой положения максимума пика плотности потока выделяющегося водорода на спектрах ТСГВ в различных материалах в условиях диффузионной и десорбционной лимитирующих стадий.
Список литературы
Bellosta von Colbe J., Ares J.-R., Barale J. et al. // Int. J. Hydrog. Energy. 2019. V. 44. No. 15. P. 7780.
Hirscher M. Handbook of hydrogen storage: new materials for future energy storage. Wiley-VCH, 2010. 373 p.
Schlapbach L., Zuttel A. // Nature. 2001. V. 414. No. 6861. P. 353.
Varin R.A., Czujko T., Wronski Z.S. Nanomaterials for solid state hydrogen storage. Boston: Springer US, 2009.
Yamamoto S. // Mater. Trans. 2004. V. 45. No. 8. P. 2647.
Kimura A. // Mater. Trans. 2005. V. 46. No. 3. P. 394.
Pundt A., Kirchheim R. // Annu. Rev. Mater. Res. 2006. V. 36. No. 1. P. 555.
Čížek J., Melikhova O., Vlček M. et al. // Int. J. Hydrog. Energy. 2013. V. 38. No. 27. Art. No. 12115.
Eliezer D., Eliaz N., Senkov O.N., Froes F.H. // Mater. Sci. Eng. A. 2000. V. 280. No. 1. P. 220.
Hong E., Dunand D.C., Choe H. // Int. J. Hydrog. Energy. 2010. V. 35. No. 11. P. 5708.
Levdanskii V.V., Smolik J., Moravec P. // J. Eng. Phys. Thermophys. 2007. V. 80. No. 2. P. 329.
Lototskyy M.V., Yartys V.A., Pollet B.G., Bowman R.C. // Int. J. Hydrog. Energy. 2014. V. 39. No. 11. P. 5818.
Djukic M.B., Bakic G M., Zeravcic V.S. et al. // Corrosion. 2016. V. 72. No. 7. P. 943.
Esaklul K.A. // In: Trends in oil and gas corrosion research and technologies. Elsevier, 2017. P. 315.
Popov B.N., Lee J.W., Djukic M.B. // In: Handbook of environmental degradation of materials. Elsevier, 2018. P. 133.
Tyurin Y., Chernov I. // Int. J. Hydrog. Energy. 2002. V. 27. No. 7–8. P. 829.
Tyurin Y.I., Sypchenko V.S., Nikitenkov N.N. et al. // Int. J. Hydrog. Energy. 2019. V. 44. No. 36. Art. No. 20223.
Rokhmanenkov A.S., Kuksin A.Y., Yanilkin A.V. // Phys. Met. Metallogr. 2017. V. 118. No. 1. P. 28.
Tyurin Y.I., Nikitenkov N.N., Sigfusson I.T. et al. // Vacuum. 2016. V. 131. P. 73.
Kristinsdóttir L., Skúlason E. // Surf. Sci. 2012. V. 606. No. 17–18. P. 1400.
Tyurin Y.I., Nikitenkov N.N., Sypchenko V.S. et al. // Int. J. Hydrog. Energy. 2021. V. 46. No. 37. Art. No. 19523.
Rokhmanenkov A.S. // Int. J. Hydrog. Energy. 2017. V. 42. No. 35. Art. No. 22610.
Juillet C., Tupin M., Martin F. et al. // Int. J. Hydrog. Energy. 2019. V. 44. No. 39. Art. No. 21264.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая


