Известия РАН. Серия физическая, 2022, T. 86, № 5, стр. 711-715
Получение покрытий переходных металлов в присутствии арабиногалактана
С. В. Столяр 1, 2, 3, Л. А. Чеканова 1, Е. В. Черемискина 3, *, Р. Н. Ярославцев 1, 2, О. П. Таран 3, 4, В. С. Боровкова 3, 4, Ю. Н. Маляр 3, 4, Д. С. Незнахин 5, С. В. Комогорцев 1, 3
1 Институт физики имени Л.В. Киренского Сибирского отделения Российской академии наук – обособленное подразделение федерального государственного бюджетного научного учреждения Федеральный исследовательский центр “Красноярский научный центр Сибирского отделения Российской академии наук”
Красноярск, Россия
2 Федеральное государственное бюджетное учреждение Федеральный исследовательский центр
“Красноярский научный центр Сибирского отделения Российской академии наук”
Красноярск, Россия
3 Федеральное государственное автономное образовательное учреждение высшего образования
“Сибирский федеральный университет”
Красноярск, Россия
4 Институт химии и химической технологии Сибирского отделения Российской академии наук – обособленное подразделение Федерального государственного бюджетного научного учреждения Федеральный исследовательский центр “Красноярский научный центр Сибирского отделения Российской академии наук”
Красноярск, Россия
5 Федеральное государственное автономное образовательное учреждение высшего образования
“Уральский федеральный университет имени первого президента России Б.Н. Ельцина”
Екатеринбург, Россия
* E-mail: elenacheremiskina@yandex.ru
Поступила в редакцию 13.12.2021
После доработки 24.12.2021
Принята к публикации 21.01.2022
- EDN: OGYEAV
- DOI: 10.31857/S036767652205026X
Аннотация
Методом химического осаждения в присутствии арабиногалактана получены покрытия переходных металлов (Fe, Co, Ni), содержащие углерод. Определена кристаллическая структура и химический состав покрытий. Методами магнитометрии, рентгеновской дифракции установлено, что углерод не входит в кристаллическую решетку металла, а присутствует в виде графитовых включений. Исследован процесс деградации арабиногалактана в щелочной среде на поверхности гальванической пары.
ВВЕДЕНИЕ
Метод химического осаждения металлических покрытий из водных растворов при помощи восстановителя отличается простотой и экономичностью. В основе метода лежит реакция взаимодействия ионов металла с растворенным восстановителем, в результате которой на каталитически активной поверхности (Fe, Co, Ni, Cu, Pd и т.д.) формируется металлический слой. В отсутствие автокатализа реакция восстановления может осуществляться во всем объеме раствора и приводить к образованию металлического порошка. В качестве восстановителей при получении магнитных металлических покрытий на основе 3d металлов используют формальдегид, гидразин, гипофосфит натрия, боран натрия, гидразинборан. Наиболее распространенным восстановителем при получении Co и Ni покрытий является гипофосфит натрия NaH2PO2. В данном случае формируются твердые растворы замещения металл–металлоид, а также выделяются фосфиды. Наличие фосфора в металлическом покрытии ухудшает его магнитные и механические свойства. Несмотря на перечисленные недостатки, промышленное получение и использование покрытий на основе никелевых и кобальтовых сплавов, получаемых с помощью NaH2PO2 неуклонно растет [1]. Сплавы на основе Fe, полученные химическим осаждением, демонстрируют высокую микротвердость и коррозионную стойкость. Проблема осаждения железных покрытий состоит в том, что по сравнению с Ni2+ (0.24 В) и Со2+ (0.27 В), Fe2+ (0.44 В) имеет больший потенциал восстановления и поэтому восстановление/осаждение за счет только восстановителя NaH2PO2 невозможно (железное покрытие можно получить с помощью боргидрида натрия). Химическое железное покрытие на медной подложке с помощью гипофосфита впервые было получено авторами работы [2] с помощью создания гальванической пары между медной подложкой и алюминиевой пластиной в щелочной среде. Алюминий в щелочной среде растворяется, сообщая отрицательный заряд медной подложки и понижает ее потенциал, тем самым обеспечивая химическое восстановление ионов металла. Структура, свойства, особенности формирования магнитных покрытий, полученных химическим осаждением, исследовались различными научными группами [3–6].
В настоящее время бурно развиваются новые подходы восстановления металлов, получившие название зеленого синтеза. При данном подходе используют микроорганизмы [7, 8], экстракты натуральных растительных продуктов [9] и т.д. Данные подходы развиваются как многообещающие экологически чистые способы, которые позволят преодолеть существующие барьеры в химических методах получения. Используемые экстракты, как правило, нетоксичны, и выполняют функцию диспергирующего и покрывающего агента, сводя к минимуму процессы окисления. Перспективным является направление получения наноструктурированных материалов с использованием полисахаридов, в частности арабиногалактана [10–12]. Арабиногалактан является разветвленным полисахаридом с химической формулой [(С5Н8O4)(C6H10O5)6]n, в которой на 6 звеньев галактозы приходится 1 звено арабинозы. Арабиногалактан, представитель водорастворимых растительных полисахаридов, входит в состав хвойных растений, особенно много его в лиственнице. Это полностью натуральное растворимое в воде волокно, образует низковязкие растворы, обладает высокими поверхностно-активными характеристиками, а также высокой стабильностью при разной концентрации, кислотности и температуре.
Потребность в разработке более экономичных поглотителей электромагнитных волн с более широкой полосой поглощения и более эффективными поглощающими свойствами постоянно растет. Известно, что потери на поглощение являются функцией значений магнитной проницаемости и диэлектрической проницаемости. Ожидается, что поглотители, сочетающие магнитный материал и углеродный материал, могут иметь большую эффективность и применяться в более широком диапазоне частот. Поэтому композиты углерод/магнитный металл привлекают к себе большое внимание как материалы, поглощающие микроволновое излучение [13].
Цель данной работы заключается в получении магнитных покрытий 3d-металл/углерод с помощью методов зеленой химии и изучении их свойств.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Покрытия переходных металлов, содержащие углерод, были получены методом химического осаждения в присутствии арабиногалактана (производитель АО “Аметис”, г. Благовещенск), выделенного из лиственницы. В растворы, содержащие сульфат металла и полисахарид добавляли цитрат натрия в качестве комплексообразователя. В полученный раствор добавляли щелочь NaOH (гидроксид аммония NH4OH) до тех пор, пока рН раствора не достигал 11. Осаждение осуществляли на медную фольгу. Медная фольга находилась в непосредственном контакте с Al фольгой. Осаждение проводили при температуре 80°C. Температура поддерживалась с помощью термостата водяного ТЖ-ТС-01.
Полученные образцы исследовались с помощью просвечивающего электронного микроскопа Hitachi HТ7700 (ускоряющее напряжение 100 кВ), сканирующего электронного микроскопа CarlZeiss EVO 60 Центра коллективного пользования Красноярского научного центра СО РАН. Структурные исследования покрытий, проводились на рентгеновском дифрактометре ДРОН-4. Магнитные свойства исследовались на СКВИД-магнетометре MPMS XL7, Quantum Design.
Исследование деградации арабиногалактана проводили с помощью метода гельпроникающей хроматографии на хроматографе Agilent 1260 Infinity II Multi-Detector GPC/SEC System с тройным детектированием: рефрактометром (RI), вискозиметром (VS) и светорассеянием (LS). Разделение проводили на двух совмещенных колонках PL Aquagel-OH Mixed-M с использованием в качестве подвижной фазы для водных растворов смесь 0.2 M NaNO3 + 0.01 M NaHPO4. Калибровку колонки осуществляли с использованием полидисперсных стандартов полиэтиленгликоля (Agilent, США). Скорость подачи элюента – 1 мл/мин, объем вводимой пробы – 100 мкл. Растворы фильтровали через 0.45 мкм мембранный ПТФЭ-фильтр (Millipore). Сбор и обработку данных выполняли с использованием программного обеспечения Agilent GPC/SEC MDS.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
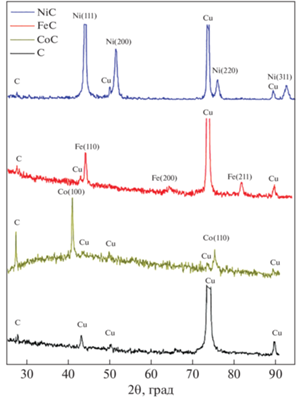
Методом химического осаждения в присутствии арабиногалактана получены покрытия 3d-металлов на медной основе, в качестве которой использовалась медная фольга толщиной 100 мкм, находящаяся в контакте с алюминиевой фольгой. Толщина ферромагнитных покрытий составляла несколько микрон. Элементный анализ покрытий, полученный с помощью просвечивающего электронного микроскопа, показал наличие углерода с концентрацией 15–20 ат. %. Методом энергодисперсионного рентгеновского анализа (c помощью сканирующего электронного микроскопа) установлено однородное распределение углерода в изготовленных покрытиях. На рис. 1 представлены рентгенограммы и их расшифровки полученных образцов: Ni–C, Fe–C, Co–C. На рентгенограммах присутствуют как отражения, соответствующие ферромагнитным металлам (ГЦК-Ni, ГПУ-Co, ОЦК-Fe), так и отражения, соответствующие медной подложке. Результаты рентгенофазового анализа позволили определить постоянную решетки изучаемых сплавов. Полученные значения соответствуют табличным для чистых Ni, Fe, Co, свидетельствуя о отсутствии углерода в кристаллической решетке металла. Отражений, характерных для карбидов 3d металлов не обнаружено [14]. На рентгенограммах наряду с отражениями от плоскостей металлов регистрировались отражения малой интенсивности при 2Θ = 27° (смотри рис. 1), которое относится к фазе графита. Это свидетельствует о том, что углерод осаждается в виде графита. На рис. 1 также приведена рентгенограмма медной фольги, которая находилась в контакте с фольгой Al в растворе арабиногалактана в щелочной среде. На данной рентгенограмме также регистрируется отражение от графитовой фазы.
Рис. 1.
Рентгенограммы покрытий Fe–C, Co–C, Ni–C на медной подложке, а также медной фольги после обработки в щелочном растворе арабиногалактана.
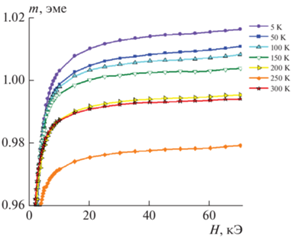
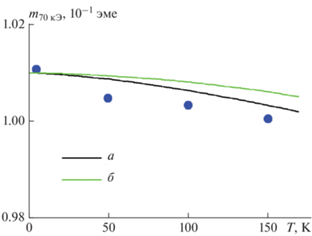
На рис. 2 представлены кривые намагничивания, измеренные в диапазоне температур 5–300 К для покрытия Co–C. Температурная зависимость намагниченности (m) в максимальном поле (70 кЭ) близка к намагниченности насыщения. Градиент спонтанной намагниченности (намагниченности насыщения) ферромагнетика в области низких температур определяется константой Блоха в законе Блоха Т 3/2. Сама величина константы Блоха однозначно задается величиной обменной константы [15]. Величина обменной константы чувствительна к ближайшему окружению обменно-связанных магнитных моментов атомов. Небольшая доля примеси способна существенно снизить величину обменной константы и повысить величину константы Блоха [16, 17]. На рис. 3 данные по низкотемпературному ходу намагниченности приведены наряду с литературными данными для чистого кобальта с ГПУ структурой [18, 19]. Отметим, что чистый кобальт характеризуется наименьшим градиентом намагниченности среди чистых 3d металлов. Наблюдаемая на рис. 3 близость температурного градиента намагниченности для исследуемых покрытий кобальта к литературным данным, указывает на близость ближнего химического порядка к порядку чистого ГПУ кобальта. Это свидетельствует об отсутствии в решетке кобальта примесных атомов, в частности углерода. Это согласуется также с данными рис. 1 и сделанным выводом, что углерод в покрытии кобальта представлен в виде фазы графита.
Рис. 3.
Температурная зависимость намагниченности покрытий кобальта (символы) в сравнении с литературными данными для фаз чистого кобальта (сплошные линии): [18] (а) ГПУ Со, [19] (б) ГЦК Со.
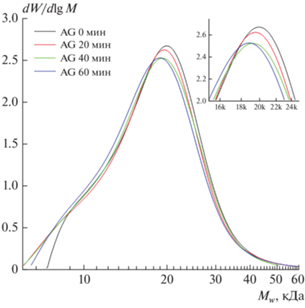
Для исследования процесса деградации арабиногалактана в щелочной среде на поверхности гальванической пары был проведен следующие эксперимент. В раствор, содержащий 200 мл воды, 2 г арабиногалактана и 20 мл NH4OH (25 об. %) опускали медную и алюминиевую пластины, находящиеся в контакте, раствор нагревали до 80°C и затем брали пробы раствора каждые 20 мин. Пробы были обозначены как AG0, AG20, AG40 и AG60. Методом гельпроникающей хроматографии определяли средневесовую молекулярную массу (Mw), среднечисловую молекулярную массу (Mn) и полидисперсность (PD) исходного арабиногалактана (AG) и образцов раствора. В табл. 1 приведено молекулярно-массовое распределение исходного арабиногалактана и образцов раствора (AG0, AG20, AG40 и AG60).
Таблица 1.
Молекулярно-массовое распределение исходного арабиногалактана и образцов раствора (AG0, AG20, AG40 и AG60)
| Образец | Mn, Да | Mw, Да | PD |
|---|---|---|---|
| AG0 | 16 783 | 19 088 | 1.14 |
| AG20 | 16 121 | 18 779 | 1.17 |
| AG40 | 16 033 | 18 606 | 1.16 |
| AG60 | 15 914 | 18 482 | 1.16 |
Согласно полученным данным, с увеличением продолжительности процесса происходит некоторое изменение молекулярно-массового распределения в образцах. Значения средневесовой молекулярной массы (Mw) снижаются с 19 088 (0 мин) до 18 482 (60 мин). Кривые молекулярно-массового распределения при этом незначительно сдвигаются в низкомолекулярную область, а степень полидисперсности остается практически неизменной (рис. 4). Отдельно на рисунке представлена область пика, иллюстрирующая смещение молекулярно-массового распределения. С учетом структурных характеристик молекул АГ и среды раствора, можно предположить, что в ходе процесса происходит щелочной гидролиз молекул АГ. Изменения значений молекулярных масс позволяют говорить, что через каждые 20 мин в среднем от каждой молекулы происходит отрыв одного остатка моносахарида (арабинозы или галактозы), с молекулярной массой ~150 Да, которые могут проявлять восстановительные свойства, а также в условиях локального перегрева карбонизоваться на поверхности металла.
Используемый нами процесс получения металлических покрытий, содержащие углеродные включения, может быть результатом наложения нескольких процессов: электрохимического благодаря использованию гальванической пары Cu/Al и растворению Al и химического процесса, связанного с восстановлением катионов Fe, Co, Ni полисахаридом. Арабиногалактан является разветвленным полисахаридом с химической формулой [(С5Н8O4)(C6H10O5)6]n, в которой на 6 звеньев галактозы приходится 1 звено арабинозы. Оба моносахарида обладают восстановительными свойствами. Алюминий в щелочной среде растворяется, сообщая отрицательный заряд медной подложки и понижает ее потенциал, тем самым обеспечивая химическое восстановление ионов 3d металлов. Возможно, образование металлического покрытия обусловлено каталитическим разложением полисахарида на металлические подложки. Гликозидные связи, образующие молекулу полисахарида устойчивы в щелочной среде при невысокой температуре. Однако известно, что при таких условиях происходит деградация на концах полисахаридных молекул. Открытые альдегидные группы на концах молекул обладают восстановительными свойствами. Таким образом, происходит отщепление моносахаридного звена, и затем окисление его до карбоновой кислоты. По всей видимости, каталитическое разложение полисахарида на подложке не ограничивается предложенной реакцией, поскольку конечным продуктом разложения полисахарида является графит, регистрируемый методом рентгенофазового анализа. Углерод, являющийся продуктом реакций, протекающих на металлической поверхности, исключительно уходит в графит и не входит в кристаллическую решетку образующегося ферромагнитного покрытия. Последнее надежно доказывается с помощью магнитных измерений.
ЗАКЛЮЧЕНИЕ
Таким образом, полученные покрытия можно рассматривать как композитные покрытия металл/углерод, в которых углерод присутствует в виде объемных графитовых включений. Поскольку магнитные материалы с углеродными включениями обладают превосходными свойствами для поглощения электромагнитных волн за счет наличия магнитного и диэлектрического компонента, полученные композитные покрытия могут быть перспективны в качестве поглотителей электромагнитного излучения.
Исследование выполнено при финансовой поддержке Российского фонда фундаментальных исследований, Правительства Красноярского края и Красноярского краевого фонда науки (проект № 20-43-240003).
Список литературы
Agarwala R.C., Agarwala V. // Sadhana. 2003. V. 28. No. 3–4. P. 475.
Ruscior C., Croial E. // J. Electrochem. Soc. 1971. V. 118. 5. P. 696.
Zhou H., Guo J. // J. Electrochem. Soc. 2013. V. 160. No. 6. Art. No. D233.
Ge Y., Bangwei Z., Lingling W. et al. // J. Electrochem. Soc. 2013. V. 160. No. 9. Art. No. D403.
Zhang X., Han W., Fan D. et al. // Mater. Lett. 2014. V. 130. P. 154.
Важенина И.Г., Чеканова Л.А., Исхаков Р.С. // Изв. РАН. Сер. физ. 2019. Т. 83. № 6. С. 786; Vazhenina I.G., Chekanova L.A., Iskhakov R.S. // Bull. Russ. Acad. Sci. Phys. 2019. V. 83. No. 6. P. 713.
Gallo G., Baldi F., Renzone G. et al. // Microb. Cell Fact. 2012. V. 11. No. 1. P. 152.
Stolyar S.V., Bayukov O.A., Gurevich Yu.L. // Inorg. Mater. 2006. V. 42. No. 7. P. 763.
Machado S., Pinto S.L., Grosso J.P. et al. // Sci. Total Environ. 2013. V. 445–446. P. 1.
Trofimov B.A., Sukhov V.G., Aleksandrova G.P. et al. // Dokl. Chem. 2003. V. 393. No. 4–6. P. 287.
Gasilova E.R., Matveeva G.N., Aleksandrova G.P. et al. // J. Phys. Chem. B. 2013. V. 117. № 7. P. 2134.
Stolyar S.V., Chekanova L.A., Yaroslavtsev R.N. et al. // J. Phys. Conf. Ser. 2019. V. 1399. Art. No. 022026.
Wang B., Wu Q., Fu Yo. et al. // J. Mater. Sci. Technol. 2021. V. 86. P. 91.
Исхаков Р.С., Столяр С.В., Жигалов В.С. // Изв. РАН. Сер. физ. 2005. Т. 69. № 4. С. 589; Iskhakov R.S., Stolyar S.V., Zhigalov V.S. // Bull. Russ. Acad. Sci. Phys. 2005. V. 69. No. 4. P. 676.
Исхаков Р.С., Шепета Н.А., Комогорцев С.В. и др. // ФММ. 2003. Т. 95. № 3. С. 37.
Varnakov S.N., Komogortsev S.V., Bartolome J. et al. // Phys. Met. Metallogr. 2008. V. 106. No. 1. P. 51.
Chekanova L.A., Denisova E.A., Goncharova J.A. et al. // Phys. Met. Metallogr. 2013. V. 114. No. 2. P. 122.
Andreev A.S., d’Espinose de Lacaillerie J.-B., Lapina O.V., Gerachenko A. // Phys. Chem. Chem. Phys. 2015. V. 17. No. 22. Art. No. 14598.
Komogortsev S.V., Iskhakov R.S., Barnakov Ch.N. et al. // Phys. Met. Metallogr. 2010. V. 109. No. 2. P. 130.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая