Известия РАН. Серия физическая, 2022, T. 86, № 6, стр. 775-780
Влияние водно-мицеллярных сред на спектральные и люминесцентные параметры гидрофобных порфиринов
А. С. Старухин 1, *, Ю. Д. Король 1, Т. А. Павич 1, А. А. Романенко 1, И. Л. Гайна 2
1 Институт физики имени Б.И. Степанова Национальной академии наук Беларуси
Минск, Беларусь
2 Университет Бабес Болия, Факультет химии и химической инженерии
Клуж-Напока, Румыния
* E-mail: a.starukhin@ifanbel.bas-net.by
Поступила в редакцию 17.01.2022
После доработки 07.02.2022
Принята к публикации 21.02.2022
- EDN: HZPNWH
- DOI: 10.31857/S0367676522060278
Аннотация
Предложена методика введения гидрофобных порфиринов с фенильными и алкильными заместителями в водные растворы с использованием полимерных мицелл. Показано, что влияние водного окружения отличается для соединений с различной структурой и зависит от природы используемого поверхностно-активного вещества.
ВВЕДЕНИЕ
Порфирины и металлопорфирины и их аналоги являются хромофорами в составе таких биологически важных соединениях как хлорофилл зеленых растений и гем крови (см. [1–3] и ссылки в них). Кроме того, указанные соединения могут быть использованы в качестве зондов при изучении разнообразных процессов внутри- и межмолекулярных взаимодействий, что обусловлено разнообразными спектральными и фотофизическими характеристиками этих соединений. Отметим, что простейшие порфирины и их металлокомплексы, как правило, являются гидрофобными, что не позволяет растворять и исследовать их свойства в водных средах [4, 5]. При предварительном растворении ряда порфиринов в относительно небольшом наборе органических растворителей возможно смешать эти растворы с водой в определенной пропорции, но при таком методе существенно изменяются их фотофизические и спектральные характеристики [6, 7]. В воде также могут растворяться катионные и анионные формы порфиринов, но это уже соединения со значительными изменениями структуры за счет присоединения дополнительных групп [8, 9].
Актуальность разработки методики растворения простейших порфириновых макроциклов в водных средах обусловлена использованием таких соединений в качестве эффективных фотосенсибилизаторов в фотодинамической терапии. Для таких применений порфириновые макроциклы должны быть растворены в воде или в физиологических растворах [10–12]. Для исследований эффектов плазмонного усиления сигналов органических соединений в спектроскопии комбинационного рассеяния и люминесценции также необходимо приготавливать растворы исследуемых соединений в водных средах. Такая необходимость обусловлена тем, что наночастицы благородных металлов, как правило, приготавливаются в водных растворах.
Целью данной работы являлось создание методик введения гидрофобных порфириновых макроциклов и их металлокомплексов в водные среды при использовании полимерных мицелл.
МАТЕРИАЛЫ И МЕТОДЫ
Исследованные порфириновые соединения: 2,3,7,8,12,13,17,18-октаэтилпорфирин (М-OEP) и 5,10,15,20-тетрафенилпорфирин (М-ТРР), где M соответствует H2, Mg, Zn, Pd и Pt, были синтезированы по модифицированным методикам [13, 14]. На рис. 1 представлены исследованные соединения и примененные полимерные мицеллы. Исследования поведения порфиринов с фенильными и алкильными заместителями (рис. 1а и 1б), а также их металлокоплексов с ионами Mg(II), Zn(II), Pd(II) и Pt(II) при использовании водно-мицелярных систем ранее не проводились. Результаты по исследованиям указанных соединений в водно-мицеллярных средах сопоставлены с аналогичными данными для указанных порфириновых комплексов в ряде органических растворителей.
Рис. 1.
Структурные формулы 2,3,7,8,12,13,17,18-октаэтилпорфирина (М-OEP) (а); 5,10,15,20-тетрафенилпорфирина (М-ТРР) (б); Тритон X-100 (в); плюроник F-127 (г); где M = H2, Mg, Zn, Pd и Pt.
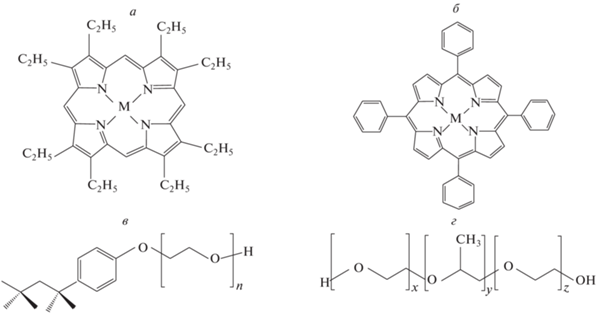
В качестве мицеллообразующих веществ использовались поверхностно-активные вещества: Triton X-100 (CAS Number: 9036-19-5 “Sigma-Aldrich”) и Pluronic F-127 (CAS Number: 9003-11-6 “Sigma-Aldrich”). Triton X-100 – неионное поверхностно-активное вещество, с химической формулой C14H22O(C2H4O)n. Данное вещество состоит из гидрофобного (4-третоктилфенол) и гидрофильного (остатки оксида этилена) фрагментов, представляет собой вязкое (менее вязкий, чем неразбавленный глицерин), прозрачное при комнатной температуре вещество (рис. 1в). Pluronic F-127 – поверхностно-активное вещество, состоящее из 3 блоков (рис. 1г); два крайних блока носят название поли(этилен оксид) и являются гидрофильными фрагментами, гидрофобный фрагмент находится в середине цепи и называется поли(пропилен оксид).
Приготовление раствора порфирина в водно-мицеллярной среде с использованием поверхностно-активной мицеллы Triton X-100 (TrX-100) состояло в растворении в жидком TrX-100 поликристаллов порфирина. Далее приготовленный раствор вещества в TrX-100 смешивался с дистиллированной водой (среда – Н2О:TrX-100).
Раствор с использованием мицеллы Pluronic F-127 (PlF-127) приготавливался по методике, которая подробно описана в [15, 16]. Предварительно поликристаллы порфирина растворялись в органическом растворителе, а затем растворитель упаривался. Полученный твердый образец, состоящий из полимера и порфирина, далее растворялся в дистиллированной воде (среда – Н2О : PlF-127).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для полученных растворов порфиринов в двух водно-мицеллярных средах Н2О : TrX-100 и Н2О : PlF-127, а также в толуоле и тетрагидрофуране были измерены спектры поглощения и спектры флуоресценции. Определены квантовые выходы люминесценции, а также измерены времена жизни флуоресценции. Все исследования проводились при комнатной температуре. Спектры поглощения растворов были измерены с использованием двулучевого спектрофотометра Shimadzu UV-3600 Plus. Спектры люминесценции и спектры возбуждения люминесценции были измерены с использованием спектрофлуориметра Fluorolog-3 фирмы HORIBA Scientific, США.
Известно, что 5,10,15,20-тетрафенилпорфирин (Н2-TPP) и его металлокомплексы хорошо растворяются в органических растворителях (например, в тетрагидрофуране (ТГФ) и в толуоле).
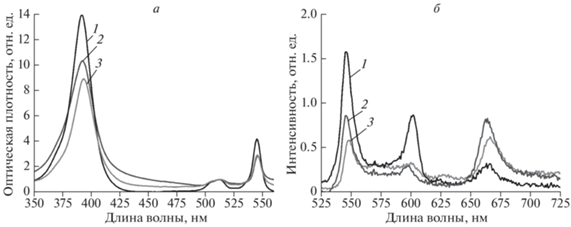
Были исследованы спектральные характеристики Н2-ТРР и его металлокомплексов в водно-мицеллярных средах На рис. 2 приведены нормированные на оптическую плотность первого электронно-колебательного перехода спектры поглощения Н2-TPP в двух органических растворителях и в двух водно-мицеллярных средах: Н2О : TrX-100 и H2O + Pluronic F-127. Как следует из рис. 2а и 2б при использовании различных органических растворителей, а также водно-мицеллярных сред Н2О : TrX-100 и Н2О : PlF-127 не происходят сдвиги полос, уширение или иная деформация полос в спектрах поглощения и флуоресценции.
Рис. 2.
Спектры поглощения Н2-ТРР в толуоле (1) и в среде Н2О : TrX-100 (2) (а), а также спектры флуоресценции в органических растворителях: Н2-TPP в ТГФ (1) и Н2-TPP в толуоле (3), а также в водно-мицеллярных средах: Н2-TPP в H2O + Pluronic F-127 (2) и Н2-TPP в Н2О : TrX-100 (4) (б).
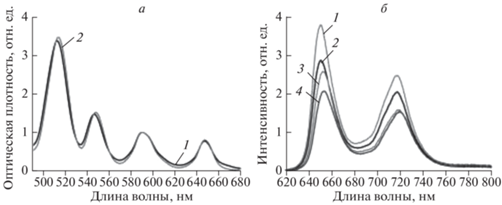
Спектры флуоресценции металлокомплексов TPP c ионами Mg (II) (Mg-TPP) и Zn(II) (Zn-TPP) представлены на рис. 2а и 2б. Для Mg-TPP характерно наличие батохромного сдвига при переходе от тетрагидрофурана (ТГФ) к водно-мицелярным средам (Н2О : TrX-100 и Н2О : PlF-127) практически на 6 нм. Указанный эффект можно обьяснить эффектом образования сольватированных форм Mg-TPP с участием полярного растворителя (рис. 2а). Такие эффекты для комплексов порфирирнов с ионами Mg (II) подробно рассмотрены в [18].
В спектрах флуоресценции Zn-TPP при переходе от толуола к водно-мицеллярным средам (Н2О : TrX-100 и Н2О : PlF-127) наблюдается батохромный сдвиг на 9–11 нм в зависимости от полосы, что тоже объясняеется проявлением эффектов сольватации в [17].
Для тетрафенилпорфирина и его металлокомплексов были определены относительные квантовые выходы, представленные в табл. 1, а также измерены времена жизни флуоресценции (табл. 2). В качестве стандарта было использовано значение квантового выхода флуоресценции Zn-TPP в толуоле, который приведен в [18].
Таблица 1.
Квантовые выходы люминесценции для H2-TPP, Zn-TPP, Mg-TPP в различных растворителях
| Вещество | Растворитель | Длина волны возбуждения, нм | Квантовый выход, % |
|---|---|---|---|
| H2-TPP | ТГФ | 590 | 8.6 ± 0.6 |
| Толуол | 590 | 7.9 ± 0.3 | |
| Н2О : TrX-100 | 590 | 10.4 ± 0.6 | |
| Н2О : PlF-127 | 590 | 8.1 ± 0.1 | |
| Mg-TPP | ТГФ | 570 | 13.1 ± 1.0 |
| Н2О : TrX-100 | 570 | 14.2 ± 1.1 | |
| Н2О : PlF-127 | 565 | 8.1 ± 0.3 | |
| Zn-TPP | Толуол | 550 | 3.0 |
| Н2О : TrX-100 | 560 | 3.5 ± 0.3 | |
| Н2О : PlF-127 | 560 | 3.3 ± 0.3 |
Таблица 2.
Времена жизни флуоресценции H2-TPP, Zn-TPP, Mg-TPP в различных растворителях
| Вещество | Растворитель | Время жизни, нс |
|---|---|---|
| H2-TPP | ТГФ | 9.75 ± 0.07 |
| Н2О : TrX-100 | 12.37 ± 0.07 | |
| Н2О : PlF-127 | 10.34 ± 0.08 | |
| Mg-TPP | ТГФ | 5.93 ± 0.05 |
| Н2О : TrX-100 | 8.26 ± 0.06 | |
| Zn-TPP | Толуол | 1.86 ± 0.03 |
| Н2О : TrX-100 | 1.95 ± 0.02 | |
| Н2О : PlF-127 | 1.52 ± 0.03 |
Для всех веществ (тетрафенилпорфирин и его металлокомплексы) квантовый выход в водно-мицеллярной среде Н2О : TrX-100 увеличивается по отношению к органическим растворителям. Эти данные хорошо коррелируют с временами жизни указанных веществ: наблюдается увеличение времен жизни флуоресценции при переходе от органического растворителя к среде Н2О : TrX-100. При переходе к Н2О : PlF-127 квантовый выход для H2-TPP и Mg-TPP уменьшается, а для Zn-TPP наблюдается небольшое увеличение. Времена жизни флуоресценции H2-TPP и Zn-TPP в Н2О : TrX-100 больше, чем в Н2О : PlF-127, что хорошо согласуется с представленными квантовыми выходами для указанных соединений.
Рассмотрим влияние водно-мицеллярных сред на металокомплексы октаэтилпорфирина с ионами Zn(II) и Pd(II). В спектрах поглощения Zn-OEP в ТГФ проявляются максимумы при 407, 537, 573 нм, в среде Н2О : TrX-100 при 410, 537, 574 нм, соответственно. Таким образом, для водно-мицеллярной среды происходит батохромный сдвиг спектра не более чем 3 нм. Уширения и деформации полос не наблюдается. Значительного изменения спектра флуоресценции при переходе от ТГФ к Н2О : TrX-100 не происходит. Наблюдается только небольшое уменьшение интенсивности флуоресценции и небольшой батохромный сдвиг спектра на 2 нм.
Рис. 3.
Спектры поглощения (а) и флуоресценции (б) Zn-ТРР в органических растворителях и в водно-мицеллярных средах: Zn-TPP в H2O + Pluronic F-127 (1), Zn-TPP в Н2О : TrX-100 (2) и Zn-TPP в толуоле (3).
Для количественной характеристики изменений параметров флуоресценции OEP и Zn-OEP были измерены относительные квантовые выходы флуоресценции и времена жизни флуоресценции. Для OEP при переходе от органического растворителя (тетрагидрофуран) к среде Н2О : TrX-100 квантовый выход флуоресценции уменьшается практически в два раза, тогда как в случае Zn-OEP падение квантового выхода незначительно. Представленные данные показали, что влияние водного окружения отличается для соединений с различной структурой и зависит от используемого поверхностно-активного вещества.
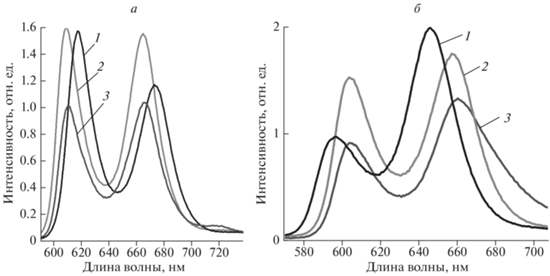
Спектр поглощения для Pd-OEP состоят из 3 полос (рис. 4а), максимумы которых не смещаются при переходе от органического растворителя к водно-мицеллярным средам. Спектры люминесценции Pd-OEP представлены на рис. 4б, при возбуждении спектров в области около 510 нм. Область спектра от 530 до 615 нм соответствует флуоресценции Pd-OEP, а спектр в области 615–690 нм принадлежит фосфоресценции Pd‑OEP. Известно, что для порфиринов с ионом Pd(II) даже при комнатных температурах удается наблюдать фосфоресценцию. Из представленных спектров на рис. 4б видно, что самая интенсивная флуоресценция наблюдается для Pd-OEP в органическом растворителе ТГФ, но фосфоресценция имеет в этом растворителе самую низкую интенсивность. В водно-мицеллярных средах интенсивность флуоресценции значительно снижается, в то время как фосфоресценция увеличивается в несколько раз. Одна из причин увеличения фосфоресценции – мицеллярное окружение не дает молекулярному кислороду в растворе подойти достаточно близко для тушения фосфоресценции Pd‑OEP.
ЗАКЛЮЧЕНИЕ
В результате выполненного исследования продемонстрирована возможность введения свободных оснований и металлокомплексов гидрофобных порфиринов (тетрафенилпорфирин, октаэтилпорфирин) в водные среды при использовании полимерных мицелл. При этом не происходит кардинальных изменений в спектрах поглощения и флуоресценции (относительных интенсивностей полос, спектральных положений и т.д.) по отношению к спектрам указанных соединений в органических растворителях. Применение используемых в работе методик введения гидрофобных веществ в водные среды позволяет избежать образования агрегатов. Установлено, что при введении комплексов тетрафенилпорфирина в среду Н2О : TrX-100 происходит увеличению квантового выхода в 1.2 раза для H2-TPP и в 1.17 раза для Zn-TPP, тогда как для Pd-TPP переход к водно-мицеллярной среде Н2О : TrX-100 сопровождается уменьшением квантового выхода фосфоресценции более чем в 3 раза по отношению к аналогичным величинам в органических растворителях. Для Mg-OEP наблюдается увеличение квантового выхода флуоресценции для среды Н2О : TrX-100 и сильное падение (в 4 раза) квантового выхода для среды Н2О : PlF-127 по отношению к органическому растворителю (тетрагидрофуран). Выявлено, что при переходе к водно-мицеллярным средам времена жизни флуоресценции увеличивались для всех веществ. Времена жизни флуоресценции для исследованных соединений в среде Н2О : TrX-100 имели большие значения, чем в Н2О : PlF-127. Результаты выполненных экспериментов продемонстрировали, что квантовые выходы и времена жизни флуоресценции существенно отличаются для различных соединений и зависят от используемого поверхностно-активного вещества.
Исследование поддержано Белорусским республиканским фондом фундаментальных исследований (проект № Ф20РА-013) и ГНПИ “Конвергенция-2025” 3.03.10.
Список литературы
Habermeyer B., Guilard R. // Photochem. Photobiol. Sci. 2018. V. 17. P. 1675.
De S., Devic T., Fateeva A. // Dalton Trans. Royal Soc. Chem. 2021. V. 50. No. 4. P. 1166.
Chen J., Zhu Y., Kaskel S. // Angew. Chem. 2021. V. 60. P. 5010.
Nishie H., Kataoka H., Yano S. et al. // Oncotarget. 2016. V. 7. No. 45. Art. No. 74259.
Zhang G., Zhu H., Chen M. et al. // Chem. Eur. J. 2018. V. 24. Art. No.15912.
Kavelin V., Fesenko O., Dubyna H. et al. // Nanoscale Res. Lett. 2017. V. 12. P. 197.
Starukhin A., Apyari V., Gorski A. et al. // EPJ Web Conf. 2019. V. 220. Art. No. 03003.
Кнюкшто В.Н., Старухин А.С., Крук Н.Н. и др. // Журн. прикл. спектроск. 2017. Т. 84. № 6. С. 877; Knyukshto V.N., Starukhin A.S., Kruk M.M. // J. Appl. Spectrosc. V. 84. No. 6. P. 960.
Ahmadi E., Ramazani A., Hamdi Z. et al. // Silicon. 2015. V. 7. P. 323.
Sun Y., Geng X., Wang Y. et al. // ACS Pharmacol. Transl. Sci. 2021. V. 4. No. 2. P. 802.
Pham Th., Nguyen V., Choi Y. et al. // Chem. Rev. 2021. V. 121. No. 2. Art. No. 13454.
Kataoka H., Nishie H., Tanaka M. et al. // J. Clin. Med. 2021. V. 10. No. 4. P. 841.
Sessler J., Mozaffari A., Johnson A. // Org. Synth. 2003. V. 70. P. 68.
Adler A., Longo F., Finarelli J. et al. // J. Org. Chem. 1967. V. 32. No. 2. P. 476.
Соловьева A.Б., Мелик-Нубаров Н.С., Аксенова Н.А. и др. // Журн. физ. хим. 2006. Т. 80. № 1. С. 124; Solov’eva A.B., Melik-Nubarov N.S., Aksenova N.A. // Russ. J. Phys. Chem. 2006. V. 80. No. 1. Р. 137.
Hait S.K., Moulik S.P. // J. Surfactants Deterg. 2011. V. 4. No. 3. P. 303.
Старухин А.С., Горский А.В., Кияк М.З. // Изв. РАН. Сер. физ. 2018. Т. 82. № 12. С. 1722; Starukhin A.S., Gorski A.V., Kijak M.Z. // Bull. Russ. Acad. Sci. Phys. 2018. V. 82. No. 12. Р. 1560.
Зенькевич Э.И., Сагун Е.И., Кнюкшто В.Н. и др. // Журн. прикл. спектроск. 1996. Т. 63. № 4. С. 599; Zen’kevich, Е.I., Sagun Е.I., Knyukshto V.N. et al. // J. Appl. Spectrosc. 1996. V. 63. No. 4. Р. 502.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая