Известия РАН. Серия физическая, 2022, T. 86, № 6, стр. 781-786
Создание и исследование водорастворимых химически связанных комплексов порфиринов с циклосахаридами
А. С. Старухин 1, *, Т. А. Павич 1, А. А. Романенко 1, Ю. А. Кальвинковская 1, С. Б. Бушук 2, И. Л. Гайна 3
1 Институт физики имени Б.И. Степанова Национальной академии наук Беларуси
Минск, Беларусь
2 Государственное научно-производственное объединение “Оптика, оптоэлектроника и лазерная техника” Национальной академии наук Беларуси
Минск, Беларусь
3 Университет Бабес Болия, Факультет химии и химической инженерии
Клуж-Напока, Румыния
* E-mail: a.starukhin@ifanbel.bas-net.by
Поступила в редакцию 17.01.2022
После доработки 07.02.2022
Принята к публикации 21.02.2022
- EDN: CPPLYZ
- DOI: 10.31857/S036767652206028X
Аннотация
Созданы и исследованы водорастворимые комплексы на основе мезо-замещенных порфиринов с активными функциональными карбокси- и амино-группами, которые использованы для химического связывания с циклосахаридами. Методами люминесцентной микроскопии исследована проникающая способность синтезированных комплексов в клеточную структуру фибробластоподобных клеток.
ВВЕДЕНИЕ
В настоящее время ведется активная работа по созданию фотосенсибилизаторов третьего поколения для применения в фотодинамической терапии, а также для использования в процессах антибактериальной фотодеструкции [1–4].
Особенно актуальным представляется создание новых химически связанных комплексов на основе различных фотосенсибилизаторов, химически связанных с моно- и полисахаридами в качестве лигандов (см. [5–8] и ссылки в них). Такие сопряженные системы должны быть растворимы в воде и в физиологических растворах, что является необходимым требованием для создания фотосенсибилизаторов третьего поколения. При этом указанные комплексы обладают способностью к векторной доставке фотосенсибилизатора в онкологическое новообразование, так как сахариды активно используются как питательное вещество клетками онкологических новообразований.
Целью данной работы являлось создание новых водорастворимых комплексов на основе различных фотосенсибилизаторов, химически связанных с циклосахаридами. Указанные комплексы должны состоять из трех составных частей: 1) фотосенсибилизаторы; 2) связующие мостики (линкеры или спейсеры); 3) циклосахариды различного состава.
МАТЕРИАЛЫ И МЕТОДЫ
В представленной работе в качестве фотосенсибилизаторов были использованы свободные основания порфиринов с активными функциональными карбокси- и амино- группами в мезо-положениях порфириновых макроциклов. Выполнен синтез 5,10,15,20- (тетра-4-аминофенил) порфирина (H2-TАPP) и 5,10,15,20-(тетра-4-карбоксифенил) порфирина (H2-TCPP). Соединения были синтезированы по модифицированным методикам, описанным в [9, 10]. На рис. 1 представлены структурные формулы синтезированных соединений, которые были использованы в качестве хромофоров в химически связанных комплексах порфиринов с циклосахаридами.
Рис. 1.
Структурные формулы 5,10,15,20-(тетра-4-аминофенил) порфирин (М-TАPP) (а); 5,10,15,20-(тетра-4-карбоксифенил) порфирин (М-TCPP) (б); химически связанные комплексы: М-TАPP-(L-Ala-Su-СD)4 (в); М-TCPP-(EDODEA-Su-СD)4 (г); где M = H2.

С использованием описанных выше хромофоров с активными функциональными карбокси- и аминогруппами в мезо-положениях порфириновых макроциклов выполнен синтез химически связанных водорастворимых комплексов с α-циклодекстрином.
На рис. 1 приведены структуры двух комплексов (рис. 1в и 1г). Соединение Н2-TАPP-(L-Ala-Su-СD)4), (рис. 1в) состоит из хромофора Н2-25,10,15,20-(тетра-4-аминофенил) порфирина (Н2-TАPP), α-циклодекстрина (СD) и линкера 1 – L-аланин с янтарной кислотой (Su). Комплекс Н2-TCPP-(EDODEA-Su-СD)4, (рис. 1г) состоит из 5,10,15,20-(тетра-4-карбоксифенил) порфирина (Н2-TCPP), α-циклодекстрина (СD) и линкера 2 – 2,2'-(этилендиокси) диэтиламина (EDODEA) с янтарной кислотой (Su).
Заключительным этапом синтеза было взаимодействие присоединенного линкера с α-циклодекстрином с образованием эфирной связи. При создании перечисленных комплексов была предложена оригинальная методика химического связывания амино- и карбокси-групп порфиринового макроцикла с α-циклодекстрином. В литературе такого типа синтезы не описаны, но ряд идей по созданию указанных комплексов был заимствован из [8, 11].
Синтезы соединений проводили с использованием сложных линкеров, состоящих из янтарного ангидрида для (L-Ala-Su-СD)4 для связывания с H2-TАPP и N-BOC-2,2'-(этилендиокси) диэтиламина и янтарного ангидрида и N-BOC-L-аланина для H2-TCPP-(EDODEA-Su-СD)4 с дальнейшим последовательным присоединением к порфирину. Карбоксильные группы на H2-TCPP и N-BOC-L-аланине активировали 1,1'-карбонилдиимидазоллом (CDI). Заключительным этапом синтеза было взаимодействие присоединенного линкера с α-циклодекстрином с образованием эфирной связи. После прекращения реакции полученную реакционную смесь выделяли охлажденным диэтиловым эфиром до образования твердого осадка и промывали хлороформом до исчезновения окраски. Полученные соединения не растворяются в гидрофобных растворителях за счет наличия в их составе α-циклодекстрина и поэтому исходные реагенты легко удалялись эфиром и хлороформом. Избыток α-циклодекстрина удаляли перекристаллизацией из диметилсульфоксида.
Спектры поглощения регистрировались на спектрофотометре Shimadzu UV-3600 Plus. С использованием спектрофлуориметра FluoroLog 3 фирмы HORIBA Scientific, США были измерены спектры флуоресценции, а также спектры возбуждения флуоресценции, корректированные на мощность фотовозбуждения и спектральную чувствительность системы регистрации.
Для ряда синезированных соединений были измерены квантовые выходы флуоресценции и времена жизни флуоресценции. Квантовые выходы флуоресценции были определены относительным методом по отношению к известному значению квантового выхода стандарта. В качестве стандарта было использовано значение квантового выхода флуоресценции Zn-TPP в толуоле [12], которое было подтверждено позднее в [13]. Для измерения времени жизни флуоресценции использовалась методика время-коррелированного счета одиночных фотонов. с применением TCSPC-контроллера DeltaHub (HORIBA Scientific). Источниками возбуждения фотолюминесценции выступали импульсный лазерный диод LDH-D-C-375 (PicoQuant, Германия) с длиной волны 376 нм и минимальной длительностью импульса 59 пс, а также импульсный светодиод PLS-400 (PicoQuant, Германия) с длиной волны 406 нм и минимальной длительностью импульса 780 пс.
Исследование скоростей накопления синтезированных комплексов живыми клетками выполнялось методами флуоресцентной и лазерной сканирующей микроскопии. Использовался лазерный сканирующий микроскоп Zeiss LSM 510 NLO на базе инвертированного исследовательского флуоресцентного микроскопа Zeiss Axiovert 200 M при возбуждении образцов излучением аргонового лазера. Были использованы объективы Zeiss Plan-Neofluar 40×/0.75 и Plan-Neofluar 20×/0.5 без иммерсии. Контроль состояния образца проводился посредством микроскопии светлого поля. Возбуждение флуоресценции проводилось излучением непрерывного аргонового лазера на длине волны 514 нм в режиме сканирования лазерного возбуждения. Регистрация конфокальных изображений производилась в спектральном диапазоне 590–800 нм с размером фрейма 512 × 512 пикселей и временем накопления сигнала 3.2 мкс/пиксель. Параметры, при которых были получены все приведенные флуоресценцентные изображения, были идентичны. Экспериментальное оборудование, которое было использовано в вышеуказанных экспериментах, более подробно было описано в [14, 15].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На рисунке 2 приведены спектры возбуждения флуоресценции и флуоресценции для H2-TАPP и H2-TCPP. Положение максимумов полос в спектрах возбуждения (аналог спектра поглощения) Н2-ТСРР и H2-TАPP близки к спектральной картине в спектрах порфиринов с арильными заместителями по мезо-положениям, например, 5,10,15,20-тетрафенилпорфирина. Максимумы полос в спектре флуоресценции H2-TCPP расположены при 652 и 720 нм, тогда как в случае H2-TАPP соответствующие полосы смещаются в длинноволновую область и расположены при 659 и 728 нм. Для H2-TCPP и H2-TАPP измерены основные фотофизические параметры. Для H2-TCPP квантовый выход флуоресценции составляет 8.5 ± 0.1%, а для H2-TАPP равен 10.0 ± 0.15%, соответственно. Время жизни флуоресценции для H2-TАPP имеет значение 10.0 ± 0.06 нс и 9.2 ± 0.06 нс в случае H2-TCPP. Все измерения выполнены для растворов указанных соединений в толуоле. Экспериментальные кривые затухания флуоресценции анализировались в приближении двухэкспоненциальной аппроксимациии. Кривые затухания флуоресценции носили моноэкспоненциальный характер и вклад второй компоненты не превышал 10%.
Рис. 2.
Спектры возбуждения флуоресценции (а) при λрег = 725 нм и флуоресценции (б) при λвозб = 419 нм Н2-ТАРР в толуоле; спектры возбуждения флуоресценции (в) при λрег = 419 нм и флуоресценции (г) при λрег = 725 нм Н2-ТСРР в толуоле.
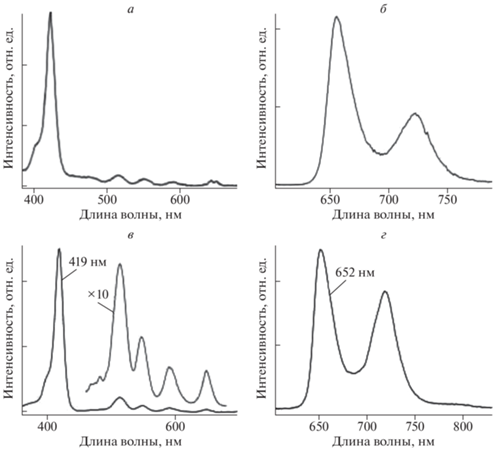
Синтезированные комплексы Н2-TCPP-(ESuСD)4 и Н2-TАPP-(LASuСD)4 показали высокую растворимость в воде (Н2О), а также в диметилсульфоксиде (ДМСО). На рис. 3 приведены спектры поглощения и флуоресценции комплекса Н2-TCPP-(ESuСD)4 в Н2О. Положения полос в спектрах поглощения и флуоресценции комплексов на рис. 3 практически не отличаются от спектров H2-TCPP, которые приведены на рис. 2в и 2г.
Синтезированные комплексы обладают высокоинтенсивной люминесценцией, что позволяет использовать их для исследований скоростей накопления синтезированных комплексов живыми клетками методами конфокальной люминесцентной спектроскопии. В качестве культуры клеток были выбраны клетки почечной ткани обезьяны BGM в буферной среде (водный раствор с определенной рН 7.4). Образец представлял из себя суспензию живых клеток в буферном растворе при температуре 37°С с концентрацией 105 ед./мл. Раствор содержался в камерах для микроскопии NUNC Lab-Tek c восемью ячейками и дном из покровного стекла c толщиной 0.17 мм. В одиночную ячейку помещалось 0.2 мл суспензии клеток и 10 мкл водного раствора синтезированного комплекса с концентрацией 1 ⋅ 10–5 М. Регистрация изображений производилась спустя 2 ч после инкубирования клеток с синтезированными комплексами и спустя 24 ч. Образцы содержались при температуре 37°С в инкубаторе с 5%-ным содержанием СО2
На начальной стадии образцы демонстрировали слабую флуоресценцию суспензии чистых клеток, которая обусловлена эндогенными хромофорами, при отсутствии в камере химически связанных комплексов порфиринов с циклосахаридами.
После двух часов инкубирования водорастворимых синтезированных комплексов были получены флуоресцентные изображения при возбуждении образца лазерным излучением (λвозб = 514 нм). Через такой временной интервал мембраны клеток слабо окрашивались, а межклеточная среда демонстрировала фоновую флуоресценцию. Через 24 ч после инкубации наблюдается эффективное вхождение комплексов в клетки и легко детектируется интенсивная флуоресценция на мембранах и внутри клеток.
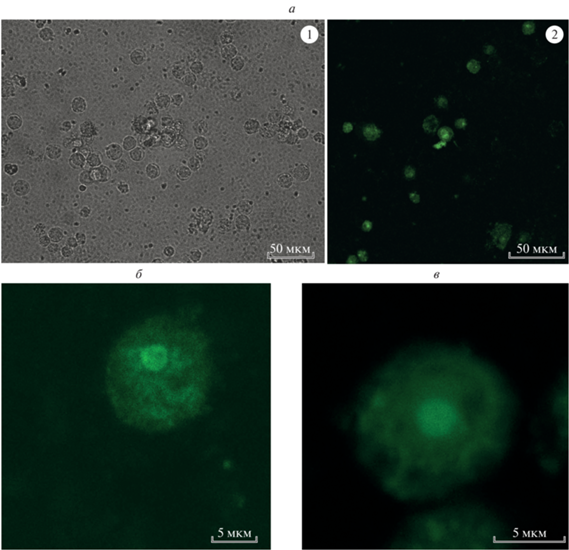
На рис. 4 также представлены флуоресцентные изображения клеток при поглощении макрофагами двух синтезированных комплексов. Сравнение изображений для одиночных клеток на рис. 4 демонстрирует существенно более интенсивное свечение при использовании комплекса Н2-TАPP-(LASuСD)4 по сравнению с применением в качестве фотосенсибилизатора комплекса Н2-TCPP-(ESuСD)4 при аналогичных условиях эксперимента. Этот факт объясняется тем, что в водных средах интенсивность свечения для комплекса Н2-TАPP-(LASuСD)4 существенно выше, чем для комплекса Н2-TCPP-(ESuСD)4. Более подробные количественные оценки люминесцентных параметров синтезированных комплексов станут предметом наших дальнейших исследований.
Рис. 4.
Изображения образцов с клетками спустя 24 ч после инкубации: при использовании комплекса Н2-TCPP-(ESuСD)4 (а): 1 – в проходящем свете и 2 – флуоресценция клеток. Флуоресценция одиночной живой клетки BGM спустя 24 ч после инкубации при использовании комплекса Н2-TCPP-(ESuСD)4 (б) и при использовании комплекса Н2-TАPP-(LASuСD)4 (в).
ЗАКЛЮЧЕНИЕ
Показано, что синтезированные водорастворимые комплексы порфириновых хромофоров химически связанные с α-циклодекстрином обладают хорошей растворимостью в различных водных средах и в биологических субстанциях.
Применение методов лазерной сканирующей конфокальной микроскопии наглядно демонстрирует высокую проникающую способность синтезированных комплексов на основе порфириновых макроциклов и полисахаридов в клеточную структуру фибробластоподобных клеток в культуре (клетки почки зеленой мартышки BGM). Созданные комплексы обеспечивают значительное усиление внутриклеточной флуоресценции, что свидетельствует об эффективном связывании фотоактивного комплекса с клетками. Вопросы избирательности связывания синтезированных соединений по отношению к определенным органеллам клетки требует дальнейшего изучения. Химически связанные комплексы порфиринов с циклодекстринами могут быть отнесены к фотосенсибилизаторам третьего поколения, что открывает широкие возможности для их практического использования в биофизике и в медицине. Следует отметить, что полученные результаты являются только первым этапом в синтезе новых комплексов порфириновых хромофоров с поли- и циклосахаридами и дальнейшее развитие предложенных подходов в синтезе и методах исследования позволит создать новые комплексы для их дальнейшего применения как эффективных фотосенсибилизаторов в фотодинамической терапии.
Исследование поддержано Белорусским республиканским фондом фундаментальных исследований (проект № Ф20РА-013) и ГНПИ “Конвергенция-2025” 3.03.10.
Список литературы
Pham Th., Nguyen V., Choi Y. et al. // Chem. Rev. 2021. V. 121. No. 2. Art. No.13454.
Simões J., Sarpaki S., Papadimitroulas P. et al. // J. Med. Chem. 2020. V. 63. No. 23. Art. No. 14119.
Amos-Tautua B., Songca S., Oluwafemi O. // Molecules. 2019. V. 24. P. 2456.
Habermeyer B., Guilard R. // Photochem. Photobiol. Sci. 2018. V. 17. P. 1675.
Kataoka H., Nishie H., Tanaka M. et al. // J. Clin. Med. 2021. V. 10. No. 4. P. 841.
Arja K., Elgland M., Appelqvist H. et al. // Chem. Open 2018. No. 7. P. 495.
Nishie H., Kataoka H., Yano S. et al. // Oncotarget. 2016. V. 7. No. 45. Art. No. 74259.
Hino S., Funada R., Sugikawa K. et al. // Chem. Med. Chem. 2021. V. 16. No. 5. P. 793.
Xiaomin W., Yuhou Z., Sumin W. et al. // Fine Chem. Intermed. 2013. V. 4. P. 57.
Ahmadi E., Ramazani A., Hamdi Z. et al. // Silicon. 2015. V. 32. P. 476.
Schneider R., Schmitt F., Frochot C. et al. // Bioorg. Med. Chem. 2005. V. 13. No. 8. P. 2799.
Зенькевич Э.И., Сагун Е.И., Кнюкшто В.Н. и др. // Журн. прикл. спектроск. 1996. Т. 63. № 4. С. 599; Zen’kevich, Е.I., Sagun Е.I., Knyukshto V.N. et al. // J. Appl. Spectr. 1996. V. 63. No. 4. Р. 502.
Taniguchi M., Lindsey J., Bocian D. et al. // J. Photochem. Photobiol. C. 2021. V. 46. No. 3. Art. No. 100401.
Lapina V., Pavich T., Bushuk S. et al. // J. Nanomed. Nanosci. 2019. V. 2019. No. 1. P. 1.
Литвинчук Я.О., Казеко Л.А., Бушук С.Б. и др. // Совр. стомат. 2021. № 1. С. 7.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая



