Известия РАН. Серия географическая, 2020, T. 84, № 2, стр. 228-238
Макрофитобентос в больших экосистемах южных морей России
О. В. Степаньян *
Федеральный исследовательский центр Южный научный центр PAH
Ростов-на-Дону, Россия
* E-mail: step@ssc-ras.ru
Поступила в редакцию 29.12.2018
После доработки 02.10.2019
Принята к публикации 28.11.2019
Аннотация
В рамках концепции Больших морских экосистем дается оценка состояния и динамики изменений качественных и количественных показателей макрофитобентоса (морские макроводоросли и травы) южных морей России. Показано, что перестройки видового состава и пространственного распределения макрофитобентоса морских экосистем (Азовское, Каспийское моря) связаны с колебаниями солености и уровня моря. Для Северного Каспия (российский сектор) с начала 2000-х годов отмечается увеличение доли сапробного комплекса зеленых и красных водорослей, расширение зоны обитания Zostera noltii, что обусловлено изменениями солености и уровня воды в водоеме. Наибольшая деструкция фитосообществ в Черном море наблюдается в морских эстуариях – портовых акваториях, в том числе в Новороссийской бухте. Наиболее устойчивыми к действию нефтепродуктов являются бурые водоросли (цистозировые), менее – зеленые (ульвовые) и красные (церамиевые). Построены математические модели отклика водной и прибрежно-водной растительности Северного Каспия на изменение уровня и солености воды, которые адекватно отражают происходящие природные процессы и позволяют прогнозировать влияние климата и антропогенной нагрузки (хозяйственной деятельности) на водные биоресурсы. Указывается на необходимость оценки экосистемных услуг макрофитобентоса для экономики России.
ВВЕДЕНИЕ
Морские макрофиты (макроводоросли и травы) являются важным компонентом прибрежных экосистем. Их видовой состав, пространственное и вертикальное распределение, особенности биологии, экологии и физиологии отдельных видов определяются, прежде всего, климатическими (океанографическими) факторами и уровнем загрязнения морской среды. Донные беспозвоночные и водоросли – хороший биоиндикатор климатических изменений в Мировом океане и внутриконтинентальных морях [16, 47]. Наиболее информативными параметрами при оценке изменений климата являются видовое разнообразие, биомасса и пространственное распределение водорослей. В южных морях России макроводоросли и морские травы образуют до 60% первичной продукции [3]. Часть видов (водоросли – Cystoseira, Phyllophora, морские травы Zostera) являются важными промысловыми объектами.
Используя подходы, разработанные в концепции Больших морских экосистем (БМЭ) [15, 16, 50], можно четко определить влияние климата и уровня содержания нефтепродуктов в морской воде на биоразнообразие и распределение макрофитов. Выявив эти закономерности можно построить прогностические модели “поведения” фитоценозов и дать рекомендации по оптимальному управлению добычей биоресурсов, что может существенно влиять на социально-экономическую ситуацию конкретных прибрежных территорий российского Юга.
В настоящее время международными организациями принята схема разделения прибрежных вод Мирового океана на 64 БМЭ, в пределах которых сосредоточено более 90% биоресурсов [50]. Для исследования БМЭ применяют модульную систему, включающую пять блоков: (1) биологическое разнообразие и продуктивность; (2) промысел; (3) загрязнение, состояние морской среды, влияние на биоту; (4) биоиндикаторы и управление прибрежными экосистемами; (5) социально-экономическая ситуация, экосистемные услуги. При этом для приокеанических районов приоритетной задачей в БМЭ являются устойчивое ведение рыболовства и ведение добычи других водных биоресурсов на основе экосистемных принципов. В пределах российской экономической зоны находятся 12 признанных на международном уровне БМЭ, одна из которых, Черное и Азовское моря, рассматривается в данной работе. Каспийское море не рассматривается в концепции БМЭ и не выделяется в отдельный район, так как не имеет прямой связи с Мировым океаном и обладает особым статусом “море–озеро”. Но, тем не менее, Каспийское море является водоемом, в акватории которого сходятся интересы 5-ти государств (Российская Федерация, Азербайджан, Казахстан, Туркменистан, Иран), ведется активная добыча биоресурсов и полезных ископаемых. По всем признакам Каспийское море соответствует критериям БМЭ, поэтому, на наш взгляд, к нему применимы подходы, разработанные в рамках концепции БМЭ.
На основе обширной базы океанографических данных [14] выделены факторы, имеющие цикличность и влияющие на динамику сообществ макрофитов: для Черного моря – температура поверхностного слоя и прозрачность воды; для Азовского моря – соленость и ледовый режим; для Каспийского моря – соленость, уровенный и ледовый режим северной части акватории.
Цель работы – используя методологию концепции Больших морских экосистем (БМЭ), показать влияние климатических изменений и уровня содержания нефтепродуктов в морской воде на биоразнообразие и распределение макрофитов.
МАТЕРИАЛЫ И МЕТОДЫ
Для оценки современного состояния фитобентоса использован полевой материал, собранный в 2000–2014 гг. в Азовском море, российском прибрежье Черного и Каспийского морей, включая более 800 количественных и качественных проб из рейсов НИС “Денеб”, НИС “Профессор Панов”, т/х “Курс”. Для анализа многолетней динамики изменений флористического состава, распределения и биомассы макрофитов использованы опубликованные данные [3–6, 22, 23, 28–31, 41, 43].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Видовое разнообразие и распределение макрофитобентоса. Влияние климатических изменений и загрязнения Азовское море
Для Азовского моря в современный период выявлено 17 видов зеленых, 5 видов бурых и 23 вида красных водорослей [36]. Характерно распределение водорослей вдоль градиента солености: в Таганрогском заливе доминируют зеленые водоросли родов Ulva, Cladophora, Rhizoclonium, Chaetomorpha, на остальной части Азовского моря и Керченского пролива преобладают морские макроводоросли из родов Ulva, Chaetomorpha, Ceramium, Polysiphonia. В юго-западной части Азовского моря к твердым естественным субстратам приурочены сообщества красных (Ceramium, Polysiphonia) и бурых (Cystoseira) водорослей, к рыхлым – морские травы (Zostera marina, Z. noltii) и харовые водоросли.
В настоящее время произошли изменения в соотношении основных групп водорослей в Азовском море, что связано с колебаниями солености, низкими температурами в зимний период [14, 17], и антропогенной деятельностью (зарегулирование и изъятие речного стока). В условиях резкого снижения пресного стока с 2010 г. и увеличения солености Азовского моря (в 2016 г. до 15‰ в центральной части моря) важную роль играет адвекция черноморских вод, которая развивается при определенных гидрометеорологических условиях (юго-западных ветрах свыше 20 м/с) и приводит к катастрофическим нагонам в восточной части Таганрогского залива [13]. При указанных условиях черноморские макрофиты или их спороносные части могут в течение нескольких часов преодолевать расстояние от Керченского пролива до Таганрогского залива, это является существенным фактором для инвазий видов из Черного моря в Азовское море. При увеличении солености возрастает видовое разнообразие в сообществах макроводорослей Азовского моря. Для Таганрогского залива значение индекса Шеннона равно 0.65, прибрежной части Азовского моря – 1.04, Таманского залива – 1.38.
Макроводоросли Азовского моря представлены мезо- и полисапробными видами, что подтверждает мезотрофный статус Азовского моря. Отметим, что в Азовском море увеличилось количество новых видов полисапробной группы из рода Ulva.
До начала 2000-х годов область распространения крупных бурых водорослей Cystoseira barbata и C. crinita была ограничена Керченским проливом. По нашим данным ареал Cystoseira в 2013–2015 гг. расширился до Казантипского залива, что связано с увеличением солености в последние годы. Другой пример активного осваивания новых биотопов – морские травы Z. marina и Z. noltii, которые с 2013 г. проникают в Таганрогский залив и встречаются в Ейском лимане, вытесняя пресноводные и солоноводные виды трав из рода Potomogeton, ранее формировавших заросли с биомассой от 1 до 6 кг/м2. При этом происходит существенная перестройка сложившихся трофических связей в сообществах донных беспозвоночных и рыб.
Черное море
В настоящее время в Черном море насчитывается более 380 видов макроводорослей, в том числе в российской части от 114 до 151 видов [30, 37, 41, 48]. Состав флоры значительно вырос по сравнению с 1970-ми годами, большинство находок новых видов, также как и максимальное видовое разнообразие, приходится на турецкий и крымский участок моря. В 1960–1970-е годы преобладал холодноводный комплекс водорослей, с доминированием широко-бореальных видов [6] (рис. 1). В 2000-е годы наметилась четкая тенденция к увеличению доли тепловодного комплекса, с преобладанием с бореально-тропических и субтропических элементов [34], во флоре Черного моря аналогичные явления отмечались в начале XX в.
Рис. 1.
Карта-схема видового сходства (индекс Шеннона) фитоценозов различных районов на акватории южных морей (1), вероятные пути инвазии водорослей с течениями (2) и из портовых акваторий (3) [14].
Обозначения: 1 – Одесский берег; 2 – филлофорное поле Зернова; 3 – Егорлыцко-Тендровско-Джарылгачско-Перекопский район; 4 – Каркинитский залив; 5 – Тарханкутско-Севастопольский берег; 6 – Севастопольская бухта; 7 – Южный берег Крыма; 8 – Прикерченский район; 9 – Новороссийская бухта; 10 – северо-восточный берег; 11 – юго-восточный берег; 12 – побережье Турции; 13 – побережье Болгарии; 14 – побережье Румынии. На врезке I – дендрограмма видового сходства водорослей из различных районов Черного моря. На врезке II – соотношение водорослей холодноводного (а) и тепловодного (б) комплексов Черного моря.

В последнее время здесь часто обнаруживаются новые виды водорослей – представителей тепловодной флоры [41, 48]. Исключением является одесское прибрежье, где отмечены находки вселенцев из северной Атлантики и субарктики – бурых водорослей Desmarestia viridis и Chorda tomentosa, образующих совместные фитоценозы [24].
Также отмечается значительное уменьшение глубины распространения прикрепленных водорослей [4–5, 23, 28], в том числе и цистозировых, с которыми связан основной комплекс водорослей-эпифитов Черного моря. Антропогенная деятельность (добыча водорослей, строительство в береговой зоне, загрязнение) оказывает значительное влияние на состав и глубинное распределение водорослей. Особенно явно такое воздействие отмечено для фитобентоса Новороссийской бухты, где разнообразие фитобентоса к концу 2000-х годов уменьшилось в 1.5 раза в сравнении с 1970-ми годами [35, 37], в основном за счет практически полного исчезновения холодноводной группы водорослей. В настоящее время здесь преобладают поли- и мезосапробные виды тепловодного комплекса. Значительно (в среднем в 3 раза по сравнению с 1960-ми годами) сократились площади распространения цистозиры – основного эдификатора и средообразующего вида зарослей средиземноморского типа. При этом биомасса цистозиры снизилась в 10 и более раз: с 14 кг/м2 в 1960-х годах до 0.1 кг/м2 в 2010-е годы [35], на глубинах до 1.5 м эти водоросли исчезли полностью. В настоящее время на большей части прибрежной зоны Новороссийской бухты растительные сообщества формируются короткоцикличными сезонными видами.
Каспийское море
В 1970-е годы список макроводорослей Каспийского моря насчитывал 63 вида, из них 29 видов зеленых, 13 – бурых и 21 – красных водорослей [6]. В ходе наших исследований обнаружено 36 видов макроводорослей, 3 вида морских трав [34]. Выявлено, что соотношение основных групп водорослей зависит от уровня и солености моря. В последние годы соотношение групп водорослей изменилось, количество видов зеленых водорослей возросло. По видовому богатству макроводорослей Каспийское море занимает промежуточное положение между Азовским и Черным морями. Основу каспийской морской флоры составляют зеленые водоросли родов Ulva, Cladophora, Ulothrix и красные водоросли родов Polysiphonia, Laurencia, Ceramium. По географическому составу флора Каспийского моря является широко-бореальной, но наличие 2 эндемичных родов и 8 эндемиков делает этот водоем уникальным [6, 8].
Для Северного Каспия и западного берега Среднего Каспия отмечено интенсивное развитие Ulva, Cladophora, Ceramium, что может свидетельствовать об увеличении уровня трофности морских вод, в том числе и из-за попадания в воду углеводородов при добыче нефти. Увеличение доли эврибионтных водорослей обусловлено понижением солености в последние годы, как в Каспийском море в целом, так и северной его части [20]. Изменение температурного режима северо-каспийских вод, по-видимому, не приведет к увеличению тепловодного комплекса водорослей, так как повторяемость суровых зим возрастает [12].
На большей части акватории Северного Каспия на глубинах 1–2 м биомасса водных цветковых растений не превышает 0.5–3 кг/м2 (до 10 кг/м2). Красные водоросли Polysiphonia и Laurencia на глубинах до 10–15 м формируют на ракушечниках обширные поля с биомассой более 1 кг/м2, но такие участки немногочисленны и локализованы на границе со Средним Каспием и вдоль его западного побережья.
Изменения в фитобентосе южных морей России невозможно объяснить только влиянием загрязнения, в том числе нефтяного, или антропогенной деструкцией, хотя именно этим ранее объясняли трансформацию фитоценозов южных морей [4, 6, 22, 23, 41]. Ведущую роль, на наш взгляд, играют климатические изменения в последние десятилетия: в Черном море потепление поверхностного слоя вод [46] и снижение прозрачности морской воды [11], обусловленное развитием кокколитофорид [10, 21], в Азовском море – колебания солености, в Каспийском море – изменения солености и уровня моря.
Запасы и промысел
Азовское море
Официально добыча водорослей и трав в Азовском море (российский сектор) не ведется. Небольшой объем выброшенной травы Zostera – камки, собирается у берегов Украины, ориентировочный объем изъятия, зачастую нелегального, составляет не более 100 т. Основной запас бурой водоросли Cystoseira (2 вида) в российских водах Черного моря находится в районе Туапсе–Анапа. По оценке А.А. Калугиной-Гутник [6] общий запас Cystoseira в советской части моря в середине 1970-х годов составлял 1 млн т, объем допустимого изъятия определялся в 300 тыс. т. Оценка допустимого улова (ОДУ) для бурых водорослей Cystoseira постоянно снижается: c 10 тыс. т в 2005 г., 8 тыс. т в 2015 г. [51]. При этом рекомендованный объем для изъятия составил в 2017 г. 100 т, а в 2018 – всего 3.88 т [51]. ОДУ для морских трав Zostera (2 вида), основные запасы которой сосредоточены в Таманском заливе, оценивается в последние годы в 70 тыс. т, при этом в 2018 г. рекомендовано к изъятию всего 200 т [51]. Отметим, что более 90% разрешенного объема изъятия водорослей и трав в настоящее время не осваивается. Вероятно, необходимо введение временного (до 5 лет) запрета на добычу Cystoseira и Zostera в южных морях России [23].
Черное море
Примером совместного воздействия изменений климата и неразумной хозяйственной деятельности является деградация филлофорного поля Зернова. Начиная с 1960-х годов деструктивные изменения филлофорного поля Зернова связывались исключительно с перепромыслом красных водорослей [6], антропогенной сукцессией фитосообществ [23]. Однако, сопоставляя динамику запасов филлофоры с колебаниями температуры и прозрачности в западной части Черного моря (рис. 2), видно, что катастрофическое снижение запасов, отмеченное в 1940-х годах, увязывается с предшествующим периодом потепления, промысел в эти годы еще не был столь масштабен. В 1950-х годах на фоне наступившего похолодания видно некоторое восстановление запасов филлофоры. Но активный промысел в 1960–1980-е годы окончательно подорвал существующие запасы водорослей, повышение температуры и снижение прозрачности воды лишь усугубило этот процесс. Отметим, что некоторые признаки восстановления запасов, отмеченные в конце 1990-х начале 2000-х годов [25, 42] можно увязать как с прекращением промысла, так и с периодом похолодания и увеличения прозрачности морской воды, отмеченными в это время. Несмотря на создание природного заказника в Украине в 2008 г. на “остатках” филлофорного поля Зерного, при первых признаках восстановления запасов, началось хищническое истребление биоресурсов. Только воссоединение Крыма с Россией в 2014 г. и введение пограничного режима прекратило браконьерский промысел биоресурсов, в том числе донными тралами.
Каспийское море
В северной части Каспийского моря запасы Z. noltii в начале 1940-х годов составляли 700 тыс. т [9]. Более поздние оценки запасов биомассы Z. noltii не проводились, но, основываясь на данных В.В. Громова [4], их можно ориентировочно принять равными около 200 тыс. т для Северного и западной части Среднего Каспия. Исследования [43] показали, что в середине 2000-х годов рост запасов Z. noltii по сравнению с 1980-ми годами [4] увеличился в 1.5–2 раза, особенно в районе о-вов Тюлених возле казахского берега.
Индикаторные виды и управление
На примере двух массовых видов морских трав Z. noltii и Stuckenia pectinata (=Potamogeton pectinatus) Северного Каспия проведены модельные расчеты по оценке влияния изменения уровня моря и сопряженных факторов на пространственное распределение [34]. Указанные виды выбраны в связи с тем, что у них при определенных условиях может быть “перекрывание” местообитаний и как следствие, конкуренция за субстрат, свет и питательные вещества. Оба вида предпочитают одни и те же глубины от 0.5 до 3 м, но Z. noltii менее чувствительна к колебаниям солености, а St. pectinata более восприимчива к снижению прозрачности морской воды. Пространственно-детализированная модель показывает, что при снижении уровня Каспийского моря происходит исчезновение промыслового вида Z. noltii на небольших глубинах и его локализация в центральной части на глубинах более 10 м (рис. 3). Граница распространения рдеста сдвигается в сторону меньших глубин, площадь покрытия уменьшается в более чем 2 раза. Аналогичная сукцессия описана для лиманов азербайджанского прибрежья [7]. В настоящее время существует возможность для расширения зоны распространения и увеличения запасов морских трав в Северном и Среднем Каспии.
Рис. 3.
Визуализация результатов модельных расчетов пространственной динамики биомассы морских трав (1 кг/м2) (1) Stuckenia pectinata (2) и Zostera noltii (3) Северного Каспия, где (4, 5) границы моря [34].
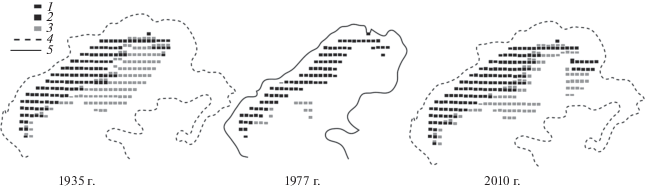
В условиях колебания уровня Каспийского моря важную роль играет изменение площади, занятой прибрежно-водной растительностью (ПВР), в основном тростника южного Phragmites australis. По результатам натурных наблюдений, к началу 2000-х годов площадь ПВР в авандельте значительно сократилась, что привело к перераспределению водоплавающих птиц, большая часть популяций которых переместилась в глубь дельты Волги, что снизило риски гибели для популяций водоплавающих птиц при возможных разливах нефти [1–2].
Морские макроводоросли – один из биологических компонентов в системе производственного мониторинга нефтегазовых компаний [44–45]. Распоряжением Минприроды РФ от 22.09.2015 № 25-р “Об утверждении перечня видов флоры и фауны, являющихся индикаторами устойчивого состояния морских экосистем Арктической зоны Российской Федерации” был утвержден перечень видов водорослей, которые являются индикаторами устойчивого развития арктических экосистем. Список насчитывает 12 видов макроводорослей и 1 вид морской травы. Это первый федеральный документ, в котором признается роль морских водорослей для устойчивого развития Арктики. Необходима разработка нормативных актов в области сохранения разнообразия макрофитобентоса южных морей России, куда должны быть включены индикаторные виды: промысловые (Cystoseira, Phyllophora, Zostera), эндемики (Laurencia coronopus, Chaetomorpha zernovii, Cladophora siwaschensis, Ulva maeotica, Dasya apiculata) и исчезающие виды (Gracelaria dura, Desmotrichum punctaroides, Porphyra ssp.).
Загрязнение и его влияние на макроводоросли
Из основных загрязнителей наиболее значимое влияние на развитие морской биоты в южных морях России (особенно Черного моря) оказывают нефтяные углеводороды, действие остальных загрязняющих веществ (тяжелые металлы, пестициды, радиоактивные элементы) не имеют столь глобального и выраженного значения [49]. Наибольшие концентрации нефтепродуктов в течение года характерны для районов Новороссийска и Туапсе (до 4.90 мг/л) [18–19], где имеются крупные нефтяные порты и наиболее напряженный трафик морских перевозок нефти. Курортные акватории Анапы и Геленджика чище в весенний период (менее 0.68 мг/л); летом и осенью концентрация углеводородов нефти возрастает в два и более раза [18–19].
Воздействие эмульсии нефти на макрофиты происходит непосредственно в водной толще, а пленки – на мелководной части прибрежья, в супралиторальной зоне, где обитает около 100 видов черноморских водорослей [6, 30]. Непосредственный контакт черноморских водорослей с пленкой нефти приводит к быстрой гибели зрелых талломов [6, 26, 27, 39]. В проведенных экспериментах проростки массовых видов черноморских водорослей C. barbata, U. intestinalis, C. virgatum, Polysiphonia sp. показали высокую устойчивость к действию эмульсии легкой нефти и нефтепродуктов, нормально развиваясь при концентрациях до 50 мг/л, бóльшие концентрации токсикантов подавляли развитие водорослей. Концентрации нефти и дизельного топлива до 10 мг/л стимулировали рост проростков водорослей. Отметим, что использованные концентрации нефти и нефтепродуктов в десятки раз превышали предельно-допустимую концентрацию (0.05 мг/л), принятую для рыбохозяйственных водоемов, но соответствовали современному уровню нефтяного загрязнения Черного моря в отдельных акваториях и бухтах. По степени устойчивости к воздействию нефти и нефтепродуктов черноморские водоросли можно расположить (по убыванию) следующим образом: Cystoseira barbata → Ulva intestinalis → Ceramium virgatum → Polysiphonia sp. Сходные результаты получены для макроводорослей эстуарных экосистем Баренцева моря [32, 33, 39–40]. Водоросли умеренно загрязненных акваторий оказываются более приспособленными к воздействию углеводородов нефти, чем из чистых районов [38], следовательно, при крупных техногенных авариях и попадании в море нефти устойчивость сообществ водорослей умеренно загрязненных прибрежий будет выше, чем в чистых акваториях. Применение водорослей из умеренно загрязненных местообитаний для плантаций-биофильтров позволит эффективней использовать этот подход в фиторемедиации [38].
На наш взгляд, разовая катастрофа скажется не столь значительно на популяциях водорослей, как хроническое поступление нефтетоксикантов в условиях заливов и лиманов. Структурный “скелет” сообщества сохранится, но могут исчезнуть чувствительные к воздействию нефти группы животных и микроводорослей. Это может привести к дисбалансу в прибрежной экосистеме и повлиять на продуктивность и распределение макроводорослей. Вероятно, сукцессионные процессы в сообществах водорослей будут развиваться аналогично наблюдаемым в Новороссийской бухте.
ЗАКЛЮЧЕНИЕ
Для управления морскими биоресурсами в южных морях России важен прогноз состояния макрофитобентоса на ближайшие годы. Выявленные в результате экспериментальных исследований индивидуальные различия в толерантности макроводорослей к нефтепродуктам, анализ перестройки фитосообществ под воздействием изменений климата позволили представить прогноз состояния макрофитобентоса эстуарных экосистем южных морей России при дальнейшем воздействии климатических изменений и уровне нефтяного загрязнения:
– в Черном море в долговременной перспективе (до середины XXI в.) будет увеличиваться доля тепловодной флоры. Представители холодноводного комплекса водорослей будут сужать ареалы, переходить в разряд редких и исчезающих видов;
– в Азовском море в ближайшие 10 лет будет и дальше происходить расширение зоны обитания черноморской флоры, формирование типичных черноморских сообществ;
– в Каспийском море в условиях стабильного уровня моря и солености существенных изменений для фитобентоса наблюдаться не будет, но возможно расширение зоны обитания промыслового вида Zostera;
– в Новороссийской бухте процесс трансформации фитосообществ будет продолжаться, что приведет в течение 10–15 лет к практически полному исчезновению типичных черноморских сообществ с участием Cystoseira и Phyllophora.
Долговременные изменения температуры, солености и прозрачности морской воды в значительной степени влияют на функционирование фитобентоса. Нефть и нефтепродукты при попадании в морскую воду способны вносить дисбаланс в структуру и функционирование прибрежных экосистем, оказывая дополнительное негативное воздействие на сообщества.
Концепция БМЭ предполагает оценку вклада отдельных компонентов морских систем в общий пул экосистемных “услуг” для экономики прибрежных стран. Для фитобентоса южных морей России в настоящее время такие оценки не проведены. И если вклад от добычи промысловых видов водорослей и трав возможно определить, то стоимость косвенных “услуг” – эстетика в рекреационных зонах, биотоп для фитофильных рыб, потоки вещества и энергии, усвоение СО2 и вклад в его снижение в морях и атмосфере, связывание и удаление из воды и донных отложений биогенных элементов, тяжелых металлов, радионуклидов и т.д. нуждается в дальнейшей проработке.
Список литературы
Бердников С.В, Маркитан Л.В., Степаньян О.В. Пространственно-детализированная модель многолетней динамики прибрежно-водной растительности и численности водоплавающих птиц устьевой области Волги // Успехи современной биологии. 2009. Т. 129. № 1. С. 80–92.
Бердников С.В, Степаньян О.В., Маркитан Л.В. Оценка влияния разливов нефти на распределение прибрежно-водной растительности и водоплавающих птиц Северного Каспия (модельный эксперимент) // Защита окружающей среды в нефтегазовом комплексе. 2018. № 5. С. 14–19.
Водоросли / справочник / под ред. С.П. Вассер, Н.В. Кондратьева, Н.П. Масюк. Киев: Наукова Думка, 1989. 608 с.
Громов В.В. Макрофитобентос южных морей России. Водоросли северо-кавказского побережья Черного моря, прибрежно-водная растительность Азовского моря и Северного Каспия. Palmarium Academic Publishing. 2012. 337 с.
Евстигнеева И.К. Видовой состав и количественная характеристика эпифитов Cystoseira crinita Bory // Альгология. 1993. Т. 3. № 4. С. 52–57.
Калугина-Гутник А.А. Фитобентос Черного моря. Киев: Наукова думка, 1975. 245 с.
Караева Н.И., Забержинская Э.Б. Динамика Zostera noltii Hornem у азербайджанского побережья Каспия // Вiсник ОНУ. 2008. Т. 13. Вип. 4. С. 196–199.
Каспийское море: Фауна и биологическая продуктивность. М.: Наука, 1985. 277 с.
Киреева М.С. Растительные богатства морей Советского Союза // Растительные ресурсы. 1965. Т. 1. Вып. 3. С. 323–335.
Копелевич О.В., Буренков В.И., Вазюля С.В., Шеберстов С.В. Проблемы индикации кокколитофоридных цветений по спутниковым данным // Современные проблемы дистанционного зондирования Земли из космоса. 2012. Т. 9. № 5. С. 241–250.
Кукушкин А.С., Прохоренко Ю.А., Хорошун С.А. Многолетняя изменчивость прозрачности вод в шельфовых и глубоководных районах Черного моря в ХХ столетии // Экологическая безопасность прибрежной и шельфовой зон моря. 2013. № 27. С. 243–248.
Матишов Г.Г. Влияние изменчивости климатического и ледового режимов на судоходство // Вестн. Российской академии наук. 2008. Т. 78. № 10. С. 896–902.
Матишов Г.Г., Бердников С.В. Экстремальное затопление дельты Дона весной 2013 г. // Изв. РАН. Сер. геогр. 2015. № 1. С. 111–118.
Матишов Г.Г., Бердников С.В., Жичкин А.П., Макаревич П.Р., Дженюк С.Л., Кулыгин В.В., Яицкая Н.А., Поважный В.В., Шевердяев И.В., Третьякова И.А., Цыганкова А.Е. Атлас климатических изменений в больших морских экосистемах северного полушария (1878–2013). Ростов-н/Д.: ЮНЦ РАН, 2014. 131 с.
Матишов Г.Г., Дженюк С.Л., Жичкин А.П., Моисеев Д.В. Климат морей Западной Арктики в начале XXI века // Изв. РАН. Сер. геогр. 2011. № 3. С. 17–32.
Матишов Г.Г., Макаревич П.Р., Моисеев Д.В. Климат и большие морские экосистемы Арктики. Ростов-н/Д.: ЮНЦ РАН, 2016. 96 с.
Матишов Г.Г., Матишов Д.Г., Гаргопа Ю.М., Дашкевич Л.В. Замерзание Азовского моря и климат в начале XXI века // Вестн. Южного научного центра. 2010. Т. 6. № 1. С. 33–40.
Матишов Г.Г., Степаньян О.В., Григоренко К.С., Харьковский В.М., Поважный В.В., Сойер В.Г. Особенности гидролого-гидрохимического режима Азовского и Черного морей в 2013 г. // Вестн. Южного научного центра. 2015. Т. 11. № 2. С. 36–44.
Матишов Г.Г., Степаньян О.В., Харьковский В.М., Сойер В.Г. Нефтяное загрязнение Азовского и Черного морей растет // Природа. 2016. № 5. С. 64–69.
Матишов Г.Г., Яицкая Н.А., Бердников С.В. Особенности внутривекового режима солености Каспийского моря // Доклады АН. 2012. Т. 444. № 2. С. 747–751.
Микаэлян А.С., Силкин В.А., Паутова Л.А. Развитие кокколитофорид в Черном море: межгодовые и многолетние изменения // Океанология. 2011. Т. 51. № 1. С. 39–48.
Мильчакова М.А. Макрофитобентос // Современное состояние биоразнообразия прибрежных вод Крыма (черноморский сектор). Севастополь: ЭКОСИ-Гидрофизика, 2003. С. 152–208.
Мильчакова Н.А., Миронова Н.В., Рябогина В.Г. Морские растительные ресурсы // Промысловые биоресурсы Чeрного и Азовского морей. Севастополь, 2011. С. 117–139.
Миничева Г.Г. Новый вселенец в Черном море: бурая водоросль Chorda tomentosa Lyngb. // Альгология. 2015. Т. 25. № 3. С. 323–329.
Миничева Г.Г. Современная морфофункциональная трансформация сообщества макрофитов филлофорного поля Зернова // Альгология. 2007. Т. 17. № 2. С. 171–190.
Миронов О.Г. Взаимодействие морских организмов с нефтяными углеводородами. Л.: Гидрометиоиздат, 1985. 127 с.
Миронов О.Г., Цымбал И.М. Развитие водорослей макрофитов в условиях нефтяного загрязнения // Науч. докл. высш. школы. Биолог. науки. 1975. № 5. С. 53–56.
Митясева Н.А., Максимова О.В., Георгиев А.А. Флора макроводорослей северной части российского побережья Черного моря // Экология моря. 2003. Вып. 64. С. 24–28.
Морские охраняемые акватории Крыма: научный справочник / под ред. Н.А. Мильчаковой. Симферополь: Н. Орiанда, 2015. 312 с.
Никитина В.Н., Лисовская О.А. Макрофитобентос верхних отделов береговой зоны российского побережья Черного моря // Труды С.-Петербург. о-ва естествоиспыт. Сер. 3. Т. 81. СПб.: СПбГУ, 2013. 132 с.
Садогурский С.Е. К изучению макрофитобентоса у черноморского побережья Керченского полуострова (Крым) // Альгология. 2007. Т. 17. № 3. С. 345–360.
Степаньян О.В. Влияние сырой нефти на ранние стадии развития макроводорослей Баренцева моря // Ботанический журн. 2013. Т. 98. № 7. С. 903–912.
Степаньян О.В. Воздействие нефтяной пленки на фотосинтез бурых водорослей Баренцева моря // Ботанический журн. 2014. Т. 99. № 10. С. 1095–1100.
Степаньян О.В. Макрофитобентос Каспийского моря: разнообразие, распределение, продуктивность // Океанология. 2016. Т. 56. № 3. С. 395–405.
Степаньян О.В. Макрофитобентос Новороссийской бухты: деградация в условиях хозяйственной деятельности и климатических изменений // Вестн. КамчатГТУ. 2018. № 4. С. 110–116.
Степаньян О.В. Распределение макроводорослей и морских трав Азовского моря, Керченского пролива и Таманского залива // Океанология. 2009. № 3. С. 393–399.
Степаньян О.В. Современное разнообразие макроводорослей Азовского, Черного и Каспийского морей // Докл. АН. 2014. Т. 458. № 2. С. 229–232.
Степаньян О.В. Хроническое загрязнение повышает устойчивость бурой водоросли Fucus vesiculosus (L.) к действию углеводородов нефти // Защита окружающей среды в нефтегазовом комплексе. 2015. № 2. С. 22–25.
Степаньян О.В., Воскобойников Г.М. Влияние нефти и нефтепродуктов на морфо-функциональные особенности морских макроводорослей // Биология моря. 2006. Т. 32. № 4. С. 241–248.
Степаньян О.В., Матишов Г.Г., Кулыгин В.В. Устойчивость макроводорослей Баренцева моря к нефтяному загрязнению // Наука Юга России. 2017. Т. 13. № 3. С. 103–108.
Теюбова В.Ф. Разнообразие и экологические особенности макрофитобентоса российского сектора Черного моря. Автореф. … дис. канд. биол. наук. Краснодар, 2012. 20 с.
Ткаченко Ф.П., Третьяк И.П., Костылев Э.Ф. Макрофитобентос филлофорного поля Зернова в современных условиях (Черное море, Украина) // Альгология. 2008. Т. 18. № 4. С. 423–431.
Чиженкова О.А., Зайцев В.Ф. Особенности формирования и распределения макрофитов и зообентоса на различных типах грунта Северном Каспии // Вестн. АГТУ. Сер. Рыбное хозяйство. 2011. № 2. С. 69–73.
Шавыкин А.А., Ильин Г.В. Оценка интегральной уязвимости акватории Баренцева моря от нефтяного загрязнения. Мурманск: ММБИ КНЦ РАН, 2010. 110 с.
Шахин Д.А., Пинаев В.Е. Оценка современного состояния окружающей среды в рамках экологического сопровождения проектов. М.: МАКС Пресс, 2013. 214 с.
Kontoyiannis H., Papadopoulos V., Kazmin A., Zatsepin A., Georgopoulos D. Climatic variability of the sub-surface sea temperatures in the Aegean-Black Sea system and relation to meteorological forcing // Climate Dynamics. 2012. V. 39. № 6. P. 1507–1525.
Merzouka A., Johnson L.E. Kelp distribution in the northwest Atlantic Ocean under a changing climate // J. of Experimental Marine Biol. and Ecol. 2011. V. 400. № 1–2. P. 90–98.
Minicheva G., Afanasyev D., Kurakin A. 2014. Black Sea Monitoring Guidelines. Macrophytobenthos. http://emblasproject.org/wp-content/uploads/2013/12/Manual_macrophytes_EMBLAS_ann.pdf
Oguz T., Velikova V. Abrupt transition of the northwestern Black Sea shelf ecosystem from a eutrophic to an alternative pristine state// Marine ecology. Progress series. 2010. V. 405. P. 231–242.
Sherman K., Sissenwine M., Christensen V., Duda A., Hempel G., Ibe C., Levin S., Lluch-Belda D., Matishov G., McGlade J., O’Toole M., Seitzinger S., Serra R., Skjoldal H.-R., Tang Q., Thulin J., Vandeweerd V., Zwanenburg K.A. Global movement toward an ecosystem approach to management of marine resources // Marine Ecology – Progress Series. 2005. V. 300. P. 275–279.
Приказ Минстерства сельского хозяйства РФ от 27 октября 2017 г. № 533 “Об утверждении общего допустимого улова водных биологических ресурсов во внутренних морских водах Российской Федерации, территориальном море Российской Федерации, на континентальном шельфе Российской Федерации и в исключительной экономической зоне Российской Федерации, в Азовском и Каспийском морях на 2018 год”. https://fishnews.ru/_img/docs/1132/prikaz_msh_-_533_ot_27-10-17_ob_utv-_odu_morskoe_2018_god.pdf (дата обращения 10.01.2020).
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия географическая



