Известия Русского географического общества, 2022, T. 154, № 3, стр. 28-46
Особенности кинетических процессов трансформации органического вещества в эвтрофных водоемах Карелии
А. В. Леонов a, *, М. В. Зобкова b, **
a Институт океанологии им. П.П. Ширшова РАН
Москва, Россия
b Институт водных проблем Севера КарНЦ РАН
Петрозаводск, Россия
* E-mail: leonov@ocean.ru
** E-mail: rincalika21@yandex.ru
Поступила в редакцию 17.02.2022
После доработки 24.04.2022
Принята к публикации 30.05.2022
- EDN: NGXYJX
- DOI: 10.31857/S0869607122030053
Аннотация
Проведено исследование по изучению долгосрочных (126 сут) БПК-экспериментов в воде из эвтрофных водных объектов Карелии (озер Крошнозеро, Святозеро, Яндомозеро, Верхнее и реки Шуя). За различные сезоны 2012–2017 гг. с водой из поверхностного горизонта было выполнено 48 экспериментов при 20 и 10°С. Были получены значения кинетических параметров БПК, которые достаточно полно отражают изменения потребления О2 по стадиям (I, II и L). В результате анализа данных был выявлен ряд общих особенностей, характерных для всех исследованных эвтрофных водных объектов. Во-первых, наблюдается резкое увеличение потребления О2 от зимы к лету при 20 и 10°С: в среднем – в 3.0 и 4.7 раза соответственно. Во-вторых, в зависимости от сезона изменяется вклад каждой стадии в БПКполн: зимой и осенью наибольший вклад при 20°С оказывает L стадия (53%), весной – II стадия (45%), а летом – I стадия (43%). Такое отличие связано с условиями продуцирования лабильного органического вещества (ОВ) в различные сезоны года. В-третьих, скорость окисления ОВ на L стадии, на которой происходит медленное окисление гумусовых веществ, во все сезоны в несколько раз ниже скорости на I стадии, где быстро окисляются лабильные компоненты ОВ. Только летом скорость на L стадии несколько возрастала, что, по-видимому, связано с интенсивным окислением взвешенного ОВ, образующегося в большом количестве в этот период. Полученные взаимосвязи между разными показателями ОВ и кинетическими параметрами БПК в воде из эвтрофных озер отражают спектр сезонных особенностей изменения условий окисления ОВ и характеризуются высокими значениями коэффициентов детерминации (R2 = 0.81–1.00).
ВВЕДЕНИЕ
Органическое вещество (ОВ) в природных водах принято разделять в зависимости от происхождения на автохтонное (образуется в водоемах в основном за счет фитопланктона) и аллохтонное (образуется на водосборе и поступает в природные воды с речным стоком). Состав автохтонного ОВ (ОВавт) характеризуется биохимически легко окисляемыми соединениями (свободными углеводами и аминокислотами, липидами, белками, мочевиной и другими веществами), а аллохтонного (ОВалл) – трудноокисляемыми гумусовыми веществами (ГВ) [3]. Следует отметить, что с ростом трофности существенный вклад в общее содержание ОВ вносит взвешенное вещество (ВВ), активно продуцируемое в воде в периоды вегетации.
Эвтрофные водоемы характеризуются высокими концентрациями биогенных веществ (БВ: соединений N, P, Si), высокой продукцией биомассы фитопланктона и низким качеством воды [2]. При этом биотрансформация БВ и продуцирование биомассы происходят при выраженных колебаниях активности этих процессов по сезонам, что связано с годовой динамикой факторов среды (температура, освещенность, прозрачность среды и содержание в ней БВ).
В сезонной динамике общего содержания ОВавт (растворенного и взвешенного) наименьшие его концентрации приходятся на период зимы, когда вегетация планктона низка и нет продуцирования ОВ. В большинстве водоемов Карелии пик концентраций ОВавт приходится на лето – период наибольшей активности фитопланктона [16]. При этом в эвтрофных водоемах концентрация взвешенного ОВавт существенно возрастает в вегетационный период при малой изменчивости содержания растворенного ОВавт [6].
На развитие кинетики в продолжительных БПК-экспериментах в воде из эвтрофных водоемов в значительной степени влияют следующие особенности: низкое содержание в придонных водах растворенного О2 (иногда и его отсутствие), специфичный состав зоо- и фитопланктона (при весеннем цветении в сообществе фитопланктона часто присутствует вид Microcystis aeruginosa), наличие характерного антропогенного влияния на водоемы с выраженным поступлением БВ и ОВ с водосборов [2], высокое содержание легкоокисляемых компонентов ОВавт [17] и, в частности, взвешенное ОВ. В результате внешний (или характерный) вид БПК-кривых может существенно изменяться в разные сезоны, что характеризуется значениями кинетических параметров [11].
Поэтому цель данного исследования состояла в оценке особенностей кинетических процессов трансформации ОВ в эвтрофных водоемах. Для этого предстояло установить значения кинетических параметров БПК в воде с учетом основных факторов среды (температурные условия, разные сезоны, состав компонентов ОВ); охарактеризовать отличия окисления различных компонентов ОВ на отдельных стадиях развития БПК (I, II и L стадии); выявить взаимосвязи между кинетическими параметрами БПК и показателями компонентов ОВ.
ОБЪЕКТЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования проводили в 2012–2017 гг. на пяти эвтрофных водных объектах (озера Крошнозеро, Святозеро, Яндомозеро, Верхнее и р. Шуя), отличающихся морфометрическими характеристиками, размерами и химическим составом (рис. 1). Все выбранные для исследования кинетики БПК эвтрофные водоемы Карелии разнотипны по содержанию БВ. В озерах повышена концентрация Робщ, и от зимы к лету его содержание возрастает при незначительных колебаниях Рмин. Содержание форм N может сильно отличаться, а концентрация Si особенно зависит от его поступления с водосборов и зимой максимальна в большинстве водоемов [16].
Рис. 1.
Карта-схема расположения исследованных водных объектов.
Fig. 1. Schematic map of the sampling sites in water objects.
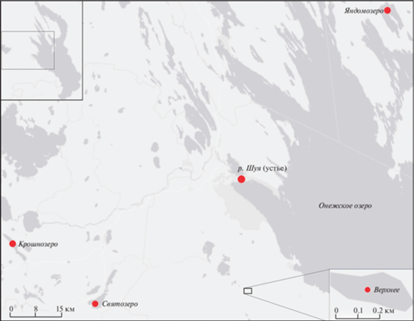
Озеро Крошнозеро (КР) относится к бассейну р. Шуи. Площадь водосборной территории 187.2 км2, период водообмена озера составляет 0.9 года, средняя и максимальная глубины 5.7 и 12.6 м соответственно. Антропогенную нагрузку на водоем оказывают сельскохозяйственные угодья [14], а также форелевое хозяйство, расположенное на его акватории. Несмотря на то, что в вегетационный период в воде КР повышены концентрации углеводов, липидов, белков, она характеризуется не очень высокой долей ОВавт из-за проточности водоема [17].
Озеро Святозеро (СВ) – водоем сельскохозяйственного района [14], находится в бассейне р. Шуя. Площадь водосборной территории 50.5 км2, а его зеркала 9.9 км2. Водоем мелководный (максимальная глубина 17.2, средняя 7.2 м) и слабопроточный (период водообмена 7.7 лет) с хорошим прогревом воды. В воде СВ отмечены значительные концентрации лабильного ОВ (углеводов, липидов, белков, растворенных аминокислот) и повышенная доля общего ОВавт (>40% из-за замедленного водообмена [17]). Водоем подвергается интенсивному антропогенному воздействию (населенные пункты, сельское хозяйство, рыбоводство и др.), которое за многолетний период способствовало возрастанию его трофического статуса [7, 16].
Озеро Яндомозеро (ЯН) – мелководное (максимальная и средняя глубины 9 и 4 м соответственно), площадь поверхности 30 км2. Предполагалось, что ЯН относится к водоемам мезотрофного типа, однако более детальные сезонные исследования дали информацию, которая позволяет считать озеро эвтрофным [16]. Водоем характеризуют следующие показатели: малый удельный водосбор (2.1) и средний по величине период водообмена (4.2 года). В зимний период в его водах повышено содержание ВВ (до 1.4 мг/л), а в осенний период отмечена наибольшая активность фитопланктона [16].
Озеро Верхнее (ВР) – мелководный водоем, расположенный на водосборе Онежского озера. Рядом с озером расположены дачные кооперативы, которые способствуют выносу БВ и загрязняющих веществ в него. Подробных гидрохимических исследований на озере ранее не проводилось, однако в этом полигумусном водоеме отмечена очень высокая концентрация ОВалл [6].
Река Шуя (РШ) – второй по величине приток Онежского озера (объем стока 3.1 км3/год). Устье реки расположено в вершинной части Петрозаводской губы озера, куда с речными водами поступает существенное количество ОВ гумусовой природы [3]. Река имеет освоенный под сельское хозяйство водосбор. Для водоемов бассейна р. Шуи характерно антропогенное евтрофирование при избыточном поступлении в водоемы БВ от рассредоточенных сельско- и рыбохозяйственных источников.
Вода для экспериментов отбиралась в районах формирования стока из озер Крошнозеро, Святозеро и Яндомозеро зимой-осенью 2012 г. и из центральной части озера Верхнее – в период открытой воды 2014 г. Из устьевой зоны р. Шуи отбор проб осуществлялся во все сезоны 2013 г., а также зимой и весной 2016 и 2017 гг. Пробы воды для БПК-опытов отбирались только из поверхностного горизонта 1 м. Всего было выполнено 48 экспериментов: 25 – при 20°С (по 7 – зимой и весной, 6 – летом и 5 – осенью), и 23 – при 10°С (6 экспериментов зимой, 7 – весной и по 5 – летом и осенью).
Методика постановки и проведения длительных БПК-экспериментов была подробно описана ранее [10]. Полученные в экспериментах мультистадийные БПК-кривые обрабатывались [13] и для каждой выделенной стадии оценивались значения кинетических параметров БПК: k – константа скорости БПК на I стадии, сут–1; w1 – константа скорости БПК на II стадии, (л · мг–1 · сут–1); ${{v}_{1}}$, ωS – соответственно скорости БПК на I и L стадиях, мг О2/(л · сут); [O2]I, [O2]II – предельные значения БПК соответственно на I и II стадиях, мг О2/л; ωS·126 – общее потребление О2 на L стадии, мг О2/л; БПКполн – БПК полное, то есть суммарное потребление О2 по выделенным стадиям, мг О2/л.
Перед началом эксперимента в пробах воды определяли значения химического потребления кислорода (ХПК) и перманганатной окисляемости (ПО), а также содержание общего фосфора (Робщ) и взвешенного вещества (ВВ). Определение органического углерода (Сорг) проводилось согласно методике [5], а общего ОВавт и ОВалл сорбцией на диэтиламиноэтилцеллюлозе [15].
Значения ряда параметров ОВ оценивалось по эмпирическим уравнениям: содержание лабильного C(Слаб = 0.3[O2]I); условно “стойкого” C (Сстаб = Сорг – Слаб), Сорг в зависимости от общего содержания ОВ (ОВƩ) [1]; содержание Сорг – в случаях, где не велось его аналитическое определение (Cорг = 0.375 ХПК) [19].
Особенность воды эвтрофных водоемов заключается в высоком содержании биомассы фитопланктона и, следовательно, органического ВВ, особенно в летний период [16]. Поэтому при исследовании воды и ее использовании в БПК-экспериментах необходимо учитывать взвешенную фракцию ОВ (ОВвзв), характеризующуюся высоким содержанием детрита, который при разложении определяет высокие скорости потребления О2 на L стадии (значения ωS могут быть сопоставимыми с ${{v}_{1}}$, и не исключаются случаи, когда ωS ≥ ${{v}_{1}}$ или ωS$ \gg $ ${{v}_{1}}$). В текущем исследовании содержание ОВвзв оценивали по разнице: ОВвзв, мг О/л = ХПК – растворенное ОВавт – ОВалл [15].
Статистическую обработку данных вели с помощью программного обеспечения So-faStatistics (www.sofastatistics.com) с пороговым критерием статистической значимости (p) равным 0.01.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Значения показателей ОВ в водах исследованных водных объектов. Среднее и сезонное содержание Робщ, ВВ, ОВ и его компонентов отличалось во всех исследованных эвтрофных водных объектах (табл. 1). Концентрации Робщ в воде всех озер оставались на высоком уровне в течение всего периода наблюдений, при этом отмечалось увеличение Робщ от зимы к лету. Отдельно выделялось СВ, в воде которого при цветении воды летом 2012 г. отмечалось резкое возрастание содержания Робщ до 222 мкг/л. В то же время были повышены значения косвенных показателей ОВ (табл. 1), а на содержание ОВвзв приходилось 18.1 мг О/л (или 68% общего ОВавт). Во время цветения резко увеличивались концентрации легкоокисляемых соединений: углеводов – до 11.0 мг/л и липидов – 0.97 мг/л [4]. Это связано с тем, что в летний период в воде СВ активно развиваются сине-зеленые и зеленые водоросли (85% общей численности), в которых содержание углеводов обычно достигает 30–60% в расчете на сухую массу [21].
Таблица 1.
Химические показатели ОВ воды в 2012–2017 гг. (пояснения в тексте) Table 1. Chemical parameters of water organic matter in 2012–2017 (explanations in the text)
| Водный объект, сезон, год |
Аналитические измерения | Расчетные значения | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Робщ, мкг/л |
ВВ, мг/л |
Сорг, мг С/л |
ПО | ХПК | ОВавт | ОВалл | ОВвзв | Слаб | Сстаб | OВΣ, мг/л |
|
| мг О/л | мг С/л | ||||||||||
| КР, З, 2012 | 53 | 0.6 | 13.2* | 17.1 | 35.1 | 10.0 | 25.1 | 1.0 | 0.08 | 13.12 | 6.1 |
| КР, В, 2012 | 78 | 11.4 | 13.2* | 14.5 | 35.2 | 14.3 | 20.9 | 7.3 | 1.08 | 12.12 | 6.1 |
| КР, Л, 2012 | 68 | 7.0 | 12.3* | 21.5 | 32.7 | 16.9 | 15.8 | 6.7 | 0.99 | 11.31 | 5.7 |
| КР, О, 2012 | 59 | 3.5 | 11.7* | 13.4 | 31.1 | 12.9 | 18.2 | 2.0 | 0.67 | 13.04 | 5.4 |
| Среднее | 64 | 5.6 | 12.6 | 16.6 | 33.5 | 13.3 | 20.0 | 4.3 | – | 12.4 | 5.9 |
| СВ, З, 2012 | 42 | 2.2 | 6.7* | 6.3 | 17.9 | 8.0 | 9.9 | 1.0 | 0.08 | 6.62 | 3.1 |
| СВ, В, 2012 | 52 | 2.7 | 7.2* | 5.3 | 19.1 | 10.7 | 8.4 | 5.7 | 0.69 | 6.51 | 3.4 |
| СВ, Л, 2012 | 222 | 9.6 | 13.2* | 9.9 | 35.3 | 24.7 | 10.6 | 18.1 | 6.05 | 7.15 | 6.1 |
| СВ, О, 2012 | 51 | 3.7 | 7.5* | 6.4 | 19.9 | 14.3 | 5.6 | 4.4 | 0.85 | 6.65 | 3.5 |
| Среднее | 92 | 4.6 | 8.7 | 7.0 | 23.0 | 14.4 | 8.6 | 7.3 | – | 6.9 | 4.0 |
| ЯН, З, 2012 | 16 | 1.4 | 7.7* | 7.5 | 20.4 | 8.7 | 11.7 | 1.4 | 0.14 | 7.56 | 3.6 |
| ЯН, В, 2012 | 20 | 1.6 | 10.5* | 9.1 | 21.8 | 15.2 | 12.8 | 8.4 | 0.53 | 9.98 | 4.9 |
| ЯН, Л, 2012 | 53 | 6.2 | 8.2* | 7.4 | 21.9 | 17.7 | 4.2 | 6.4 | 1.29 | 6.91 | 3.8 |
| ЯН, О, 2012 | 22 | 3.3 | 13.7* | 17.1 | 36.6 | 17.6 | 19.0 | 4.7 | 0.66 | 13.04 | 6.4 |
| Среднее | 28 | 3.1 | 10.0 | 10.3 | 25.2 | 14.8 | 11.9 | 5.2 | – | 9.4 | 4.7 |
| РШ, З, 2013 | 35 | 1.6 | 17.0 | 23.7 | 45.9 | 7.8 | 38.1 | 2.3 | 0.40 | 16.60 | 7.9 |
| РШ, В, 2013 | 34 | 9.3 | 11.8 | 19.7 | 33.4 | 7.0 | 26.4 | 0.6 | 1.02 | 10.78 | 5.5 |
| РШ, Л, 2013 | 65 | 2.5 | 15.6 | 15.1 | 38.5 | 14.4 | 24.1 | 4.9 | 2.39 | 13.21 | 7.3 |
| РШ, О, 2013 | 41 | 6.0 | 12.9 | 14.1 | 30.8 | 7.7 | 23.1 | 2.9 | 0.45 | 12.45 | 6.0 |
| РШ, З, 2016 | 35 | 2.0 | 18.0 | 21.5 | 51.3 | 12.8 | 38.5 | 0.9 | 0.60 | 17.40 | 8.4 |
| РШ, В, 2016 | 37 | 0.9 | 16.2 | 19.7 | 42.4 | 7.6 | 34.8 | 1.2 | 0.83 | 15.37 | 7.5 |
| РШ, З, 2017 | 37 | 2.2 | 18.6 | 22.6 | 49.0 | 6.9 | 42.1 | 2.4 | 0.83 | 17.47 | 8.7 |
| РШ, В, 2017 | 44 | 11.5 | 16.2 | 21.6 | 44.9 | 5.6 | 39.3 | 1.2 | 0.30 | 15.90 | 7.5 |
| Среднее | 41 | 4.5 | 15.8 | 19.8 | 42.0 | 8.0 | 30.4 | 2.1 | – | 14.9 | 7.3 |
| ВР, В, 2014 | 47 | – | 30.3 | 41.6 | 61.5 | 10.2 | 53.3 | 0.0 | 0.45 | 29.85 | 14.1 |
| ВР, Л, 2014 | 66 | 0.8 | 26.9 | 39.3 | 79.5 | 10.5 | 69.0 | 0.4 | 0.25 | 26.65 | 12.5 |
| ВР, О, 2014 | 46 | 1.6 | 21.3 | 13.5 | 70.0 | 13.1 | 56.1 | 2.4 | 0.47 | 20.83 | 9.9 |
| Среднее | 53 | 1.2 | 26.2 | 31.5 | 70.3 | 11.3 | 59.5 | 0.9 | – | 25.8 | 12.2 |
Примечания: * Расчет Сорг по эмпирической формуле; обозначения сезонов в табл. 1–2: З – зима, В – весна, Л – лето, О – осень; прочерк – отсутствие данных.
Содержание ВВ в воде эвтрофных озер выше, чем в мезо- и олиготрофных, что особенно заметно в период открытой воды во время активных продукционных процессов и подтверждается увеличением содержания взвешенной формы ОВавт, тесной связью ВВ и Слаб (Тест Пирсона: 9.376е–3 < 0.01; R = –0.541; df = 20). Однако, в озере ВР отмечались наименьшие содержания ВВ и ОВвзв (табл. 1). Это может быть связано с высоким содержанием ОВалл в воде, которое уменьшает фотический слой и тем самым лимитирует первичную продукцию [19]. Такая тенденция подтверждается статистически: установлено, что с ростом ОВалл в исследованных объектах снижалось содержание ОВвзв (Тест Пирсона: 6.601е–3 <0.01; R = –0.561; df = 20). Исследованные водные объекты отличались по содержанию ОВалл, минимальные концентрации отмечались в мезогумусном СВ (в среднем 8.6 мг О/л), а максимальные – в полигумусном ВР (в среднем 59.5 мг О/л). Содержание ОВавт значительно варьировало в течение всего периода наблюдений, за счет изменения взвешенной его формы, минимальные значения которой были отмечены в зимний период, когда продуцирования ОВ практически не происходило.
Особенности кинетики БПК в воде из эвтрофных водных объектов. С помощью БПК-кривых c выраженными двумя-тремя стадиями потребления О2 были получены значения отдельных кинетических параметров (табл. 2). Обработка данных по кинетике БПК показала ряд общих особенностей, характерных для всех эвтрофных водных объектов. Наблюдается резкое увеличение потребления О2 от зимы к лету: в среднем – в 3.0 и 4.7 раза соответственно при 20 и 10°С. В зависимости от сезона изменяется вклад каждой стадии в общее потребление О2 (БПКполн) (рис. 2). Зимой и осенью при разных температурах наибольший вклад в БПКполн (50% и более) оказывает L стадия. В зимний период, когда новообразования ОВ практически не происходит, выявлен минимальный вклад I и II стадий в БПКполн. Весной при 20°С доминирует II стадия (45% от БПКполн). Это связано с активным продуцированием диатомовыми водорослями липидов [6], взаимосвязь которых от потребления О2 на II стадии была выявлена ранее [11]. В летний период, когда происходит максимальное продуцирование лабильного ОВ, превалирует I стадия, что подтверждается связью, установленной между [O2]I и ОВавт (Тест Пирсона: 5.666е–3 < 0.01; R = –0.558; df = 21). Суммарное потребление О2 на I и II стадиях летом при 20 и 10°С достигает соответственно 68 и 59%.
Таблица 2.
Значения кинетических параметров БПК при разных температурах: 20°С – числитель и 10°С – знаменатель (числа в скобках – принятые конечные значения БПК, учитываемые при обработке данных экспериментов; пояснения в тексте) Table 2. The values of kinetic parameters estimated at different temperatures: the numerator is the 20°C and the denominator is the 10°C (numbers in parentheses are adjusted final experimental BOD values taken into account at processing the experimental data; explanations in the text)
| Водный объект, сезон, год |
Тип БПК |
Кинетические БПК-параметры | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| I стадия (по Е- или А-типу) | Линейная стадия | II стадия | БПКполн | |||||||
| [O2]I, мг О2/л |
k или w1, л мг–1 сут–1 |
${{v}_{1}}$, $\frac{{{\text{мг}}\,{{{\text{O}}}_{{\text{2}}}}}}{{\left( {{\text{л}}\,{\text{сут}}} \right)}}$ |
ωS, $\frac{{{\text{мг}}\,{{{\text{O}}}_{{\text{2}}}}}}{{\left( {{\text{л}}\,{\text{сут}}} \right)}}$ | ωS·126, мг О2/л |
[O2]II, мг О2/л |
w2, л м–1 сут–1 |
расчет | опыт | ||
| мг О2/л | ||||||||||
| КР, З, 2012 | $\frac{{{\text{АL}}}}{{{\text{АL}}}}$ | $\frac{{0.26}}{{0.08}}$ | $\frac{{0.233}}{{0.494}}$ | $\frac{{0.0011}}{{3.79 \times {{{10}}^{{ - 4}}}}}$ | $\frac{{0.0633}}{{0.0275}}$ | $\frac{{5.317{\kern 1pt} *}}{{2.310{\kern 1pt} *}}$ | $\frac{ - }{ - }$ | $\frac{ - }{ - }$ | $\frac{{5.577}}{{2.390}}$ | $\frac{{5.55}}{{2.39}}$ |
| КР, В, 2012 | $\frac{{{\text{EA}}}}{{{\text{ЕAL}}}}$ | $\frac{{3.60}}{{1.36}}$ | $\frac{{0.175}}{{0.140}}$ | $\frac{{0.6300}}{{0.1900}}$ | $\frac{ - }{{0.0434}}$ | $\frac{ - }{{5.468}}$ | $\frac{{4.53}}{{1.31}}$ | $\frac{{0.365}}{{0.207}}$ | $\frac{{8.093{\kern 1pt} *}}{{8.138}}$ | $\frac{{8.25\,(8.09)}}{{8.14}}$ |
| КР, Л, 2012 | $\frac{{{\text{EL}}}}{{{\text{ЕL}}}}$ | $\frac{{3.30}}{{1.97}}$ | $\frac{{0.111}}{{0.129}}$ | $\frac{{0.3660}}{{0.2540}}$ | $\frac{{0.1320}}{{0.0587}}$ | $\frac{{16.632}}{{7.396}}$ | $\frac{ - }{ - }$ | $\frac{ - }{ - }$ | $\frac{{19.93}}{{9.366}}$ | $\frac{{19.93}}{{9.36}}$ |
| КР, О, 2012 | $\frac{{{\text{AAL}}}}{{{\text{AL}}}}$ | $\frac{{2.59}}{{1.12}}$ | $\frac{{0.223}}{{0.298}}$ | $\frac{{0.3120}}{{0.0535}}$ | $\frac{{0.0212}}{{0.0256}}$ | $\frac{{2.671}}{{3.226}}$ | $\frac{{2.94}}{ - }$ | $\frac{{0.101}}{ - }$ | $\frac{{8.201}}{{4.346}}$ | $\frac{{8.20}}{{4.38}}$ |
| СВ, З, 2012 | $\frac{{{\text{AAL}}}}{{{\text{AAL}}}}$ | $\frac{{0.27}}{{0.21}}$ | $\frac{{0.150}}{{0.254}}$ | $\frac{{1.02 \times {{{10}}^{{--3}}}}}{{1.14 \times {{{10}}^{{--3}}}}}$ | $\frac{{0.0174}}{{0.0050}}$ | $\frac{{1.462{\kern 1pt} *}}{{0.420{\kern 1pt} *}}$ | $\frac{{2.54}}{{0.51}}$ | $\frac{{0.098}}{{0.150}}$ | $\frac{{4.272}}{{1.140}}$ | $\frac{{4.05\left( {4.27} \right)}}{{1.14}}$ |
| СВ, В, 2012 | $\frac{{{\text{ЕAL}}}}{{{\text{ЕAL}}}}$ | $\frac{{2.30}}{{1.43}}$ | $\frac{{0.130}}{{0.108}}$ | $\frac{{0.2990}}{{0.1540}}$ | $\frac{{0.0259}}{{0.0231}}$ | $\frac{{3.263}}{{2.911}}$ | $\frac{{2.80}}{{0.86}}$ | $\frac{{0.093}}{{0.401}}$ | $\frac{{8.363}}{{5.201}}$ | $\frac{{8.37}}{{5.20}}$ |
| СВ, Л, 2012 | $\frac{{{\text{АAL}}}}{{{\text{ЕAL}}}}$ | $\frac{{20.15}}{{12.52}}$ | $\frac{{0.347}}{{0.085}}$ | $\frac{{26.22}}{{1.064}}$ | $\frac{{0.0643}}{{0.0750}}$ | $\frac{{{{{4.051}}^{{2*}}}}}{{9.450}}$ | $\frac{{16.46}}{{8.78}}$ | $\frac{{0.180}}{{0.042}}$ | $\frac{{40.66}}{{30.75}}$ | $\frac{{42.0\left( {40.7} \right)}}{{30.75}}$ |
| СВ, О, 2012 | $\frac{{{\text{АAL}}}}{{{\text{ЕAL}}}}$ | $\frac{{2.84}}{{1.60}}$ | $\frac{{0.255}}{{0.143}}$ | $\frac{{0.4090}}{{0.2290}}$ | $\frac{{0.0335}}{{0.0150}}$ | $\frac{{4.221}}{{1.890}}$ | $\frac{{1.47}}{{1.12}}$ | $\frac{{0.100}}{{0.108}}$ | $\frac{{8.531}}{{4.610}}$ | $\frac{{8.54}}{{4.61}}$ |
| ЯН, З, 2012 | $\frac{{{\text{АL}}}}{{{\text{АL}}}}$ | $\frac{{0.46}}{{0.47}}$ | $\frac{{0.157}}{{0.220}}$ | $\frac{{0.0953}}{{0.00566}}$ | $\frac{{0.0348}}{{0.0143}}$ | $\frac{{2.923{\kern 1pt} *}}{{1.201{\kern 1pt} *}}$ | $\frac{ - }{ - }$ | $\frac{ - }{ - }$ | $\frac{{3.383}}{{1.671}}$ | $\frac{{3.37}}{{1.68}}$ |
| ЯН, В, 2012 | $\frac{{{\text{AAL}}}}{{{\text{АAL}}}}$ | $\frac{{1.75}}{{1.13}}$ | $\frac{{0.332}}{{0.280}}$ | $\frac{{0.1960}}{{0.0339}}$ | $\frac{{0.0264}}{{0.0173}}$ | $\frac{{3.326}}{{2.179}}$ | $\frac{{1.42}}{{0.76}}$ | $\frac{{0.490}}{{0.176}}$ | $\frac{{6.562}}{{4.073}}$ | $\frac{{6.39\left( {6.56} \right)}}{{3.91\left( {4.07} \right)}}$ |
| ЯН, Л, 2012 | $\frac{{{\text{АA}}}}{{{\text{ЕAL}}}}$ | $\frac{{4.30}}{{1.23}}$ | $\frac{{0.223}}{{0.111}}$ | $\frac{{0.9480}}{{0.137}}$ | $\frac{ - }{{0.0257}}$ | $\frac{ - }{{3.238}}$ | $\frac{{3.89}}{{1.40}}$ | $\frac{{0.052}}{{0.116}}$ | $\frac{{8.186}}{{5.868}}$ | $\frac{{8.31\left( {8.19} \right)}}{{5.85}}$ |
| ЯН, О, 2012 | $\frac{{{\text{ЕAL}}}}{{{\text{ЕAL}}}}$ | $\frac{{2.20}}{{0.70}}$ | $\frac{{0.105}}{{0.136}}$ | $\frac{{0.2310}}{{0.0952}}$ | $\frac{{0.0330}}{{0.0169}}$ | $\frac{{4.158}}{{2.129}}$ | $\frac{{1.50}}{{0.94}}$ | $\frac{{0.092}}{{0.082}}$ | $\frac{{7.858}}{{3.769}}$ | $\frac{{7.67\left( {7.86} \right)}}{{3.77}}$ |
| ВР, В, 2014 | $\frac{{{\text{ЕL}}}}{{{\text{АAL}}}}$ | $\frac{{1.51}}{{1.25}}$ | $\frac{{0.195}}{{0.269}}$ | $\frac{{0.2940}}{{0.0716}}$ | $\frac{{0.0871}}{{0.0266}}$ | $\frac{{{{{6.097}}^{{3*}}}}}{{3.352}}$ | $\frac{ - }{{1.11}}$ | $\frac{ - }{{0.165}}$ | $\frac{{7.607}}{{5.712}}$ | $\frac{{7.61}}{{5.71}}$ |
| ВР, Л, 2014 | $\frac{{{\text{AL}}}}{{{\text{АAL}}}}$ | $\frac{{0.85}}{{1.76}}$ | $\frac{{0.724}}{{0.390}}$ | $\frac{{0.5010}}{{0.0657}}$ | $\frac{{0.1852}}{{0.0200}}$ | $\frac{{{{{6.482}}^{{4*}}}}}{{2.520}}$ | $\frac{ - }{{2.37}}$ | $\frac{ - }{{0.037}}$ | $\frac{{7.327}}{{6.650}}$ | $\frac{{7.32}}{{6.65}}$ |
| ВР, О, 2014 | $\frac{{{\text{AL}}}}{{{\text{АL}}}}$ | $\frac{{1.57}}{{0.39}}$ | $\frac{{0.381}}{{0.357}}$ | $\frac{{0.2060}}{{1.04 \times {{{10}}^{{--3}}}}}$ | $\frac{{0.1107}}{{0.0361}}$ | $\frac{{{{{5.424}}^{{5*}}}}}{{4.549}}$ | $\frac{ - }{ - }$ | $\frac{ - }{ - }$ | $\frac{{6.994}}{{4.939}}$ | $\frac{{6.95}}{{4.94}}$ |
| РШ, З, 2016 | $\frac{{{\text{АAL}}}}{{{\text{ЕAL}}}}$ | $\frac{{2.00}}{{0.68}}$ | $\frac{{0.352}}{{0.189}}$ | $\frac{{0.0330}}{{0.1290}}$ | $\frac{{0.0327}}{{0.0201}}$ | $\frac{{4.120}}{{2.533}}$ | $\frac{{1.90}}{{0.75}}$ | $\frac{{0.170}}{{0.224}}$ | $\frac{{8.020}}{{3.963}}$ | $\frac{{7.99}}{{3.94\left( {3.96} \right)}}$ |
| РШ, В, 2016 | $\frac{{{\text{ЕAL}}}}{{{\text{AAL}}}}$ | $\frac{{2.75}}{{0.90}}$ | $\frac{{0.083}}{{0.430}}$ | $\frac{{0.2280}}{{0.1560}}$ | $\frac{{0.0066}}{{0.0071}}$ | $\frac{{0.828}}{{{{{0.646}}^{{6*}}}}}$ | $\frac{{4.51}}{{1.92}}$ | $\frac{{0.116}}{{0.123}}$ | $\frac{{8.088}}{{3.466}}$ | $\frac{{8.06}}{{3.54\left( {3.47} \right)}}$ |
| РШ, З, 2017 | $\frac{{{\text{ЕA}}}}{{{\text{EAL}}}}$ | $\frac{{2.75}}{{0.66}}$ | $\frac{{0.125}}{{0.175}}$ | $\frac{{0.3440}}{{0.1160}}$ | $\frac{ - }{{0.0143}}$ | $\frac{ - }{{{{{1.301}}^{{6*}}}}}$ | $\frac{{1.419}}{{1.49}}$ | $\frac{{0.106}}{{0.127}}$ | $\frac{{{{{4.169}}^{5}}^{*}}}{{3.451}}$ | $\frac{{4.17}}{{3.54}}$ |
| РШ, В, 2017 | $\frac{{{\text{AA}}}}{{{\text{АA}}}}$ | $\frac{{1.00}}{{1.65}}$ | $\frac{{0.420}}{{0.276}}$ | $\frac{{0.00773}}{{0.0688}}$ | $\frac{ - }{ - }$ | $\frac{ - }{ - }$ | $\frac{{6.98}}{{3.44}}$ | $\frac{{0.076}}{{0.081}}$ | $\frac{{7.980}}{{5.090}}$ | $\frac{{7.96}}{{5.22(5.06)}}$ |
Рис. 2.
Вклад каждой стадии (I, II и L) в общее потребление кислорода, а также скорость окисления ОВ на I и L стадиях в различные сезоны при 20 (a) и 10°С (б). Пояснения в тексте.
Fig. 2. Contribution of each stages (I, II, and L) to total oxygen consumption and the rate of organic matter oxidation at I and L stages in different seasons at 20 (a) and 10°С (б). Explanations in the text.
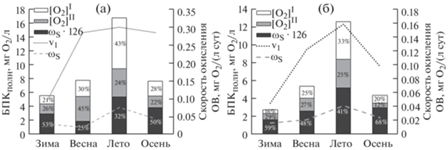
Скорость окисления ОВ на L стадии во все сезоны наблюдений была в несколько раз ниже скорости на I стадии (см. рис. 2). Это связано с тем, что на L стадии происходит медленное окисление ГВ, а на I стадии – сравнительно быстрое окисление лабильных компонентов ОВ. Только летом скорость потребления О2 на L стадии возрастала при 20°С в среднем до 0.076 мг О2/(л · сут) и при 10°С – до 0.041 мг О2/(л · сут). Это может быть связано с интенсивным окислением не только ГВ, но и взвешенного ОВ [11], образующегося в большом количестве в этот период. Скорость окисления ОВ на I стадии была минимальной в зимней воде, а в летней при 20 и 10°С она увеличивалась соответственно в 3.2 и 3.6 раза. Таким образом, вклад каждой стадии в общее потребление О2, а также скорости окисления ОВ на разных стадиях, характеризуют состав и особенности окисления различных компонентов ОВ в разные сезоны года в эвтрофных водоемах.
Принципиальная особенность опытов с водой из эвтрофных водных объектов заключается в различиях скоростей процессов потребления О2 на разных стадиях БПК и особенно на L стадии. В ходе экспериментов до завершения намеченного их срока, часто фиксируется полное исчерпание растворенного О2 на I и II стадиях. Такие случаи были отмечены на 35–70-е сут в экспериментах с водой из КР, ЯН, ВР и РШ. Особенности процессов кинетики БПК и их параметров для конкретных исследованных водных объектов приведены ниже в описаниях каждой из пяти серий экспериментов.
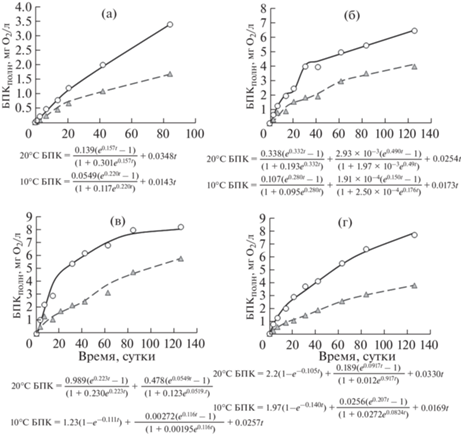
Серия 1 – данные экспериментов с водой из озера Крошнозеро. В зимней и осенней воде сохранялся порядок значений констант скорости w1, но существенно отличались значения параметров [O2]I, и ${{v}_{1}}$: они были выше осенью как при 20, так и при 10°С (табл. 2, рис. 3). Весной и летом средние значения констант скорости БПК при 20 и 10°С отличались мало, а средние значения параметров [O2]I и ${{v}_{1}}$ были выше в 2.1–2.2 раза в опытах при 20°С (см. табл. 2). Развитие II стадии отмечено в экспериментах весной и осенью, а значения потребления О2 на II стадии в целом выше, чем на I стадии.
Рис. 3.
Развитие БПК в экспериментах при 20 и 10°С с водой из оз. Крошнозеро в 2012 г.: а – зима, б – весна, в – лето, г – осень. Обозначения расчетных кривых и экспериментальных данных по БПК при разных температурах на рис. 3б–г и рис. 4–7 такие же, как на рис. 3а. Под рисунками 3–7 приведены уравнения БПК-кривых.
Fig. 3. BOD-curves in the experiments at 20 and 10°С with water from the lake Kroshnozero in 2012: а – winter, б – spring, в – summer; г – autumn. The designations of the BOD calculation curves and experimental data in Figs. 3б–3г and Figs. 4–7 are the same as in Fig. 3a. Under the Fig. 3–7 are different BOD-curve equations.
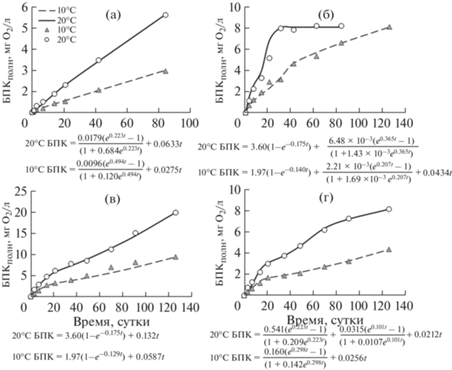
Обнаружены повышенные значения скоростей БПК ωS на L стадии (см. табл. 2). Весной из-за полного потребления О2 на I стадии на развитие L стадии его не осталось. Наибольшие скорости потребления О2 на L стадии отмечены в опытах с летней водой: при 20°С она была в 2.2 раза выше, чем при 10°С. Надо отметить, что в отличие от других озер, где максимальная скорость ${{v}_{1}}$ приходилась на летний период, в КР она наблюдалась весной, что, по-видимому, связано с особенностями продукционных процессов в данном водоеме.
Таким образом, в экспериментах с водой из КР при 10°С повышенное потребление О2 отмечено на I стадии летом, а на L стадии – летом и осенью. При 20°С наибольшие значения потребления О2 выявлены на I стадии весной и летом, на II стадии – весной и осенью, и на L стадии – летом и зимой (см. табл. 2). Высокие значения ωS при 20°С были установлены в экспериментах при отсутствии II стадии. В опытах при 10°С развитие II стадии отмечено лишь весной, и оценить особенности развития БПК в другие сезоны нельзя.
Серия 2 – данные экспериментов с водой из озера Святозеро. В разные сезоны в воде из СВ при разных температурах выявлены небольшие визуальные отличия в развитии БПК в первые 10–15 сут. Такие особенности развития БПК предполагают высокую окислительную способность имеющихся в воде компонентов ОВ независимо от сезонной их изменчивости.
Зимой кинетику I стадии БПК при 20 и 10°С описывали близкие параметры уравнения А-типа, а значения параметров на II стадии при разных температурах отличались (табл. 2, рис. 4). Весной и осенью при разных температурах значения параметров I стадии БПК были близки, но оставались значительно ниже, чем летом во время цветения воды (см. табл. 2). Скорости потребления О2 на L стадии при 20 и 10°С увеличивались от зимы к лету и затем постепенно снижались к осени.
Рис. 4.
Развитие БПК в экспериментах при 20 и 10°С с водой из оз. Святозеро в 2012 г.: а – зима, б – весна, в – лето, г – осень.
Fig. 4. BOD-curves in the experiments at 20 and 10°С with water from the lake Svyatozero in 2012: а – winter, б – spring, в – summer; г – autumn.
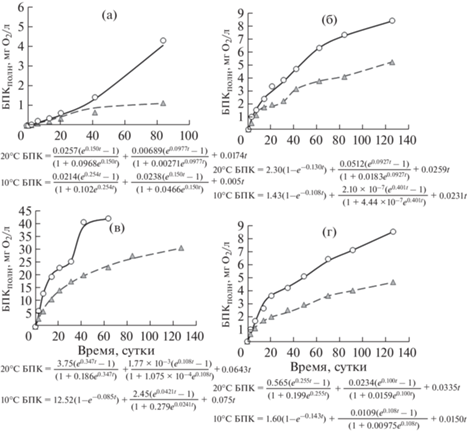
В результате были выявлены следующие особые свойства окисления имеющихся в воде СВ компонентов ОВ. На I стадии БПК предельные значения потребления О2 в зимней воде при 20 и 10°С фактически совпадали, а в вегетационный период при 20°С были почти одинаково пропорционально превышены в 1.6–1.8 раза в сравнении с таковыми при 10°С. По L стадии установлен один порядок скоростей ωS при 20 и 10°С весной и летом, и отличия в 3.5 и 2.2 раза зимой и осенью соответственно.
Интенсивное цветение воды в 2012 г., а также повышенное антропогенное воздействие на водоем, очевидно, нашли отражение не только в повышении концентраций БВ, показателей ОВ и ВВ, но и свойств окисляемых компонентов ОВ. Летом в воде СВ отмечено наибольшее общее потребление О2, которое существенно выше, чем в других озерах, при этом вклад I и II стадий суммарно составлял 90%. А скорость потребления О2 на I стадии при 20°С была в 88 и 64 раза выше, чем весной и осенью соответственно.
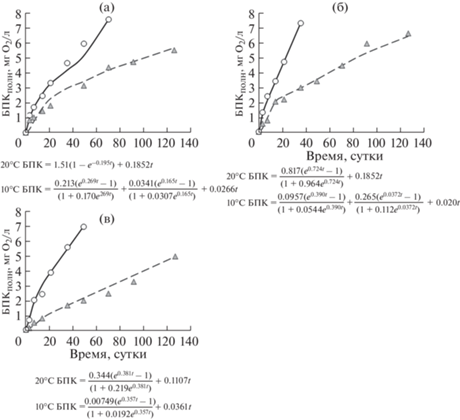
Серия 3 – данные экспериментов с водой из озера Яндомозеро. Развитие I стадии БПК в зимней и весенней воде при 20 и 10°С отражалось параметрами уравнения А-типа, при этом для зимней воды значения этих параметров были ниже, чем для весенней (рис. 5). Летом при 20°С развитие I стадии БПК отражали параметры уравнения А-типа, а при 10°С – уравнения Е-типа, при этом значения всех параметров были значительно выше, чем в другие сезоны. Скорости БПК на L стадии ωS при 20°С в экспериментах с зимней, весенней и осенней водой были близки (в летней воде из-за отсутствия О2 стадия не выражена) и в среднем составляли 0.0314 мг О2/(л · сут), а при 10°С – 0.0186 мг О2/(л · сут) во все четыре сезона.
Рис. 5.
Развитие БПК в экспериментах при 20 и 10°С с водой из озера Яндомозеро в 2012 г.: а – зима, б – весна, в – лето, г – осень.
Fig. 5. BOD-curves in the experiments at 20 and 10°С with water from the lake Yandomozero in 2012: а – winter, б – spring, в – summer; г – autumn.
Таким образом, высокое потребление О2 в воде из озера ЯН отмечено в летней воде при 10°С: на I, II и L стадиях оно составляло соответственно 21, 24 и 55% общего потребления О2, а при 20°С – 53 и 47% на I и II стадиях соответственно (L стадии зафиксировано не было из-за полного расхода О2 на других стадиях).
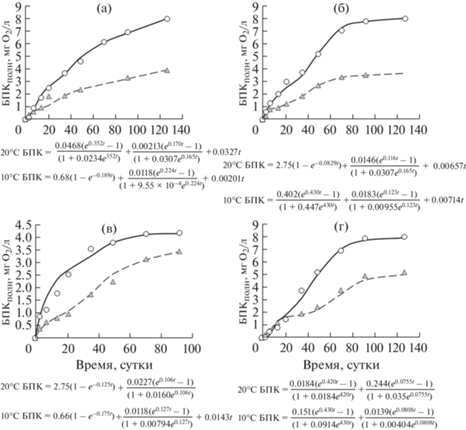
Серия 4 – данные экспериментов с водой из озера Верхнее. При 20°С в 2014 г. в весенней воде из озера ВР развитие I стадии БПК характеризовали уравнения Е-типа, а в летней и осенней воде – уравнения А-типа (рис. 6). Потребление О2 на L стадии воде ВР отражали скорости, которые летом были выше, чем весной и осенью, в 2.1 и 1.7 раза соответственно. Надо отметить, что скорости ωS в воде ВР были наибольшими среди исследованных эвтрофных озер (см. табл. 2). Скорости БПК на L стадии ωS при 10°С в весенней, летней и осенней воде были соответственно в 3.3, 9.3 и 3.1 раза ниже скоростей потребления О2 на L стадии при 20°С.
Рис. 6.
Развитие БПК в экспериментах при 20 и 10°С с водой из оз. Верхнее в 2014 г.: а – весна, б – лето, в – осень.
Fig. 6. BOD-curves in the experiments at 20 and 10°С with water from the lake Verhnee in 2012: а – spring, б – summer; в – autumn.
Таким образом, повышенное потребление О2 на I стадии при 20°С отмечено в весенней и осенней воде, II стадия не зафиксирована, а на L стадии – в летней воде. При 10°С повышенное потребление О2 на I и II стадиях отмечено летом, а на L стадии – осенью (см. табл. 2). В отличие от других исследованных водных объектов вклад L стадии в общее потребление О2 оставался неизменно высоким в течение всех сезонов и в среднем составлял 82%, что связано с высоким содержанием в воде ГВ.
Серия 5 – данные экспериментов с водой из реки Шуя. Анализ данных экспериментов с водой из устья РШ в 2013 г. [12] показал, что общее потребление О2 зимой и осенью составляло соответственно 8.18 и 7.01 мг О2/л (на I стадии – 16.2–21.4%, на II стадии – 35.0–37.0%, на L стадии – 48.8–41.6%), весной – 7.752 мг О2/л (на I и II стадиях – 43.9 и 56.1% соответственно, L стадия не выявлена), и летом – 7.97 мг О2/л (при 100% потреблении на I стадии). Выявлено резкое возрастание роли лабильной фракции в окислении ОВ в летний период, что связано с выраженной высокой трофностью вод р. Шуя.
В 2016 г. развитие БПК на L стадии при 20 и 10°С в зимней воде характеризовалось гораздо большими скоростями, чем в весенней, что связано с пониженным содержанием О2 в исследуемой воде к концу эксперимента (рис. 7). В 2017 г. развитие L стадии БПК зимой отмечалось только при 10°С со скоростью ωS = 0.0143 мг О2/(л · сут). Весной при 20°С из-за полного расхода О2 после 91 сут его потребление прекращалось. В тоже время при наличии в воде кислорода необъяснима остановка его потребления: при 20°С зимой после 50 сут и при 10°С весной после 90 сут (рис. 7). Отсутствие потребления О2 при его наличии в воде отмечалось в опытах 2013 г. с водой из центрального плеса Онежского озера при 10 и 20°С в зимней воде и при 10°С в весенней (после 49–70 сут) [10]. Подобные случаи требуют тщательного изучения для выяснения причин остановки процесса потребления О2 в исследуемых водах.
Рис. 7.
Развитие БПК в экспериментах при 20 и 10°С с водой из р. Шуя в 2016 г. (а – зима, б – весна) и 2017 г. (в – зима, г – весна).
Fig. 7. BOD-curves in the experiments at 20 and 10°С with water from River Shuya in 2016: (а – winter, б – spring) and in 2017 (в – summer, г – autumn).
Сопоставление показателей ОВ и параметров кинетики БПК. Ранее проведенный анализ соответствия значений кинетических параметров в пробах воды из разных районов Онежского озера со значениями показателей ОВ выявил взаимосвязи параметров для I, II и L стадий процесса [11]. В текущем исследовании выделенные взаимосвязи I–III для эвтрофных водных объектов отличались высокими значениями коэффициентов детерминации R2 = 0.81–1.00 (рис. 8).
Рис. 8.
Соответствие значений показателей ОВ и кинетических параметров БПК. Пояснения в тексте.
Fig. 8. Correspondence of organic matter concentrations and kinetic BOD parameters. Explanations in the text.
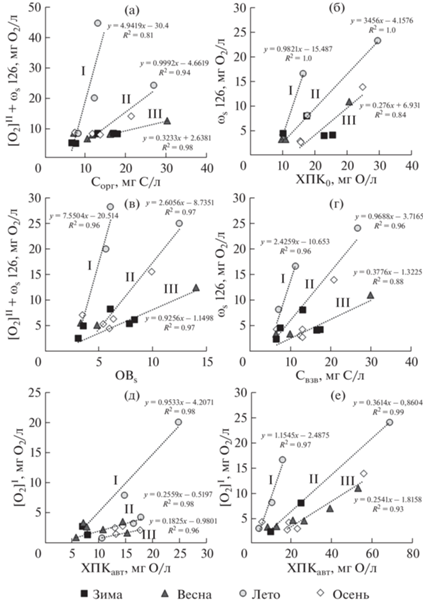
Так как вода из эвтрофных водоемов характеризовалась повышенным потреблением О2, то ряд экспериментов из-за полного его расходования на I и II стадиях заканчивался до завершения планируемых 126 сут (см. табл. 2). В таких случаях скорости потребления О2 на L стадии, оцененные на промежуточных этапах развития БПК, пересчитывались на весь период эксперимента (ωS × 126) и далее использовались для сопоставления c показателям ОВ.
В целом каждую группу взаимосвязей I–III характеризовали изменяющиеся по сезонам исходные концентрации форм ОВ и условия их окисления за период экспериментов, отражаемые развитием нескольких стадий окисления. В нижнюю зону всех взаимосвязей попадали данные с наименьшими значениями показателей ОВ и БПК, однако диапазон отличий параметров БПК был ниже, чем показателей ОВ. Верхнюю и центральную зону взаимосвязей I формировали данные только летних сезонов СВ, КР и РШ (период наибольших значений БПК и активной трансформации форм ОВ в природных водах). Взаимосвязи II определяли данные весенних, летних и осенних сезонов в водоемах ВР, КР и ЯН (в целом при высоких значениях показателей БПК и ОВ). Взаимосвязи III формировали в основном данные весенних и зимних сезонов (ВР, РШ) и в меньшей степени – осенних сезонов ЯН (пониженные значения показателей БПК и сравнительно высокие показатели ОВ).
Существенно изменялись значения тангенсов углов наклона к горизонтальным осям кривых взаимосвязей I–III. Между показателями Сорг и БПК126 они составили соответственно 4.942, 0.999 и 0.323; между ХПК и ωS × 126 – 0.982, 0.346 и 0.276; между ОВS и ([O2]I + ωS × 126) – 7.550, 2.606 и 0.926; между Свзв и ωS × 126 – 2.426, 0.969, 0.378; между ХПКавт и [O2]I– 0.953, 0.256 и 0.183; и между ХПКалл и ωS × 126 – 1.154, 0.361 и 0.254. О более активном окислении ОВ свидетельствуют высокие значения коэффициентов 𝛂 (отношение показателя БПК к показателю ОВ) и тангенсы углов наклона взаимосвязей I в сравнении с меньшими их значениями во взаимосвязях II и III. В каждой паре показателей БПК и ОВ при переходе от взаимосвязи I ко II и далее к III, значения показателей БПК и 𝛂, как правило, снижались, а ОВ – возрастали. Максимальные значения коэффициента 𝛂 характеризовали взаимосвязи I между интегральными показателями: БПК126 и Сорг (𝛂 = 3.387) и между общим потреблением О2 на I-й и L стадиях и содержанием ОВS (𝛂 = 4.600). Высокий угол наклона (2.426) взаимосвязи I между потреблением О2 на L стадии и содержанием Сстаб отражал условия окисления не только ГВ, но и ОВвзв в воде эвтрофных водоемов, особенно в летний период, что подчеркивает важную роль ВВ в кинетике БПК.
ЗАКЛЮЧЕНИЕ
В статье представлены результаты совместных сезонных исследований содержания разных форм ОВ и их способности к окислению в длительных БПК-экспериментах с водой из разных эвтрофных водных объектов (озера Святозеро, Крошнозеро, Яндомозеро, Верхнее и устьевая зона р. Шуя). Воды всех водоемов испытывают разное антропогенное воздействие, а также имеют состав ОВ разного генезиса, что в итоге отражается на процессе его окисления в течение длительных БПК-экспериментов.
Полученные в исследовании материалы позволяют охарактеризовать по сезонам состояние имеющихся в воде разных форм ОВ, их трансформацию и способность к окислению. По окислению лабильных компонентов ОВ (соотношение [O2]I/ПО) водоемы располагаются в следующей последовательности: СВ → ЯН → РШ → КР → ВР по снижению этого соотношения (2.03, 0.58, 0.53, 0.15 и 0.02 соответственно) при отличиях в 100 раз между крайними водоемами в этом ряду. Выявлен ряд общих особенностей, характерных для всех эвтрофных водных объектов: наблюдается резкое увеличение потребления О2 от зимы к лету; в зависимости от сезона изменяется вклад каждой стадии в БПКполн (зимой и осенью наибольший вклад оказывает L стадия, весной – II стадия, а летом – I стадия); скорость окисления ОВ на L стадии во все сезоны несколько раз ниже скорости на I стадии.
Разностороннюю оценку условий окисления компонентов ОВ можно получить по обобщенным данным соответствия разных показателей ОВ кинетическим параметрам БПК. По выбранным парам значений ОВ и БПК построены взаимосвязи I–III, которые отражают спектр сезонных особенностей изменения условий окисления разных ОВ по всем исследованным водоемам и сезонам как на основе общих показателей, так и показателей для отдельных стадий.
Финансовое обеспечение исследований осуществлялось из средств федерального бюджета в рамках государственного задания Института водных проблем Севера Кар НЦ РАН, а в ИО РАН им. П.П. Ширшова в рамках темы № 0128-2021-0016 “Взаимодействие биогеосфер в Мировом океане”. Исследования выполнены на научном оборудовании Центра коллективного пользования Кар НЦ РАН.
Список литературы
Бульон В.В. Первичная продукция планктона внутренних водоемов. Л.: Наука, 1983. 150 с.
Даценко Ю.С. Эвтрофирование водохранилищ. Гидролого-гидрохимические аспекты. М.: ГЕОС, 2007. 252 с.
Ефремова Т.А., Зобкова М.В. Содержание, распределение и соотношение основных компонентов органического вещества в Онежском озере // Тр. Кар. НЦ РАН. 2019. № 9. С. 60–75. https://doi.org/10.17076/lim1017
Ефремова Т.А., Сабылина А.В., Лозовик П.А. Углеводы и липиды в поверхностных водах Карелии // Вода: Химия и экология. 2014. № 1. С. 11–19.
Зобков М.Б., Зобкова М.В. Устройство для определения органического углерода в воде с фотохимическим персульфатным окислением в системе непрерывного газового потока и ИК-Фурье спектрометрическим детектированием // Заводская лаборатория. Диагностика материалов. 2015. № 8. С. 10–15.
Зобкова М.В., Ефремова Т.А., Лозовик П.А., Сабылина А.В. Органическое вещество и его компоненты в поверхностных водах гумидной зоны // Успехи современного естествознания. 2015. № 12. С. 115–120.
Каталог озер и рек Карелии / Ред. Н.Н. Филатов, А.В. Литвиненко. Петрозаводск, 2001. 290 с.
Леонов А.В. Обобщение, типизация и кинетический анализ кривых потребления кислорода по данным БПК-опытов // Океанология. 1974. Т. 16, вып. 1. С. 82–87.
Леонов А.В., Зобкова М.В. Общая характеристика развития БПК в длительных экспериментах с водой из разнотипных водных объектов Карелии // Тр. Кар. НЦ РАН. 2019. № 3. С. 61–79. https://doi.org/10.17076/lim952
Леонов А.В., Зобкова М.В. Значения кинетических параметров БПК длительных экспериментов (на примере анализа данных с разными интегральными пробами воды из центральной части Онежского озера) // Тр. Кар. НЦ РАН. 2020. № 4. С. 40–61. https://doi.org/10.17076/lim1164
Леонов А.В., Зобкова М.В. Соответствие значений параметров долгосрочной кинетики БПК концентрациям компонентов органического вещества в воде из разных акваторий Онежского озера // Тр. Кар. НЦ РАН. 2020. № 9. С. 40–64. https://doi.org/10.17076/lim1287
Леонов А.В., Зобкова М.В. Применение длительных БПК-экспериментов для сезонных исследований окисления компонентов органического вещества в воде из разных районов Онежского озера // Тр. Кар. НЦ РАН. 2021. № 9. С. 37–57. https://doi.org/10.17076/lim1369
Леонов А.В., Лозовик П.А., Икко О.И. Использование экспериментальных данных по биохимическому потреблению кислорода для корректной оценки состояния водных объектов и качества природных вод // Тр. Кар. НЦ РАН. 2018. № 3. С. 11–30. https://doi.org/10.17076/lim726
Лозовик П.А., Куликова Т.П., Мартынова Н.Н. Мониторинг водных объектов Карелии в 1992–2000 гг.// Гидроэкологические проблемы Карелии и использование водных ресурсов. Петрозаводск: ИВПС Кар. НЦ РАН, 2003. С. 135–144.
Лозовик П.А., Мусатова М.В. Методика разделения органического вещества природных вод адсорбцией на диэтиламиноэтилцеллюлозе на автохтонную и аллохтонную составляющие // Вестник МГОУ. Сер. Естественные науки. 2013. № 3. С. 63–68.
Лозовик П.А., Мусатова М.В., Рыжаков А.В. Автохтонное и аллохтонное органическое вещества в разнотипных озерах Карелии // Вода, химия и экология. 2014. № 4. С. 11–17.
Лозовик П.А., Рыжаков А.В., Сабылина А.В. Внутриводоемные процессы трансформации, круговорота и образования веществ в природных водах // Тр. КарНЦ РАН. 2011. № 4. С. 21–28.
Озера Карелии. Справочник. / Под ред. Н.Н. Филатова, В.И. Кухарева. Петрозаводск: КарНЦ РАН, 2013. 464 с.
Скопинцев Б.А. Органическое вещество в природных водах (водный гумус) // Тр. ГОИН. 1950. Вып. 17 (29). 290 с.
Creed I.F., Bergström A.K., Trick C.G., Grimm N.B., Hessen D.O., Karlsson J., Kidd K.A., Kritzberg E., McKnight D.M., Freeman E.C., Senar O.E., Andersson A., Ask J., Berggren M., Cherif M., Giesler R., Hotchkiss E.R., Kortelainen P., Palta M.M., Vrede T. & Weyhenmeyer G.A. Global change – driven effects on dissolved organic matter composition: Implications for food webs of northern lakes // Global change biology. 2018. V. 24. № 8. pp. 3692–3714. https://doi.org/10.1111/gcb.14129
Ittekkot V. Variations of dissolved organic matter during a plankton bloom: qualitative aspects based on sugar and amino acids analyses // Mar. Chem. 1982. V. 11. pp. 143–158. https://doi.org/10.1016/0304-4203(82)90038-X
Дополнительные материалы отсутствуют.
Инструменты
Известия Русского географического общества


