Журнал высшей нервной деятельности им. И.П. Павлова, 2019, T. 69, № 1, стр. 98-112
Дифференциально экспрессирующиеся гены семейства Slc6a как маркеры измененной функции нейромедиаторных систем мозга при патологических состояниях у мышей
В. Н. Бабенко 1, 2, 3, Д. А. Смагин 1, 2, И. Л. Коваленко 1, 2, А. Г. Галямина 1, 2, Н. Н. Кудрявцева 1, 2, *
1 Лаборатория моделирования нейропатологий
Новосибирск, Россия
2 Сектор нейрогенетики социального поведения
Новосибирск, Россия
3 Лаборатория молекулярной генетики человека,
ФИЦ Институт цитологии и генетики СО РАН
Новосибирск, Россия
* E-mail: n.n.kudryavtseva@gmail.com
Поступила в редакцию 02.08.2017
После доработки 01.02.2018
Принята к публикации 05.03.2018
Аннотация
Исследуются нейромолекулярные механизмы формирования патологии поведения, развивающейся у самцов мышей под влиянием повторного опыта агрессии, а также смешанного тревожно-депрессивного расстройства под влиянием хронического социального стресса. Проверяется предположение о возможности использования измененной экспрессии генов семейства Slc6a, кодирующих белки-транспортеры моноаминов, ГАМК, таурина, глицина и других аминокислот в качестве показателя изменения работы нейромедиаторных систем в пяти отделах мозга, вовлеченных в процессы формирования патологических форм поведения. Транскриптомы отделов мозга контрольных, агрессивных и депрессивных мышей были секвенированы ЗAO Геноаналитика (http://genoanalytica.ru/, Moscow, Russia). Результаты анализа (RNA-Seq) выявили различные изменения экспрессии генов транспортеров семейства Slc6a в зависимости от отдела мозга, патологии поведения и функции белка, кодируемого соответствующим геном. В частности, показано повышение экспрессии большинства ГАМКергических Slc6a генов в гипоталамусе, гиппокампе и стриатуме депрессивных мышей и в гипоталамусе агрессивных самцов. В ядрах шва среднего мозга и вентральной тегментальной области специфически и противоположно изменили свою экспрессию моноаминергические гены. Делается вывод, что измененная экспрессия генов Slc6a, кодирующих соответствующие транспортеры, может быть маркером измененной функции нейромедиаторных систем при патологических состояниях.
ВВЕДЕНИЕ
Гены семейства Slc6а (Slc6a*) кодируют переносчики аминокислот, таких как гамма-аминомасляная кислота (далее ГАМК), глицин и таурин, являющиеся ингибиторными нейротрансмиттерами и регулирующие нейрональную возбудимость в ЦНС, а также переносчики моноаминов – серотонина, дофамина и норадреналина, имеющих разные функции и паттерны активности. Эти транспортеры являются мишенью для широкого круга терапевтических препаратов при лечении различных психоневрологических болезней, включая депрессию, тревогу, гиперактивность и дефицит внимания, эпилепсию [обзор, Kristensen et al., 2011]. Более того, психостимулянты, такие как кокаин и амфетамин, имеют первичной мишенью именно переносчики нейротрансмиттеров, кодируемых генами семейства Slc6а*. При поиске способов лечения многих заболеваний внимание чаще всего обращается именно на этот этап последовательных изменений нейромедиаторной регуляции. Так, в ответ на длительное снижение серотонинергической активности, как это наблюдается при развитии депрессии, вводятся препараты – антидепрессанты, которые блокируют обратный захват, таким образом приводя к увеличению содержания серотонина в синаптической щели.
Использование переносчиков моноаминов в качестве биомаркеров для визуализации моноаминергического кругооборота [Fowler et al., 1999; Laakso, Hietala, 2000; Huang et al., 2002; Meyer, 2007; обзор, Kristensen et al., 2011] привело к разработке высокоселективных радиоактивных меток – индикаторов in vivo, используемых при позитронно-эмиссионной томографии и однофотонной эмиссионной компьютерной томографии [Houle et al., 2000; Wilson et al., 2000]. Было показано, что моноамины находятся исключительно в соответствующих моноаминергических нейронах, поэтому их распределение в мозге связывается с функцией этих систем. Для ГАМК и глицина распределение в головном мозге носит более сложный характер, включая различия между отделами мозга, при этом отмечается их локализация в астроцитах [Zahniser, Doolen, 2001; Chen et al., 2004; Bak et al., 2006]. Основная роль белков-переносчиков Slc6а состоит в быстром поглощении из внеклеточного пространства высвобожденного нейротрансмиттера, оказавшего свое действие на соответствующие рецепторы, в результате чего происходит его инактивация с помощью фермента моноаминооксидазы или переносом в пресинаптические везикулы для дальнейшего использования.
Нами было показано, что под влиянием повторного опыта агрессии или хронического социального стресса мозг претерпевает изменения в метаболизме и рецепции многих медиаторов. Впервые установлено, что на фоне активации дофаминергических систем мозга [Кудрявцева, Бакштановская, 1991] у агрессивных самцов происходит увеличение экспрессии дофаминергических генов (Th, Dat1, Snca) в вентральной тегментальной области [Filipenko et al., 2001; Bondar et al., 2009], в которой находится большое количество дофаминергических нейронов, и ответственной за механизмы положительного подкрепления. У агрессивных животных в ядрах шва среднего мозга [Smagin et al., 2013], содержащих максимальное скопление серотониновых нейронов, развивается гипофункция серотонинергической активности [Кудрявцева, Бакштановская, 1991], которая сопровождается снижением экспрессии генов, кодирующих белки, участвующие в синтезе, инактивации и рецепции серотонина (Tph2, Sert, Maoa, Htr1a). У животных, находящихся длительное время под влиянием хронического социального стресса, происходит снижение активности серотонинергической и дофаминергической систем в мозге. Было показано вовлечение генов, кодирующих белки, участвующие в метаболизме ГАМКергической и глутаматергической систем в стриатуме, при этом формируются неврологические симптомы, такие как повторяющиеся стереотипии и парезы у обеих групп животных с альтернативным опытом социального поведения – с повторным опытом агрессии или социальных поражений [Смагин и др., 2018]. Были выявлены изменения экспрессии этих же генов в вентральной тегментальной области депрессивных животных [Галямина и др., 2017], в частности, изменение экспрессии генов, кодирующих белки-транспортеры дофамина – Slc6a3, серотонина – Slc6a4 и глутамата – Slc17a7.
В этой работе предполагается подробно изучить возможное изменение экспрессии генов семейства Slc6а*, кодирующих белки-транспортеры, вовлеченные в метаболизм медиаторов. Внимание к этим транспортерам как маркерам нейромедиаторной системы вызвано тем, что изменение экспрессии этих генов может быть следствием изменения медиаторной активности в ответ на средовое воздействие различного происхождения, и может отражать активацию или ингибицию работ нейромедиаторных систем в процессе развития патологии поведения, которая формируется, как это было показано нами в многолетних исследованиях ранее, по типу психоза у животных под влиянием повторного опыта агрессии [обзоры, Kudryavtseva, 2006; Кудрявцева, 2013] и тревожно/депрессивного расстройства под влиянием хронического социального стресса [Kudryavtseva, et al., 1991; обзор, Августинович и др., 2004]. Кроме того, уже известны изменения в показателях, оценивающих синтез и катаболизм некоторых медиаторов, в частности, серотонина и дофамина в структурах головного мозга у животных в используемой нами экспериментальной парадигме.
В настоящей работе по данным полнотранскриптомного анализа (RNA-Seq) предполагается выявить дифференциально экспрессирующиеся гены, кодирующие транспортеры глутамата, ГАМК, катехоламинов (дофамина, адреналина и норадреналина), серотонина и др., из семейства Slc6а*, в гипоталамусе, гиппокампе, ядрах шва среднего мозга, вентральной тегментальной области, дорсальном стриатуме, и рассмотреть гипотезу об использовании их в качестве маркеров активности нейромедиаторных систем в отделах мозга, вовлеченных в процессы формирования патологических форм поведения.
МЕТОДИКА
Животные. Эксперименты проводили на самцах мышей линии С57BL/6 (возраст 2.5 мес., масса тела 26–28 г) в Конвенциональном виварии Института цитологии и генетики СО РАН. Животные были привезены из Питомника лабораторных животных Института биоорганической химии РАН (Пущино, Московская область). Воду и корм (гранулы) животные получали ad libitum. Световой режим был равен 12:12 часам, тестирование проводили во второй половине дня. Все процедуры осуществляли в соответствии с международными правилами проведения экспериментов с животными (Directive 2010/63/EU of the European Parliament and of the Council on the protection of animals used for scientific purposes). Применяемая модель для изучения поведения и формирования патологических состояний и дизайны экспериментов были одобрены Научной комиссией N9 Института цитологии и генетики СО РАН (март, 24, 2010, N 613).
Формирование альтернативных типов социального поведения у самцов мышей
Для формирования альтернативных типов социального поведения у самцов мышей использовали модель сенсорного контакта [Kudryavtseva, 1991; Kudryavtseva et al., 2014]. Животных попарно помещали в экспериментальные клетки, разделенные прозрачной перфорированной перегородкой на два равных отсека, позволяющей мышам видеть, слышать, воспринимать запахи друг друга, но предотвращающей физический контакт. Ежедневно во второй половине дня перегородку убирали на 10 мин, что приводило к межсамцовым конфронтациям. Во время первых трех тестов выявлялись победители (агрессоры, агрессивные мыши) и побежденные особи (жертвы, депрессивные мыши) при взаимодействии с одним и тем же партнером. В последующие дни побежденного самца после теста пересаживали в другую клетку к незнакомому агрессивному партнеру, сидящему за перегородкой. Если интенсивные атаки со стороны агрессивного самца длились более трех мин, взаимодействие мышей прекращали, устанавливая между ними перегородку и предотвращая таким образом физическое повреждение самцов, терпящих социальное поражение.
В эксперименте были исследованы три группы животных: 1. депрессивные самцы, потерпевшие социальные поражения в течение 20 дней агонистических взаимодействий, у которых под влиянием хронического социального стресса развивается смешанное тревожно/депрессивное расстройство [обзор, Августинович и др., 2004] с признаками выраженного депрессивного состояния, а также тревоги и страха; 2. агрессивные самцы с повторным опытом агрессии в течение 20 дней, которые демонстрировали повышенную агрессивность, тревожность и двигательную активность [Kudryavtseva, 2006]; 3. контрольные животные – особи без последовательного опыта агонистических взаимодействий [Kudryavtseva et al., 2014].
Животных с альтернативным опытом социального поведения декапитировали на следующий день после последней конфронтации, контроль – через 5 дней индивидуального содержания в клетках. Один и тот же исследователь в соответствии с атласом мозга [Allen Mouse Brain Atlas; http://mouse.brain-map.org/static/atlas] выделял исследуемые отделы мозга. Все пробы маркировали и помещали в раствор (RNAlater) для предотвращения деградации РНК. До секвенирования пробы хранили при температуре –70°C.
При выборе отделов головного мозга учитывали их преимущественную функцию и локализацию нейронов медиаторных систем. Мультифункциональная область ядер шва среднего мозга содержит тела серотонинергических нейронов. Вентральная тегментальная область (ВТО) с тесно примыкающей к ней черной субстанцией содержит преимущественно тела нейронов мезолимбической дофаминергической системы, которая принимает участие в механизмах положительного подкрепления, мотиваций, эмоций, а также регуляции моторного поведения. Дорсальный стриатум входит в состав нигростриарной дофаминергической системы и отвечает за модуляцию двигательных функций, моторную активность и стереотипное поведение. Гипоталамус регулирует стресс-реактивность и многие другие физиологические процессы. Гиппокамп принадлежит к лимбической системе и играет важную роль в нейрогенезе, механизмах формирования эмоций, хранения и консолидации памяти.
Метод RNA-Seq
Транскриптомный анализ (RNA-Seq) пяти отделов головного мозга у агрессивных и депрессивных самцов проводили на базе ЗАО “Геноаналитика” (http://genoanalytica.ru, Москва), при этом использовали более 20 млн. прочтений ДНК. мРНК экстрагировали с использованием кита Dynabeads mRNA Purification Kit (Ambion, Thermo Fisher Scientific, Waltham, MA, USA). cDNA-библиотеки были сконструированы с использованием протокола производителя NEBNext mRNA Library PrepReagent Set for Illumina (New England Biolabs, Ipswich, MA, USA). Секвенирование транскриптома выполнялось на оборудовании Illumina. Картирование полученных ридов (прочтений) ДНК из файлов в формате fastq на референсный геном мыши GRCm38.p3 выполнялось с помощью программы TopHat [Trapnell et al., 2009]. Анализировали экспрессию более 30 000 генов в отделах мозга животных. Категории генных онтологий списков дифференциально экспрессирующихся генов определяли с использованием биоинформатического интернет-ресурса (DAVID Bioinformatics Resources 6.7 http://david.abcc.ncifcrf.gov). Программа Cufflinks была использована для того, чтобы оценить уровень экспрессии генов в единицах FPKM (fragments per kilobase of transcript per million mapped reads) при сравнении контрольной и опытных групп. Только аннотированные гены брались для последующего анализа. Дифференциально экспрессирующимися считали гены, уровень экспрессии которых статистически значимо различался у контрольных и подопытных мышей (p < 0.05). Решение о статистически значимых различиях экспрессии принималось также с использованием поправки на множественные сравнения (q-значения – скорректированные p-значения по методу Беньямини–Хохберга (FDR)). Для биоинформатической обработки исследуемого массива транскриптомных данных был использован также корреляционный анализ.
Для исследования отбирались животные с наиболее выраженными признаками развития патологии агрессивного поведения, демонстрирующие неконтролируемую агрессивность, не поддающуюся коррекции ситуационными факторами, с одной стороны, и животные с выраженным депрессивно-подобным поведением, с другой.
При описании и анализе полученных результатов использовались биоинформатические ресурсы: база данных генов человека (The Human Gene Database, http://www.genecards.org/); онлайн-каталог генов человека и генетических болезней (OMIM, http://omim.org/); база данных болезней человека (MalaСards, http://www.malacards.org).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Согласно данным, полученным с использованием полнотранскриптомного секвенирования, из 20 генов, кодирующих Slc6а* транспортеры, изменили свою экспрессию под влиянием повторного опыта агонистических взаимодействий в том или ином отделе 15. Не изменили экспрессию ген Slc6a10, кодирующий белок креатин, гены Slc6a14, Slc6a15, Slc6a16 и Slc6a19, кодирующие белки, осуществляющие, согласно данным, приведенным в обзоре [Kristensen et al., 2011], транспорт нейтральных аминокислот, преимущественно в периферических тканях. Анализ показал, что изменения экспрессии генов являются специфичными как для отделов мозга, так и обусловливаются социальным опытом животных (табл. 1).
Таблица 1.
Дифференциально экспрессирующиеся гены семейства Slc6а* в различных отделах мозга у агрессивных и депрессивных животных Table 1. Differentially expressed Slc6a* genes in different brain regions in aggressive and depressive mice
| Гены | Описание функции генов, области мозга | Агрессивные | Депрессивные |
|---|---|---|---|
| Гипоталамус | |||
| Slc6a1 | solute carrier family 6 (neurotransmitter transporter, GABA), member 1 | Δ | Δ Δ Δ* |
| Slc6a6 | solute carrier family 6 (neurotransmitter transporter, taurine), member 6 | Δ Δ* | |
| Slc6a7 | solute carrier family 6 (neurotransmitter transporter, L-proline), member 7 | Δ Δ | Δ Δ Δ* |
| Slc6a9 | solute carrier family 6 (neurotransmitter transporter, glycine), member 9 | Δ | |
| Slc6a11 | solute carrier family 6 (neurotransmitter transporter, GABA), member 11 | Δ | Δ Δ |
| Slc6a12 | solute carrier family 6 (neurotransmitter transporter, betaine/GABA), member12 | $\blacktriangledown \blacktriangledown \blacktriangledown \blacktriangledown $* | |
| Slc6a13 | solute carrier family 6 (neurotransmitter transporter, GABA), member 13 | $\blacktriangledown \blacktriangledown \blacktriangledown \blacktriangledown $* | |
| Slc6a17 | solute carrier family 6 (neurotransmitter transporter), member 17 | Δ Δ* | |
| Slc6a18 | solute carrier family 6 (neurotransmitter transporter), member 18 | $\blacktriangledown \blacktriangledown \blacktriangledown $* | $\blacktriangledown \blacktriangledown \blacktriangledown \blacktriangledown $* |
| Slc6a20b | solute carrier family 6 (neurotransmitter transporter), member 20B | $\blacktriangledown \blacktriangledown \blacktriangledown \blacktriangledown $* | |
| Ядра шва среднего мозга | |||
| Slc6a2 | solute carrier family 6 (neurotransmitter transporter, noradrenalin), member 2 | $\blacktriangledown \blacktriangledown \blacktriangledown $* | |
| Slc6a4 | solute carrier family 6 (neurotransmitter transporter, serotonin), member 4 | $\blacktriangledown \blacktriangledown \blacktriangledown \blacktriangledown $* | $\blacktriangledown \blacktriangledown \blacktriangledown \blacktriangledown $* |
| Slc6a5 | solute carrier family 6(neurotransmitter transporter, glycine), member 5 | Δ | |
| Slc6a17 | solute carrier family 6 (neurotransmitter transporter), member 17 | $\blacktriangledown \blacktriangledown $ | $\blacktriangledown \blacktriangledown $ |
| Вентральная тегментальная область | |||
| Slc6a2 | solute carrier family 6 (neurotransmitter transporter, noradrenalin), member 2 | Δ Δ | $\blacktriangledown \blacktriangledown \blacktriangledown $* |
| Slc6a3 | solute carrier family 6 (neurotransmitter transporter, dopamine), member 3 | Δ Δ Δ Δ* | |
| Slc6a4 | solute carrier family 6 (neurotransmitter transporter, serotonin), member 4 | Δ Δ Δ Δ* | |
| Slc6a5 | solute carrier family 6 (neurotransmitter transporter, glycine), member 5 | $\blacktriangledown \blacktriangledown \blacktriangledown \blacktriangledown $* | |
| Slc6a8 | solute carrier family 6 (neurotransmitter transporter, creatine), member 8 | $\blacktriangledown $ | |
| Гиппокамп | |||
| Slc6a1 | solute carrier family 6 (neurotransmitter transporter, GABA), member 1 | Δ Δ | |
| Slc6a7 | solute carrier family 6 (neurotransmitter transporter, L-proline), member 7 | Δ Δ Δ* | |
| Slc6a13 | solute carrier family 6 (neurotransmitter transporter, GABA), member 13 | Δ | |
| Slc6a17 | solute carrier family 6 (neurotransmitter transporter), member 17 | Δ | |
| Slc6a18 | solute carrier family 6 (neurotransmitter transporter), member 18 | $\blacktriangledown \blacktriangledown $ | |
| Дорсальный стриатум | |||
| Slc6a7 | solute carrier family 6 (neurotransmitter transporter, L-proline), member 7 | Δ Δ Δ Δ* | |
| Slc6a9 | solute carrier family 6 (neurotransmitter transporter, glycine), member 9 | Δ | |
| Slc6a11 | solute carrier family 6 (neurotransmitter transporter, GABA), member 11 | Δ Δ Δ Δ* | |
| Slc6a13 | solute carrier family 6 (neurotransmitter transporter, GABA), member 13 | Δ Δ | |
| Slc6a20b | solute carrier family 6 (neurotransmitter transporter), member 20B | Δ | |
Примечание: по сравнению с контролем: повышение экспрессии: Δ – р < 0.05; Δ Δ – р < 0.01; Δ Δ Δ – р < 0.001; Δ Δ Δ Δ – р < 0.0001. Cнижение экспрессии: $\blacktriangledown $ – р < 0.05. $\blacktriangledown \blacktriangledown $ – р < 0.01; $\blacktriangledown \blacktriangledown \blacktriangledown $ – р < 0.001; $\blacktriangledown \blacktriangledown \blacktriangledown \blacktriangledown $ – р < 0.0001; * – q < 0.05. Note: Δ – increase, $\blacktriangledown $ – decrease vs control; Δ – р < 0.05; Δ Δ – р < 0.01; Δ Δ Δ – р < 0.001; Δ Δ Δ Δ – р < 0.0001; $\blacktriangledown $ – р < 0.05. $\blacktriangledown \blacktriangledown $ – р < 0.01; $\blacktriangledown \blacktriangledown \blacktriangledown $ – р < 0.001; $\blacktriangledown \blacktriangledown \blacktriangledown \blacktriangledown $ – р < 0.0001; * – q < 0.05.
Гипоталамус
В гипоталамусе (рис. 1, табл. 1) агрессоров у генов Slc6a1 (p < 0.019), Slc6a7 (p ≤ 0.007), Slc6a11 (p < 0.040) экспрессия генов увеличивалась, а у гена Slc6a18 (p < 0.0002; q < 0.01) снизилась. У жертв экспрессия генов Slc6a1 (p < 0.001; q ≤ 0.009), Slc6a6 (p < 0.006; q < < 0.033), Slc6a7 (p < 0.0005; q ≤ 0.005), Slc6a9 (p < 0.021), Slc6a11 (p ≤ 0.011), Slc6a17 (p < < 0.009; q < 0.044) увеличивалась, в то время экспрессия генов Slc6a12 (p < 0.0001; q < < 0.001), Slc6a13 (p < 0.0001; q < 0.001), Slc6a18 (p < 0.0001; q < 0.001) и Slc6a20b (p < 0.0001; q < 0.001) снижалась.
Рис. 1.
Дифференциально экспрессирующиеся гены Slc6a в гипоталамусе и ядрах шва среднего мозга. Серые столбы – контроль; темные столбы – агрессивные или депрессивные мыши. * – p < 0.05; ** – p < 0.01; *** – p < 0.001 по отношению к контролю. Данные представлены в единицах FPKM.
Fig. 1. Differentially expressed Slc6a genes in the hypothalamus and midbrain raphe nuclei. Grey columns – the control; dark columns – aggressive or depressive mice. Data are presented in FPKM units. * – p < 0.05; ** – p < 0.01; *** – p < 0.001 vs the controls.
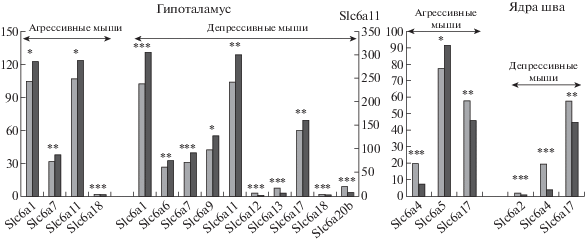
Надо отметить, что некоторые дифференциально экспрессирующиеся гены у агрессивных самцов были таковыми и у депрессивных животных. Гены Slc6a1 и Slc6a11 кодируют транспортеры ГАМК, и увеличение их экспрессии может свидетельствовать об активации ГАМКергической системы. В своих исследованиях мы также отмечали, что в гипоталамусе животных обеих групп у многих генов, кодирующих, например, коллагеновые гены или рибосомальные и митохондриальные гены [Smagin et al., 2016; Smagin et al., 2018a,b], экспрессия сходным образом была увеличена, что связывали с неспецифическими эффектами длительного социального стресса, который отслеживали по увеличению состояния тревожности у животных обеих групп [Kudryavtseva et al., 2002; Kudryavtseva, Avgustinovich, 1998; Августинович и др., 2004]. Так же ведет себя ген Slc6a7, кодирующий белок пролин, который синтезируется из глутаминовой кислоты и участвует в формировании коллагена. При этом экспрессия гена Slc6a18, кодирующего переносчик нейтральных аминокислот, была снижена.
Среди специфически изменивших экспрессию у депрессивных животных была отмечена up-регуляция генов Slc6a6 и Slc6a9, кодирующих белки, осуществляющие транспорт таурина и глицина соответственно, которые обладают выраженной тормозной функцией в мозге. Предполагается, что таурин ингибирует синаптическую передачу, обладает противосудорожной активностью и способствует улучшению энергетических процессов. Глицин, связываясь с рецепторами (кодируемых генами Glra1, Glra2, Glra3, Glrb), вызывает “тормозное” воздействие на нейроны, уменьшая выделение возбуждающих аминокислот, таких как глутаминовая кислота, и повышает выделение ГАМК.
В то же время у двух ГАМКергических генов с исходно небольшой экспрессией, Slc6a12 и Slc6a13, а также у гена Slc6a20b, кодирующего транспортер глицина, экспрессия снижалась. Мы можем предположить, что разнонаправленные изменения могут быть обусловлены работой этих генов в различных ядрах гипоталамуса. То же самое можно подозревать и относительно генов Slc6a17 и Slc6a18, кодирующих белки – переносчики нейтральных аминокислот. Отметим, что ген Slc6a17 обладает широкой специализацией и кодирует везикулярный транспортер, селективный для пролина, глицина, лейцина и аланина. Максимальной экспрессией обладают гены Slc6a1 и Slc6a11, кодирующие транспортные белки ГАМК. При этом у гена Slc6a11 обнаружена выраженная экспрессия только в гипоталамусе.
Несмотря на сходство изменений экспрессии некоторых генов у животных с альтернативным опытом социального поведения, у депрессивных мышей, которые подвергаются более сильному стрессу, число дифференциально экспрессирующихся генов больше.
Ядра шва среднего мозга
В ядрах шва среднего мозга (рис. 1, табл. 1), в котором находится скопление тел серотонинергических нейронов, у агрессивных самцов под влиянием повторного опыта агрессии произошло снижение экспрессии гена Slc6a4 (p < 0.0001; q < 0.005), кодирующего транспортер серотонина, и гена Slc6a17 (p << 0.0034), в то же время экспрессия гена Slc6a5 (p < 0.04), кодирующего транспортер глицина, была повышена. У депрессивных самцов была снижена экспрессия гена Slc6a2 (p < 0.0003; q < 0.025), кодирующего транспортер норадреналина, и, также как и у агрессивных самцов, гена Slc6a4 (p < 0.0001; q ≤ 0.005) и Slc6a17 (p ≤ 0.0061).
Надо отметить, что для обеих групп ранее другим методом (RT-PCR) в аналогичном эксперименте было показано также снижение экспрессии гена Slc6a4, кодирующего серотониновый транспортер [Boyarskikh et al., 2013; Smagin et al., 2013], что отражает хорошую воспроизводимость результатов в используемой нами модели. Кроме того, было показано снижение экспрессии гена Tph2, кодирующего основной фермент синтеза серотонина триптофангидроксилазу, а также генов Htr2a, Htr3a и Htr5b, кодирующих серотониновые рецепторы. Снижение экспрессии этих генов подтверждало полученные ранее данные [Kudryavtseva, 2006; обзор, Августинович и др., 2004], свидетельствующие о снижении серотонинергической активности у животных с развитием патологии агрессивного поведения, как мы предполагаем, по типу психозов, и у животных со смешанным тревожно/депрессивным расстройством, которое регистрировали по снижению уровня серотонина или его метаболита. Предполагались разные механизмы, казалось бы, сходного снижения серотонинергической активности у групп животных с альтернативным опытом социального поведения. У агрессивных животных серотонинергическая система блокируется, что приводит к развитию повышенной импульсивности, которая зачастую является причиной проявления повышенной агрессивности [Kudryavtseva, 2006]. У депрессивных животных снижение активности происходило за счет истощения серотонинергической системы в результате ее длительной активации под влиянием стресса [Августинович и др., 2004]. Подтверждал это предположение и тот факт, что после двухнедельного периода прекращения агонистических взаимодействий измененная экспрессия серотонинергических генов у агрессоров восстанавливалась, а у жертв – длительно сохранялась [Boyarskikh et al., 2013; Smagin et al., 2013].
Таким образом, в ядрах шва среднего мозга снижение экспрессии гена Slc6а4, кодирующего транспортер серотонина, и гена, кодирующего везикулярный транспортер Slc6a17, селективного для нескольких аминокислот, отмечается у животных с альтернативным опытом социального поведения и происходит, по-видимому, в ответ на снижение активности серотонинергической системы в этом отделе. При этом специфически снижается экспрессия гена, кодирующего переносчик норадреналина Slc6a2 у депрессивных животных. У агрессивных самцов отмечается up-регуляция экспрессии гена-транспортера аминокислоты глицина Slc6a5, обладающего тормозной активностью.
Вентральная тегментальная область
В вентральной тегментальной области (рис. 2, табл. 1) у агрессивных самцов повышалась экспрессия только гена Slc6a2 (p < 0.007), кодирующего транспортер норадреналина, что может свидетельствовать об активации норадренергической cистемы под влиянием повторного опыта агрессии. В то же время у депрессивных животных экспрессия этого гена снизилась (p < 0.0004; q < 0.035), также как и гена Slc6a5 (p < 0.0001; q < 0.0063), кодирующего перенос глицина, и гена Slc6a8 (p < < 0.014), кодирующего транспортер креатина. Экспрессия гена Slc6a3 (p < 0.0001; q < < 0.0063), кодирующего транспортер дофамина, и гена Slc6a4 (p < 0.0001; q < 0.0063), кодирующего транспортер серотонина, увеличилась.
Рис. 2.
Дифференциально экспрессирующиеся гены Slc6a в вентральной тегментальной области, гиппокампе и стриатуме. Серые столбы – контроль; темные столбы – агрессивные или депрессивные мыши. * – p < 0.05; ** – p < 0.01; *** – p < 0.001 по отношению к контролю. Данные представлены в единицах FPKM.
Fig. 2. Differentially expressed Slc6a genes in the ventral tegmental area, hippocampus and striatum. Grey columns – the control; dark columns – aggressive or depressive mice. Data are presented in FPKM units. * – p < 0.05; ** – p < 0.01; *** – p < 0.001 vs the controls.
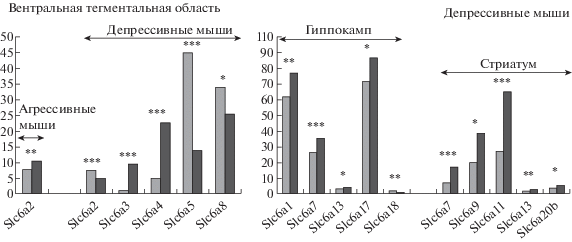
Выявленные изменения укладываются в представления о специализации этой структуры мозга и роли дофамина, участвующего в механизмах положительного подкрепления любых форм мотивационного поведения и аддиктивных состояний [Russo, Nestler, 2013; Fields et al., 2007]. Полагают также, что в мозге млекопитающих вентральная тегментальная область является одним из важнейших звеньев, обеспечивающих взаимодействие лимбической и моторных систем, участвующих в организации сложных форм поведения [http://lib4all.ru/base/B2433/B2433Part21-185.php].
Вентральная тегментальная область является гетерогенной структурой мозга [обзор, Walsh, Han, 2014], в которой расположены тела дофаминергических нейронов, составляющие по разным источникам ~50–70% всех нейронов этого отдела [Margoulis et al., 2006; Herve et al., 1987; Yamaguchi et al., 2007, Nair-Roberts et al., 2008], около ~30% ГАМКергических нейронов [Bourdi, Barrot, 2012], небольшой процент глутаматергических нейронов (~2-3%) [Yamaguchi et al., 2007; Nair-Ro-berts et al., 2008], и в которой также находятся тела серотонинергических нейронов [Carkaci-Salli et al., 2011]. Ранее нами было показано, что формирование смешанного тревожно/депрессивного расстройства под влиянием хронического социального стресса у мышей ведет в этой области к увеличению экспрессии генов, кодирующих белки, участвующие в синтезе и рецепции серотонинергической системы – гены Тph2, Htr4, Htr1a [Кудрявцева и др., 2017], дофаминергической – гены Th, Ddc, Drd2 и Maob [Коваленко и др., 2016; Filipenko et al., 2001] и ГАМКергической системы – гены Gabra1, Gabra2, Gabrg2, Gabrg1, Gabrq, Gad1, Gad2 [Галямина и др., 2017].
Таким образом, и в вентральной тегментальной области прослеживается четкая взаимосвязь между экспрессией генов Slc6a и активностью медиаторных систем. Известно, что нарушения в дофаминергической системе вентральной тегментальной области характерны для шизофрении, болезни Паркинсона, синдрома дефицита внимания и гиперактивности [Grace, 1991; Tomasi, Volkow, 2014], а также депрессии [Barker et al., 2016; Russo, Nestler, 2013; Polter, Kauer, 2014]. Показано, что разрушение дофаминергических нейронов в этой области может усиливать депрессивноподобное поведение [Winter et al., 2007]. Интересным было отметить снижение экспрессии гена Slc6a8, кодирующего переносчик креатина, функция которого заключается в транспортировке вещества в клетку и из клетки. Болезни, ассоциируемые с недостаточностью белка SLC6A8с, характеризуются ухудшением движения (Slc6a8-Related Creatine Transporter Deficiency), нейрологическая основа которого выявляется в изменении координации и скорости свободного движения, которые отмечаются и у депрессивных животных [Смагин и др., 2018]. В то же время гиперактивность и дефицит внимания, часто сопровождаемые повышенной агрессивностью, сопровождаются повышенной концентрацией креатина [Carrey et al., 2007].
Гиппокамп
В гиппокампе (рис. 2, табл. 1) у агрессивных самцов ни у одного из генов семейства Slc6а* экспрессия не изменилась под влиянием повторного опыта агрессии. У депрессивных животных экспрессия генов Slc6a1 (p < 0.004) и Slc6a13 (p < 0.033), кодирующих транспортеры ГАМК, гена Slc6a7 (p < 0.0003; q ≤ 0.021), кодирующего транспортер пролина, и гена Slc6a17 (p < 0.014), кодирующего везикулярный транспортер нейтральных аминокислот, повышалась, в то время как у гена Slc6a18 со сходной функцией экспрессия снижалась (p < 0.0044).
Основной тип клеток гиппокампа – это пирамидальные клетки, среди которых выделяют несколько типов. Зубчатую извилину составляют зернистые клетки, аксоны которых (мшистые волокна) связывают зубчатую извилину и другие области гиппокампа. Кроме этих типов клеток, составляющих основные клеточные слои, в состав гиппокампа и поясной извилины также входят ГАМКергические вставочные нейроны, которые регулируют передачу нервного возбуждения. Эти клетки содержат не только тормозный нейромедиатор ГАМК, но и разнообразные нейропептиды и кальций-связывающие белки.
Известно, что в гиппокампе содержится большое количество глюкокортикоидных рецепторов. При этом стероиды снижают возбудимость отдельных нейронов гиппокампа, ингибируют процесс нейрогенеза в зубчатой извилине и вызывают атрофию дендритов в пирамидальных клетках. Проведенные исследования показали, что у людей, переживающих длительный стресс, атрофия гиппокампа, которая наблюдается у пациентов с синдромами Кушинга (высокий уровень кортизола в крови), депрессии и шизофрении, была значительно выше, чем в других областях мозга.
Стриатум
В дорсальном стриатуме (рис. 2, табл. 1), как и в гиппокампе, ни в одном из исследуемых генов экспрессия у мышей под влиянием повторного опыта агрессии не изменилась. У депрессивных животных повышалась экспрессия гена Slc6a7 (p < 0.0001; q < 0.0033), кодирующего транспортер пролина, генов Slc6a9 (p < 0.023) и Slc6a20b, (p < 0.024), кодирующих транспортеры глицина, генов Slc6a11 (p < 0.0001; q < 0.0033) и Slc6a13 (p ≤ 0.0041), кодирующих транспортеры ГАМК.
Эти изменения укладываются в представления о специализации стриатума, участвующего в регуляции моторной функции и тонуса мышц. Стриатум связан афферентными и эфферентными проекциями с ассоциативными, моторными и сенсомоторными областями коры [обзоры, Liljeholm, O’Doherty, 2012; Devan et al., 2011]. 95% всех нейронов являются ГАМКергическими [Yager et al., 2015], тесно связанными метаболическими процессами с глутаматергической системой. Было показано [Смагин и др., 2018], что у депрессивных животных экспрессия ГАМКергических генов Gabbr2 и Gabrb2, кодирующих рецепторы, повысилась, в то время как экспрессия гена Gabra2 снизилась. При этом в стриатуме этих самцов, демонстрирующих гипоактивность в любой ситуации, ранее наблюдали снижение экспрессии катехоламинергических генов Сomt, Drd1, Drd2, Snca и Adra2c и повышение экспрессии Sncb, Adra2a, Adra1b, Adrbk1, Adrbk и глутаматергических генов Grm1, Grm2, Slc17a6, Slc17a7, Grin2c, Grik1, Grid2ip [Смагин и др., 2018]. Возможно, что изменения в этой структуре отражаются более всего на экспрессии генов, кодирующих рецепторы соответствующих нейромедиаторных систем. У агрессивных животных повышенная двигательная активность и развитие стереотипий сопровождались увеличением экспрессии генов Drd4 и Slc17a7, down-регуляцией экспрессии гена Th и генов Gabra2, Gabrа3, Gabrb2, Gabrg2, Gabrg3, кодирующих ГАМКергические рецепторы. Предполагалось, что у агрессивных мышей в дорсальном стриатуме основную ответственность за изменение моторного поведения, сопровождающегося повышенной двигательной активностью, несет снижение тормозного контроля со стороны ГАМКергической системы, в то время как у депрессивных животных происходит активация глутаматергической системы [Смагин и др., 2018].
Таким образом, в дорсальном стриатуме снижение моторной активности у депрессивных мышей сопровождается up-регуляцией экспрессии генов-переносчиков ГАМК, а также глицина. При этом основные изменения у агрессивных и депрессивных животных происходят, скорее всего, на уровне метаболизма и рецепции в глутаматергической и ГАМКергической системах.
Исследование корреляционной взаимосвязи между экспрессией генов, кодирующих ферменты синтеза моноаминов, и экспрессией генов Slc6a, кодирующих соответствующие транспортеры
Для проверки гипотезы о том, что выраженность экспрессии генов, кодирующих белки-транспортеры, может быть показателем активности соответствующих медиаторных систем, был проведен корреляционный анализ между параметрами экспрессии генов, кодирующих, с одной стороны, основные ферменты синтеза серотонина – триптофангидроксилазу (Tph2), лимитирующий фермент синтеза серотонина; дофамина и норадреналина – тирозингидроксилазу (Th1 кодирующего ключевой лимитирующий фермент синтеза дофамина, и дофамин-β-гидроксилазу (Dbh) – фермент синтеза норадреналина из дофамина, которые мы исследовали ранее [Коваленко и др., 2017; Галямина и др., 2017; Кудрявцева и др., 2017; Смагин и др., 2018] и, с другой стороны, показателями экспрессии генов, кодирующих соответствующие транспортеры: серотонина – Slc6a4, дофамина – Slc6a3 и норадреналина – Slc6a2. При этом учитывали показатели экспрессии генов у каждого животного при разных состояниях (контрольные, агрессивные и депрессивные самцы) в исследуемых структурах. Изменение экспрессии генов, участвующих в синтезе медиаторов под влиянием нашего воздействия, подробно рассматривалось нами ранее [Smagin et al., 2013; Boyarskikh et al., 2013; Кудрявцева и др., 2017]. Дополнительно в анализ были включены ГАМКергические гены Slc6a1 и Slc6a11, экспрессия которых в основном увеличивалась в различных отделах мозга.
Показано (табл. 2), что экспрессия гена Slc6a4 с высоким уровнем значимости положительно коррелирует с параметрами экспрессии гена Tph2 (r = 0.993; DF = 44; p < 2E-43), как и параметры экспрессии гена Slc6a2 и гена Dbh (r = 0.988, df = 44, p < 7.6E-38). Экспрессия гена Slc6a3 коррелирует с экспрессией гена Th (r = = 0.734, df = 44, p < 2.9E-9). Экспрессия гена Th коррелирует также с экспрессией генов Slc6a1 и Slc6a11 (p < 1E-11; p < 3E-10 соответственно). Коэффициент корреляции между показателями экспрессии гена Dbh и ГАМКергических генов также преодолевает порог статистической значимости (p < 0.03). Кроме того, показатели экспрессии гена Tph2 коррелируют с таковыми у генов Slc6a2 и Slc6a3 соответственно (p < 0.001; p < 0.002). Эти данные свидетельствуют о наличии взаимосвязей изменений экспрессии генов, кодирующих исследуемые белки по всем отделам мозга.
Таблица 2.
Коэффициенты корреляций между величинами экспрессии исследуемых генов в структурах головного мозга Table 2. Coefficients of correlation between expressions of genes in brain regions
| Slc6a1 | Slc6a11 | Slc6a2 | Slc6a3 | Slc6a4 | |
|---|---|---|---|---|---|
| Tph2 | 0.200 | 0.231 | 0.447 | 0.421 | 0.993 |
| Dbh | 0.299 | 0.299 | 0.988 | 0.266 | 0.432 |
| Th | 0.805 | 0.768 | 0.328 | 0.734 | 0.246 |
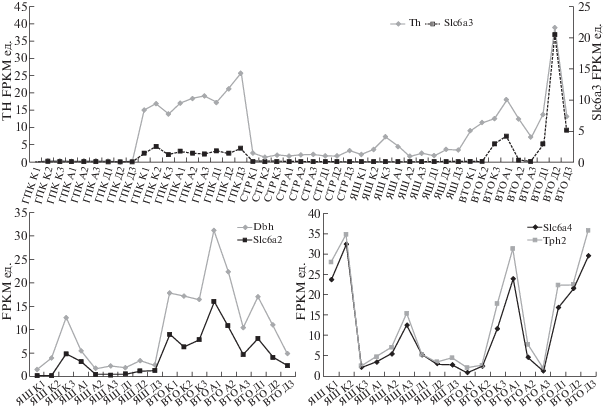
На рис. 3 представлены графики экспрессии исследуемых генов, выраженные в единицах FPKM, в отделах мозга. Видно, что исходно у контрольных животных ген Tph2 экспрессируется довольно высоко в ядрах шва среднего мозга и вентральной тегментальной области. Под влиянием агонистических взаимодействий и у агрессивных, и у депрессивных животных происходит снижение экспрессии генов Tph2 и Slc6a4 в ядрах шва среднего мозга, а в вентральной области – их повышение. Гены Dbh и Slc6a2 экспрессируются преимущественно в вентральной тегментальной области и ядрах шва среднего мозга (рис. 3). Гены Th и Slc6a3 существенно экспрессируются у животных в гипоталамусе и в вентральной тегментальной области. Можно сделать вывод, что показатели экспрессии генов, кодирующих белки-транспортеры, следуют за выраженностью изменений показателей экспрессии генов, кодирующих ферменты синтеза, в частности, под влиянием экспериментального воздействия. В целом исследования подтверждают выдвинутую гипотезу о том, что дифференциально экспрессирующиеся гены семейства Slc6a* могут быть маркерами измененной функции нейромедиаторных систем мозга, впрочем, также и vice versa, при патологических состояниях.
Рис. 3.
Корреляции между экспрессией генов Th и Slc6a3 (r = 0.734, df = 44, p < 2,E-15), генов Dbh и Slc6a2 (r = 0.988, df = 44, p < 2,4E-21) и генов Tph2 и Slc6a4 (r = 0.993; DF = 44; p <3E-24). ГПТ – гипоталамус; ЯШ – ядра шва среднего мозга; ГПК – гиппокамп; ВТО – вентральная тегментальная область; СТР – стриатум; К1, К2, К3 – контроль; А1, А2, А3 – агрессивные мыши; Д1, Д2, Д3 – депрессивные мыши.
Fig. 3. Correlation between expression rates across different brain regions: Th and Slc6a3 genes (r = 0.734, df = 44, p < 2,E-15), Dbh and Slc6a2 genes (r = 0.988, df = 44, p < 2,4E-21), Tph2 and Slc6a4 genes (r = 0.993; DF = 44; p < 3E-24). ГПТ – ЯШ – midbrain raphe nuclei; ВТО – ventral tegmental area; ГПК – hippocampus, СТР – striatum; К1, К2, К3 – control; А1, А2, А3 – aggressive mice; Д1, Д2, Д3 – depressive mice.
ЗАКЛЮЧЕНИЕ
Всего генов семейства Slc* (solute carrier family), кодирующих мембранные везикулярные транспортеры аминов, митохондриальные транспортеры, транспортеры стероидных молекул, холиноподобные транспортеры, транспортеры ионов металлов и др., насчитывается приблизительно 350, объединенных в 55 семейств [Hediger et al., 2004; Fredriksson et al., 2008; He et al., 2009].
В настоящей работе исследовалось изменение экспрессии генов Slc6a*, кодирующих преимущественно транспортеры, работающие в синапсе и переносящие в синаптическое окончание моноамины – норадреналин, серотонин, дофамин и аминокислоты – ГАМК, глицин, таурин, пролин и др. медиаторы, выделившиеся в синаптическую щель при стимуляции соответствующих нейронов. Предполагалось, что по характеру изменений экспрессии этих генов можно будет судить о нейромедиаторных процессах, происходящих в отделах мозга при формировании патологических форм поведения.
Если взять в рассмотрение все отделы, можно сделать вывод, что экспрессия генов ГАМК, глицина и таурина, кодирующих белки, обладающих тормозным действием, а также пролина, была увеличена в гипоталамусе, стриатуме и гиппокампе депрессивных животных и в гипоталамусе агрессивных, в то время как экспрессия генов, кодирующих переносчики других аминокислот, была снижена. Специфика изменений моноаминергических генов определялась функцией отдела и преимущественным содержанием различных нейронов, имеющих отношение к той или иной медиаторной системе. В частности, была снижена экспрессия генов Slc6a4 и Slc6a17 у животных обеих групп в ядрах шва среднего мозга и повышена экспрессия генов Slc6a3 и Slc6a4 в вентральной тегментальной области у депрессивных животных. Изменения других дифференциально экспрессирующих генов семейства Slc6a* были во многом специфичны для каждого отдела мозга и также определялись приобретенным социальным опытом животных, то есть спецификой развивающейся патологии поведения.
Ответ на то, как же ген, находящийся в ядре нейрона, реагирует на изменение процессов, происходящих в синапсе, и увеличивает или снижает свою экспрессию в ответ на средовой стимул, был получен в нобелевской работе Э. Кандаля в 2000 г. с применением упрощенных нейронных цепей, которые были взяты в тканевой культуре (единственный сенсорный нейрон, связанный с единственным мотонейроном). Причем в этих экспериментах был использован серотонин в качестве возбуждающего сигнала, поступающего на сенсорный нейрон, при этом авторы рассматривали однократное и многократное воздействие [Kandel, 2012, обзор]. Как было обнаружено авторами, однократное введение серотонина повышает концентрацию циклического АМФ (cAMP) и протеинкиназы А (PKA, ныне PRKA) преимущественно в районе синапса, а многократное введение приводит к более высоким концентрациям циклического АМФ, которые вызывают поступление протеинкиназы А в ядро, где она обеспечивает активацию генов с помощью киназы MAPK (mitogen associated protein kinase), которая связана с ростом синапсов и тоже поступает в ядро. Показано, что протеинкиназа А может активировать регуляторный белок CREB (cyclic АМР response element-binding protein), который связывается с промотором (элементом, реагирующим на циклический АМФ). Было предположено, что именно белок CREB может быть ключевым компонентом переключения, переводящего кратковременное усиление синаптической связи в долговременное и обеспечивающего формирование новых связей. Активация CREB, в свою очередь, вызывает изменение клетки в структурном и функциональном отношении. Причем существует две формы белка CREB: одна (CREB-1) активирует, а другая (CREB-2) подавляет экспрессию генов. Многократное действие раздражителя приводит к тому, что протеинкиназа А и MAPкиназа поступают в ядро, где протеинкиназа А активирует CREB-1, а MAPкиназа инактивирует CREB-2. Таким образом, для долговременного усиления синаптических связей требуется не только включение одних генов, но и выключение других. Противоположное действие белков суммируется, обеспечивая работу механизма регуляции. Молекулы информационной РНК синтезируются в ядре, а затем в определенных синапсах на их матрице происходит синтез белков [Kandel, 2012].
Хотя исследователи изучали на этой модели механизмы формирования долговременной памяти при повторном воздействии стимула, однако эти же рассуждения могут быть использованы для объяснения механизмов формирования различных патологий, которые развиваются при хроническом воздействии психопатогенных средовых факторов, в нашем случае, социальной природы. При этом, как показано нами, изменения в психоэмоциональном состоянии [Avgustinovich et al., 2005] и экспрессии генов могут длительно сохраняться [Berton et al., 2006; Bondar et al., 2009], что подтверждает высказанное предположение. Кроме того, нами были обнаружены гены (неопубликованные данные), кодирующие белки CPEB (cytoplasmic polyadenylation element-binding protein), обладающие прионными свойствами, которые вызывают развитие нейродегенеративных заболеваний [Rayman, Kandel, 2017, обзор], симптомы которых обнаружены и у наших животных [Kudryavtseva et al., 2014; Kudryavtseva, 2006]. Как показали исследования [Rayman, Kandel, 2017, обзор], прионы – это белки, которые могут принимать самоподдерживающиеся конформации и считаются этиологическим фактором, лежащим в основе таких нейродегенеративных заболеваний, как болезнь Альцгеймера, боковой амиотрофический склероз, болезнь Хантингтона и др. Однако предстоит еще проверить эту гипотезу, используя данные транскриптомного анализа. Исследование осложняется тем, что, как показал предварительный поиск в имеющейся у нас базе данных дифференциально экспрессирующихся генов, на сегодняшний день найдено несколько подтипов отдело-специфичных белков CREB, MAPK, CPEB, протеинкиназ и др.
Созданная база дифференциально экспрессирующихся генов в пяти отделах мозга у самцов мышей с повторным опытом агонистических взаимодействий является оригинальной разработкой коллектива, которая позволяет исследовать особенности участия более 30 тысяч генов в каждой структуре мозга в механизмах формирования патологии поведения. Предлагаемый комплексный анализ дифференциально экспрессирующихся генов, кодирующих различные транспортеры, позволит понять и всесторонне охарактеризовать молекулярные механизмы формирования патологии поведения, формирующейся по типу психозов под влиянием повторного опыта агрессии, с одной стороны, а также смешанного тревожно/депрессивного расстройства, с другой, в отделах мозга, отличающихся функциональной активностью. В нашем случае можно думать, что это исследование будет способствовать более глубокому пониманию нейробиологических механизмов исследуемых нами патологических процессов и позволит выявить гены-мишени, воздействие на которые в дальнейшем поможет открыть пути комплексного терапевтического воздействия. Очевидно, что исследование нейробиологических механизмов и социальных факторов, провоцирующих проявление различных болезней, является актуальной фундаментальной задачей.
Исследование поддержано Российским научным фондом, № 14-15-00063, Российским фондом фундаментальных исследований № 17-04-00140/17; БП 0324-2018-0016.
Список литературы
Августинович Д.Ф., Алексеенко О.В., Бакштановская И.В., Корякина Л.А., Липина Т.В., Тендитник М.В., Бондарь Н.П., Коваленко И.Л., Кудрявцева Н.Н. Динамические изменения серотонинергической и дофаминергической активности мозга в процессе развития тревожной депрессии: экспериментальное исследование. Усп. физиол. наук. 2004. 35 (4): 19–40.
Галямина А.Г., Коваленко И.Л., Смагин Д.А., Кудрявцева Н.Н. Изменение экспрессии генов нейромедиаторных систем в вентральной тегментальной области депрессивных мышей: данные RNA-Seq. Журн. высш. нервн. деят. им. И.П. Павлова, 2017. 1:113–118.
Коваленко И.Л., Смагин Д.А., Галямина А.Г., Орлов Ю.Л., Кудрявцева Н.Н. Изменение экспрессии дофаминергических генов в структурах мозга самцов мышей под влиянием хронического социального стресса: данные RNA-seq. Мол. Биол. 2016. 50 (1): 184–187.
Кудрявцева Н.Н. Нейробиология агрессии: Мыши и люди. Монография, Из-во “Наука-Центр” 2013. 272 стр.
Кудрявцева Н.Н., Бакштановская И.В. Нейрохимический контроль агрессии и подчинения. Журн. высш. нерв. деят. им. И.П. Павлова. 1991. 41: 5: 459–466.
Кудрявцева Н.Н., Смагин Д.А., Коваленко И.Л., Галямина А.Г., Вишнивецкая Г.Б., Бабенко В.Н., Орлов Ю.Л. Серотонинергические гены в развитии тревожно/ депрессивного расстройства и патологии агрессивного поведения у самцов мышей: данные RNA-SEQ. Мол. биол. 2017. 51: 2: 288–300.
Смагин Д.А., Галямина А.Г., Коваленко И.Л., Бабенко В.Н., Тамкович Н.В., Борисов С.А., Толстикова Т.Г., Кудрявцева Н.Н. Дифференциально экспрессирующиеся гены нейромедиаторных систем в дорсальном стриатуме самцов мышей с двигательными нарушениями. Журн. высш. нервн. деят. им. И.П. Павлова 2018. 68: 2: 227–249.
Avgustinovich D.F., Kovalenko I.L., Kudryavtseva N.N. A model of anxious depression: persistence of behavioral pathology. Neurosci. Behav. Physiol. 2005. 35 (9): 917–924.
Bak L.K., Schousboe A.,Waagepetersen H.S. (2006) The glutamate/GABA glutamine cycle: aspects of transport, neurotransmitter homeostasis and ammonia transfer. J. Neurochem. 98: 641–653.
Barker D.J., Root D.H., Zhang S., Morales M. Multiplexed neurochemical signaling by neurons of the ventral tegmental area. J. Chem. Neuroanat. 2016. 73: 33–42.
Berton O., McClung C.A., Dileone R.J., Krishnan V., Renthal W., Russo S.J., Graham D., Tsankova N.M., Bolanos C.A., Rios M., Monteggia L.M., Self D.W., Nestler E.J. Essential role of BDNF in the mesolimbic dopamine pathway in social defeat stress. Science. 2006. 311 (5762), 864–868.
Bondar N.P., Boyarskikh U.A., Kovalenko I.L., Filipenko M.L., Kudryavtseva N.N. Molecular implications of repeated aggression: Th, Dat1, Snca and Bdnf gene expression in the VTA of victorious male mice. PLoS ONE. 2009. 4 (1): e4190.
Bourdy R., Barrot M. A new control center for dopaminergic systems: pulling the VTA by the tail. Trends Neurosci. 2012. 35 (11): 681–690.
Boyarskikh U.A., Bondar N.P., Filipenko M.L., Kudryavtseva N.N. Downregulation of serotonergic genes expression in the raphe nuclei of midbrain under chronic social defeat stress in male mice. Mol. Neurobiol. 2013. 48 (1): 13–21.
Carkaci-Salli N., Salli U., Kuntz-Melcavage K.L., Pennock M.M., Ozgen H., Tekin I., Freeman W.M., Vrana K.E. TPH2 in the ventral tegmental area of the male rat brain. Brain Res. Bull. 2011. 84 (6): 376–380.
Carrey N.J., MacMaster F.P., Gaudet L., Schmidt M.H. Striatal creatine and glutamate/glutamine in attention-deficit/hyperactivity disorder. J. Child Adolesc Psychopharmacol. 2007. 17(1): 11–17.
Chen N.H., Reith M.E., Quick M.W. Synaptic uptake and beyond: the sodium- and chloride-dependent neurotransmitter transporter family SLC6. Pflugers Arch. 2004. 447: 519–531.
Devan B.D., Hong N.S., McDonald R.J. Parallel associative processing in the dorsal striatum: Segregation of stimulus–response and cognitive control subregions. Neurobiol. Learn. Mem. 2011. 96: 95–120.
Fields H.L., Hjelmstad G.O., Margolis E.B., Nicola S.M. Ventral tegmental area neurons in learned appetitive behavior and positive reinforcement. Annu. Rev. Neurosci. 2007. 30: 289–316.
Filipenko M.L., Alekseyenko O.V., Beilina A.G., Kamynina T.P., Kudryavtseva N.N. Increase of tyrosine hydroxylase and dopamine transporter mRNA levels in ventral tegmental area of male mice under influence of repeated aggression experience. Mol. Brain Res., 2001. 30: 96 (1–2), 77–81.
Fowler J.S., Volkow N.D., Wang G.J., Ding Y.S., Dewey S.L. PET and drug research and development. J. Nucl. Med. 1999. 40: 1154–1163.
Fredriksson R., Nordstrom K.J., Stephansson O., Hagglund M.G., Schioth H.B. The solute carrier (SLC) complement of the human genome: phylogenetic classification reveals four major families. FEBS Lett. 2008. 582: 3811–3816.
He L., Vasiliou K., Nebert D.W. Analysis and update of the human solute carrier (SLC) gene superfamily. Hum. Genomics. 2009. 3: 195–206.
Hediger M.A., Romero M.F., Peng J.B., Rolfs A., Takanaga H., Bruford E.A. The ABCs of solute carriers: physiological, pathological, and therapeutic implications of human membrane transport proteins. Pflugers Arch. 2004. 447: 465–468.
Herve D., Pickel V.M., Joh T.H., Beaudet A. Serotonin axon terminals in the ventral tegmental area of the rat: fine structure and synaptic input to dopaminergic neurons. Brain Res. 1987. 435 (1–2): 71–83.
Houle S., Ginovart N., Hussey D., Meyer J.H., Wilson A.A. Imaging the serotonin transporter with positron emission tomography: initial human studies with [11C]DAPP and [11C]DASB. Eur. J. Nucl. Med. 2000. 27: 1719–1722.
Huang Y., Hwang D.R., Narendran R., Sudo Y., Chatterjee R., Bae S.A., Mawlawi O., Kegeles L.S., Wilson A.A., Kung H.F., et al. Comparative evaluation in nonhuman primates of five PET radiotracers for imaging the serotonin transporters: [11C]McN 5652, [11C]ADAM, [11C]DASB, [11C]DAPA, and [11C]AFM. J. Cereb. Blood Flow Metab. 2002. 22: 1377–1398.
Grace A.A. Phasic versus tonic dopamine release and the modulation of dopamine system responsivity: a hypothesis for the etiology of schizophrenia. Neuroscience. 1991. 41 (1): 1–24.
Kandel E.R. The molecular biology of memory: cAMP, PKA, CRE, CREB-1, CREB-2, and CPEB. Mol Brain. 2012. 5: 14.
Kristensen A.S., Andersen J., Jørgensen T.N., Sørensen L., Eriksen J., Loland C.J., Strømgaard K., Gether U. SLC6 Neurotransmitter transporters: structure, function, and Regulation. Pharmacol. Rev. 2011. 63: 585–640.
Kudryavtseva N.N. The psychopathology of repeated aggression: a neurobiological aspect. In “Perspectives on the Psychology of Aggression”. Ed. JP Morgan. NY: Nova Science Publichers, Inc. 2006, Chapter 2. p. 35–64.
Kudryavtseva N.N. The sensory contact model for the study of aggressive and submissive behaviors in male mice. Aggress. Behav. 1991. 17: 5: 285–291.
Kudryavtseva N.N., Avgustinovich D.F. Behavioral and physiological markers of experimental depression induced by social conflicts (DISC). Aggress. Behav. 1998. 24: 271–286.
Kudryavtseva N.N., Bakshtanovskaya I.V., Koryakina L.A. (1991): Social model of depression in mice of C57BL/6J strain. Pharmacol. Biochem. Behav., 38, 2, 315–320.
Kudryavtseva N.N., Bondar N.P., Avgustinovich D.F. Association between experience of aggression and anxiety in male mice. Behav. Brain Res. 2002; 133 (1): 83–93.
Kudryavtseva N.N., Smagin D.A., Kovalenko I.L., Vishnivetskaya G.B. Protocol for repeated positive fighting experience in male mice: the tool for the study of movement disorders. Nature Prot. 2014. 9: 11: 2705–2717. doi:. 10.1038/nprot.2014.156.
Laakso A., Hietala J. PET studies of brain monoamine transporters. Curr. Pharm. Des. 2000. 6: 1611–1623.
Liljeholm M., O’Doherty J.P. Contributions of the striatum to learning, motivation, and performance: an associative account. Trends Cogn. Sci. 2012. 16 (9): 467–475.
Margolis E.B., Lock H., Hjelmstad G.O., Fields H.L. The ventral tegmental area revisited: Is there an electrophysiological marker for dopaminergic neurons? J. Physiol. 2006. 577 (3): 907–924.
Meyer J.H. Imaging the serotonin transporter during major depressive disorder and antidepressant treatment. J. Psychiatry Neurosci. 2007. 32: 86–102.
Nair-Roberts R.G., Chatelain-Badie S.D., Benson E., White-Cooper H., Bolam J.P., Ungless M.A. Stereological estimates of dopaminergic, GABAergic and glutamatergic neurons in the ventral tegmental area, substantia nigra and retrorubral field in the rat. Neuroscience. 2008. 152: 1024–1031.
Polter A.M., Kauer J.A. Stress and VTA synapses: implications for addiction and depression. Eur. J. Neurosci. 2014. 39 (7): 1179–1188.
Rayman J.B., Kandel E.R. Functional Prions in the Brain. Cold Spring Harb. Perspect Biol. 2017. 9 (1).
Russo S.J., Nestler E.J. The brain reward circuitry in mood disorders. Nat. Rev. Neurosci. 2013. 14 (9): 609–625.
Smagin D.A., Boyarskikh U.A., Bondar N.P., Filipenko M.L., Kudryavtseva N.N. Reduction of serotonergic gene expression in the midbrain raphe nuclei under positive fighting experience. Adv. Biosci. Biotech. 2013. 4 (10B): 36–44.
Smagin D.A., Kovalenko I.L., Galyamina A.G., Bragin A.O., Orlov Y.L., Kudryavtseva N.N. Dysfunction in ribosomal gene expression in the hypothalamus and hippocampus following chronic social defeat stress in male mice as revealed by RNA-Seq. Neural Plast. 2016: 3289187.
Smagin D.A., Kovalenko I.L., Galyamina A.G., Orlov Yu.L., Babenko V.N., Kudryavtseva N.N. Heterogeneity of brain ribosomal genes expression following repeated experience of aggression in male mice as revealed by RNA-Seq. Mol. Neurobiol. 2018a. 55 (1): 390–401.
Smagin D.A., Galyamina A.G., Kovalenko I.L., Babenko V.N., Kudryavtseva N.N. Aberrant expression of collagen family genes in the brain regions developing under agonistic interactions in male mice: RNA-Seq data. BioRxiv. 2018b. http://dx.doi.org/. doi 10.1101/276063
Tomasi D., Volkow N.D. Functional connectivity of substantia nigra and ventral tegmental area: maturation during adolescence and effects of ADHD. Cereb. Cortex. 2014. 24 (4): 935–944.
Trapnell C., Pachter L., Salzberg S.L. TopHat: discovering splice junctions with RNA-Seq. Bioinformatics. 2009. 25 (9): 1105–1111.
Walsh J.J., Han M.H. The heterogeneity of ventral tegmental area neurons: Projection functions in a moodrelated context. Neuroscience. 2014. 282: 101–108.
Wilson A.A., Ginovart N., Schmidt M., Meyer J.H., Threlkeld P.G., Houle S. (2000) Novel radiotracers for imaging the serotonin transporter by positron emission tomography: synthesis, radiosynthesis, and in vitro and ex vivo evaluation of 11C-labeled 2-(phenylthio)araalkylamines. J. Med. Chem. 2000. 43: 3103–3110.
Winter C., von Rumohr A., Mundt A., Petrus D., Klein J., Lee T., Morgenstern R., Kupsch A., Juckel G. Lesions of dopaminergic neurons in the substantia nigra pars compacta and in the ventral tegmental area enhance depressive-like behavior in rats. Behav. Brain Res. 2007. 184 (2): 133–141.
Yager L.M., Garcia A.F., Wunsch A.M., Ferguson S.M. “The ins and outs of the striatum: Role in drug addiction”. Neuroscience 2015. 301: 529–541.
Yamaguchi T., Sheen W., Morales M. Glutamatergic neurons are present in the rat ventral tegmental area. Eur. J. Neurosci. 2007. 25: 106–118
Zahniser N.R., Doolen S. Chronic and acute regulation of Na+/Cl- -dependent neurotransmitter transporters: drugs, substrates, presynaptic receptors, and signaling systems. Pharmacol. Ther. 2001. 92: 21–55.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


