Журнал высшей нервной деятельности им. И.П. Павлова, 2019, T. 69, № 2, стр. 194-210
ВЛИЯНИЕ СНИЖЕНИЯ ЭКСПРЕССИИ РЕЦЕПТОРОВ ДОФАМИНА (D1 И D2) В БАЗОЛАТЕРАЛЬНОЙ МИНДАЛИНЕ КРЫС НА УСЛОВНЫЕ ОБОРОНИТЕЛЬНЫЕ РЕФЛЕКСЫ
И. В. Павлова *, М. П. Рысакова, Ю. С. Спивак, Н. Д. Брошевицкая, Ю. В. Аксенова, С. В. Саложин
Федеральное государственное бюджетное учреждение науки
Институт высшей нервной деятельности и нейрофизиологии РАН
Россия, Москва
* E-mail: pavlovfml@mail.ru
Поступила в редакцию 22.11.2017
После доработки 30.01.2018
Принята к публикации 05.03.2018
Аннотация
С помощью метода РНК-интерференции с использованием лентивирусной трансдукции изучали влияние снижения экспрессии рецепторов дофамина (D1R и D2R) в базолатеральном ядре миндалины крыс на выработку и угашение условных оборонительных рефлексов. Иммуногистохимическое окрашивание показало, что трансдукции подвергаются как нейроны (в среднем 19%), так и астроциты (73%). У крыс со сниженной экспрессией D1R по сравнению с контрольными животными ухудшалась выработка и облегчалось угашение условного оборонительного рефлекса на звук, ускорялось угашение рефлекса пассивного избегания, замедлялось обучение поиску скрытой платформы в водном лабиринте Морриса в 1–2 день. При условнорефлекторном страхе поведение крыс с длительным замиранием изменялось в большей степени, чем у крыс с кратковременным замиранием после снижения экспрессии D1R в миндалине. У крыс со сниженной экспрессией D2R угашение классического оборонительного рефлекса и рефлекса пассивного избегания проходило быстрее. Полученные результаты свидетельствуют о разной роли D1R и D2R миндалины, функционирование D1R в отличие от D2R важно для выработки оборонительных рефлексов и проявления условнорефлекторного страха в виде длительного замирания. Активность как D2R, так и D1R существенна для устойчивости рефлексов к угашению.
В клинике широко распространены такие невротические заболевания, как посттравматические стрессовые расстройства и тревожные расстройства, происхождение которых связывают с нарушениями в угашении страха и патологической тревожностью. В настоящее время с развитием молекулярно-генетических способов воздействия на мозг актуален поиск новых не фармакологических методов лечения таких заболеваний.
В нейрофизиологии накоплены убедительные доказательства того, что базолатеральное и центральное ядра миндалины участвуют в механизмах возникновения тревожных состояний и страха [Le Doux, 2007]. Дофаминергическая синаптическая передача в миндалине играет большую роль в механизмах возникновения страха. Как было показано с помощью микродиализа, повышение уровня выделения дофамина в базолатеральной миндалине увеличивается при стрессе [Inglis, Moghaddam, 1999] и выработке условнорефлекторного страха [Yokoyama et al., 2005]. Дофамин выделяется в миндалине из нервных терминалей, принадлежащих клеткам вентрального тегментума и черной субстанции, которые оканчиваются в основном на паракапсулярных вставочных скоплениях ГАМКергических клеток, а также нейронах латеральной части центрального ядра [de la Mora et al., 2010]. В миндалине обнаружены рецепторы дофамина D1, D2, D3 и D4 типа [de la Mora et al., 2010; Guarraci et al., 2000; Greba, Kokkinidis, 2000; Nader, LeDoux, 1999; Perez de la Mora, 2012; Martina, Bergeron, 2008], лучше всего изучена роль D1R и D2R. Наибольшая плотность D1R обнаружена в паракапсулярных скоплениях, а D2R – в латеральной части центрального ядра [de la Mora et al., 2010]. Известно, что локальное введение в миндалину агонистов D1R или D2R способствует выработке условнорефлекторного страха при классическом оборонительном рефлексе и консолидации памяти, а антагонистов, наоборот, препятствует этим процессам и уменьшает проявление страха [de la Mora et al., 2010; Bananej et al., 2012; Guarraci et al., 1999; Guarraci et al., 2000; Greba, Kokkinidis, 2000; de Souza Caetano et al., 2013; Lalumiere et al., 2004; Павлова и др., 2015]. В некоторых работах была показана разная роль D1R и D2R при страхе в ответ на обстановку и звуковой стимул [de Souza Caetano et al., 2013; Павлова и др., 2015]. Локальное введение антагонистов D1R или D2R в миндалину приводило к ускорению угашения страха [Павлова и др., 2015]. Что касается механизма действия дофамина на клетки миндалины, то показано его тормозное влияние на вставочные ГАМКергические интернейроны паракапсулярных скоплений через D1R, что вызывало растормаживание основных глутаматергических клеток базолатерального и центрального ядра миндалины и увеличение тревожности и страха [Pape, 2005; Marowsky et al., 2005; Manko et al., 2011]. С помощью метода patch-clamp на срезах мозга крысы было также показано, что дофамин может оказывать влияние непосредственно на основные нейроны базолатеральной миндалины, при этом активация D1R приводит к увеличению, а D2R – к снижению возбудимости клеток [Kroner et al., 2005]. D2R могут располагаться пресинаптически на терминалях, идущих от префронтальной коры [Pinto, Sesack, 2008]. Известно, что активация D2R способна пресинаптически подавлять ГАМКергическую передачу от парвальбумин-положительных интернейронов к основным клеткам миндалины [Chu et al., 2012]. Таким образом, согласно приведенным данным литературы, D1R и D2R миндалины являются перспективной мишенью для воздействия, поскольку снижение их активности приводит к уменьшению условнорефлекторного страха.
В настоящее время для модуляции экспрессии генов широко используется метод РНК-интерференции, основанный на том, что присутствие в клетке экзогенной либо эндогенной короткой двухцепочечной РНК приводит к селективной деградации определенных мРНК [Lebedev et al., 2013]. В настоящее время используют вирусные конструкции, которые управляют синтезом малых “шпилечных” РНК (shРНК) предшественников интерферирующих siРНК. shРНК содержат последовательность направляющей цепи siРНК (длиной 21–29 п.н.), следующую за ней петлю примерно из 9 нуклеотидов и последовательность, комплементарную направляющей цепи siРНК. Применение такой конструкции позволяет обеспечить подавление экспрессии гена в течение длительного времени и прекращение синтеза белка рецептора. Для доставки shРНК в клетки мозга используют векторы на основе адено- и лентивирусов, при этом наибольшей эффективностью трансдукции и долговременной экспрессией трансгена характеризуются лентивирусные системы [Саложин, Большаков, 2009], что дает существенные преимущества методу лентивирусной трансдукции. Чаще всего применяют векторы, полученные на основе вируса иммунодефицита человека. В ряде работ метод вирусной трансдукции использовался для подавления или увеличения экспрессии некоторых генов клеток миндалины с целью изучения их роли в механизмах условнорефлекторного страха [Gafford et al., 2012; Heldt et al., 2014; de Solis et al., 2015; Liu et al., 2009; Banerjee et al., 2016], однако модифицирования работы D1R и D2R не проводилось.
В лаборатории молекулярной биологии ИВНД и НФ были синтезированы лентивирусные конструкции, направляющие синтез коротких шпилечных (short hairpin, sh) РНК к генам D1R и D2R, и способные, таким образом, снижать их экспрессию. Последующая проверка in vitro вирусных конструкций на культуре клеток HEK293T с помощью метода ПЦР в режиме реального времени, согласно исследованиям С.В. Саложина, показала, что экспрессия мРНК D1R по сравнению с контролем составляла 6.0–27.4%, а D2R – 5.0–9.7%. Введение контрольного вируса не влияло на экспрессию рецепторов. При использовании лентивирусных конструкций in vivo закономерно возникает ряд вопросов. Неизвестно, будут ли наблюдаться изменения в поведении животного после локальной лентивирусной трансдукции, насколько длительными они будут, не будет ли происходить компенсация со временем. Непонятно, будут ли эти изменения в поведении животных сходны с эффектами от локального введения антагониста данного рецептора.
Целью нашей работы было исследование влияния на оборонительное поведение крыс длительного уменьшения уровня экспрессии рецепторов дофамина (D1 и D2) в базолатеральном ядре миндалины с помощью локальной лентивирусной трансдукции. В задачи работы входило изучение влияние лентивирусной трансдукции 1) на проявление ранее выработанной реакции страха, ее угашение и повторное обучение при классическом оборонительном условном рефлексе; 2) на выработку и угашение условного рефлекса пассивного избегания в темно-светлой камере; 3) на обучение поиску скрытой платформы в водном лабиринте Морриса. Предполагали, что с помощью молекулярно-генетического метода воздействия на активность рецепторов мы сможем получить новые сведения о роли D1R и D2R в оборонительном поведении.
МЕТОДИКА
Объект исследования. Опыты проводили на 66 крысах самцах линии Wistar (питомник Столбовая) в течение 2.5 мес. В начале экспериментов возраст животных составлял 3–4 мес., вес достигал 250–300 г. Животных содержали в виварии при 12-часовом световом режиме (смена режима в 8 и 20 ч), в клетках группами по 5 крыс, со свободным доступом к воде и стандартному сухому корму. Эксперименты осуществляли с соблюдением принципов гуманности, изложенных в директивах Европейского Сообщества (2010/63/EU) и одобренных Комитетом по медицинской этике в соответствии с положением ИВНД и НФ РАН о работе с экспериментальными животными.
Выработка, тестирование и угашение условнорефлекторного страха. Для опытов использовали камеру Startle and Fear Combined System производства PanLab Harvard apparatus (Spain, 2000). В первом опыте проводили обучение животных (рис. 1 (а)), для этого после периода для исследования обстановки в 120 с давали 5 сочетаний звука (30 с, 80 дБ, 2000 Гц) и электрокожного раздражения лап через решетку пола (2 с, 0.8 мА, задержка 28 с от начала действия звука) с межстимульными интервалами в 20 с. Во втором опыте через 24 ч тестировали условнорефлекторный страх (Тест 1). При этом после 120 с периода исследования обстановки давали звук (120 с, 80 дБ, 2000 Гц), после которого следовал 120 с период без стимулов. На основании появления периодов замирания в Тесте 1 и их длительности судили об успешности обучения. После Теста 1 крыс оперировали, и суспензию лентивирусов вводили в миндалину. Для определения влияния лентивирусов на проявление условнорефлекторного страха через 12–14 дней после Теста 1 (через 8–11 дней после операции) животных тестировали повторно (Тест 2). В Тесте 2, как и во всех последующих тестах, порядок следования стимулов был такой же, как в Тесте 1. В дальнейшем в новом контексте в двух опытах угашали условнорефлекторный страх (рис. 1 (а)), при этом после 120 с периода исследования камеры давали 10 изолированных звуковых стимулов (30 с, 80 дБ, 2000 Гц) без электрокожных раздражений с 20 с межсигнальными интервалами. Через 24 ч после каждого опыта с угашением тестировали сохранность рефлекса в контексте Б (соответственно Тест 3 и 4). Далее проводили повторное обучение в первоначальном контексте, до и после которого следовали Тесты 5 и 6, чтобы можно было оценить эффективность обучения. На последнем этапе рефлекс повторно угашали в двух опытах.
Рис. 1.
Влияние лентивирусной трансдукции миндалины крыс на процент времени замирания при выработке и угашении классического оборонительного условного рефлекса. (а) – схематическое изображение последовательности опытов, Т1-6 – тесты с 1 по 6, Об1, 2 – обучение 1 и 2, Уг 1, 2 – угашение 1 и 2. (б) – суммарные данные по проценту времени замирания в Тестах 1–6, К – крысы с контрольным вирусом (scr), В1 D1 и В2 D1 – крысы с вирусами, снижающими экспрессию D1 рецепторов (шпильки sh1D1, sh3D1 соответственно), В1 D2 и B2 D2 – крысы с вирусами, снижающими экспрессию D2 рецепторов (шпильки sh3D2 и sh4D2 соответственно). n – число крыс в группе. * – статистически значимые различия между подгруппами крыс с рабочим и контрольным вирусом в тесте (р < 0.05, Repeated measures ANOVA, post-hoc анализ), # – тенденция (0.05 < р < 0.1). ↓ – снижение времени замирания по сравнению с Тестом 1 (р < 0.05, Repeated measures ANOVA, post-hoc анализ). (в) – процент времени замирания в различные интервалы времени в Тесте 5, (г) – в Тесте 6 (Factorial ANOVA). В D1 – суммарные данные по крысам с вирусами, снижающими экспрессию D1R, B D2 – по крысам с вирусами, снижающими экспрессию D2R. Интервалы времени: До – до действия, Звук – во время, После – после действия звука.
Fig. 1. The effects of the amygdalar lentiviral transduction on the acquisition and extinction of fear conditioning. (а) – Scheme of the experiment, T1-6 – tests 1-6, Об1, 2 – training 1 and 2, УГ 1, 2 – extinction 1 and 2. (б) – Averaged data on the percentage of freezing in Tests 1-6, K – the rats injected with control virus (scr), B1 D1 and B2 D1 – the rats with DRD1 knockdown (sh1D1, sh3D1 virus respectively), B1 D2 and B2 D2 – rats with DRD2 knockdown (sh3D2 and sh4D2 virus respectively). n – number of rats in the group. * – significant differences compared to control group in the test (p < 0.05, Repeated measures ANOVA, post hoc analysis), # – tendency to change compared to control group (0.05 < p < 0.1). ↓– the decrease in freezing time compared to Test 1 (p < 0.05, Repeated measures ANOVA, post hoc analysis). (в) – the percentage of freezing at different intervals in the Test 5, (г) – at the Test 6. В D1 – the rats with D1R down-regulation, B D2 – rats with D2R down-regulation. До – before, Звук – during, После – after the sound.
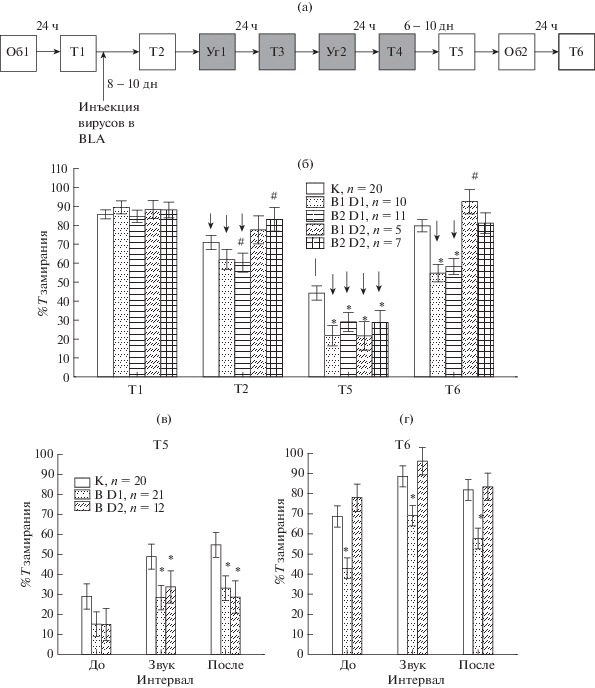
Исследовали поведение крыс в интервалы времени до, во время и после действия звука. По механограмме с помощью амплитудного и временного порогов выделяли периоды неподвижности (замирания) крыс длительностью не менее 2 с, когда наблюдались только периодические дыхательные движения животного. Подсчитывали процент времени замирания от общего времени каждого поведенческого этапа, а также число эпизодов замирания и среднее время таких эпизодов. Для обработки использовали стандартную программу, прилагающуюся к установке фирмы Panlab. Кроме того, после каждого опыта для определения степени эмоционального напряжения подсчитывали число уринаций и дефекаций.
Как и ранее [Павлова и др., 2015], на основании времени замирания в Тесте 1 выделяли группы крыс с разным проявлением условнорефлекторного страха – “много”- (МНЗ) и “малозамирающих” (МАЗ) животных. Крысы группы МНЗ с длительным замиранием представляли особый интерес, поскольку именно у них угашение рефлекса затруднено [Павлова и др., 2015]. Разделение на группы осуществляли, опираясь на медиану (med = = 81.7%) распределения крыс в зависимости от процента их времени замирания в опыте.
Выработка и угашение рефлекса пассивного избегания. Через 30–35 дней после операции, после последнего угашения условнорефлекторного страха у крыс вырабатывали рефлекс пассивного избегания в новой камере. Камера для обучения состояла из двух отсеков: темного (освещенность 2–12 лкс, размеры 24 × 24 × 24 см) и светлого (освещенность 270–300 лкс, размеры 27 × 27 × 27 см), соединенных между собой отверстием (5 × 7 см), которое могло закрываться шторкой. Пол темного отсека представлял собой решетку, через которую подавался ток. Вначале в двух опытах определяли латентный период входа в темный отсек до обучения (контроль). При этом крысу сажали в светлый отсек, в течение 30 с животное исследовало отсек, затем поднимали шторку, закрывающую вход в темный отсек, и определяли латентность входа в темный отсек. Далее в течение 180 с анализировали число переходов между отсеками и время нахождения в каждом отсеке. В третьем опыте после входа крысы в темный отсек давали электрокожное раздражение лап в течение 3 с током 0.8 мА. На следующий день после обучения в одной попытке определяли успешность обучения, при этом крыс сажали в светлый отсек, через 30 с шторка поднималась и в течение 180 с животному предоставлялась возможность зайти в темный отсек. Далее в течение 13 дней изучали угашение рефлекса, при этом крыс один раз в день сажали в экспериментальную камеру, последовательность событий была такой же, как в первом опыте после обучения. Под входом в отсек понимали перемещение всех четырех лап в темный отсек. По каждому дню подсчитывали число и латентность входов, время, проведенное в темном и светлом отсеках, число болюсов, уринаций и заглядываний в темный отсек, вероятность входа в темный отсек (число крыс, заходящих в темный отсек самостоятельно/общее число протестированных крыс). Разделяли заглядывания с засовыванием только головы и заглядывания с постановкой от одной до трех лап и перемещением части туловища в темный отсек. На последнем этапе условнорефлекторный страх на обстановку темного отсека камеры принудительно угашали, помещая крыс в темный отсек на 10–15 мин в течение двух опытов.
Обучение в водном лабиринте Морриса. Лабиринт представлял собой круглый бассейн диаметром 150 см, с высотой стенок 50 см, заполненный водой на 35 см. Платформа, выполненная из прозрачного пластика диаметром 10 см, располагалась ниже уровня воды на 1.5 см и отстояла от края лабиринта на 26 см. На стенках лабиринта размещали четыре плоские фигуры (треугольник, квадрат, крест, трапеция) для ориентации животных. Температура воды была 25–26°С. Обучение проходило в течение пяти дней, каждый день крысе предоставлялось четыре попытки длительностью 60 с для поиска платформы, при этом начальная точка посадки в бассейн все время менялась. При помещении в воду животное было ориентировано носом в сторону стенки бассейна. С помощью программы Etho Vision регистрировали траекторию движения крыс, дистанцию, скорость, латентность нахождения платформы, процент времени движения у края бассейна (20 см) и в средней его части. На шестой день для оценки успешности обучения следовал тест длительностью 30 с, во время которого платформу убирали. При этом подсчитывали латентность первого попадания на место, где ранее была платформа, дистанцию, скорость движения и процент времени движения в четырех квадрантах бассейна. Кроме того, для каждого дня и попытки рассчитывали вероятность нахождения платформы (число крыс, нашедших платформу/общее число протестированных животных).
Хирургическая операция с введением суспензии лентивирусов
В работе использовали пять лентивирусных конструкций, синтезированных на основе вируса иммунодефицита человека, которые были способны доставить в клетку короткие интерферирующие участки РНК. Две конструкции блокировали экспрессию генов D1R (вирусы B1 D1 и B2 D1, имели соответственно “шпильки” sh1D1 и sh3D1), две другие блокировали D2R (вирусы B1 D2 и B2 D2, содержали соответственно “шпильки” sh3D2 и sh4D2), одна конструкция использовалась в качестве контроля, поскольку не нарушала экспрессию генов рецепторов (scr). Все конструкции содержали зеленый флюоресцентный белок (green fluorescent protein, GFP), который позволял визуализировать область распространения суспензии в мозге. Лентивирусные конструкции были предоставлены лабораторией молекулярной нейробиологии ИВНД и НФ РАН. Титр вирусов составлял 107–108/мкл. 11-ти животным вводили вирус sh1D1, 15-ти – вирус sh3D1, 25-ти – контрольный вирус scr, 8-ми – вирус sh3D2 и 7-ми – вирус sh4D2.
Во время операции для наркоза использовали хлоралгидрат (400 мг/кг, внутрибрюшинно). Крыс фиксировали в стереотаксисе фирмы Kopf, США. Суспензию лентивирусов вводили в базолатеральную миндалину крыс по координатам АР = –2.8, L = 4.8, H = = 8.5 [Paxinos, Watson, 1998] в объеме 2 мкл в течение 8 мин со скоростью 0.25 мкл/мин последовательно в правую и левую миндалину. Для введения использовали электронный инжектор и шприц Гамильтона на 10 мкл с иглой диаметром 0.33 мм. После окончания введения иглу шприца вынимали только через 10 мин, для того чтобы избежать обратного тока суспензии. В конце операции отверстия в кости закрывали стоматологической пластмассой. Эксперименты с крысами начинали через 10 дней после операции.
Морфологический контроль и иммуногистологический анализ. После окончания опытов проводили транскардиальную перфузию мозга 50 мл 0.9% физиологического раствора, после чего мозг помещали на сутки в 4% раствор формалина. Срезы мозга толщиной 50 мкм изготавливали на вибротоме Leica VT 1200S. Область распространения лентивируса определяли в соответствии со стереотаксическим атласом мозга крыс [Paxinos, Watson, 1998] по свечению зеленого флюоресцентного белка (GFP) на флуоресцентном микроскопе (Keyence BioRevo BZ9000). Часть срезов была докрашена с использованием антител к GFP.
У группы крыс было проведено дополнительное иммуногистохимическое окрашивание срезов на белок NeuN (Neuronal Nuclei), являющийся маркером ядер нейронов, и глиальный фибриллярный кислый белок (Glial fibrillary acidic protein, GFAP), являющийся маркером астроглиальных клеток. В качестве первичных антител к GFAP использовали mouse anti-GFAP (Sigma, USA), а к NeuN – rabbit anti-NeuN антитела (Sigma, USA) в разведении 1:500 и 1:800 соответственно. Вторичные антитела к GFAP (goat-anti-mouse, Alexa Fluor 546 conjugate, USA Invitrogen) и к NeuN (goat-anti-rabbit, Alexa Fluor 568 conjugate, Invitrogen, USA Invitrogen) использовали в разведении 1:500. Более подробно процедура окрашивания была описана ранее [Tukhbatova et al., 2011]. Для иммуногистохимического окрашивания изготавливали срезы мозга толщиной 25–30 мкм на вибротоме Leica VT 1200S. Окрашенные срезы были помещены на предметное стекло и покрыты защитной средой с DAPI (для прокрашивания ядер клеток), предотвращающей быстрое выцветание флуоресцентных меток. Визуализация результатов окрашивания и фотографии срезов были сделаны на флюоресцентом микроскопе Keyence BioRevo BZ9000.
Статистический анализ. При сопоставлении групп крыс применяли дисперсионный анализ ANOVA/MANOVA, раздел для повторных измерений (Repeated measures ANOVA), многофакторный дисперсионный анализ (Factorial ANOVA) и однофакторный анализ (One-way ANOVA). Анализировали влияние факторов “вид вируса”, “номер опыта”, “номер пробы”, “группа крыс”. При post-hoc анализе применяли критерий Fisher LSD. Различия считали значимыми при p < 0.05, отмечали наличие тенденции при 0.05 ≤ р ≤ 0.1. При сравнении процентных соотношений использовали 2 × 2 Table (Nonparametric Statistics), применяли критерий χ2.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Результаты иммуногистохимического анализа. Исследование срезов мозга на флуоресцентном микроскопе обнаружило зеленое свечение GFP метки на уровне миндалины у 60 животных (90.9%, рис. 2 (а), (б)), что свидетельствовало об успешной трансдукции заданной структуры у подавляющего большинства крыс. У четырех животных свечение отсутствовало, у двух наблюдалось в других структурах мозга. Из 60 крыс со свечением GFP метки в миндалине у 40 крыс (60.6%) наблюдалось достаточно яркое свечение на уровне BLA, у 12 (18.2%) – на уровне центральных ядер и на границе с BLA, у 8 животных (12.1%) свечение в миндалине было слабое с одной или двух сторон. Все результаты, описанные в статье, получены на животных, показавших как сильное, так и слабое свечение GFP-метки в миндалине.
Рис. 2.
Иммуногистохимический анализ эффективности лентивирусной трансдукции в миндалине. (а), (б) – фотографии среза мозга крысы с разным увеличением, окрашивание на GFP. (в)–(д) – фотографии одного и того же среза мозга с разными фильтрами, (в) – окрашивание на GFP (вирус), (г) – окрашивание на GFAP (астроциты), (д) – совмещение окрашивания на GFP и GFAP. (е)–(з) – фотографии другого среза мозга с разными фильтрами, (е) – окрашивание на GFP, (ж) – окрашивание на NeuN (ядра нейронов), (з) – совмещение. На (в)–(з) масштабная линейка – 50 мкм. Зеленые стрелки указывают на зараженные вирусом астроциты, оранжевые – на нейроны.
Fig. 2. Immunohistochemical analysis of the lentiviral transduction efficiency in the amygdala. (а), (б) – images (with different magnification) showing green fluorescent protein (GFP) immunostaining in amygdala. In (в)–(д) – images of the same section after antibody staining against: (в) – GFP (virus), GFAP (astrocytes), (г) – merge of GFP and GFAP immunostaining. (е)–(з) – Immunohistochemistry images of another section after antibody staining against: (е) – GFP (virus), (ж) – NeuN (neurons), (з) – merge. On (в)–(з) scale bar – 50 mcm. Green arrows indicate infected astrocytes, orange ones – neurons.

У трех крыс было проведено дополнительно иммуногистохимическое окрашивание срезов мозга на GFP (вирус), GFAP (астроциты), NeuN (ядра нейронов). Анализ срезов мозга позволил определить, что заражению вирусом подвергаются как астроциты (рис. 2 (в-д)), так и нейроны (рис. 2 (е-з)). Число зараженных нейронов у разных крыс составляло 14%, 12% и 31% (в среднем 19%) от общего числа нервных клеток, наблюдаемых в поле зрения размером 100 × 100 мкм. Число зараженных астроцитов было больше – 74%, 73%, 67% (в среднем 73%).
Влияние лентивирусной трансдукции клеток миндалины на выработку, проявление и угашение условнорефлекторного страха. На рис. 1 (б) представлены данные по изменению времени замирания у крыс с введенными в миндалину как контрольными вирусами (К), так и вирусами, снижающими экспрессию D1R (В1 D1, В2 D1) и D2R (B1 D2 и B2 D2). Схема экспериментов приведена на рис. 1 (а). Анализ с помощью Repeated measures ANOVA обнаружил влияние фактора “вид вируса” (F4.154 = 3.9, p = 0.005) и взаимодействие факторов “вид вируса” и “номер теста” (F12.462 = 6.2, p < 0.001). Post-hoc анализ показал, что изначально после обучения в Тесте 1 между группами крыс, которым в дальнейшем вводились разные вирусы, не было обнаружено различий по времени замирания. В Тесте 2 через 8–10 дней после введения вирусов у крыс с К наблюдалось снижение времени замирания, у крыс с B1 D1 и B2 D1 снижение было несколько более выраженным (тенденция), чем у животных с K. Снижение времени замирания в Тесте 2 могло быть связано с длительным интервалом времени между Тестом 1 и 2. После двух сеансов угашения в Тесте 5 время замирания снижалось у всех групп крыс по сравнению с Тестом 1, однако у животных как с B1 D1, B2 D1, так и с В1 D2, B2 D2 снижение было более сильным, чем у крыс с К (рис. 1 (б)). Повторное обучение у крыс с вирусами, снижающими экспрессию D1R, было менее эффективным, чем у других групп животных, и приводило к значительно меньшему замиранию в Тесте 6. Эффективность обучения крыс с вирусами, действующими на D2R, не отличалась от животных с К (рис. 1 (б)).
Важно отметить, что группы крыс с двумя разными вирусными конструкциями, нарушающими экспрессию одного и того же рецептора, показали сходные результаты, что позволило в дальнейшем объединить крыс в группы с вирусами, влияющими на работу D1R (В D1) и D2R (B D2).
Подробный анализ по различным интервалам в Тестах 5 и 6 показал (рис. 1 (в), (г)), что в Тесте 5 после угашения крысы с В D1 и B D2 меньше замирали во время и после действия звука, чем контрольные животные. В Тесте 6 крысы с B D1 меньше замирали до, во время и после действия звука.
Таким образом, снижение экспрессии D1R в миндалине вызывало ускорение угашения условнорефлекторного страха и препятствовало повторному обучению. Снижение экспрессии D2R приводило только к ускорению угашения, но не влияло на повторное обучение.
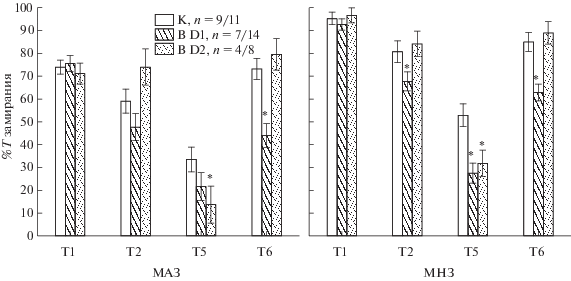
Результаты сопоставления влияния вирусов на группы крыс с разным уровнем замирания представлены на рис. 3. Анализ с помощью Repeated measures ANOVA обнаружил влияние фактора “вид вируса” (F2.153 = 10.1, p < 0.001), “группа крыс” (F1.153 = 29.0, p < < 0.001), “номер теста” (F2.153 = 207.8, p < < 0.001), однако взаимодействие факторов “вид вируса”/“номер теста”/“группа крыс” не было выявлено (F6.459 = 1.3, p = 0.245). Post-hoc анализ показал, что в группе МНЗ крыс введение В D1 вызывало значимое снижение времени замирания в Тестах 2, 5, 6 по сравнению с контролем, в то время как в группе МАЗ животных значимые изменения наблюдались только в Тесте 6, т.е. введение В D1 оказывало большее влияние на МНЗ группу, чем на МАЗ. Введение В D2 приводило к сходным изменениям во времени замирания в группах МНЗ и МАЗ, значимые отличия получены только в Тесте 5. Таким образом, при выработке и угашении условнорефлекторного страха снижение экспрессии D1R в миндалине оказывало большее влияние на МНЗ крыс, чем МАЗ животных.
Рис. 3.
Влияние лентивирусной трансдукции миндалины на процент времени замирания при выработке и угашении классического оборонительного условного рефлекса у мало- (МАЗ) и многозамирающих (МНЗ) крыс. В D1 – суммарные данные по крысам с вирусами, снижающими экспрессию D1R, B D2 – по крысам с вирусами, снижающими экспрессию D2R, К – крысы с контрольным вирусом. Остальные обозначения как на рис. 1.
Fig. 3. The effects of the amygdalar lentiviral transduction on the percentage of freezing on the expression and extinction of fear conditioning in rats with low freezing level (MAЗ) and high freezing level (MНЗ). BD1 – the rats with D1R down-regulation, BD2 – rats with D2R down-regulation, K – rats with a control virus. Other designations as in Fig. 1.
Влияние лентивирусной трансдукции клеток миндалины на выработку и угашение рефлекса пассивного избегания. Анализ с помощью Repeated measures ANOVA различных показателей поведения в процессе выработки и угашения рефлекса обнаружил влияние фактора “вид вируса” на латентность входа в темный отсек (F30.461 = 23.17, p < 0.001), на вероятность входа (F30.461 = 20.12, p < 0.001), на заглядывания с постановкой лап в темном отсеке (F24.389 = 23.73, p < 0.001), число болюсов (F30.461 = 9.53, p < 0.001). Post-hoc анализ показал, что до обучения и в 1–2 день после выработки рефлекса значимых различий между группами крыс с разными вирусами не наблюдалось (рис. 4 (а-в)). В 1–2 день после обучения из группы с К заходили в темный отсек 9% крыс (рис. 4 (г)), из группы с В D1 несколько больше – 18%, а из группы с B D2 – 0%, различие между группами незначительно. Таким образом, условный рефлекс пассивного избегания выработался одинаково успешно у всех групп крыс.
Рис. 4.
Влияние лентивирусной трансдукции миндалины на выработку и угашение рефлекса пассивного избегания в темно-светлой камере. (а) – латентность входа в темный отсек камеры (ТО), (б) – вероятность самостоятельного входа, (в) – заглядывания с постановкой одной-трех лап в темном отсеке. По оси абсцисс на (а)–(в) – номер опыта, -2 и -1 – до обучения, 0 – в день обучения, 1–13 – после выработки условного рефлекса. На (а)–(в): * – значимые различия (р < 0.05, Repeated measures ANOVA, post-hoc анализ) между группами крыс с BD1, BD2 и контрольным вирусом (K) в опыте, # – тенденция (0.05 < р < 0.1). (г) – процент крыс, заходящих в темный отсек в 1-2 опыте после выработки рефлекса (не выработали рефлекс). (д) – процент крыс, не заходивших в темный отсек ни разу в течение 13 дней после выработки рефлекса (нет угашения). На (д) * – статистически значимые различия (р < 0.05, 2 Х 2 table, Nonparametric Statistics, критерий χ2). В D1 – суммарные данные по крысам с вирусами, снижающими экспрессию D1R, B D2 – по крысам с вирусами, снижающими экспрессию D2R.
Fig. 4. The effect of DRD1 and DRD2 down-regulation in the amygdala on passive avoidance learning and extinction in dark-light chamber. (а) – the latency to enter the dark compartment, (б) – the probability to enter the dark compartment independently, (в) – looking in the dark compartment with the setting up to three paws. On OX-axis: (а)–(в) – the number of trial, -2 and -1 – before, 0 – training, 1-13 – after training. * – Significant differences (p < 0.05, Repeated measures ANOVA, post hoc analysis) compared to control group, # – tendency to change compared to control group (0.05 < p < 0.1). (г) – the percentage of rats entering the dark compartment on day 1–2 after training. (д) – the percentage of rats not entering the dark compartment on any of 13 days after training (resistant to extinction). On (д) * – significant differences (p < 0.05, a 2 X 2 table, Nonparametric Statistics, χ2 criterion). Other designations as in Fig. 1.
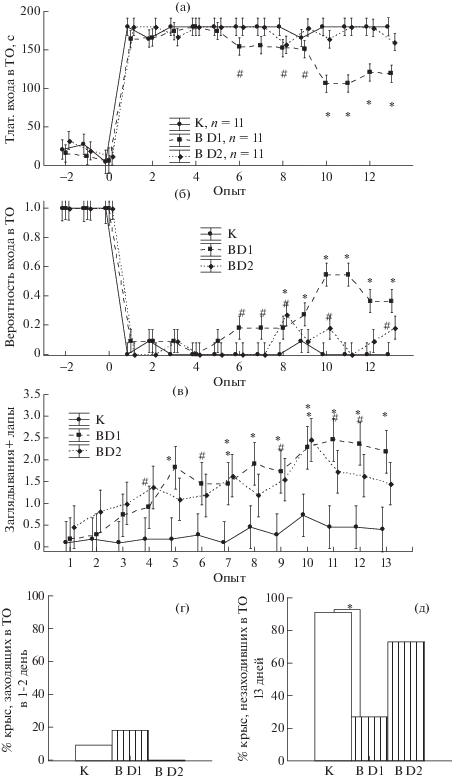
Анализ динамики угашения рефлекса пассивного избегания на протяжении 13 дней показал, что у крыс с В D1 латентность входа в темный отсек с 10 дня была меньше (рис. 4 (а)), а вероятность входа с 9 дня больше (рис. 4 (б)), чем у животных с К. Число заглядываний с постановкой лап в темном отсеке (“полувходы”) у крыс с В D1 было больше, чем у животных с К, начиная с пятого дня (рис. 4 (в)). У крыс с В D2 латентность входа в темный отсек практически не отличалась от животных с К (рис. 4 (а)), вероятность входа в отдельные дни (8, 10 и 13 день) могла быть выше, чем у животных с К (рис. 4 (б)). Число заглядываний с постановкой лап у крыс с В D2, начиная с седьмого дня, было выше, чем у животных с К (рис. 4 (в)). В целом из группы крыс с В D1 не заходили в темный отсек ни разу на протяжении 13 дней 27% животных, из группы К значительно больше – 91%, из группы с В D2 – 73% крыс (рис. 4 (д)).
Таким образом, снижение экспрессии D1R или D2R в клетках миндалины ускоряло угашение рефлекса пассивного избегания, наиболее эффективным было влияние на D1R.
Влияние лентивирусной трансдукции клеток миндалины на обучение в водном лабиринте Морриса. Анализ с помощью Repeated measures ANOVA различных показателей поведения на протяжении 5 дней обучения в бассейне Морриса не обнаружил влияния фактора “вид вируса” на вероятность нахождения платформы (F2.116 = 2.2, p = 0.116) и на дистанцию, проплываемую до платформы (F2.115 = = 2.3, p = 0.101). Вместе с тем фактор “вид вируса” влиял на процент времени движения у края бассейна (F2.113 = 11.3, p < 0.001) и скорость движения (F2.113 = 9.28, p < 0.001).
Post-hoc анализ показал, что у крыс с В D1 в первый день (четвертая попытка), второй день (вторая попытка), четвертый и пятый дни (первые попытки) вероятность нахождения платформы была ниже, чем у крыс с К (рис. 5 (а)). Крысы с В D1 (рис. 5 (б)) проплывали большую дистанцию на второй день (вторая попытка), четвертый и пятый дни (первая попытка), а также больше времени проводили у края бассейна (четвертый, пятый и шестой дни), чем крысы с К (рис. 5 (в)). Таким образом, крысы с В D1 имели трудности в обучении в первый-второй день и первые попытки на четвертый-пятый день у них были менее успешные, чем у животных с К.
Рис. 5.
Влияние лентивирусной трансдукции миндалины на обучение крыс в лабиринте Морриса. (а) – вероятность нахождения платформы, (б) – дистанция, проплываемая в опыте, (в) – процент времени движения крысы около края бассейна. По оси абсцисс – номер попытки (верхняя строка), день (нижняя строка). * – значимые различия (р < 0.05) между группами крыс с B D1, B D2 и контрольным вирусом (K), # – тенденция (0.05 < р < 0.1). Сопоставление 1–5 дня с помощью Repeated measures ANOVA, анализ данных 6 дня с помощью One-way ANOVA. Остальные обозначения как на рис. 4.
Fig. 5. The effect of DRD1 and DRD2 down-regulation in the amygdala on learning in the Morris water maze. (а) – the probability of finding the hidden platform, (б) – distance moved in water maze on the trial, (в) – the percentage of the movement near the walls of maze. Labels on the OX axis indicate the number of trial (top row), day (bottom row). * – significant differences (p < 0.05) compared to control group, # – trend (0.05 < p < 0.1). Other designations as in Fig. 4.
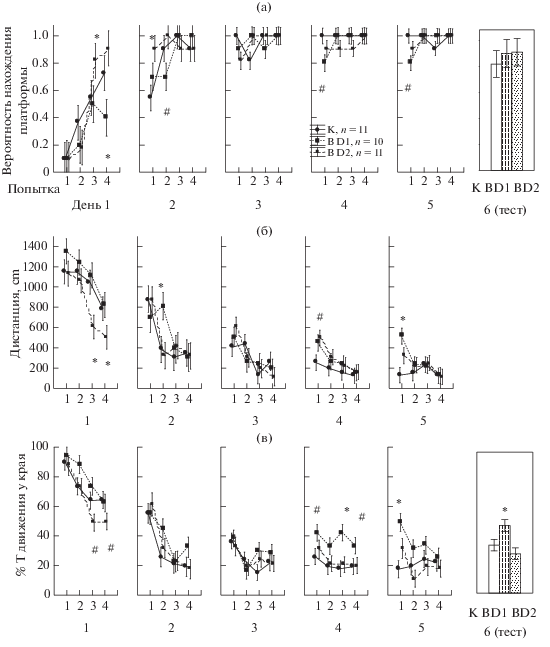
У крыс с В D2 в первый день на третьей попытке, во второй день на первой попытке вероятность нахождения была больше (рис. 5 (а)), они проплывали меньшее расстояние до платформы (рис. 5 (б)), чем животные с К. Крысы с В D2 меньше времени двигались у края бассейна в первый день (рис. 5 (в)) и имели большую скорость движения на второй, третий, пятый и шестой дни. Таким образом, обучение крыс с В D2 по ряду параметров проходило быстрее в начале экспериментов.
Другие показатели поведения крыс, например, латентность нахождения платформы, процент времени движения в целевом квадранте, число болюсов не отличались между группами крыс с разными вирусами на протяжении всех шести дней.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В нашей работе яркое зеленое свечение GFP метки на уровне базолатерального и центрального ядра миндалины наблюдалось у 78% крыс, у 12% свечение было слабое, т.е. экспрессия вирусных конструкций прослеживалась у подавляющего большинства крыс. По данным литературы [Naldini et al., 1996] лентивирусы характеризуются высокой эффективностью трансдукции, что обеспечивает высокий процент зараженных животных. Поскольку используемые нами лентивирусы не содержали тканеспецифические промоторы, трансдукции подверглись как нейроны, так и глиальные клетки. Больший процент зараженных клеток среди астроцитов, чем среди нейронов можно, по-видимому, объяснить тем, что астроциты выполняют защитную функцию, являются ключевыми элементами гематоэнцефалического барьера [Cakir et al., 2007].
Вопрос о том, какую роль играют трансфицированные клетки астроглии в наблюдаемых нами поведенческих эффектах, не ясен. Лентивирусы хотя и проникают в астроциты, но изменить их работу могут только при наличии дофаминовых рецепторов на глиальных клетках. Известно, что астроциты стриатума и коры мозга в культуре клеток были способны реагировать на подводимый к ним дофамин, причем эффект блокировался антагонистами D1R и D2R (SCH 23390 и сульпиридом) [Reuss et al., 2001]. Наличие D1R на астроцитах стриатума было показано с помощью ПЦР анализа и вестерн-блот анализа [Zanassi et al., 1999], а также иммуногистохимических методов [Nagatomo et al., 2017]. Так, GFAP-положительные астроциты в черной субстанции мышей являлись и иммунореактивными на D1R. Данные о наличии D1R или D2R у астроцитов миндалины в настоящее время отсутствуют.
В нашей работе у крыс со сниженной экспрессией D1R и D2R в миндалине наблюдалось более быстрое угашение условнорефлекторного страха в модели классического оборонительного рефлекса по сравнению с животными с контрольным вирусом, о чем свидетельствовало более быстрое снижение времени замирания. Сходные результаты были получены ранее при локальной инъекции антагонистов D1R (SCH 23390) или D2R (раклоприда) в базолатеральную миндалину непосредственно перед сеансами угашения [Павлова и др., 2015]. Повторная выработка классического оборонительного условного рефлекса у крыс со сниженной экспрессией D1R была менее эффективна, чем у животных с контрольным вирусом и у животных с B D2. Как было ранее показано, введение в миндалину антагонистов D1R до начала выработки условнорефлекторного страха приводило к уменьшению замирания при тестировании рефлекса, введение агониста данного рецептора вызывало, наоборот, его увеличение [Guarraci et al., 1999; Guarraci et al., 2000; Nader, LeDoux, 1999; Павлова и др., 2015], а введение антагониста D2R практически не влияло на повторное обучение [Павлова и др., 2015]. Таким образом, наблюдалось сходство эффектов от введения антагонистов дофаминовых рецепторов и от снижения их экспрессии с помощью лентивирусной трансдукции. Вместе с тем длительность изменений в поведении крыс была разной, после введения антагонистов эффекты ослабевали через несколько часов и исчезали уже на следующий день, после лентивирусной трансдукции изменения в поведении крыс наблюдались в течение всего времени наблюдения (2 мес.), что придает особую ценность такому методу воздействия на активность D1R и D2R. Для ответа на вопрос о том, не ослабевают ли эффекты от вирусной трансдукции с течением времени, требуются дополнительные опыты. При использовавшейся в нашей работе схеме экспериментов у всех крыс последовательность опытов была одинаковой, и каждый вид рефлексов тестировался однократно.
Разделение крыс на группы МНЗ и МАЗ при классическом оборонительном рефлексе позволило показать, что снижение экспрессии D1R вызывает наибольшие изменения у МНЗ крыс, снижение экспрессии D2R одинаково повлияло на обе группы. Эти результаты позволяют предположить особую роль D1R миндалины в обеспечении разного проявления условнорефлекторного страха у животных с различными индивидуально-групповыми особенностями поведения. Ранее с помощью локального введения антагониста D1R в миндалину крыс была показана большая чувствительность у МНЗ крыс по сравнению с МАЗ животными при угашении условнорефлекторного страха на звук [Павлова и др., 2015].
При выработке пассивного избегания число необучившихся крыс, т.е. заходящих в темный отсек в 1–2 день после обучения, не отличалось у животных с В D1, B D2 и К. Вместе с тем у крыс с В D1 угашение рефлекса пассивного избегания проходило существенно быстрее, чем у животных с К. У крыс с В D2 по некоторым параметрам рефлекс пассивного избегания также угашался быстрее, чем у контрольных крыс, хотя изменения были менее выражены, чем у животных с В D1. Известно, что блокада или активация D1R и D2R способна повлиять на выработку и угашение рефлекса пассивного избегания. Согласно данным литературы, при системном введении антагониста D2R (сульпирида) ухудшалась выработка рефлекса пассивного избегания у нормальных животных, а при введении агониста (квинпирола) наблюдался дефицит угашения [Дубровина, Зиновьева, 2008]. У животных с депрессивноподобным состоянием, вызванным вынужденным плаванием, блокада D1R и D2R приводила к ускорению угашения [Дубровина, Зиновьева, 2008]. Введение агониста D1R приводило к удлинению угашения рефлекса у субмиссивных, но не агрессивных мышей [Дубровина, 2005]. Показано, что локальное введение антагонистов D1R (SCH23390) или D2R (сульпирида) в миндалину крыс сразу после выработки рефлекса пассивного избегания приводило к ослаблению памяти при тестировании, что свидетельствовало, по мнению авторов, о нарушении консолидации памяти [Lalumiere et al., 2004]. Наши результаты об ускорении угашения рефлекса пассивного избегания у животных со снижением экспрессии D1R и D2R в миндалине дополняют данные литературы с введением антагонистов и не противоречат им.
Обучение в лабиринте Морриса у всех групп крыс прошло успешно, судя по результатам шестого тестового дня. При планировании экспериментов данная форма оборонительного поведения бралась в качестве контроля, мы не ожидали увидеть изменения в пространственном обучении после лентивирусной трансдукции. Однако в процессе обучения, в первый-второй день, крысы с В D1 хуже находили платформу, чем контрольная группа, и первые попытки в четвертый и пятый день у них были менее успешные, что можно рассматривать как признаки некоторого нарушения кратковременной и долговременной памяти. Крысы с В D1 больше времени проводили у края бассейна в 4–6 дни, что, по-видимому, препятствовало быстрому нахождению платформы, которая была расположена в средней части бассейна. Выявленные отклонения в начале обучения у крыс после снижения экспрессии D1R в миндалине могли быть связаны также с эмоционально-мотивационными отличиями данных животных, а именно с уменьшением мотивации избавления при попадании в воду. Среди этой группы крыс было много животных, которые после нахождения платформы спрыгивали с нее и продолжали плавание.
Крысы с В D2 в первый день, наоборот, легче находили платформу, проплывая меньшее расстояние, чем контрольная группа. У крыс этой группы был меньше тигмотаксис в первый день, возможно, из-за меньшей тревожности, и это могло способствовать быстрому нахождению платформы. Ранее при локальном введении антагониста D2 рецепторов (раклоприда) в миндалину наблюдали снижение тревожности крыс в приподнятом крестообразном лабиринте [Павлова и др., 2015].
Как известно, поиск скрытой платформы в лабиринте Морриса – это тест на пространственную память (см. обзор [Vorhees, Williams, 2014]). В многочисленных работах была установлена зависимость пространственной навигации, прежде всего, от активности и сохранности гиппокампа, энторинальной коры и окружающих их структур. Миндалина, как известно, имеет морфологические связи с гиппокампом. Электрическая стимуляция миндалины с последующими судорогами могла приводить к нарушению пространственного обучения в лабиринте Морриса [McNamara et al., 1992], или, наоборот, улучшать обучение у животных с перерезкой связей между бахромкой и сводом (fimbria и fornix) [Almaguer et al., 2005]. Разрушение миндалины с помощью иботеновой кислоты нарушало обучение в лабиринте Морриса у мышей при дополнительном стрессирующем воздействии (запах хищника) [Galliot et al., 2010]. Исходя из этих данных, не кажется удивительным, что воздействие на миндалину в наших опытах могло приводить к изменению динамики обучения поиску скрытой платформы.
В литературе имеются сведения о влиянии дофаминергической системы на пространственное обучение. Системное введение антагониста D2R (сульпирида) или D1R (SCH 23390) приводило к нарушению нахождения скрытой платформы в бассейне Морриса [Stuchlik et al., 2007; Voller et al., 2008]. Микроинъекции агониста D1R (SKF38393) в вентральный паллидум [Peczely et al., 2014] или зубчатую фасцию гиппокампа [Wan et al., 2014], наоборот, улучшали пространственное обучение в бассейне Морриса. Мутантные мыши с дефицитом D1R демонстрируют нарушения в пространственном обучении [Karasinska et al., 2000; Xing et al., 2010]. Наши данные о трудностях в обучении поиску скрытой платформы в первый-второй день после лентивирусной трансдукции подтверждают большую роль D1R в пространственном обучении.
Таким образом, снижение экспрессии рецепторов дофамина (D1 и D2) в миндалине с помощью лентивирусной трансдукции показало их разную роль при выработке и угашении оборонительных рефлексов. D1R важны при выработке классического оборонительного рефлекса, для проявления условнорефлекторного страха в виде длительного замирания, обучению поиску скрытой платформы в лабиринте Морриса, а также необходимы для стойкого сохранения следа памяти, устойчивости к угашению рефлексов. D2R важны для длительного сохранения следа памяти. Можно предположить, что разная роль данных рецепторов в оборонительном поведении связана с различиями в их локализации [de la Mora et al., 2010], а также с разными механизмами влияния на клетки миндалины [Pape, 2005; Marowsky et al., 2005; Manko et al., 2011; Chu et al., 2012; Pinto, Sesack, 2008].
В целом метод локальной лентивирусной трансдукции продемонстрировал свою эффективность для получения животных с локальными генетическими модификациями и изменениями в оборонительном поведении.
ВЫВОДЫ
1. Введение суспензии лентивирусов c титром 107–108/мкл в объеме 2 мкл билатерально в миндалину крыс приводило к их успешной экспрессии у 78% животных, о чем судили по уровню свечения флюоресцентного белка GFP. Дополнительное иммуногистохимическое окрашивание показало, что заражению подвергаются как нейроны (в среднем 19%), так и астроциты (73%).
2. Снижение экспрессии D1R в миндалине препятствовало выработке классического оборонительного рефлекса, способствовало его быстрому угашению, ускоряло угашение рефлекса пассивного избегания в темно-светлой камере, создавало трудности в начале обучения поиску скрытой платформы в водном лабиринте Морриса.
3. Поведение многозамирающих крыс изменялось в большей степени, чем у малозамирающих животных при классическом оборонительном рефлексе после снижения экспрессии D1R в миндалине.
4. Снижение экспрессии D2R в миндалине ускоряло угашение классического оборонительного рефлекса, условного рефлекса пассивного избегания и способствовало успешному поиску платформы в лабиринте Морриса в начале обучения.
5. При классическом оборонительном рефлексе снижение экспрессии D1R и D2R вызывало сходные изменения в поведении крыс, как при локальном введении в миндалину антагонистов данных рецепторов.
6. Роль D1R и D2R миндалины отличается при оборонительном поведении. Функционирование D1R в отличие от D2R в миндалине важно для приобретения оборонительных рефлексов, для проявления условнорефлекторного страха в виде длительного замирания. Работа как D1R, так и D2R обеспечивает высокий уровень сохранности рефлексов, устойчивости к угашению.
Список литературы
Дубровина Н.И. Влияние активации Д1-дофаминовых рецепторов на угашение условной реакции пассивного избегания и амнезию у агрессивных и субмиссивных мышей. Журн. высш. нерв. деят. 2005. 55 (4): 543–548.
Дубровина Н.И., Зиновьева Д.В. Влияние активации и блокады дофаминовых рецепторов на угашение реакции пассивного избегания у мышей с депрессивноподобным состоянием. Журн. высш. нерв. деят. 2008. 58 (5): 605–610.
Павлова И.В., Рысакова М.П., Сергеева М.И. Влияние блокады D1 и D2 рецепторов в базолатеральной миндалине на поведение крыс с высоким и низким уровнем тревожности и страха. Журн. высш. нерв. деят. 2015. 65 (4): 471–485.
Саложин С.В., Большаков А.П. Трансфекция клеток нервной системы. Журн. высш. нерв. деят. 2009. 59 (1): 3–14.
Almaguer W., Capdevila V., Ramirez M., Vallejo A., Rosillo J.C., Bergado J.A. Post-training stimulation of the basolateral amygdale improves spatial learning in rats with lesion of the fimbria-fornix. Restor. Neurol. Neurosci. 2005. 23 (1): 43–50.
Bananej M., Karimi-Sori A., Zarrindast M.R., Ahmadi S. D1 and D2 dopaminergic systems in the rat basolateral amygdale are involved in anxiogenic-like effects induced by histamine. J. Psychopharmacol. 2012. 26 (4): 564–574.
Banerjee A., Luong J.A., Ho A., Saib A.O., Ploski J.E. Overexpression of Homer1a in the basal and lateral amygdala impairs fear conditioning and induces an autism-like social impairment. Mol. Autism. 2016. 29: 7–16.
Cakir T., Alsan S, Saybasili H., Akin A., Ulgen K. Reconstruction and flux analysis of coupling between metabolic pathways of astrocytes and neurons: application to cerebral hypoxia. Theor. Biol. Med. Model. 2007. 4 (48): 1–18.
Chu H.Y., Ito W., Li J., Morozov A. Target-specific suppression of GABA release from parvalbumin interneurons in the basolateral amygdala by dopamine. J Neurosci. 2012. 32 (42):14815–14820.
de la Mora M.P., Gallegos-Cari A., Arizmendi-García Y., Marcellino D., Fuxe K. Role of dopamine receptor mechanisms in the amygdaloid modulation of fear and anxiety: Structural and functional analysis. Prog Neurobiol. 2010. 90 (2): 198–216.
de Solis C.A. Holehonnur R., Banerjee A., Luong J.A., Lella S.K., Ho A., Pahlavan B., Ploski J.E. Viral delivery of shRNA to amygdala neurons leads to neurotoxicity and deficits in Pavlovian fear conditioning. Neurobiol. Learn. Mem. 2015. 124: 34–47.
de Souza Caetano K.A., de Oliveira A.R., Brandão M.L. Dopamine D2 receptors modulate the expression of contextual conditioned fear: role of the ventral tegmental area and the basolateral amygdala. Behav. Pharmacol. 2013. 24 (4): 264–274.
Inglis F.M., Moghaddam B. Dopaminergic innervation of the amygdala is highly responsive to stress. J. Neurochem. 1999. 72 (3):1088–1094.
Gafford G.M., Guo J.D., Flandreau E.I., Hazra R., Rainnie D.G., Ressler K.J. Cell-type specific deletion of GABA(A)α1 in corticotropin-releasing factor-containing neurons enhances anxiety and disrupts fear extinction. Proc. Natl. Acad. Sci. USA. 2012. 109 (40): 16330–16335.
Galliot E., Levaillant M., Beard E., Millot J.L., Pourie G. Enhancemment of spatial learning by predator oddor in mice: involvement of amygdale and hippocampus. Neurobiol. Learn. Mem. 2010. 93 (2): 196–202.
Greba Q, Kokkinidis L. Peripheral and intraamygdalar administration of the dopamine D1 receptor antagonist SCH 23390 blocks fear-potentiated startle but not shock reactivity or the shock sensitization of acoustic startle. Behav Neurosci. 2000. 114 (2): 262–272.
Guarraci F.A., Frohardt R.J., Kapp B.S. Amygdaloid D1 dopamine receptor involvement in Pavlovian fear conditioning. Brain Res. 1999. 827 (1–2): 28–40.
Guarraci F.A., Frohardt R.J., Falls W.A., Kapp B.S. The effects of intra-amygdaloid infusions of a D2 dopamine receptor antagonist on Pavlovian fear conditioning. Behav Neurosci. 2000. 114 (3): 647–651.
Heldt S.A., Zimmermann K., Parker K., Gaval M., Weinshenker D., Ressler K.J. BDNF deletion or TrkB impairment in amygdala inhibits both appetitive and aversive learning. J. Neurosci. 2014. 34 (7): 2444–2450.
Karasinska J.M., George S.R., El-Ghundi M., Fletcher P.J., O’Dowd B.F. Modification of dopamine D(1) receptor knockout phenotype in mice lacking both dopamine D(1) and D(3) receptors. Eur. J. Pharmacol. 2000. 399 (2–3): 171–181.
Kroner S., Rosenkranz J.A., Grace A.A., Barrionuevo G. Dopamine modulates excitability of basolateral amygdale neurons in vitro. J. Neurophysiol. 2005. 93 (3): 1598–1610.
Lalumiere R.T., Nguyen L.T., McGaugh J.L. Post-training intrabasolateral amygdale infusions of dopamine modulate consolidation of inhibitory avoidance memory: involvement of noradrenergic and cholinergic systems. Eur. J. Neurosci. 2004. 20 (10): 2804–2810.
Lebedev T.D., Spirin P.V., Prassolov V.S. Transfer and expression of small interfering RNAs in mammalian cells using lentiviral vectors. Acta Naturae. 2013. 5 (2): 7–18.
LeDoux J. E. The amygdale. Curr. Biol. 2007. 17 (20): 868–874.
Liu Y.F., Chen H.I., Wu C.L., Kuo Y.M., Yu L., Huang A.M., Wu F.S., Chuang J.I., Jen C.J. Differential effects of treadmill running and wheel running on spatial or aversive learning and memory: roles of amygdalar brain-derived neurotrophic factor and synaptotagmin I. J Physiol. 2009. 587: 3221–3231.
Marowsky A., Yanagawa Y., Obata K., Vogt K.E. A specialized subclass of interneurons mediates dopaminergic facilitation of amygdala function. Neuron. 2005. 48 (6):1025–1037.
Mańko M., Geracitano R., Capogna M. Functional connectivity of the main intercalated nucleus of the mouse amygdala. J Physiol. 2011. 589 (Pt 8): 1911–1925.
Martina M., Bergeron R. D1 and D4 dopaminergic receptor interlay mediates coincident G protein-independent and dependent regulation of glutamate NMDA receptors in the lateral amygdale. J. Neurochem 2008. 106 (6): 2421–2435.
McNamara R.K., Kirkby R.D., dePape G.E., Corcoran M.E. Limbic seizures, but not kindling, reversibly impair place learning in the Morris water maze. Behav. Brain. Res. 1992. 50 (1-2): 167–175.
Nader K., LeDoux J.E. Inhibition of the mesoamygdala dopaminergic pathway impairs the retrieval of conditioned fear associations. Behav Neurosci. 1999. 113 (5): 891–901.
Nagatomo K., Suga S., Saitoh M., Kogawa M., Kobayashi K., Yamamoto Y., Yamada K. Dopamine D1 receptor immunoreactivity on fine processes of GFAP-Positive astrocytes in the subctantia nigra pars reticulate of adult mouse. Front. Neuroanat. 2017. 11 (3): 1–11.
Naldini L., Blomer U., Gage F.H., Trono D., Verma I.M. Efficient transfer, integration, and sustained long-term expression of the transgene in adult rat brains injected with a lentiviral vector. Proc. Natl. Acad. Sci. USA. 1996. 93 (21): 11382–11388.
Pape H.C. GABAergic neurons: gate masters of the amygdale, mastered by dopamine. Neuron. 2005. 48 (6): 1025–1037.
Paxinos G., Watson C. The rat brain in stereotaxic coordinates. Academic Press. 474 p. 1998.
Perez de la Mora M., Gallegos-Cari A., Crespo-Ramirez M., Marcellino D., Hansson A.C., Fuxe K. Distribution of dopamine D(2)-like receptors in the rat amygdala and their role in the modulation of unconditioned fear and anxiety. Neuroscience. 2012. 201: 252–66.
Peszely L., Ollmann T., Laszlo K., Kovacs A., Galosi R., Szabo A., Karadi Z., Lenard L. Effects of ventral pallidal D1 dopamine receptor activation on memory consolidation in morris water maze test. Behav Brain Res. 2014. 274: 211–218.
Pinto A., Sesack S.R. Ultrastructural analysis of prefrontal cortical inputs to the rat amygdale: spatial relationships to presumed dopamine axons and D1 and D2 receptors. Brain Struct. Funct. 2008. 213 (1-2): 159–175.
Reuss B., Lorenzen A., Unsicker K. Dopamine and epinephrine, but not serotonin, downregulate dopamine sensitivity in cultured cortical and striatal astroglial cells. Receptors Channels. 2001. 7 (6): 441–451.
Stuchlik A., Rehakova L., Telensky P., Vales K. Morris water maze learning in Long-Evans rats is differentially affected by blockade of D1-like and D2-like dopamine receptors. Neurosci. Lett. 2007. 422 (3): 169–174.
Tukhbatova G.R., Kuleshova E.P., Stepanichev M.Yu., Ivanov A.D., Salozhin S.V. Optimization of a preparation of lentiviral particles for transduction of neurons in vivo. Neuurochemical Journal. 2011. 5 (4): 294–300.
Voller J., Donek A., Cendeln J., Korelusova I., Vozeh F. The effect of D1-like receptor blockade on motor functions and spatial learning in B6CBA mice. Prague Med. Rep. 2008. 109 (1): 32–39.
Vorhees C.V., Williams M.T. Assessing spatial learning and memory in rodents. ILAR Journal. 2014. 55 (2): 310–333.
Wan P., Wang S., Zhang Y., Lv J., Jin Q.H. Involvement of dopamine D1 receptors of the hippocampal dentate gyrus in spatial learning and memory deficits in a rat model of vascular dementia. Pharmazie. 2014. 69 (9): 709–710.
Xing B., Kong H., Meng X., Wei S.G., Xu M., Li S.B. Dopamine D1 but not D3 receptor is critical for spatial learning and related signaling in the hippocampus. Neuroscience. 2010. 169 (4): 1511–1519.
Yokoyama M., Suzuki E., Sato T., Maruta S., Watanabe S., Miyaoka H. Amygdalic levels of dopamine and serotonin rise upon exposure to conditioned fear stress without elevation of glutamate. Neurosci. Lett. 2005. 379 (1): 37–41.
Zanassi P., Paolillo M., Montecucco A., Avvedimento E.V., Schinelli S. Pharmacological and molecular evidence for dopamine D(1) receptor expression by striatal astrocytes in culture. J. Neurosci. Res. 1999. 58 (4): 544–552.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


