Журнал высшей нервной деятельности им. И.П. Павлова, 2019, T. 69, № 3, стр. 354-363
ВЛИЯНИЕ ЭТАНОЛА НА НЕЙРОНЫ В КУЛЬТУРЕ КЛЕТОК ГИППОКАМПА В ПРИСУТСТВИИ ТЕТРОДОТОКСИНА
Э. А. Коркотян 1, 2, *, А. С. Боталова 1
1 Кафедра микробиологии и иммунологии,
Пермский государственный национальный исследовательский университет
г. Пермь, Россия
2 Департамент нейробиологии, Институт имени Вейцмана
г. Реховот, Израиль
* E-mail: eduard.korkotian@weizmann.ac.il
Поступила в редакцию 13.04.2018
После доработки 16.09.2018
Принята к публикации 20.11.2018
Аннотация
Влияние физиологических (0.25–1%) доз этанола на спонтанную генерацию потенциалов действия в присутствии низких концентраций тетродотоксина (25 нМ) изучали в первичной культуре клеток гиппокампа крысы. Сетевую активность оценивали по динамике изменений внутриклеточной концентрации ионов Ca2+. Установлено, что сравнительно низкие концентрации этанола вызывают усиление на 50% спонтанной генерации потенциалов действия культивируемых нейронов. Блокатор потенциал-зависимых натриевых каналов тетродотоксин несколько снижает уровень активности нейронов. Однако последующее добавление 0.25, 0.5 и 1% этанола не повышает, а еще активнее подавляет их активность. Таким образом возбудительные эффекты этанола в области физиологических концентраций инвертируются в присутствии тетродотоксина. Установлено, что вызванное этанолом угнетение нейронной активности при частичной блокаде потенциал-зависимых натриевых каналов опосредовано активацией ГАМКергической системы гиппокампа.
Исследования выявили множество синаптических и внесинаптических механизмов, в той или иной степени затрагиваемых воздействием этанола (EtOH). Обнаружен ряд молекулярных мишеней острого действия алкоголя на мозг [Ивлиева, 2011; Мельников и др., 2017], калиевые каналы [Li et al., 2013; Bukiya et al., 2014], глутамат- и гамма-аминомасляные (ГАМКергические) тормозные синапсы [Zorumski et al., 2014; Richardson, Rossi, 2017], а также синаптические каркасные белки [Romero et al., 2013; Golub et al., 2015]. Однако согласно установившемуся консенсусу основной мишенью этанола является ГАМКергическая передача: напрямую, путем влияния на синаптические и экстрасинаптические ГАМК-рецепторы, либо через нейростероиды [Valenzuela, Jotty, 2015; Sun et al., 2016; Lindemeyer et al., 2017; Jensen et al., 2017].
В то же время при поступлении алкоголя в нервных сетях мозга нарастает и возбудительная синаптическая активность [Silberman et al., 2015; Zuo et al., 2017], которая может частично или полностью перекрываться тормозными эффектами [Korkotian et al., 2015] в зависимости от полученных доз и экспозиции. Так, при сравнительно низких концентрациях EtOH (0.25–0.5%) наблюдаются повышение спонтанной генерации потенциалов действия нейронов (далее спонтанная активность нейронов) и постепенный ее спад при более высоких дозах (1.5–4%) [Korkotian et al., 2013]. Установлено, что возбудительный эффект низких концентраций EtOH обусловлен прямым участием кальций-зависимых калиевых каналов малой проводимости (SK-каналов) [Brodie et al., 1999]. В присутствии ионов Ca2+ происходит открытие SK-каналов, что приводит к ускоренной реполяризации мембраны, и создаются условия для быстрого постсинаптического ответа [Tonini et al., 2013; Chen et al., 2014].
Наличие прямой связи между EtOH и калиевыми каналами обнаружено с помощью специфического блокатора SK-каналов – апамина [Korkotian et al., 2013]. В его присутствии низкие дозы EtOH не вызывают усиления спонтанной активности, но более высокие дозы по-прежнему ее угнетают. Угнетающий эффект, в свою очередь, устранялся добавлением бикукуллина – антагониста ГАМК(А)-рецепторов. Таким образом, эффект торможения EtOH обусловлен усилением ГАМКергической активности в гиппокампе, в то время как низкие дозы EtOH даже на фоне бикукуллина продолжают усиливать нейронную активность. Можно предположить, что возбудительное действие низких доз EtOH поначалу маскирует тормозной эффект, поскольку порог чувствительности ГАМКергических рецепторов очевидно выше, чем для SK-каналов, но при повышении концентрации EtOH начинает доминировать его тормозное воздействие.
Несмотря на косвенные доказательства, вышеизложенная гипотеза нуждается в прямом обосновании. Целью настоящего исследования является изучение изменения баланса между возбудительными и тормозными процессами в гиппокампе, происходящими под влиянием этанола. Наша экспериментальная парадигма основана на свойстве блокатора потенциал-зависимых натриевых каналов – тетродотоксина (ТТХ) [Krylov et al., 1999] по-разному воздействовать на возбудительные и тормозные явления в гиппокампе и других отделах мозга [Westphalen et al., 2010]. Так, воздействие очень низких концентраций ТТХ (от 10 до 30 нМ) на глутаматергические клетки в 2–3 раза более эффективно, чем на ГАМКергическую систему. В результате происходит частичное угнетение возбудительных нейронов, в то время как тормозная активность затронута мало. Причем именно в гиппокампе эффект наиболее выражен. Поскольку усиление спонтанной активности EtOH опосредуется SK-каналами, то снижение числа возбуждающих сигналов в нейронной сети приведет к исчезновению эффекта. В то же время ГАМКергическая активность сохранится, и, следовательно, EtOH сможет ее усилить. В этих новых условиях возбудительные эффекты EtOH перестанут маскировать тормозные и проявятся уже при дозах алкоголя, близких к тем, что встречаются при его употреблении.
МЕТОДИКА
Методика приготовления культуры клеток гиппокампа
Приготовление культуры проводили по протоколу [Korkotian, Segal, 1996]. Крысят быстро декапитировали непосредственно после рождения (P0). Их мозг быстро изымали и помещали в охлажденный (до 4°С), насыщенный кислородом раствор Лейбовица L15 (Gibco), обогащенный 0.6% глюкозой и гентамицином (Sigma) из расчета 20 мкг/мл. Ткань гиппокампа подвергали механической диссоциации после инкубации в растворе с добавлением трипсина (0.25%) и дезоксирибонуклеазы (50 мкг/мл) и перемещали в инкубационный раствор, содержащий 5% инактивированной лошадиной сыворотки (HS), 5% эмбриональной телячьей сыворотки и комплексного фактора роста B-27 (1 мкл/1 мл), на основе базовой среды (MEM), приготовленной по протоколу Эрла (Gibco), обогащенной 0.6% раствором глюкозы, гентамицином (20 мкг/мл), и 2 мМ GlutaMax (Gibco).
Примерно 105 клеток в 1 мл среды высеивали в каждую лунку 24-луночного планшета, поверх слоя глиальных клеток гиппокампа, высеянных и выращенных на 13 мм покровном стекле за 2 нед до привнесения туда нейронов [Korkotian, Segal, 2006]. Клетки помещали в стерильный инкубатор при температуре 37°C и 5% CO2 на 4 дня, после чего среду меняли на 10% HS в обогащенном MEM с добавлением смеси из 5-фтор-2’-дезоксиуридина (5-fluoro-2-deoxyuridine/uridine, FUDR) (Sigma; 20 мкг и 50 мкг/мл соответственно), для блокирования пролиферации глии. Этот раствор через 4 дня заменяли на 10% HS в MEM и далее оставляли без изменений.
Динамика изменений внутриклеточной концентрации ионов кальция и анализ данных
В день эксперимента при возрасте культуры ~14 дней покровное стекло извлекали и инкубировали в течение одного часа при комнатной температуре в регистрационном растворе (в мM, 129 NaCl; 4 KCl; 2 CaCl2; 1 MgCl2; 10 Глюкоза; 10 HEPES; pH 7.4, 320 мосм/л) [Korkotian, Segal, 1996], содержащем 3 мкМ кальциевого сенсора Fluo-4(AM) или Fluo-2HA (AM) (TEFLabs). Вследствие пассивного проникновения внутрь клеток его концентрация в них достигала 50 мкМ, что достаточно для флуоресцентной записи внутриклеточных кальциевых сигналов [Korkotian, Segal, 2006]. После завершения инкубации культуру переводили в раствор без красителя в проточную камеру, закрепленную на предметном столике одного из конфокальных микроскопов: прямого Zeiss PASCAL LSM-5 (Германия), оснащенного водно-иммерсионными объективом Olympus ×63 (0.9 NA) или инвертированного Zeiss LSM-510 (Германия) с масляно-иммерсионным объективом Zeiss ×40 (1.3 NA). Во втором случае моторизованный столик позволял сохранять и воспроизводить местоположение нескольких полей в пределах одного препарата. В перфузионной системе применяли пассивный приток раствора. Его отведение осуществлялось принудительным регулируемым отсосом на базе перистальтического насоса. Точечное отверстие микроскопа находилось в закрытом положении, позволяя получать оптические срезы толщиной 3–5 мкм. Изображения формировались путем сканирования высокой скорости и разрешающей способности в возбуждающем флуоресценцию свете аргонового лазера при длине волны 488 нм и в спектре излучения 505–550 нм. Высокая скорость сканирования достигалась методом двунаправленного движения сканера, а также сканированием ограниченных по площади “регионов интереса” с уменьшенным числом пикселей. Скорость сканирования достигала 20 и более Гц. Серия изображений длительностью от нескольких до нескольких десятков минут, в зависимости от целей эксперимента, записывали в стек. Серии изображений анализировались в программах Zeiss LSM и ImageJ. Числовые матрицы транслировались в программу MatLab, где обрабатывались автоматически. Статистический анализ осуществлялся на основе t-теста и дисперсного анализа.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Влияние этанола на спонтанную нейронную активность
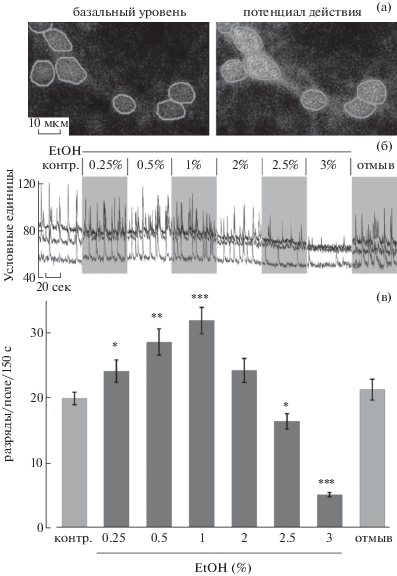
Как и в предшествующих экспериментах, было установлено нарастание спонтанной активности нейронов при добавлении в раствор 0.25, 0.5 и 1% EtOH и снижение на фоне более высоких (2–3%) концентраций (рис. 1). На панели 1(а) показаны состояния нейронов, соответствующие базальному уровню Са2+ в клетке и во время потенциала действия в сети нейронов, который сопряжен с повышением уровня Са2+. Во время непрерывной записи в перфузионный раствор добавляли нарастающие концентрации EtOH (рис. 1(б)). На панели 1В показаны обобщенные частотные характеристики кальциевых разрядов за 150 с. Наблюдалось повышение средней частоты событий с 20.2 ± 1.9 в контроле до 32.0 ± ± 3.2 (+58%) в присутствии 1% EtOH (p < 0.0001 в соответствии с парным t-тестом), а далее – снижение до 5.9 ± 0.9 (p < 0.0001) (12 экспериментов). Отмывка EtOH приводила к постепенному снижению частоты импульсации до контрольного уровня.
Рис. 1.
Влияние разных концентраций EtOH на спонтанную активность нейронов в первичной культуре клеток гиппокампа крысы (срок in vitro 14 дней). (а) Кадры демонстрируют уровень флуоресценции внутриклеточного кальциевого сенсора Fluo-2: базального (слева) и при потенциале действия (справа). Тела 7 нейронов выделены светло-серым как области дальнейшего анализа, масштаб – 10 мкм. (б) Запись активности трех из выделенных нейронов в контроле, на фоне нарастающих доз EtOH (0.25–3%) и после отмывки. Чередование светлых и серых зон облегчает восприятие элементов записи. (в) График средних частот активности нейронов, записанных в 12 экспериментах. Его построение симметрично панели Б. Светло-серые столбики – контроль и отмывка, темно-серые – дозы EtOH. Здесь и далее, *, ** и *** соответствуют уровням статистической достоверности p < 0.05, <0.01 и <0.001 соответственно.
Fig. 1. Effect of different concentrations of EtOH on spontaneous activity of primary rat hippocampal cultured neurons. (а) Two frames demonstrate the fluorescence level of intracellular calcium sensor Fluo-2: basal level (left) and in action potential (right). Seven neuronal bodies are marked using light gray as the regions of interest (scale 10 μm). (б) Activity recording from three neurons among marked above, in control conditions, under increasing doses of EtOH (0.25–3%) and after washout. The sequence of white and gray areas is used for reader’s convenience. (в) Diagram of averaged frequencies of neurons recorded in 12 experiments, and organized according to panel Б. Light gray bars – control and washout, dark gray bars – EtOH doses. Here and further, *, ** and *** indicate the levels of statistical significance p < 0.05, <0.01 and <0.001, respectively.
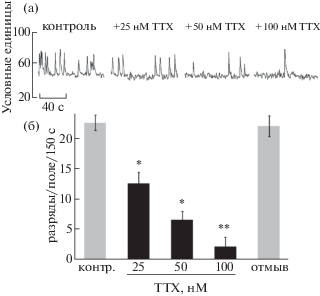
Влияние на активность нейронов различных доз ТТХ
В целях изменения баланса между тормозной и возбудительной активностью в нейронных сетях гиппокампа применяли нарастающие концентрации ТТХ. На рис. 2(а) показана динамика влияния ТТХ на импульсацию нейронов в культуре. ТТХ подавали в концентрациях от 25 нМ до 100 нМ. Под влиянием 25 нМ частота кальциевых событий снижалась почти в 2 раза (падение частоты с 22.9 ± ± 1.2 в контроле до 12.95 ± 1.9 за 150 с, p < < 0.05). При аппликации 50 и 100 нМ ТТХ наблюдалось более значительное снижение спонтанной активности (до 6.85 ± 1.5 при 50 нМ ТТХ, p < 0.05 и до 2.2 ± 1.6 при 100 нМ ТТХ, р < 0.01). После отмывки исходный уровень спонтанной активности почти полностью восстанавливался (2б, 9 экспериментов). Наибольший интерес для изучения механизма влияния EtOH представляет эффект низкой (25 нМ) концентрации ТТХ.
Рис. 2.
Влияние трех концентраций блокатора потенциал-зависимых натриевых каналов ТТХ на спонтанную активность нейронов в культуре клеток гиппокампа крысы. (а) Типичный пример записи спонтанной активности нейрона в условиях контроля и в присутствии 25, 50, 100 нМ ТТХ. Наблюдается незначительное снижение базального уровня Са2+ из-за общего спада активности нейрона. (б) Частотный график обобщает данные 9 экспериментов и отражает контроль (серый столбик), нарастающие дозы ТТХ (черные столбики) и отмывку (серый столбик).
Fig. 2. Effect of three concentrations of voltage-gated sodium channel blocker TTX on the spontaneous activity of cultured rat hippocampal neurons. (а) Typical example of neuronal spontaneous activity recording in control and following 25, 50, 100 nM TTX. An insignificant decrease in the basal Ca2+ level is seen due to a general decline in neuronal activity. (б) The diagram of frequencies summarizes the data of 9 experiments and reflects control (gray bars), increasing doses of TTX (black bars) and the washout (gray bars) conditions.
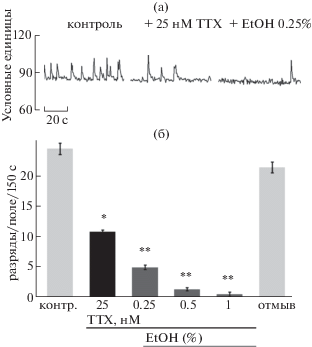
Влияние на активность нейронов физиологических концентраций этанола на фоне ТТХ
В следующей серии экспериментов мы добивались определенного снижения, но не чрезмерного подавления, частоты кальциевых событий в присутствии ТТХ, а затем добавляли EtOH (рис. 3 (а)). При добавлении ТТХ в концентрации 25 нМ вновь наблюдалось примерно двукратное снижение частоты спонтанной активности нейронов (с 24.8 ± ± 1.1 в контроле до 11.0 ± 0.2 при 25 нМ ТТХ, р < 0.05). На этом фоне добавление даже низкой, 0.25%, дозы EtOH снижало (а добавление 0.5 и 1% еще существеннее уменьшало) частоту спонтанной активности регистрируемых нейронов (5.0 ± 0.4, р < 0.01; 1.4 ± 0.2, р < < 0.01; 0.6 ± 0.3, р < 0.001 соответственно; 8 экспериментов). Отмыв восстанавливал уровень импульсной активности (рис. 3 (б)). Таким образом, возбудительное влияние физиологических концентраций этанола на активность нейронов гиппокампа в случае частичного подавления работы потенциал-зависимых натриевых каналов инвертировалось, становясь тормозным. Иными словами, тормозное действие алкоголя (рис. 1 (б), (в)) проявлялось уже при низких его концентрациях.
Рис. 3.
Эффект физиологических концентраций этанола на фоне ТТХ. (а): Пример активности нейрона в контроле, в присутствии ТТХ и в сочетании с 0.25% EtOH. Наблюдается снижение активности в присутствии ТТХ и дальнейшее снижение при добавлении EtOH. (б) Частотные данные обобщают исследования 8 экспериментов. Светло-серые столбики – контроль и отмывка, черный столбик – ТТХ, темно-серые столбики – дозы EtOH.
Fig. 3. Effect of physiological concentrations of ethanol in the presence of TTX. (а) An example of neuronal activity in control, in the presence of TTX and that combined with 0.25% EtOH. An activity decrease in the presence of TTX and a further decrease following application of EtOH is seen. (б) Frequency data comprises 8 experiments. Light gray bars – control and washout, black bar – TTX, dark gray bars – EtOH doses.
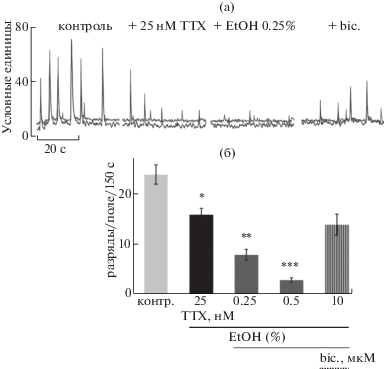
Восстановление уровня нейронной активности бикукуллином
Мы предположили, что эффект снижения нейронной активности после воздействия низких концентраций EtOH на фоне ТТХ был вызван усилением ГАМКергической активности, в то время как глутаматергическая активность была в значительной степени заблокирована. Для проверки этого предположения мы применили бикукуллин (bic., 10 мкМ) – антагонист ГАМК(А)-рецепторов. Рис. 4 (а) отражает ход восьми экспериментов, в которых в омывающую среду последовательно вводили 25 нМ ТТХ, далее 0.25 и 0.5% EtOH и, наконец, бикукуллин. На панели 4(б) показан значительный спад нейронной активности после последовательного добавления ТТХ и двух низких концентраций этанола. Введение бикукуллина предсказуемо восстанавливало ту часть активности, которая была снижена из-за воздействия EtOH, но не ту ее часть, которая зависела от присутствия ТТХ.
Рис. 4.
Влияние блокатора ГАМК(А)-рецепторов бикукуллина на спонтанную активность нейронов гиппокампа, ингибированную совместным воздействием ТТХ и EtOH. (а) Типичный пример спонтанной активности двух клеток в ходе эксперимента с последовательной аппликацией ТТХ (25 нМ), EtOH (0.25%) и бикукуллина (bic., 10 мкМ). Кроме основных эффектов см. некоторое снижение базального уровня кальция из-за торможения спонтанной активности и его восстановление на фоне bic. (б) Усредненные данные 8 экспериментов. Оттенки столбиков 1–4 – как на предыдущих рисунках, bic. – с продольной штриховкой.
Fig. 4. Effect of GABA(A) receptor blocker bicuculline on spontaneous activity of hippocampal neurons suppressed by the combined action of TTX and EtOH. (а) Typical example of spontaneous activity of two cells during an experiment with sequential application of TTX (25 nM), EtOH (0.25%) and bicuculline (bic., 10 μM). In addition to the main effects, some decrease in the calcium baseline due to reduction of spontaneous activity and its later recovery with bic. is seen. (б) Data of 8 experiments is averaged. 1–4 column tones are consistent with previous figures, bic. is marked with vertical shading.
Сравнение частоты разрядов на фоне EtOH и ТТХ + EtOH
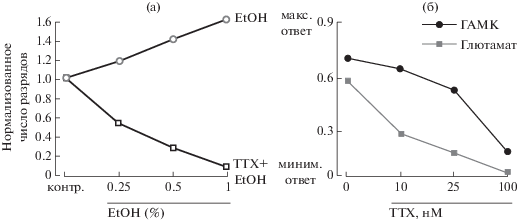
Рисунок 5(а) позволяет наглядно сравнить спонтанную активность культивируемых нейронов при EtOH или EtOH + ТТХ. Если первое постепенно учащает спонтанную активность с ростом концентрации до 1%, то второе имеет прямо противоположный эффект.
Рис. 5.
Различное влияние низких доз ТТХ на возбудительные (глутаматергические) и тормозные (ГАМКергические) нейроны гиппокампа. (а) График построен на основе данных рисунков 1 и 3 и демонстрирует усредненную динамику изменения частоты разрядов на фоне 0.25, 0.5 и 1% EtOH в отсутствие (полые серые кружки) и в присутствии (полые черные квадратики) 25 нМ ТТХ. Ось ординат – число разрядов нормализовано относительно контроля (данная частота/частота в контроле). (б) Стандартные реакции ГАМКергических нейронов (черные кружки) и глутаматергических нейронов (серые квадратики) гиппокампа в контроле (0) и в присутствии 10, 25 и 100 нМ ТТХ. Наибольшая разница между амплитудами стандартных ответов двух кривых (по оси ординат) наблюдается при 10 и 25 нМ ТТХ (по оси абсцисс). Модифицировано, на основе Westphalen et al., 2010.
Fig. 5. Differential effects of low doses of TTX on excitatory (glutamatergic) and inhibitory (GABAergic) neurons of hippocampus. (а) Graph is based on the data in Figures 1 and 3 and shows the averaged dynamics of change in the spike frequency following 0.25, 0.5 and 1% EtOH (hollow, gray circles) and the same in the presence of 25nM TTX (hollow, black squares). On Y-axis – number of spikes, normalized according to control (given frequency/frequency in control). (б) Standardized responses of GABAergic hippocampal neurons (black circles) and glutamatergic neurons (gray squares) in control (0) and in the presence of 10, 25 and 100 nM TTX. The greatest difference between the amplitudes of two standardized responses in the curves (along the ordinate axis) is observed at 10 and 25 nM TTX (X-axis). Modified from Westphalen et al., 2010.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты исследования показывают, что алкоголь после частичной блокады нейронной активности тетродотоксином становится средством не возбуждающим, как это было показано ранее [Korkotian et al., 2013], а подавляющим активность (рис. 5 (а)).
Из-за несимметричного воздействия ТТХ на комплекс возбудительных и тормозных нейронов гиппокампа происходит резкое снижение возбуждающей афферентации в локальных нейронных сетях. Из-за этого начальные дозы EtOH не могут в равной степени воздействовать на ГАМКергические и глутаматергические афферентные входы регистрируемых нейронов, значительно активируя первые, но практически не воздействуя на вторые. Эта мысль схематически показана на рисунке 5 (б) [по Westphalen et al., 2010], где видно, что малые дозы ТТХ (10 и 25 нМ) в большей степени воздействуют на глутаматергическую, чем на ГАМКергическую систему, которая угнетается в меньшей степени. Следовательно, в таких условиях под влиянием EtOH произойдет еще большее снижение сетевой нейронной активности. Этот вывод подтверждается тем, что блокатор ГАМК(А)-рецепторов, бикукуллин, устраняет эффекты EtOH, позволяя сделать важный вывод о том, что хорошо известные возбуждающие эффекты EtOH всегда развиваются параллельно с торможением и маскируют его. Без них торможение проявилось бы с самого начала.
Подобный смещенный баланс тормозного и возбуждающего воздействия EtOH отражают результаты исследований хронического действия алкоголя на культуру нейронов [Korkotian et al., 2015], указывающие на снижение числа SK-каналов из-за хронической инкубации с EtOH, длящейся 1, 2 и особенно 5 дней, что приводит к тотальному снижению уровня импульсной сетевой активности. Так, инкубация с EtOH в течение 5 дней приводит к практически полному подавлению активности, которая не восстанавливается после отмывки. Одной из возможных причин такого подавления является общее усиление активности ГАМКергической системы [Ariwodola, Weiner, 2004]. Действительно, в присутствии бикукуллина наблюдается заметное восстановление спонтанной активности. Не исключено также постепенное цитотоксическое влияние EtOH при его хроническом присутствии. Можно утверждать, что возбуждающий эффект EtOH всегда окажется достаточно кратковременным и будет проявляться только в определенных условиях тонкого баланса между возбудительными и тормозными системами, который алкоголь сам же в конце концов и нарушает.
Один из возникающих при этом вопросов связан с самой природой тормозной спонтанной активности в культуре клеток гиппокампа, когда она существует в условиях отсутствия источников возбуждения. Действительно, что же вызывает в тормозных нейронах потенциалы действия? Впрочем, существуют ясные свидетельства того, что ГАМКергические нейроны септальной и гиппокампальной областей обладают пейсмекерными свойствами [Barger et al., 2016] и могут генерировать эндогенные потенциалы действия.
Согласно данным клинических исследований, употребление алкоголя человеком сопровождается как стимулирующим, так и ингибирующим действием. Первые фазы опьянения влияют на личностный контроль, нарушая базовые тормозные механизмы, которые обычно служат для подавления неуместного поведения, провоцируют расторможенность, импульсивность. Затем начинает преобладать ингибирующее действие, развивается седативный эффект [Shannon et al., 2011]. Интересно, что при преобладании стимулирующего эффекта над седативным повышается риск развития алкогольной зависимости, и наоборот [Holdstock et al., 2000]. Таким образом, результаты клинических исследований на людях в какой-то мере сопоставимы с результатами острого и хронического воздействия EtOH in vitro, хотя по понятным причинам культура нервных клеток не может выступать в качестве адекватной тест-системы влияния алкоголя на мозг.
ВЫВОДЫ
1. EtOH обладает двухфазным воздействием на культивируемые нейроны гиппокампа, сначала активируя, а затем угнетая нейронную активность.
2. Угнетающее воздействие EtOH опосредуется ГАМКергической системой и вначале маскируется возбуждающим, глутаматергическим эффектом.
3. В случае частичного подавления возбуждающего компонента начинает превалировать тормозное влияние EtOH, чувствительное к бикукуллину.
Список литературы
Ивлиева Н.Ю. Нейробиологические механизмы аддиктивного поведения. Журн. высш. нерв. деят. 2011. 61 (2): 133–150.
Мельников М.Е., Штарк М.Б., Савелов А.А., Брюль А. Биоуправление по сигналу фМРТ, регистрируемому в реальном времени: новое поколение нейротерапии. Журн. высш. нерв. деят. 2017. 67 (1): 3–32.
Ariwodola O.J., Weiner J.L. Ethanol potentiation of GABAergic synaptic transmission may be self-limiting: role of presynaptic GABA(B) receptors. J. Neurosci. 2004. 24: 10679–86.
Barger Z., Easton C.R., Neuzil K.E., Moody W.J. Early network activity propagates bidirectionally between hippocampus and cortex. Dev. Neurobiol. 2016. 76 (6): 661–72.
Brodie M.S., McElvain M.A., Bunney E.B., Appel S.B. Pharmacological reduction of small conductance calcium-activated potassium current (SK) potentiates the excitatory effect of ethanol on ventral tegmental area dopamine neurons. J. Pharmacol. Exp. Ther. 1999. 290 (1): 325–333.
Bukiya A.N., Kuntamallappanavar G., Edwards J., Singh A.K., Shivakumar B., Dopico A.M. An alcohol-sensing site in the calcium- and voltage-gated, large conductance potassium (BK) channel. Proc. Natl. Acad. Sci. USA. 2014. 111 (25): 9313–8.
Chen S., Benninger F., Yaari Y. Role of small conductance Ca2+-activated K+ channels in controlling CA1 pyramidal cell excitability. J. Neurosci. 2014. 34(24): 8219–30.
Golub H.M., Zhou Q.G., Zucker H., McMullen M.R., Kokiko-Cochran O.N., Ro E.J., Nagy L.E., Suh H. Chronic alcohol exposure is associated with decreased neurogenesis, aberrant integration of newborn neurons, and cognitive dysfunction in female mice. Alcohol. Clin. Exp. Res. 2015. 39 (10): 1967–77.
Holdstock L., King A.C., de Wit H. Subjective and objective responses to ethanol in moderate/heavy and light social drinkers. Alcohol. Clin. Exp. Res. 2000. 24 (6): 789–94.
Jensen J.P., Nipper M.A., Helms M.L., Ford M.M., Crabbe J.C., Rossi D.J., Finn D.A. Ethanol withdrawal-induced dysregulation of neurosteroid levels in plasma, cortex, and hippocampus in genetic animal models of high and low withdrawal. Psychopharmacology. 2017. 234 (18): 2793–2811.
Korkotian E., Bombela T., Odegova T., Zubov P., Segal M. Ethanol affects network activity in cultured rat hippocampus: mediation by potassium channels. PLOS ONE 2013. 8 (11): e75988.
Korkotian E., Botalova A., Odegova T., Segal M. Chronic exposure to alcohol alters network activity and morphology of cultured hippocampal neurons. NeuroToxicology. 2015. 47: 62–71.
Korkotian E., Segal M. Spatially confined diffusion of calcium in dendrites of hippocampal neurons revealed by flash photolysis of caged calcium Cell Calcium. 2006. 40 (5–6): 441–9.
Korkotian E., Segal M. Lasting effects of glutamate on nuclear calcium concentration in cultured rat hippocampal neurons: regulation by calcium stores. J. Physiol. 1996. 496: 39–48.
Krylov B.V., Vilin Y.Y., Katina I.E., Podzorova S.A. Ethanol modifies the ion selectivity of sodium channels in the rat sensory neurons. Ross. Fiziol. Zh. im. I.M. Sechenova. 1999. 85 (1): 110–8.
Lindemeyer A.K., Shen Y., Yazdani F., Shao X.M., Spigelman I., Davies D.L., Olsen R.W., Liang J. α2 subunit-containing GABAA receptor subtypes are upregulated and contribute to alcohol-induced functional plasticity in the rat hippocampus. Mol. Pharmacol. 2017. 92 (2): 101–112.
Li Q., Fleming R.L., Acheson S.K., Madison R.D., Moore S.D., Risher M.L., Wilson W.A., Swartzwelder H.S. Long-term modulation of A-type K(+) conductances in hippocampal CA1 interneurons in rats after chronic intermittent ethanol exposure during adolescence or adulthood. Alcohol. Clin. Exp. Res. 2013. 37 (12): 2074–85.
Richardson B.D., Rossi D.J. Recreational concentrations of alcohol enhance synaptic inhibition of cerebellar unipolar brush cells via pre- and postsynaptic mechanisms. J. Neurophysiol. 2017. 118 (1): 267–279.
Romero A.M., Renau-Piqueras J., Pilar Marin M., Timoneda J., Berciano M.T., Lafarga M., Esteban-Pretel G. Chronic alcohol alters dendritic spine development in neurons in primary culture. Neurotox. Res. 2013. 24 (4): 532–48.
Silberman Y., Fetterly T.L., Awad E.K., Milano E.J., Usdin T.B., Winder D.G. Ethanol produces corticotropin-releasing factor receptor-dependent enhancement of spontaneous glutamatergic transmission in the mouse central amygdala. Alcohol. Clin. Exp. Res. 2015. 39 (11): 2154–62.
Shannon E.E., Staniforth E.R., McNamara J., Bernosky-Smith K.A., Liguori A. Response inhibition impairments predict alcohol-induced sedation. Alcohol Alcohol. 2011. 46 (1): 33–8.
Sun Y., Jiang S.Y., Ni J., Luo Y.J., Chen C.R., Hong Z.Y., Yanagawa Y., Qu W.M., Wang L., Huang Z.L. Ethanol inhibits histaminergic neurons in mouse tuberomammillary nucleus slices via potentiating GABAergic transmission onto the neurons at both pre- and postsynaptic sites. Acta Pharmacol. Sin. 2016. 37 (10): 1325–1336.
Tonini R., Ferraro T., Sampedro-Castañeda M., Cavaccini A., Stocker M., Richards C.D., Pedarzani P. Small-conductance Ca2+-activated K+ channels modulate action potential-induced Ca2+ transients in hippocampal neurons. J. Neurophysiol. 2013. 109 (6): 1514–24.
Valenzuela C.F., Jotty K. Mini-Review: effects of ethanol on GABAA receptor-mediated neurotransmission in the cerebellar cortex – recent advances. Cerebellum. 2015. 14 (4): 438–46.
Westphalen I.R., Yu J., Krivitski M., Jih T., Hemmings C.H.Jr. Regional differences in nerve terminal Na+ channel subtype expression and Na+ channel dependent glutamate and GABA release in rat central nervous system. J. Neurochem. 2010. 113 (6): 1611–1620.
Zorumski C.F., Mennerick S., Izumi Y. Acute and chronic effects of ethanol on learning related synaptic plasticity. Alcohol. 2014. 48 (1): 1–17.
Zuo W., Wang L., Chen L., Krnjević K., Fu R., Feng X., He W., Kang S., Shah A., Bekker A., Ye J.H. Ethanol potentiates both GABAergic and glutamatergic signaling in the lateral habenula. Neuropharmacology. 2017. 113 (Pt. A): 178–187.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


