Журнал высшей нервной деятельности им. И.П. Павлова, 2020, T. 70, № 1, стр. 115-124
ПРЕСИНАПТИЧЕСКАЯ LTP В УСЛОВИЯХ БЛОКАДЫ NMDA2B-РЕЦЕПТОРОВ
И. В. Кудряшова *
Федеральное государственное бюджетное учреждение науки
Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
* E-mail: iv_kudryashova@mail.ru
Поступила в редакцию 11.03.2019
После доработки 02.08.2019
Принята к публикации 16.09.2019
Аннотация
Задачей работы было исследование динамики пресинаптических модификаций в условиях блокады NR2B субъединиц NMDA-рецепторов, ключевых для консолидации LTP. С этой целью при исследовании особенностей развития NMDA-зависимой долговременной потенциации (LTP) в поле СА1 инкубированных с ифенпродилом переживающих срезов гиппокампа крыс тестирование парными стимулами проводили в течение всего времени регистрации до и в течение 1 ч после высокочастотного раздражения коллатералей Шаффера (100 Гц, 1 с). Перфузия срезов с ифенпродилом не оказывала влияния на базовые характеристики СА3-СА1 синапсов – зависимость амплитуды первого и второго ответа от интенсивности раздражения и соответственно PPF. LTP была существенно ниже в инкубированных с ифенпродилом срезах, при этом потенциация второго в паре ответа практически совпадала в контрольной и экспериментальной группах. В контрольных срезах потенциация сопровождалась достоверным снижением PPF сразу после тетанизации. Этого эффекта не наблюдалось в инкубированных с ифенпродилом срезах, более того через 15 мин после тетанизации обнаружен кратковременный прирост PPF. В обеих группах ранняя LTP усиливалась пропорционально снижению PPF. В отсутствие пресинаптических модификаций LTP была ослаблена, в том числе и в контрольных срезах, а увеличение PPF в экспериментальных срезах сопровождалось временной депрессией фокальных потенциалов. Очевидного влияния ифенпродила на поддержание LTP не обнаружено. Предполагается, что для выявления негативного влияния ифенпродила на процесс консолидации необходим комплексный анализ с учетом всех действующих факторов. Полученные результаты подтверждают тесную связь LTP с модификациями парной пластичности и дают основание полагать, что NR2B-субъединица NMDA-рецепторов имеет непосредственное отношение к вовлечению пресинаптического компартмента в долговременную потенциацию синапсов.
Исследования долговременной пластичности синапсов свидетельствуют о том, что в процесс консолидации вовлекаются многие постсинаптические и пресинаптические белки и ферменты. При этом практически неизвестно, как происходит интеграция молекулярных механизмов консолидации действующих в пресинаптических и постсинаптических компартментах.
Полагают, что свойства долговременной пластичности могут зависеть от композиционного состава NMDA-рецепторов [Liu et al., 2004; Fox et al., 2006; Li et al., 2007; Shipton, Paulsen, 2014]. Разный уровень экспрессии подтипов NR2-субъединиц определяет свойства ионного канала, а также локализацию NMDA-рецепторов в клеточной мембране [Paoletti, Neyton, 2007]. На этом основании наиболее вероятной функцией NR2B-рецепторов считалось их преимущественное участие в развитии LTD [Liu et al., 2004; Fox et al., 2006; Ge et al., 2010]. Необходимо отметить, что эксперименты с применением специфических ингибиторов не всегда свидетельствуют в пользу этой гипотезы [Hendricson et al., 2002; Bartlett et al., 2007; Morishita et al., 2007; Yasuda, Mukai, 2015], а более точные и локальные генетические манипуляции вовсе не подтверждают необходимость NR2B-рецепторов при выработке LTD [Wong, Gray, 2018].
Вместе с тем при использовании этих методов удалось описать роль NMDA2В-рецепторов при консолидации LTP. Оказалось, что необходимым условием консолидации LTP является взаимодействие CaMKII с внутриклеточным доменом NMDA2В-рецепторов, что способствует встраиванию фермента в комплекс белков постсинаптического уплотнения [Halt et al., 2012; Sanhueza, Lisman, 2013]. Для блокады процесса консолидации достаточно одной единственной мутации, прерывающей возможность установить взаимодействие CaMKII с NMDA2B [Barria, Malinow, 2005; Coultrap, Bayer, 2012; Halt et al., 2012]. Обнаружено, что у таких животных полностью отсутствует поздняя LTP [Barria, Malinow, 2005; Halt et al., 2012; Stein et al., 2014]. Участие синаптических NMDA2В-рецепторов в LTP, но не в LTD подтверждается также фармакологическими исследованиями [Gardoni et al., 2009].
Необходимо отметить, что LTP, как правило, включает комплекс модификаций [Blundon, Zakharenko, 2008; Enoki et al., 2009], и, в частности, постсинаптическая потенциация в поле СА1 сопровождается увеличением пресинаптического высвобождения медиатора [Sokolov et al., 2002; Emptage et al., 2003; Stanton et al., 2005; Bayazitov et al., 2007]. Более того, было обнаружено, что пресинаптические механизмы развиваются медленно и наиболее существенны в фазе поддержания, тогда как постсинаптическая активация наблюдается сразу же после высокочастотного раздражения коллатералей Шаффера и затем постепенно затухает [Bayazitov et al., 2007; Blundon, Zakharenko, 2008].
Для определения пресинаптической или постсинаптической локализации механизмов долговременной пластичности используется метод парной стимуляции [Schulz, 1997; Zucker, Regehr, 2002; Fioravante, Regehr, 2011; Scullin et al., 2012 и многие другие авторы]. Теоретические и экспериментальные исследования демонстрируют однозначную зависимость парной фасилитации (PPF) от исходной вероятности выброса медиатора [Fioravante, Regehr, 2011]. Считается, что синаптическая потенциация, которая сопровождается снижением парной фасилитации (PPF), может свидетельствовать об увеличении пресинаптического высвобождения медиатора [Schulz, 1997; Volgushev et al., 1997; Zucker, Regehr, 2002]. Показано, что индукция синаптической потенциации ассоциирована с подавлением парной фасилитации, тогда как в фазе поддержания LTP в поле СА1 может сопровождаться как снижением, так и увеличением PPF [Schulz, 1997]. Тем не менее имеются основания полагать, что развитие долговременной потенциации в поле СА1 гиппокампа крыс протекает в соответствии с модификациями парной пластичности. В частности, в наших экспериментах было обнаружено, что поддержание LTP улучшается при условии снижения PPF [Кудряшова и соавт., 2014]. Полученные нами результаты дают основание предполагать влияние ранних пресинаптических модификаций на эффективность консолидации.
Может ли влияние пресинаптических и постсинаптических модификаций на процесс консолидации осуществляться независимо? Реорганизация синаптических контактов в период консолидации [Кудряшова, 2019] подразумевает сопряженность структурных модификаций в пресинаптических и постсинаптических компартментах, что, по-видимому, не может не отражаться на их функциональных характеристиках. К сожалению, данные литературы о влиянии NMDA2B-рецепторов на пресинаптическую LTP практически отсутствуют. Являются ли пресинаптические модификации следствием NMDA2B-зависимой дестабилизации синапсов, или же для консолидации необходимо совпадение независимых друг от друга пресинаптических и постсинапических модификаций? Известно, в частности, что содержащие NMDA2B-субъединицу незрелые синапсы ассоциированы с высокой вероятностью выброса медиатора [Xiao et al., 2016].
Задачей работы было исследование пресинаптических модификаций при индукции LTP на фоне блокады NMDA2B-рецепторов. Для определения свойств пресинаптической пластичности использован метод парной стимуляции.
МЕТОДИКА
Электрофизиологические эксперименты проводили на переживающих срезах гиппокампа крыс Вистар массой 90–180 г. Состав перфузионной среды (мМ): NaCl 124; KCl 5; MgSO4 · 7H2O 1.3; CaCl2 2.5; NaH2PO4 1; NaHCO3 26; D-глюкоза – 10; карбоген – 95% O2 и 5% CO2; pН 7.3–7.4, температура 30°С. Для регистрации фокальных потенциалов в пирамидном слое поля CА1 использовали стеклянные микроэлектроды, заполненные 0.33 M раствором хлористого натрия. Раздражающие биполярные электроды устанавливали в радиальном слое на коллатерали Шаффера. Тестирование моносинаптических фокальных потенциалов в течение всего времени регистрации проводили каждые 30 с парными стимулами с межстимульным интервалом 70 мс. До начала основного эксперимента определяли амплитуду первого и второго в паре ответа, а также их соотношение (A2/A1, PPF) при разной интенсивности раздражения. В экспериментальных срезах ту же процедуру повторяли после добавления в перфузионную среду блокатора NMDA2B-рецепторов ифенпродила (10 μM) [Paoletti, Neyton, 2007]. Средняя и максимальная интенсивность раздражения были использованы соответственно для тестирования и тетанизации. Для индукции LTP применяли высокочастотное раздражение коллатералей Шаффера 100 Гц, 1 с. В экспериментальной группе срезов индукция LTP производилась на фоне аппликации ингибитора NMDA2B рецепторов ифенпродила (10 μM). Перфузию ингибитора прекращали через 15 мин после тетанизации.
В группе экспериментальных срезов сравнивали характеристики входного сигнала до и после аппликации ифенпродила. После тетанизации сравнивали величину прироста амплитуды ответа в контрольных и экспериментальных срезах, а также нормированную относительно исходного уровня величину PPF. Дополнительно вычисляли также различия между изменениями амплитуд вторых ответов. Для определения достоверности влияния ифенпродила на специфические характеристики LTP-зависимых модификаций использовали ANOVA (Repeated Measure) и t-критерий Стьюдента. Связь LTP с изменениями PPF сравнивали с помощью регрессионного анализа.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Задачей работы было исследование динамики пресинаптических модификаций в условиях блокады ключевых для консолидации NR2B-субъединиц NMDA-рецепторов. С этой целью при исследовании особенностей развития NMDA-зависимой долговременной потенциации (LTP) в поле СА1 инкубированных с ифенпродилом переживающих срезов гиппокампа крыс тестирование парными стимулами проводили в течение всего времени регистрации. Измерение PPF в наших экспериментах производилось каждые 5 мин до и в течение 1 ч после высокочастотного раздражения коллатералей Шаффера (100 Гц, 1 с).
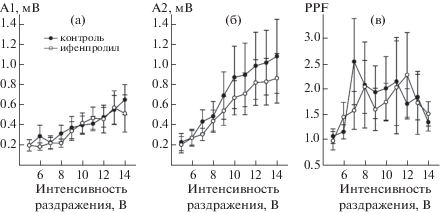
В работе было использовано 32 среза от 29 животных. Перфузия срезов с ифенпродилом не оказывала влияния на базовые характеристики СА3-СА1 синапсов. Зависимость амплитуды ответа от интенсивности раздражения коллатералей Шаффера совпадала до и через 10 мин после начала перфузии (рис. 1а). Эффект ифенпродила F(1.22) = = 0.006, p = 0.79; взаимодействие с фактором интенсивности раздражения F(9.198) = 0.39, p = 0.93. Амплитуда второго в паре ответа, также как и первого, зависела от интенсивности тестирующего раздражения (соответственно F(9.198) = 10.56, p = 0.0000 и F(9.198) = 7.92, p = 0.0000). При этом при любой интенсивности не было обнаружено влияния ифенпродила на амплитуду второго ответа (рис. 1б, F(1.22) = 0.26, p = 0.61, взаимодействие с фактором интенсивности тестирующего раздражения F(9.198) = 0.2, p = = 0.99) и соответственно PPF (рис. 1в, F(1.22) = 0.72, p = 0.4, взаимодействие с фактором интенсивности тестирующего раздражения F(9.198) = 0.98, p = 0.46).
Рис. 1.
Зависимость амплитуды первого (а) и второго (б) в паре ответа и их соотношения (в) от интенсивности парной стимуляции до и после аппликации ифенпродила.
Fig. 1. The dependence of first (а) and second (б) in pair amplitudes and PPF ratio (в) on the intensity of paired-pulse stimulation before and after ifenprodil application.
Вместе с тем из рис. 2а видно, что в инкубированных с ифенпродилом срезах прирост амплитуды ответа в поле СА1 после высокочастотного раздражения коллатералей Шаффера был существенно ниже и составил в среднем лишь 120 ± 10%, тогда как в контрольных срезах прирост был существенно больше и составил 196 ± 13% (F(1.293) = = 22.66, p = 0.000003). При тестировании парными стимулами было обнаружено, что амплитуда второго в паре ответа также достоверно увеличивалась в обеих группах срезов. В контрольной группе прирост второго ответа был существенно меньше первого и достигал лишь 131 ± 10%. Такая же потенциация второго ответа (137 ± 11%) наблюдалась и в инкубированных с ифенпродилом срезах (F(1.198) = 0.52, p = 0.46 по сравнению с контрольными срезами, рис. 2б).
Рис. 2.
Динамика изменения процента прироста амплитуды первого (а) и второго (б) ответа и отклонения PPF от исходного уровня (в) в течение 1 ч после высокочастотного раздражения коллатералей Шаффера в контрольных и инкубированных с ифенпродилом срезах. Пунктиром отмечен момент тетанизации.
Fig. 2. The profiles of potentiation of first (а) and second (б) in pair responses and PPF decrements (в) during 1 h after LTP induction in the control and incubated with ifenprodil slices. Dotted line indicates the moment of tetanization.
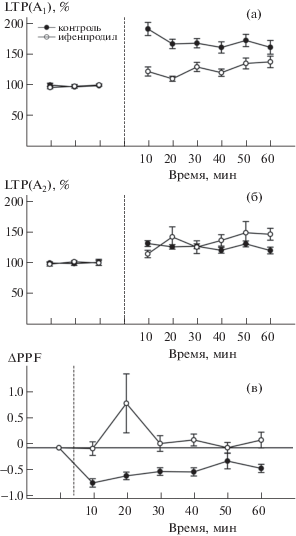
В контрольных срезах потенциация сопровождалась достоверным снижением PPF. Достоверное снижение PPF наблюдалось сразу после тетанизации (t = 8.99, p = 0.0000 по сравнению с исходным уровнем). Такая реакция была типична для подавляющего большинства контрольных срезов. Этого эффекта не наблюдалось в инкубированных с ифенпродилом срезах. Более того, через 15 мин после тетанизации PPF в экспериментальных срезах достоверно увеличивалась относительно фонового уровня (t = 2.8, p = 0.005). В итоге после тетанизации контрольная и экспериментальная группа достоверно различались по величине PPF (F(1.198) = 39.26, p = 0.000000).
Величина прироста амплитуды ответа при индукции LTP зависит, по всей вероятности, не столько от абсолютных значений PPF, сколько от их отклонения от исходного уровня. На рис. 2в представлена динамика изменения нормированных относительно исходного уровня значений PPF. Относительная величина ∆PPF = PPFLTP-PPF0, характеризующая степень снижения, достигала –0.68 ± 14 сразу после тетанизации в контрольной, но не в экспериментальной группе (рис. 2в). В экспериментальных срезах величина ∆PPF в основном оставалась в области нулевых значений, за исключением уже упоминаемого кратковременного повышения через 20 мин после тетанизации (рис. 2 (в)). Статистическая значимость межгрупповых различий F(1.268) = 22.19, p = 0.000004.
Следует отметить, что высокочастотное раздражение коллатералей Шаффера не всегда приводило к однозначным изменениям PPF во всех срезах. Зависимость величины прироста амплитуды фокальных потенциалов через 15 мин после тетанизации от степени снижения PPF представлена на рис. 3. Видно, что в отсутствие LTP после высокочастотного раздражения коллатералей Шаффера парная фасилитация почти не менялась (рис. 3, темные символы), тогда как максимальная LTP сопровождалась наиболее существенным снижением PPF. Если рассматривать всю выборку в целом, посттетаническая потенциация сразу же после высокочастотного раздражения усиливалась пропорционально снижению PPF (r = –0.65, p < 0.001). Полученные результаты демонстрируют тесную связь синаптической потенциации с пресинаптическими модификациями парной пластичности.
Рис. 3.
Соотношение парной пластичности, ранней и поздней LTP в контрольных и инкубированных с ифенпродилом срезах. (а) – зависимость величины прироста амплитуды фокальных потенциалов через 15 мин после тетанизации от степени снижения PPF, (б) поддержание LTP через 1 ч после тетанизации (пLTP, ось ординат) в контрольных и экспериментальных подгруппах срезов с разным уровнем ранней потенциации (рLTP, 15 мин после тетанизации, ось абсцисс).
Fig. 3. The balance of paired-pulse plasticity, early and late LTP in the control and incubated with ifenprodil slices. (а): The dependence of early potentiation (15 min after tetanization) on PPF decrements, (б) LTP maintenance 1 h after tetanization (ordinate) in the control and incubated with ifenprodil slices grouped according to the magnitudes of early LTP (abscissa).
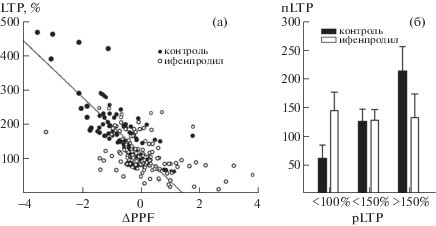
С целью визуального сравнения областей регрессии данные, полученные в группе инкубированных с ифенпродилом срезов, представлены на том же графике (рис. 3, светлые символы). Обращает на себя внимание тот факт, что данные экспериментальной группы почти полностью распределены внутри контрольной области регрессии. Видно, что если тетанизация на фоне ифенпродила все же приводила к некоторому снижению PPF, LTP в таких срезах по величине в основном соответствовала аналогичному контролю. Вместе с тем немало экспериментальных данных однозначно не вписывается в контрольную область регрессии. И это не только большая вариабельность относительно контрольной линии регрессии, но и что, по-видимому, более существенно, появление срезов, реагирующих на высокочастотное раздражение депрессией фокальных потенциалов, которое сопровождается увеличением PPF. Тем не менее складывается впечатление, что с точки зрения зависимости долговременной пластичности от пресинаптических модификаций данные контрольной и экспериментальной групп могут принадлежать одной и той же выборке. Об этом свидетельствует тот факт, что экспериментальные данные в основном группируются вокруг контрольной линии регрессии, включая нетипичную для контроля пресинаптическую депрессию. Полученные данные дают основание полагать, что NR2B-субъединица NMDA-рецепторов имеет непосредственное отношение к вовлечению пресинаптического компартмента в долговременную потенциацию синапсов.
Интересно, что дефицит постсинаптической потенциации после блокады NMDA2B-рецепторов если и наступает, то в строгом соответствии с нарушениями пресинаптических механизмов LTP. В пользу этого предположения свидетельствует тот факт, что в отсутствие пресинаптических модификаций LTP была ослаблена, в том числе и в контрольных срезах (рис. 3). С другой стороны, несмотря на явные различия в пресинаптических модификациях, потенциация второго, мало зависимого от вероятности выброса мелиатора ответа, практически совпадала в контрольной и экспериментальной группах (рис. 2б).
Не было обнаружено также очевидного влияния ифенпродила на поддержание LTP. Из рис. 1 (а) видно, что в инкубированных с ифенпродилом срезах LTP сохраняется не хуже, а возможно даже лучше, чем в норме (F(5.1465) = 6.25, p = 0.00001), что может объясняться постепенным угашением пресинаптической потенциации в контрольных срезах. Действительно, в исследуемый период времени величина ∆PPF постепенно сокращается (рис. 2в, F(5.1340) = 2.12, p = 0.06). Более значимое влияние фактора прошедшего после тетанизации времени было обнаружено при сравнении абсолютных значений (F = = 2.42, p < 0.008). Тем не менее в большинстве срезов низкий уровень сохранялся как минимум в течение часа после тетанизации (все время регистрации), хотя в ряде случаев такие изменения были непродолжительными, и в течение 15–50 мин уровень PPF постепенно восстанавливался до исходного уровня. В среднем PPF так и не достигает исходного уровня в течение исследуемого периода времени. Статистическая значимость отклонения PPF от исходного уровня составила t = 7.87, p = 0.0000 через 15 мин, t = 6.55, p = = 0.0000 через 25 минут, t = 6.33, p = 0.0000 через 35 мин, t = 1.86, p = 0.06 через 45 мин, и t = 5.39, p = 0.0000 через 55 мин после тетанизации. К тому же относительно стабильной в течение всего опыта величины PPF в экспериментальных срезах не было обнаружено статистически значимого взаимодействия факторов “группа” × “ время после тетанизации” F(5.990) = 1.32, p = 0.25, что, по-видимому, свидетельствует об отсутствии угашения пресинаптической LTP в контрольных срезах.
Не исключено также, что при сравнении эффективности поддержания необходимо учитывать различия в ранней потенциации. Так, если при анализе межгрупповых различий использовать величину ранней потенциации в качестве дополнительного фактора, влияние ифенпродила на LTP в фазе поддержания в целом скорее отсутствует (эффект группы F(1.21) = 0.004, p = 0.94). При сравнении подгрупп с разным уровнем ранней потенциации можно наблюдать, что видимость более стабильного посттетанического прироста в экспериментальной группе, по всей вероятности, создается преимущественно за счет тех срезов, в которых нарушена индукция ранней LTP (рис. 3б). Однако низкая значимость этого эффекта (t = 1.56, p = 0.15) не позволяет прийти к окончательному заключению, также как и относительно некоторой тенденции к ухудшению поддержания при активации ранней LTP в условиях блокады NMDA2B рецепторов по сравнению с соответствующим контролем (рис. 3б, взаимодействие факторов “группа” × “магнитуда рLTP” F(2.262) = 2.48, p = 0.1), t = 1.14, p = 0.28 при сравнении срезов, демонстрирующих максимальный прирост в ранней фазе LTP). И следовательно, для выявления негативного влияния ифенпродила на процесс консолидации необходимы дополнительные исследования и тщательный анализ всех действующих факторов.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные результаты находятся в соответствии с данными литературы о частичном подавлении LTP при блокаде NMDA2B-рецепторов [Fox et al., 2006; Li et al., 2007; Shipton, Paulsen, 2014]. Основным результатом работы является отсутствие снижения PPF в ответ на высокочастотное раздражение коллатералей Шаффера в инкубированных с ифенпродилом переживающих срезах гиппокампа крыс, тогда как результаты контрольных экспериментов подтверждают факт снижения парной фасилитации при индукции LTP. Если вслед за другими авторами [Schulz, 1997; Volgushev et al., 1997; Scullin et al., 2012] рассматривать снижение PPF в качестве признака увеличения вероятности выброса медиатора, то дефицит LTP в инкубированных с ифенпродилом срезах может, по-видимому, объясняться ингибированием индукции пресинаптических механизмов долговременной пластичности.
В отличие от некоторых других препаратов с похожим действием [например, Иванова с соавт., 2019], эффект ифенпродила выявляется только после тетанизации и, следовательно, блокада NMDA2B-рецепторов вряд ли влияет непосредственно на механизмы парной пластичности. Известно, что LTP в поле СА1 гиппокампа крыс является смешанной и складывается как из постсинаптических, так и пресинаптических модификаций. Преобладание постсинаптических механизмов LTP не исключает увеличения пресинаптического высвобождения медиатора, которое может и не проявляться или частично проявляться в величине PPF из-за более интенсивного роста второго ответа. Однако потенциация второго в паре ответа практически совпадала в контрольной и экспериментальной группах, поэтому особенности влияния высокочастотного раздражения коллатералей Шаффера на величину PPF в инкубированных с ифенпродилом срезах вряд ли можно объяснить просто изменением баланса пресинаптического и постсинаптического компонента LTP.
Полученные данные имеют непосредственное отношение к вопросу о механизмах трансляции постсинаптических модификаций в зону пресинапса. Учитывая различия в проводимости и константах инактивации, характеристики генерируемого высокочастотным раздражением Са2+ сигнала и соответственно свойства долговременной пластичности, по всей вероятности изменяются при блокаде NMDA2B-рецепторов [Hestrin, 1992; Malenka, 1994], также как, например, при замене NR2B на NR2A-субъединицу по окончании критических периодов развития, которые характеризуются повышенной пластичностью синапсов [Williams et al., 1993]. Более того, снижение уровня входящего кальция ниже определенного порога может способствовать развитию посттетанической синаптической депрессии [Stanton, 1996], что и наблюдалось в отдельных экспериментах. Такая депрессия сопровождалась увеличением PPF, что иногда наблюдается при выработке LTD в зависимости от исходного состояния синапсов [Santschi, Stanton, 2003]. Вместе с тем такое объяснение плохо согласуется с ранними представлениями о преимущественной роли NMDA2B рецепторов при выработке LTD [Liu et al., 2004].
В соответствии с изменениями Са2+ сигнала меняется молекулярный состав участвующих в долговременной пластичности белков и ферментов [Shipton, Paulsen, 2014]. В том числе это относится и к интегринам, которые координируют взаимодействие постсинаптического и пресинаптического компартмента. Не исключено, что это может влиять на механизмы регуляции вероятности выброса медиатора [Валиуллина-Рахматуллина с соавт., 2019]. В частности, этот механизм задействован в развивающихся синапсах, согласовывая замену NR2B субъединицы с изменением вероятности выброса медиатора [Xiao et al., 2016]. Очевидно, что при блокаде NMDA2B рецепторов такие синапсы не участвуют в потенциации фокальных потенциалов. Не исключено, что оставшиеся синапсы с исходно более низкой вероятностью выброса медиатора имеют больший потенциал для пресинаптической потенциации.
Сравнение с этими онтогенетическими исследованиями [Xiao et al., 2016], а также с исследованиями на культуре нервных клеток [Chavis, Westbrook, 2001] вызывает определенный интерес с точки зрения возможного объяснения полученных результатов нарушением синаптогенеза при консолидации LTP. Полагают, что NMDA2B-рецепторы необходимы для дестабилизации и активации синаптогенеза, а их вытеснение NMDA2A-субъединицей способствует стабилизации синапсов [Foster et al., 2010; Gambrill, Barria, 2011]. Что если снижение PPF после высокочастотного раздражения коллатералей Шаффера в той или иной степени связано с образованием незрелых синапсов с характеристиками, описанными в работе [Xiao et al., 2016]? Интересно, что нарушение взаимодействия CaMKII с NR2В-субъединицей NMDA-рецепторов не только приостанавливает структурную пластичность в ходе консолидации [Halt et al., 2012], но и вызывает, также как и в представленных в данной работе экспериментах, кратковременное увеличение PPF [Barcomb et al., 2016]. Сходство эффектов дополняется восстановлением PPF после отмывания препаратов. Таким образом, концептуальные представления о зависимой от CaMKII/NR2В комплексов структурной пластичности в большей степени соответствуют полученным результатам. В данной работе тестирование проводилось парными стимулами в течение лишь 1 ч после тетанизации. Возможно, этого времени было недостаточно для угашения постсинаптического компонента, и поэтому не было обнаружено очевидного влияния ифенпродила на поддержание LTP. Не исключено, что к объяснению такого эффекта можно было бы привлечь развиваемые некоторыми авторами представления о сходстве механизмов депотенциации и зависимой от NR2В-рецепторов LTD [Sachser et al., 2016]. Необходимы специальные исследования, чтобы определить вклад механизмов консолидации и депотенциации в поддержание LTP и изучить, может ли нарушение выработки LTD при блокаде NR2В рецепторов быть причиной замедления скорости депотенциации, затрудняя выявление всех других эффектов ифенпродила.
ВЫВОДЫ
1. Дефицит ранней LTP в поле СА1 переживающих срезов гиппокампа крыс месячного возраста в условиях блокады NMDA2B-рецепторов определяется преимущественно нарушением пресинаптических механизмов долговременной пластичности. В обеих группах ранняя LTP усиливалась пропорционально снижению PPF. В отсутствие пресинаптических модификаций LTP была ослаблена, в том числе и в контрольных срезах, а увеличение PPF в экспериментальных срезах сопровождалось временной депрессией фокальных потенциалов.
2. Этот эффект не связан с влиянием блокады NMDA2B-рецепторов на исходные входные характеристики (зависимость амплитуды первого и второго ответа от интенсивности раздражения и соответственно PPF) и, следовательно, с изменением уровня активации при тетанизации.
3. Очевидного влияния блокады NMDA2B рецепторов на поддержание LTP не обнаружено, что может быть связано с изменением скорости депотенциации.
Работа выполнена в соответствии с планом Института высшей нервной деятельности и нейрофизиологии РАН.
Список литературы
Валиуллина-Рахматуллина Ф.Ф., Большаков А.П., Розов А.В. Три модальности синаптического выброса нейромедиатора: быстрый синхронный, мультивезикулярный и асинхронный. Сходства и различия в механизмах. Журн. высш. нервн. деят. 2019. 69 (1): 3–13.
Иванова О.Я., Добрякова Ю.В., Маркевич В.А. Dickkopf-1 и norrinдавляют долговременную потенциацию in vivo в гиппокампе крыс. Журн. высш. нервн. деят. 2019. 69 (4): 514–521.
Кудряшова И.В. Молекулярные основы дестабилизации синапсов как фактор структурной пластичности. Нейрохимия. 2019. 36 (1): 3–13.
Кудряшова И.В., Онуфриев М.В. Гуляева Н.В. Каспаза-3 и калпаин: разнонаправленное участие в пресинаптической долговременной пластичности. Нейрохимия. 2014. 31 (3): 200–206.
Barcomb K., Hell J.W., Benke T.A., Bayer K.U. The CaMKII/GluN2B Protein Interaction Maintains Synaptic Strength. J. Biol. Chem. 2016. 291 (31): 16082–16089.
Barria A., Malinow R. NMDA receptor subunit composition controls synaptic plasticity by regulating binding to CaMKII. Neuron. 2005. 48: 289–301.
Bartlett T.E., Bannister N.J., Collett V.J., Dargan S.L., Massey P.V., Bortolotto Z.A., Fitzjohn S.M., Bashir Z.I., Collingridge G.L., Lodge D. Differential roles of NR2A and NR2B-containing NMDA receptors in LTP and LTD in the CA1 region of two-week old rat hippocampus. Neuropharmacology. 2007. 52: 60–70.
Bayazitov I.T., Richardson R.J., Fricke R.G., Zakharenko S.S. Slow presynaptic and fast postsynaptic components of compound long-term potentiation. J. Neurosci. 2007. 27 (43): 11510–11521.
Blundon J.A., Zakharenko S.S. Dissecting the Components of Long-Term Potentiation. Neuroscientist. 2008. 14 (6): 598–608.
Chavis P., Westbrook G. Integrins mediate functional pre- and postsynaptic maturation at a hippocampal synapse. Nature. 2001. 411: 317–321.
Coultrap S.J., Bayer K.U. CaMKII regulation in information processing and storage. Trend. Neurosci. 2012. 35 (10): 607–618.
Emptage N.J., Reid C.A., Fine A., Bliss T.V. Optical quantal analysis reveals a presynaptic component of LTP at hippocampal Schaffer-associational synapses. Neuron. 2003. 38: 797–804.
Enoki R., Hu Y.-L., Hamilton D., Fine A. Expression of long-term plasticity at individual synapses in hippocampus is graded, bidirectional, and mainly presynaptic: optical quantal analysis. Neuron. 2009. 62: 242–253.
Fioravante D., Regehr W.G. Short-term forms of presynaptic plasticity. Curr. Opin. Neurobiol. 2011. 21: 269–274.
Foster K.A., McLaughlin N., Edbauer D., Phillips M., Bolton A., Constantine-Paton M., Sheng M. Distinct roles of NR2A and NR2B cytoplasmic tails in long-term potentiation. J. Neurosci. 2010. 30 (7): 2676–2685.
Fox C.J., Russell K.I., Wang Y.T., Christie B.R. Contribution of NR2A and NR2B NMDA subunits to bidirectional synaptic plasticity in the hippocampus in vivo. Hippocampus. 2006. 16(11): 907–915.
Gambrill A.C., Barria A. NMDA receptor subunit composition controls synaptogenesis and synapse stabilization. Proc. Natl. Acad. Sci. USA. 2011. 108 (14): 5855–5860.
Gardoni F., Mauceri D., Malinverno M., Polli F., Costa C., Tozzi A., Siliquini S., Picconi B., Cattabeni F., Calabresi P., Di Luca M. Decreased NR2B subunit synaptic levels cause impaired long-term potentiation but not long-term depression. J. Neurosci. 2009. 29: 669–677.
Ge Y., Dong Z., Bagot R.C., Howland J.G., Phillips A.G., Wong T.P., Wang Y.T. Hippocampal long-term depression is required for the consolidation of spatial memory. Proc. Natl. Acad. Sci. USA. 2010. 107 (38): 16697–16702.
Halt A.R., Dallapiazza R.F., Zhou Y., Stein I.S., Qian H., Juntti S., Wojcik S., Brose N., Silva A.J., Hell J.W. CaMKII binding to GluN2B is critical during memory consolidation. EMBO J. 2012. 31 (5): 1203–1216.
Hendricson A.W., Miao C.L., Lippmann M.J., Morrisett R.A. Ifenprodil and ethanol enhance NMDA receptor-dependent long-term depression. J. Pharmacol. Exp. Ther. 2002. 301: 938–944.
Hestrin S. Developmental regulation of NMDA receptor-mediated synaptic currents at a central synapse. Nature. 1992. 357: 686–689.
Li R., Huang F.-S., Abbas A.-K., Wigström H. Role of NMDA receptor subtypes in different forms of NMDA-dependent synaptic plasticity. BMC Neurosci. 2007. 8: 55.
Liu L., Wong T.P., Pozza M.F., Lingenhoehl K., Wang Y., Sheng M., Auberson Y.P., Wang Y.T. Role of NMDA receptor subtypes in governing the direction of hippocampal synaptic plasticity. Science. 2004. 304: 1021–1024.
Malenka R.C. Synaptic plasticity in the hippocampus: LTP and LTD. Cell. 1994. 78 (4): 535–538.
Morishita W., Lu W., Smith G.B., Nicoll R.A., Bear M.F., Malenka R.C. Activation of NR2B-containing NMDA receptors is not required for NMDA receptor-dependent long-term depression. Neuropharmacology. 2007. 52 (1):71–76.
Paoletti P., Neyton J. NMDA receptor subunits: function and pharmacology. Curr. Opin. Pharmacol. 2007. 7: 39–47.
Sanhueza M. Lisman J. The CaMKII/NMDAR complex as a molecular memory. Mol. Brain. 2013. 6: 10.
Santschi L.A., Stanton P.K. A paired-pulse facilitation analysis of long-term synaptic depression at excitatory synapses in rat hippocampal CA1 and CA3 regions. Brain Res. 2003. 962 (1–2): 78–91.
Schulz P.E. Long-term potentiation involves increases in the probability of neurotransmitter release. Proc. Natl. Acad. Sci. USA. 1997. 94 (11): 5888–5893.
Scullin C.S., Tafoya L.C., Wilson M.C., Partridge L.D. Presynaptic residual calcium and synaptic facilitation at hippocampal synapses of mice with altered expression of SNAP-25. Brain Res. 2012. 1431: 1–12.
Shipton O.A., Paulsen O. GluN2A and GluN2B subunit-containing NMDA receptors in hippocampal plasticity. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 2014. 369 (1633): 20130163.
Sokolov M.V., Rossokhin A.V., Astrelin A.V., Frey J.U., Voronin L.L. Quantal analysis suggests strong involvement of presynaptic mechanisms during the initial maintenance of long-term potentiation in rat hippocampal CA1 area in vitro. Brain Res. 2002. 957: 61–75.
Stanton P.K., Winterer J., Zhang X.L., Muller W. Imaging LTP of presynaptic release of FM1-43 from the rapidly recycling vesicle pool of Schaffer collateral-CA1 synapses in rat hippocampal slices. Eur. J. Neurosci. 2005. 22: 2451–2461.
Stanton P.K. LTD, LTP, and the sliding threshold for long-term synaptic plasticity. Hippocampus. 1996. 6 (1): 35–42.
Stein I.S., Donaldson M.S., Hell J.W. CaMKII binding to GluN2B is important for massed spatial learning in the Morris water maze. F1000Res. 2014. 3: 193.
Sachser R.M., Santana F., Crestani A.P., Lunardi P., Pedraza L.K., Quillfeldt J.A., Hardt O., Alvares L. Forgetting of long-term memory requires activation of NMDA receptors, L-type voltage-dependent Ca2+ channels, and calcineurin. Sci. Rep. 2016. 6: 22771.
Volgushev M., Voronin L.L., Chistiakova M., Singer W. Relations between long-term synaptic modifications and paired-pulse interactions in the rat neocortex. Eur. J. Neurosci. 1997. 9 (8): 1656–1665.
Williams K., Russell S.L., Shen Y.M., Molinoff P.B. Developmental switch in the expression of NMDA receptors occurs in vivo and in vitro. Neuron. 1993. 10: 267–278.
Wong J.M., Gray J.A. Long-Term Depression Is Independent of GluN2 Subunit Composition. J Neurosci. 2018. 38 (19): 4462–4470.
Xiao X., Levy A.D., Rosenberg B.J., Higley M.J., Koleske A.J. Disruption of Coordinated Presynaptic and Postsynaptic Maturation Underlies the Defects in Hippocampal Synapse Stability and Plasticity in Abl2/Arg-Deficient Mice. J. Neurosci. 2016. 36 (25): 6778–6791.
Yasuda H., Mukai H. Turning off of GluN2B subunits and turning on of CICR in hippocampal LTD induction after developmental GluN2 subunit switch. Hippocampus. 2015. 25: 1274–1284.
Zucker R.S., Regehr W.G. Short-term synaptic plasticity. Annu. Rev. Physiol. 2002. 64: 355–405.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


