Журнал высшей нервной деятельности им. И.П. Павлова, 2020, T. 70, № 1, стр. 104-114
УДАЛЕНИЕ ОБОНЯТЕЛЬНЫХ ЛУКОВИЦ У МЫШЕЙ ПРИВОДИТ К ИЗМЕНЕНИЯМ ЭМОЦИОНАЛЬНОГО ПОВЕДЕНИЯ
О. А. Недогреева 1, *, М. Ю. Степаничев 1, Н. В. Гуляева 1
1 Федеральное государственное бюджетное учреждение науки
Институт высшей нервной деятельности и нейрофизиологии
Москва, Россия
* E-mail: nedogreewaolga@gmail.com
Поступила в редакцию 29.07.2019
После доработки 15.08.2019
Принята к публикации 16.09.2019
Аннотация
Удаление обонятельных луковиц вызывает множественные поведенческие нарушения, наиболее воспроизводимым из которых является гиперлокомоция. Ольфакторная бульб-эктомия широко применяется для моделирования тревожных и депрессивноподобных состояний. В этой работе самцов мышей C57Bl/6 после ольфакторной бульбэктомии протестировали в стандартных тестах для исследования тревожности и депрессивноподобного поведения. Было продемонстрировано, что удаление обонятельных луковиц у мышей вызывает усиление тревожности и эмоциональности. В данной работе внимание акцентируется на том, что гиперактивность, индуцированная бульбэктомией, может серьезно искажать результаты, полученные в тестах на тревожность. Сделан вывод о том, что необходимо учитывать вклад гиперлокомоции при интерпретации показателей поведения в тесте “приподнятый крестообразный лабиринт”.
Удаление обонятельных луковиц у лабораторных грызунов (обонятельная бульбэктомия, ОБ) вызывает многочисленные поведенческие изменения, такие как повышение двигательной активности в новой обстановке, нарушение обучения и формирования памяти. Наряду с этим многие авторы отмечают изменения эмоциональности у крыс и мышей, проявляющиеся в усилении депрессивноподобного поведения, например, ангедонии и неспособности к уходу за собой, а также преобладании пассивного типа совладания со стрессом в тесте вынужденного плавания [Otmakhova et al., 1992; Hellweg et al., 2007, Kang et al., 2010, Flores et al., 2014, Borre et al., 2012, Hendriksen et al., 2015; Stepanichev et al., 2016; Almeida et al., 2017]. Впервые ОБ была применена в 1971 г. для оценки влияния аносмии на обучение крыс. В 1976 г. van Riezen с соавт. предложили ее для проверки действия новых антидепрессантов, исходя из того, что вызванные ОБ нарушения поведения купировались продолжительным введением таких препаратов, как амитриптилин, вилоксазин, миансерин и, в меньшей степени, сульфат лития. Хлорпромазин и хлордиазепоксид вызывали снижение активности как у подопытных, так и у ложнооперированных животных [van Riezen et al., 1976, Cairncross et al., 1977; Otmakhova et al., 1992]. В настоящее время ОБ у крыс и в меньшей степени у мышей стала обычной моделью для изучения механизмов развития депрессии. Показаны многочисленные биохимические нарушения в мозге животных после ОБ, схожие с таковыми у пациентов с клинической депрессией, в том числе, изменения в метаболизме моноаминов [Nesterova et al., 1997; Hellweg et al., 2007]. В то же время с использованием этой модели у мышей проводят изучение патогенеза болезни Альцгеймера, среди признаков которой наблюдается и депрессивноподобное состояние [Bobkova et al., 2014; Gulyaeva et al., 2017].
Основным и наиболее воспроизводимым последствием ОБ является увеличение двигательной активности – гиперактивность [Kelly, 1997; Song, Leonard, 2005]. У крыс гиперактивность в домашней клетке проявляется уже через 3 дня после ОБ, в то время как активность в тесте “открытое поле” (ОП) еще не меняется [Vinkers et al., 2009]. Мыши, подвергнутые ОБ, также демонстрируют более высокие уровни активности в тестах ОП, Т-образном лабиринте, новой клетке, которые купируются анксиолитиками и антидепрессантами [Гуревич и соавт., 1992; Zueger et al., 2005]. Часто поведение в тех же тестах рассматривается с точки зрения оценки эмоциональности, под которой принято понимать всю совокупность широкого спектра форм тревожного и депрессивноподобного поведения животных [Guilloux et al., 2011]. В новой незнакомой обстановке эмоционально-негативное состояние животных определяется тревожностью и страхом. Это два сильно перекрывающихся аверсивных индуцированных состояния, обусловленных опасностью ситуации и/или характерными чертами индивида. При этом тревожность – это эмоциональное состояние, проявляющееся в обстановке с потенциальной угрозой, тогда как страх выражается в качестве реакции на непосредственно угрожающий стимул [Павлова, Рысакова, 2015; Ennaceur, 2014; Perusini, Fanselow, 2015]. Столкновение животного с незнакомым контекстом экспериментальной установки и необходимостью ее обследования в одиночку, порождает конфликт между страхом и исследовательской мотивацией, который является основой возникновения тревожности. В свою очередь, поведение в камерах для выполнения тестов, например, приподнятом крестообразном лабиринте (ПКЛ), который является стандартом для разработки анксиолитиков [Ennaceur, 2014; File, 2001], в существенной степени зависит от уровня активности грызунов [Bourin et al., 2007]. Таким образом, результаты общепринятых тестов для определения уровня тревожности (ОП, ПКЛ, темно-светлая камера) и выявления депрессивноподобного состояния у мышей, подвергнутых ОБ, могут быть неверно интерпретированы без учета этого специфического эффекта.
В настоящей работе мы исследовали вклад гиперлокомоции в поведение мышей линии C57Bl/6 после удаления обонятельных луковиц в стандартных тестах для изучения тревожности, а также на основе полученных характеристик поведения оценили их общую эмоциональность.
МЕТОДИКА
Самцы мышей линии C57Bl/6 в возрасте 3 мес. массой 25–30 г были получены из Филиала “Столбовая” Федерального государственного бюджетного учреждения науки “Научного центра биомедицинских технологий Федерального медико-биологического агентства” (Московская обл., РФ). Мышей содержали в конвенциональном виварии по 5 особей в клетке в условиях 12-часового светового дня при свободном доступе к воде и корму. Эксперименты с животными выполнены в соответствии с требованиями Директивы 2010/63/EU Европейского Парламента, Совета от 22 сентября 2010 г. и Приказа № 267 МЗ РФ от 19 июня 2003 г. в области защиты и использования животных в экспериментальных исследованиях. Протокол эксперимента утвержден Этической комиссией ИВНД и НФ РАН.
Животных случайным образом делили на две группы: ложнооперированные (ЛО, n = = 18) и бульбэктомированные (ОБ, n = 22). Удаление обонятельных луковиц осуществляли согласно общепринятому протоколу [Bobkova et al., 2014; Stepanichev et al., 2016]. Для этого мышей анестезировали введением хлоралгидратного наркоза (400 мг/кг), после чего помещали в стереотаксический аппарат (“Kopf Instruments”, США) и под местным обезболиванием (2% лидокаин подкожно) подготавливали операционное поле. Дополнительное обезболивание было обусловлено чрезвычайной болезненностью манипуляций с надкостницей и костями крыши черепа. В черепе сверлили отверстие диаметром 2 мм на расстоянии 5 мм ростральнее брегмы. Обонятельные луковицы удаляли путем аспирации. Образовавшуюся полость заполняли гемостатической губкой, а отверстие закрывали акриловым цементом (Акродент, Украина). Ложнооперированные мыши, перенесшие все манипуляции кроме удаления обонятельных луковиц, служили контрольной группой. Восстановительный период после операции составлял 30 сут. Масса тела контрольных и бульбэктомированных животных в период восстановления значимо не различалась.
Поведение мышей исследовали в малом экспериментальном комплексе (НПК “Открытая Наука”, Россия), представляющем собой бокс из панелей серого цвета (внутренние размеры: длина – 1.19 м, ширина – 1.23 м, высота – 1.9 м) с ровной матовой поверхностью, оснащенный потолочной плоской регулируемой светодиодной панелью и цифровой видеокамерой DMK 23GV024 GigE (“The Imaging Source Europe GmbH”, ФРГ). Установки для исследования поведения помещали внутрь бокса таким образом, что животные и наблюдатель были разделены стенками во время теста. Поведение животных записывали с помощью персонального компьютера для последующего анализа, используя программу IC-Capture Ver. 2.2.248.1000 (“The Imaging Source Europe GmbH”, ФРГ).
Исследование поведения в тесте “темно-светлая камера” проводили в установке с двумя отсеками одинакового размера (НПК “Открытая Наука”, Россия). Стенки светлого отсека были окрашены в белый цвет, освещенность его составляла 700 люкс. Темный отсек имел стенки черного цвета и был закрыт крышкой. На 30-й день после операции животное помещали в темный отсек и в течение 5 мин регистрировали латентность первого выхода из темного отсека, число выходов из темного отсека, число стоек в светлом отсеке и число выглядываний из темного отсека. Последний показатель является наиболее стабильной характеристикой для оценки тревожности у мышей в этом тесте [Лапин, 1999].
Исследование спонтанного чередования в Y-образном лабиринте проводили в установке, выполненной из серого пластика с длиной рукава 32.5 см, шириной рукава 8.5 см и высотой стенок 15 см (НПК “Открытая Наука”, Россия). Рукава располагались под углом 120° друг к другу. Тест использовали через 31–32 дня после операции. Животное помещали в один из рукавов носом в направлении от центра и в течение 8 мин регистрировали число переходов между рукавами и возвратов. Считали, что животное покинуло рукав, когда оно выходило из него всеми четырьмя лапами. Максимально возможное число чередований рассчитывали, вычитая 2 из общего числа входов в рукава. Долю фактически совершенных чередований от максимально возможного числа выражали в процентах, как описано ранее [Stepanichev et al., 2016].
Исследование поведения в тесте “открытое поле” проводили в установке, представляющей собой круглую арену белого цвета диаметром 63 см и с высотой стенок 32 см. В полу имелось 13 отверстий диаметром 1 см, расположенных в центре и по двум окружностям на периферии и в промежуточной зоне (НПК “Открытая Наука”, Россия). Тестирование шло в течение 4 последовательных дней (33–36 сут после ОБ) для оценки угашения двигательной активности. Каждое животное помещали на освещенную арену (350 люкс) и в течение 5 мин регистрировали поведение при помощи видеокамеры.
Для исследования поведения в тесте “приподнятый крестообразный лабиринт” использовали четырехлучевую установку, приподнятую над полом на 38 см, с длиной рукавов 30 см и шириной рукавов 5 см (НПК “Открытая Наука”, Россия). Два закрытых рукава имели стенки высотой 15 см. На 37-й день после ОБ животное помещали в один из закрытых рукавов и в течение 5 мин регистрировали число выходов в центр и в освещенные рукава, число заходов в темные рукава, число выглядываний из темных рукавов и число свешиваний, число актов груминга в светлых и темных рукавах отдельно, а также измеряли пройденную животными дистанцию.
Исследование поведения в тесте вынужденного плавания осуществляли согласно протоколу, разработанному для тестирования антидепрессантов у мышей [Castagné et al., 2011]. На 52-й день после ОБ мышей на 6 мин помещали в пластиковые цилиндры диаметром 10 см, заполненные водой с температурой 21–23°С до высоты 20 см (НПК “Открытая Наука”, Россия), и регистрировали периоды иммобильности в течение последних 4 мин теста. Одновременно оценивали поведение пяти животных. Для того чтобы исключить визуальный контакт между ними, цилиндры были разделены черными непрозрачными пластиковыми перегородками. Оценку иммобильности проводили по видеозаписи.
Оценку общей эмоциональности определяли путем расчета интегрального показателя Z, как описано [Guilloux et al., 2011]. Поскольку поведение животных является мультимодальным, количественная оценка эмоциональности возможна при условии, что все животные были испытаны во всех тестах. Для этого проводили z-нормализацию индивидуальных показателей, характеризующих поведение животных в каждом из проведенных тестов, согласно формуле z = (X – μ)/σ, где X – индивидуальное значение для каждого животного; μ и σ – среднее значение показателя и стандартное отклонение в контрольной группе. Этот тип нормализации позволяет сравнивать данные, измеренные с помощью разных шкал. Оценивали следующие параметры: долю тигмотаксиса и число фекальных болюсов для ОП, время в светлых рукавах и долю выходов в светлые рукава от общего числа переходов для ПКЛ, число выглядываний, выходов в открытое пространство и фекальных болюсов для теста “темно-светлая камера”.
Статистическую обработку данных осуществляли при помощи программных пакетов Ethovision 3.0, Ethovision XT11 (“Noldus”, Нидерланды) и STATISTICA 8.0. Данные анализировали с применением метода ANOVA для повторных измерений, t-критерия Стьюдента или непараметрического критерия Манна–Уитни с поправкой на множественные сравнения после оценки нормальности распределения переменных в выборках по критерию Шапиро–Уилкса. Данные на рисунках представлены в виде средних и стандартных ошибок среднего, медиан и интер-квартильного размаха либо медиан и индивидуальных значений.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
В тесте “темно-светлая камера” животные после ОБ значимо не отличались от группы ЛО по числу выходов из темного отсека, а также по латентному периоду первого выхода (рис. 1а, 1б; р = 0.57 и р = 0.68 соответственно). Показатель стоек в светлом отсеке в группе ОБ был значимо выше по отношению к контрольной группе (рис. 1а; р < 0.02). В то же время наблюдалась явная тенденция к снижению числа выглядываний из темного отсека у мышей группы ОБ (рис. 1в; p = = 0.054). Эти данные показывают существенное увеличение вертикальной двигательной активности в новой обстановке после ОБ, а также тенденцию к увеличению тревожности у этих животных.
Рис. 1.
Показатели в тесте “темно-светлая камера”: (а) – число выходов в светлый отсек и число стоек в светлом отсеке, (б) – латентный период первого выхода в светлый отсек, (в) – число выглядываний из темного отсека. Данные представлены в виде медиан и интерквартильных размахов. * – р < 0.05.
Fig. 1. Dark-light chamber: (a) – number of light compartment entries and rearings, (б) – latency of the first light compartment entry, (в) – number of nosepokes out of the dark compartment. Data are presented as median and interquartile range. * – p < 0.05.

Спонтанное чередование – форма инстинктивного поведения грызунов: в лабиринте животные выбирают рукав, не посещенный в результате предыдущего выбора. Бульбэктомированные животные демонстрировали статистически значимое увеличение локомоторной активности, измеренной как число переходов между рукавами, по сравнению с контрольной группой (ЛО – 25.11 ± 3.96 и ОБ – 47.50 ± 4.87; p < 0.003). Поведение чередования при этом оставалось сходным в обеих группах, так как доля чередований в группе ОБ (55.26 ± 2.85%) не отличалась от показателя контрольной группы (55.52 ± 2.64%; р = 0.56). Таким образом, мыши группы ОБ в новой обстановке проявляли повышенную почти в два раза горизонтальную локомоцию.
В ходе первого обследования арены теста ОП пройденная животными контрольной группы дистанция была значимо длиннее таковой, наблюдавшейся у животных после ОБ (p < 0.03). Различий в вертикальной двигательной активности (число стоек с опорой) и исследовательском поведении (заглядывания в отверстия в полу установки) выявлено не было. Однако при дальнейшем тестировании общая двигательная активность бульбэктомированных мышей резко повысилась и оставалась на уровне значимо более высоком, чем в группе ЛО (рис. 2а). По результатам дисперсионного анализа общей пройденной дистанции был выявлен эффект фактора “группа” (F(1, 15) = 5.16, p < 0.04) и взаимодействие факторов “группа” × “день тестирования” (F(1,45) = 15.27, p < 0.0001). Подобные эффекты выявлены как для стоек с опорой (рис. 2б): “группа” (F(1,15) = 9.05, p < 0.01), взаимодействие “группа” × “день тестирования” (F(1,45) = 7.58, p < 0.001), так и для исследовательской активности (число заглядываний): “группа” (F(1,15) = 15.09, p < 0.01), “день тестирования” (F(1,15) = 3.01, p < 0.04), “группа” × “день тестирования” (F(1,45) = = 7.54, p < 0.001). Как и в предыдущих тестах, мыши из группы ОБ демонстрировали высокую двигательную активность, проходя более длинную дистанцию внутри арены и совершая гораздо больше стоек как с опорой, так и без опоры, по сравнению с контрольными животными (рис. 2). Активность мышей группы ОБ не угасала при повторяющемся тестировании в течение четырех дней в отличие от контрольных животных. Следует отметить, что хотя и контрольные, и подопытные животные двигались преимущественно на периферии арены, в первый и второй дни теста мыши ОБ демонстрировали большую долю тигмотаксиса по сравнению с контрольными (рис. 2д). Таким образом, ОБ приводила к необычному сочетанию более выраженной тревожности (по показателю тигмотаксиса) с высокой двигательной и сниженной исследовательской активностью.
Рис. 2.
Показатели поведения мышей контрольной группы и группы ОБ в тесте “открытое поле”. (а) – общая длина пройденной дистанции; (б) – число стоек с опорой; (в) – число стоек без опоры, (г) – число заглядываний в отверстия в полу установки, (д) – доля дистанции, пройденной вдоль стенок установки (тигмотаксис). (а)–(г) – данные представлены в виде средних и стандартных ошибок средних; (д) – данные представлены в виде медиан и интерквартильных размахов. * – р < 0.05, ** – p < 0.01.
Fig. 2. Behavioral indices of control and bulbectomized animals in the open field test. (a) – total travelled distance; (b) – climbing; (c) – rearings; (d) – number of head dippings into the holes in the arena; (e) – part of distance travelled along the arena walls (thigmotaxis). Data are presented in (a)–(d) as means ± SEM and in (д) – data are presented as median and interquartile range. * – р < 0.05, ** – p < 0.01.

Животные группы ОБ более активно выходили в открытые рукава ПКЛ (p < 0.001) по сравнению с группой ЛО и совершали большее число переходов между рукавами лабиринта (рис. 3а, 3в–3д). Подопытные мыши меньше времени проводили в закрытых рукавах (р = 0.045) и больше в светлых (р = 0.046, см. рис. 3б). Кроме того, у мышей группы ОБ было больше свешиваний по сравнению с группой ЛО (p < 0.001). При этом наблюдалась тенденция к увеличению пройденной дистанции в ПКЛ в группе ОБ (рис. 3е) при сходной скорости перемещения мышей обеих групп по лабиринту (рис. 3ж). Таким образом, увеличение частоты посещения открытых рукавов, активное исследование, свешивание с открытых рукавов и большая пройденная дистанция позволяют предположить, что ОБ приводила к снижению уровня тревожности. В то же время результаты, полученные в других тестах, дают возможность говорить о существенном вкладе приобретенной вследствие экспериментального воздействия гиперлокомоции в поведение бульбэктомированных животных в ПКЛ.
Рис. 3.
Поведение животных в приподнятом крестообразном лабиринте: (а) – число заходов в открытые рукава, число выглядываний из закрытых рукавов и число свешиваний с открытых рукавов; (б) – время, проведенное в закрытых и открытых рукавах и в центре лабиринта; (в), (г) – типичные траектории для животных контрольной и подопытной групп; (д) – общее число переходов между рукавами лабиринта; (е) – пройденная дистанция; (ж) – средняя скорость движения. На (а) и (б) данные представлены в виде средних и стандартных ошибок средних; на (д)–(ж) – данные представлены в виде медиан, индивидуальных значений и интерквартильных размахов.
Fig. 3. Animal behavior in the elevated plus-maze: (a) – number of opened arms entries, number of nose poking out of the closed arms, and head dipping from the opened arms; (b) – time spent in the central compartment, closed and opened arms; (c) and (d) typical tracks for sham-operated and OB groups; (e) – total number of arm entries; (f) – total distance travelled; (g) – mean velocity. Data are presented in (a) and (b) mean ± standard error of mean and in (e)–(g) as median, interquartile range and individual values.

Период неподвижности в тесте вынужденного плавания по Порсолту составил 223.0 ± ± 4.88 с у контрольных животных и 219.0 ± ± 4.59 с в группе ОБ. Статистически значимых различий между группами по этому показателю обнаружено не было.
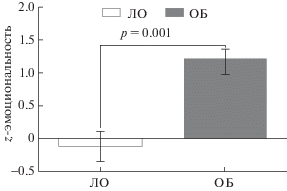
На основе проведенных тестов, которые по отдельности характеризуют определенные показатели поведения как проявления тревожности и/или депрессивности, сложно сделать вывод об изменениях эмоциональности в целом. Поэтому мы провели z-нормализацию показателей поведения для получения интегральной оценки, которая включает в себя специфические показатели для каждого из использованных тестов. Это позволило сделать вывод о том, что интегральный показатель эмоциональности был статистически значимо выше у мышей группы ОБ по сравнению с контролем (рис. 4).
Рис. 4.
Интегральный показатель эмоциональности (z-score) у контрольных и бульбэктомированных животных. Данные представлены в виде медиан и интерквартильных размахов.
Fig. 4. The integral indices of emotionality (z-score) in the control and bulbectomixed animals. Data are presented as median and interquartile range.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Эксперименты, проведенные в представленной работе, показали, что ОБ у мышей приводит к существенному росту эмоциональности. В результате этого происходит изменение поведения самцов мышей в традиционных тестах, используемых для оценки тревожности. В частности, наблюдается усиление тигмотаксиса, т.е стремления избегать открытого пространства, увеличение числа стоек с опорой, снижение числа заглядываний в отверстия пола в тесте ОП. В темно-светлой камере наблюдается уменьшение числа выглядываний из темного отсека. В то же время показатели поведения в ПКЛ-тесте, традиционно используемом для оценки как тревожности, так и эффективности анксиолитиков и анксиогенов [Pellow et al., 1985; File, 2001; Ennaceur, 2014], свидетельствуют об обратном эффекте ОБ. Увеличение числа выходов в открытые рукава и времени пребывания в них указывает на снижение тревожности у бульбэктомированных мышей.
Еще одной важной характеристикой поведения мышей, перенесших ОБ, была повышенная двигательная активность. Приобретенная гиперлокомоция отразилась на результатах всех использованных нами моделей поведения. Удлинение пройденной дистанции наблюдалось в тесте ОП, и аналогичная тенденция была обнаружена в ПКЛ. Вертикальная активность была более высокой во всех использованных тестах. При этом не наблюдалось угашения локомоции в тесте ОП при повторном помещении животных в знакомую арену. В ПКЛ и Y-образном лабиринте мыши группы ОБ совершали больше переходов между рукавами по сравнению с группой ЛО. Мы полагаем, что именно гиперлокомоция сделала невозможной корректную интерпретацию поведения животных в ПКЛ.
Несмотря на почти пятидесятилетнюю историю использования ОБ в качестве экспериментальной модели, исследование изменений в эмоциональности и тревожности как проявлении эмоциональности у мышей было проведено лишь в небольшом числе работ. В них авторы отмечали увеличение двигательной активности после ОБ в большинстве применявшихся тестов [Гуревич и соавт., 1992; Zueger et al., 2005], и этот эффект является крайне устойчивым. Almeida et al. [2017] показали, что гиперлокомоция появляется у мышей линии C57Bl/6, спустя 2 нед., и сохраняется через 4 и 8 нед. после ОБ. Наши данные, полученные через 5 нед. после операции, согласуются с этими результатами. Более того, даже четырехкратное предъявление теста “открытое поле” не выявило существенного угашения двигательной активности. Можно предположить, что такое гиперактивное поведение в тесте ОП, да и в других использованных тестах, вызвано потерей животными обоняния и невозможностью идентификации пространственных ориентиров с использованием запаховых меток. Однако было показано ранее, что аносмия, вызванная орошением полости носа раствором сульфата цинка у крыс, не вызывает столь выраженных изменений активности, выработки пассивного избегания и гипервозбудимости, которые характерны для бульбэктомированных животных [van Riezen et al., 1977]. У мышей аносмия в отличие от ОБ не приводила к усилению тревожности, которую оценивали по числу заглядываний в отверстия пола норковой камеры [Saitoh et al., 2006].
Поведение в тесте ОП мотивировано как новизной предъявляемой обстановки, которая провоцирует двигательную и исследовательскую активность, так и страхом, обусловленным агорафобией и изоляцией от конспецификов [Bourin et al., 2007]. Гиперлокомоция может быть обусловлена по крайней мере двумя разными механизмами. Во-первых, вызванной ОБ гипофункцией холинергической системы [Hendriksen et al., 2015; Stepanichev et al., 2016], которая в значительной степени контролирует привыкание к новому контексту [Easton et al., 2012]. Результат этого может наблюдаться в повышенной активности мышей после ОБ во всех использованных тестах. Во-вторых, ОБ значительно модифицирует состояние дофаминергической системы. В частности, у крыс линии Sprague-Dawley ОБ изменяет дофаминергическую передачу в вентральном стриатуме. Разрастание отростков неповрежденных деафферентацией дофаминергических клеток обонятельного бугорка и увеличение экспрессии дофаминовых рецепторов и тирозингидроксилазы в вентральном стриатуме являются причиной гиперлокомоции [Gilad, Reis, 1979; Lingham, Gottesfeld, 1986; Masini et al., 2004; Eisenstein et al., 2010]. Несмотря на то что дофаминергическая система в целом задействована и в реакции на новизну, нейроны вентрального стриатума мышей не отвечают на новый стимул, не ассоциированный с подкреплением, что было показано с помощью детекции кальциевого сигнала [Menegas et al., 2017]. Кроме того, в отличие от крыс, у мышей возникновение гиперлокомоции в модели ОБ связано со снижением экспрессии тирозингидроксилазы в стриатуме, сочетавшимся с увеличением плотности и чувствительности D2-дофаминовых рецепторов в прилежащем ядре [Takahashi et al., 2016]. Изменение эффективности дофаминергической передачи при одновременном дефиците холинергической трансмиссии у мышей может как снижать привыкание, так и усиливать двигательную активность в новом контексте. Эти данные еще раз показывают, что проявления экспериментальной патологии при ОБ имеют значительные межвидовые различия [Hendriksen et al., 2015; Stepanichev et al., 2016].
В темно-светлой камере непрерывное перемещение между отсеками нивелирует значимость латентного периода первого выхода из темного отсека и числа таких выходов. В то же время более выраженная тревожность проявляется в снижении числа выглядываний из темного отсека, которое является более надежным показателем тревожности у мышей в этом тесте [Лапин, 1999]. В то же время оценка тревожности мышей после ОБ в ПКЛ становится невозможной, так как предпочтения животных маскируются постоянным перемещением. При отсутствии значимых различий в общей длине пройденной дистанции и средней скорости перемещения в ПКЛ увеличенное относительно контроля время пребывания в светлых рукавах ПКЛ дает картину сниженной тревожности мышей с ОБ, тогда как в тесте ОП в первые два дня доля дистанции, пройденной ими вдоль стенок установки (тигмотаксис), значимо выше, чем в контрольной группе. Предположительно, это говорит о влиянии разницы в размерах установок и их конфигурации. Меньшие размеры и узкие рукава ПКЛ могут способствовать более равномерному перемещению по установке животных с двигательной ажитацией, а в условиях круглой равномерно освещенной арены тревожность может быть выражена в форме тигмотаксиса. Кроме того, на повышенную тревожность мышей после ОБ указывает снижение числа заглядываний в отверстия пола арены ОП, которое при исследовании поведения в норковой камере интерпретируют как индекс высокой тревожности [Saitoh et al., 2006].
Нам не удалось выявить существенных различий в поведении мышей групп ЛО и ОБ в тесте вынужденного плавания по Порсолту. По всей видимости, из-за выявленной гиперактивности этот тест меньше всех перечисленных подходит для комплексной оценки эмоциональности у мышей с ОБ, поскольку предполагает исключительно оценку продолжительности периодов иммобильности.
Таким образом, анализ эмоциональности и, как следствие, тревожности и депрессивноподобных проявлений в модели ОБ требует применения методов, которые позволяли бы разделить оценку этих характеристик и двигательной ажитации. Преодолеть этот “недостаток” модели позволяет использование z-нормализации индивидуальных данных, полученных в разных тестах и даже в разное время [Guilloux et al., 2011]. Использование этого подхода в нашей работе позволило на основе показателей тревожности, полученных в каждом из тестов, показать усиления эмоциональности у мышей с ОБ. Следует отметить, что о повышенной эмоциональности, вызванной ОБ у крыс, ранее сообщали в некоторых работах. Она проявлялась в усилении агрессивности и реактивности на предъявляемый объект и/или стимул [Shibata et al., 1980; Takahashi et al., 2011]. Единичные работы по исследованию эмоциональности у мышей с ОБ также указывают на гиперэмоциональное состояние у животных, подвергнутых этому воздействию [Saitoh et al., 2006]. Использование z-нормализации представляется более объективным подходом к количественной оценке повышенной эмоциональности по сравнению со шкалами, использованными в большинстве предыдущих работ.
ВЫВОДЫ
1. Удаление обонятельных луковиц индуцирует у мышей гиперактивность, которая вносит значительный вклад в поведение животных в большинстве тестов, используемых для оценки тревожности, и затрудняет интерпретацию результатов.
2. Удаление обонятельных луковиц у мышей вызывает усиление тревожности и эмоциональности.
3. При интерпретации показателей поведения бульбэктомированных мышей в тесте “приподнятый крестообразный лабиринт” необходимо учитывать вклад гиперлокомоции, которая маскирует проявления тревожности.
Работа выполнена при частичной финансовой поддержке по Программе фундаментальных исследований Президиума РАН № 18 “Биомедицинские технологии: инновационные разработки” (М.Ю.С.) и Российского Фонда фундаментальных исследований (проект № 19-515-12006 Н.В.Г.).
Список литературы
Гуревич Е.В., Бобкова Н.В., Катков Ю.А., Отмахова Н.А., Нестерова И.В. Поведенческие и биохимические последствия удаления обонятельных луковиц у мышей C57Bl/6j. Журн. высш. нерв. деят. им. И.П. Павлова. 1992. 42: 779–787.
Лапин И.Л. Уменьшение частоты выглядываний из темного отсека – единственный постоянный показатель влияния анксиогенов на поведение мышей в камере “свет–темнота”. Журн. высш. нерв. деят. им. И.П. Павлова. 1999. 49: 521–526.
Павлова И.В., Рысакова М.П. Проявление тревожности крыс Вистар при выработке условнорефлекторного страха. Журн. высш. нерв. деят. им. И.П. Павлова. 2015. 65 (6): 720–734.
Almeida de R.F., Ganzella M., Machado D.G., Loureiro S.O., Leffa D., Quincozes-Santos A., Pettenuzzo L.F., Duarte M.M.M.F., Duarte T., Souza D.O. Olfactory bulbectomy in mice triggers transient and long-lasting behavioral impairments and biochemical hippocampal disturbances. Prog. Neuropsychopharmacol. Biol. Psychiatry. 2017. 76: 1–11.
Bobkova N.V., Garbuz D.G., Nesterova I., Medvinskaya N., Samokhin A., Alexandrova I., Yashin V., Karpov V., Kukharsky M.S., Ninkina N.N., Smirnov A.A., Nudler E., Evgen’ev M. Therapeutic effect of exogenous hsp70 in mouse models of Alzheimer’s disease. J. Alzheimers Dis. 2014. V. 38 (2): 425–435.
Borre Y., Bosman E., Lemstra S., Westphal K.G., Olivier B., Oosting R.S. Memantine partly rescues behavioral and cognitive deficits in an animal model of neurodegeneration. Neuropharmacology. 2012. 62 (5–6): 2010–2017.
Bourin M., Petit-Demoulière B., Nic Dhonnchadha B., Hascöet M. Animal models of anxiety in mice. Fund. Clin. Pharmacol. 2007. 21 (6): 567–574.
Cairncross K.D., Cox B., Schnieden H., Wren A. Modification by anti-depressant drugs of plasma corticosterone levels in the stressed bulbectomized rat [proceedings]. Br. J. Pharmacol. 1977. 61 (1): 144.
Castagné V., Moser P., Roux S., Porsolt R.D. Rodent models of depression: forced swim and tail suspension behavioral despair tests in rats and mice. Curr. Protoc. Neurosci. 2011. Chapter 8. Unit 8.10A.
Easton A., Douchamps V., Eacott M., Lever C. A specific role for septohippocampal acetylcholine in memory? Neuropsychologia. 2012. 50: 3156–3168.
Eisenstein S.A., Clapper J.R., Holmes P.V., Piomelli D., Hohmann A.G. A role for 2-arachidonoylglycerol and endocannabinoid signaling in the locomotor response to novelty induced by olfactory bulbectomy. Pharmacol. Res. 2010. 61 (5): 419–429.
Ennaceur A. Tests of unconditioned anxiety – pitfalls and disappointments. Physiol. Behav. 2014. 135: 55–71.
File S.E. Factors controlling measures of anxiety and responses to novelty in the mouse. Behav. Brain Res. 2001. 125 (1–2): 151–157.
Flores G., Ibañez-Sandoval O., Silva-Gómez A.B., Camacho-Abrego I., Rodríguez-Moreno A., Morales-Medina J.C. Neonatal olfactory bulbectomy enhances locomotor activity, exploratory behavior and binding of NMDA receptors in pre-pubertal rats. Neuroscience. 2014. 259: 84–93.
Gilad G.M., Reis D.J. Collateral sprouting in central mesolimbic dopamine neurons: biochemical and immunocytochemical evidence of changes in the activity and distrubution of tyrosine hydroxylase in terminal fields and in cell bodies of A10 neurons. Brain Res. 1979. 160 (1): 17–26.
Guilloux J.-P., Seney M., Edgar N Sibille E. Integrated Behavioral Z-Scoring Increases the Sensitivity and Reliability of Behavioral Phenotyping in mice: Relevance to Emotionality and Sex. J. Neurosci. Methods. 2011. 197 (1): 21–31.
Gulyaeva N.V., Bobkova N.V., Kolosova N.G., Samokhin A.N., Stepanichev M.Y., Stefanova N.A. Molecular and cellular mechanisms of sporadic alzheimer’s disease: studies on rodent models in vivo. Biochemistry (Mosc.). 2017. 82 (10): 1088–1102.
Hellweg R., Zueger M., Fink K., Hörtnagl H., Gass P. Olfactory bulbectomy in mice leads to increased BDNF levels and decreased serotonin turnover in depression related brain areas. Neurobiol. Dis. 2007. 25 (1): 1–7.
Hendriksen H., Korte S.M., Olivier B., Oosting R.S. The olfactory bulbectomy model in mice and rat: One story or two tails? Eur. J. Pharmacol. 2015. 753: 105–113.
Kang H.M., Jin J., Lee S., Ryu J., Park C. A novel method for olfactory bulbectomy using photochemically induced lesion. Neuroreport. 2010. 21 (3): 179–184.
Kelly J.P., Wrynn A.S., Leonard B.E. The olfactory bulbectomized rat as a model of depression: an update. Pharmacol. Ther. 1997. 74 (3): 299–316.
Lingham R.B., Gottesfeld Z. Deafferentation elicits increased dopamine-sensitive adenylate cyclase and receptor binding in the olfactory tubercle. J. Neurosci. 1986. 6 (8): 2208–2214.
Masini C.V., Holmes P.V., Freeman K.G., Maki A.C., Edwards G.L. Dopamine overflow is increased in olfactory bulbectomized rats: an in vivo microdialysis study. Physiol. Behav. 2004. 81 (1): 111–119.
Menegas W., Babayan B.M., Uchida N., Watabe-Uchida M. Opposite initialization to novel cues in dopamine signaling in ventral and posterior striatum in mice. Elife. 2017. 6i: e21886.
Nesterova I.V., Gurevich E.V., Nesterov V.I., Otmakhova N.A., Bobkova N.V. Bulbectomy-induced loss of raphe neurons is counteracted by antidepressant treatment. Prog. Neuropsychopharmacol. Biol. Psychiatry. 1997. 21 (1): 127–140.
Otmakhova N.A., Gurevich E.V., Katkov Y.A., Nesterova I.V., Bobkova N.V. Dissociation of multiple behavioral effects between olfactory bulbectomized C57Bl/6J and DBA/2J mice. Physiol. Behav. 1992. 52 (3): 441–448.
Pellow S., Chopin P., File S.E., Briley M. Validation of open closed arm entries in an elevated plus-maze as a measure of anxiety in the rat. J. Neurosci. Methods. 1985. 14 (3):149–67.
Perusini J.N., Fanselow M.S. Neurobehavioral perspectives on the distinction between fear and anxiety. Learn. Mem. 2015. 22 (9): 417–425.
Saitoh A., Hirose N., Yamada M., Yamada M., Nozaki C., Oka T., Kamei J. Changes in emotional behavior of mice in the hole-board test after olfactory bulbectomy. J. Pharmacol. Sci. 2006. 102: 377–386.
Shibata S., Watanabe S., Ueki S. The effect of age on the development of hyperemotionality following bilateral olfactory bulbectomy in rats. J. Pharmacobiodyn. 1980. 3: 309–313.
Song C., Leonard B.E. The olfactory bulbectomised rat as a model of depression. Neurosci. Behav. Rev. 2005. 29 (4–5): 627–647.
Stepanichev M., Markov D., Pasikova N., Gulyaeva N. Behavior and the cholinergic parameters in olfactory bulbectomized female rodents: Difference between rats and mice. Behav. Brain Res. 2016. 297: 5–14.
Takahashi K., Murasawa H., Yamaguchi K., Yamada M., Nakatani A., Yoshida M., Iwai T., Inagaki M., Yamada M., Saitoh A. Riluzole rapidly attenuates hyperemotional responses in olfactory bulbectomized rats, an animal model of depression. Behav. Brain Res. 2011. 216: 46–52.
Takahashi K., Nakagawasai O., Nemoto W., Nakajima T., Arai Y., Hisamitsu T., Tan-No K. Alterations in behavioral responses to dopamine agonists in olfactory bulbectomized mice: relationship to changes in the striatal dopaminergic system. Psychopharmacology (Berl.). 2016. 233 (7): 1311–1322.
van Riezen H., Schnieden H., Wren A. Behavioural changes following olfactory bulbectomy in rats: a possible model for the detection of antidepressant drugs [proceedings]. Br. J. Pharmacol. 1976. 57 (3): 426–427.
van Riezen H., Schnieden H., Wren A.F. Olfactory bulb ablation in the rat: behavioural changes and their reversal by antidepressant drugs. Br. J. Pharmacol. 1977. 60 (4): 521–528.
Vinkers C.H., Breuer M.E., Westphal K.G., Korte S.M., Oosting R.S., Olivier B., Groenink L. Olfactory bulbectomy induces rapid and stable changes in basal and stress-induced locomotor activity, heart rate and body temperature responses in the home cage. Neuroscience 2009. 159: 39–46.
Zueger M., Urani A., Chourbaji S., Zacher C., Roche M., Harkin A., Gass P. Olfactory bulbectomy in mice induces alterations in exploratory behavior. Neurosci. Lett. 2005. 374: 142–146.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


