Журнал высшей нервной деятельности им. И.П. Павлова, 2020, T. 70, № 1, стр. 125-132
ВЛИЯНИЯ НООПЕПТА И ПИРАЦЕТАМА НА ДЕПРЕССИЮ ВЫЗВАННОГО АЦЕТИЛХОЛИНОМ ТОКА В КОМАНДНЫХ НЕЙРОНАХ ВИНОГРАДНОЙ УЛИТКИ
А. С. Пивоваров 1, Г. Б. Мурзина 2, *, Н. В. Васильева 1, 2
1 Кафедра высшей нервной деятельности МГУ имени М.В. Ломоносова
Москва, Россия
2 Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
* E-mail: gbmurzina@mail.ru
Поступила в редакцию 08.07.2019
После доработки 01.08.2019
Принята к публикации 16.09.2019
Аннотация
Исследовали воздействие ноотропов – ноопепта и пирацетама на депрессию вызванного ацетилхолином тока на клеточном аналоге привыкания. Математическое моделирование экспериментальных кривых и их анализ, проведенный с использованием полученных ранее результатов по влиянию ингибиторов различных протеинкиназ и протеинфосфатаз на выработку депрессии вызванного ацетилхолином тока на клеточном аналоге привыкания, позволили конкретизировать внутриклеточные процессы и мишени, на которые воздействуют эти препараты.
В настоящее время известен целый ряд веществ, ноотропов, улучшающих умственную деятельность, стимулирующих познавательные процессы, обучение и память, повышающие устойчивость мозга к повреждающим факторам. К ним относится ноопепт – дипептидный аналог пирацетама. Ноопепт (от слов “ноотропный” и “пептид”) был создан в Институте фармакологии им. В.В. Закусова [Gudasheva et al., 1996], и в настоящее время используется в качестве лекарственного препарата (№ ЛС-001577), препятствующего развитию амнезии, вызванной электрошоком, блокадой центральных холинэргических структур, лишением парадоксальной фазы сна. Профиль активности ноопепта в целом сходен с таковым для пирацетама, но активность проявляется в дозах значительно меньших. Согласно имеющимся экспериментальным данным ноопепт стимулирует синтез мРНК нейротрофических факторов, таких как NGF и BDNF в гиппокампе крыс [Ostrovskaya et al., 2008] и взаимодействует с находящимися на мембране нейронов специфическим местами связывания двух типов: высокоаффинными с kd = 6.85 × 10–7 М и низкоаффинными с kd = 7.69 × 10–4 М [Гудашева, Сколдинов, 2003]. А в диапазоне концентраций 10–11–10–9 M увеличивает амплитуду деполяризации на микроапликацию ацетилхолина (АХ) у нейронов виноградной улитки [Островская и др., 2001]. Следовательно, возникает вопрос о механизмах модуляции ноопептом активности ацетилхолиновых рецепторов (АХР).
Проведенные нами исследования воздействия различных концентраций ноопепта на входящий АХ-ток на командных нейронах виноградной улитки показали, что дозозависимая кривая имеет колоколообразный вид [Разумовская и др., 2018]. Препарат усиливает АХ-ток при концентрациях 0.1–10 нM. Согласно результатам анализа (произведенного с помощью математического моделирования), изменение амплитуды вызванного АХ входящего тока может быть связано с увеличением количества никотиновых ацетилхолиновых рецепторов на мембране нейрона или изменением эффективности мускариновых АХР [Мурзина, Пивоваров, 2019]. Было высказано предположение, что это является следствием влияния препарата на процессы эндо- или экзоцитоза рецепторов в результате его взаимодействия с белками примембранного матрикса или влияния на протеинкиназы (ПК) или протеинфосфатазы (ПФ), участвующие в процессе мембранной или внутриклеточной транспортировки АХР. В то же время отсутствие влияния ноопепта на кривые ионного тока через мембраны ооцитов, экспрессирующих никотиновые АХР α3β2 типа, позволило нам предположить отсутствие прямого влияния ноопепта на свойства таких рецепторов у нейронов виноградной улитки [Мурзина, Пивоваров, 2019].
С целью конкретизации, на какие именно процессы эндо- или экзоцитоза АХР ноопепт оказывает влияние, было решено провести исследование воздействия препарата на депрессию вызванного АХ входящего тока на командных нейронах виноградной улитки. Известно, что ритмическая аппликация агониста АХР на сому этих нейронов приводит к обратимому снижению их холиночувствительности, которое можно рассматривать как клеточный аналог поведенческого привыкания. Проведенные нами ранее исследования по изучению влияния ингибиторов ПК и ПФ и ряда блокаторов транспортных процессов на депрессию АХ-тока [Махновский и др., 2011; Пивоваров и др., 2012; Пивоваров и др., 2013а; Пивоваров и др., 2013б] позволяют соотнести их воздействие с влиянием ноопепта. Это дает возможность конкретизировать внутриклеточные мишени воздействия препарата. Были проведены исследования с двумя концентрациями ноопепта – 1 нМ и 10 мкМ (вызывающими соответственно наибольшее увеличение и недостоверное уменьшение входящего АХ-ток [Разумовская и др., 2018]).
Поскольку ноопепт является производной пирацетама, для которого (в отличие от ноопепта) показано воздействие на плотность мускариновых АХР [Pilch, Muller, 1988] и не обнаружено сродства к этим рецепторам [Pugsley et al., 1983], и нами показано увеличение амплитуды вызванного АХ входящего тока при физиологических концентрациях препарата 0.1–10 мМ [Разумовская и др., 2018], было решено также провести исследование воздействия пирацетама (концентрации 1 мМ) на депрессию вызванного АХ входящего тока. Это позволяет сравнить механизмы воздействия на нейроны двух родственных препаратов, имеющих однонаправленное воздействие, но различающихся на несколько порядков концентрациями, при которых наблюдается увеличение амплитуды АХ-тока.
МЕТОДИКА
Электрофизиологические методы. Электpофизиологичеcкие экcпеpименты проведены на идентифициpованныx нейpонаx (ЛПа3, ЛПа2, ППа3 и ППа2) наземного моллюска (виногpадной улитки Helix lucorum) на пpепаpате изолиpованныx ганглиев. Указанные нейроны вовлечены в pеализацию оборонительного поведения этого наземного моллюcка [Иерусалимский и др., 1992]. Регистрировали тpанcмембpанные токи нейронов, используя методику двуxэлектpодной фиксации потенциала на мембране по cxеме заземления объекта на “виpтуальную землю”. Для этого применяли микpоэлектpодный усилитель MEZ-8201 и усилитель фиксации потенциала CEZ-1100 (оба пpибоpа фирмы NihonKohden, Япония). Внутриклеточные острые электроды, изготовленные из стекла “пиpекc” (Harvard Apparatus, CША), заполняли 2 М pаcтвоpом ацетата калия.
Теcтиpующая стимуляция. Применяли локальную ионофоpетичеcкую аппликацию АX на дорзальную повеpxноcть cомы нейрона из стеклянной микропипетки, заполненной 1М раcтвоpом xлоpида АX (Sigma, CША) в ответ на пропускание катионных токов (200–500 нА) от изолированного от земли уcтpойcтва (НейроБиолаб, Россия), подключенного к электpоcтимулятоpу SEN-3 (Nihon Kohden). Во время фонового тестирования (без ноотропов) аппликацию АХ осуществляли с интервалом 5 мин. Во время серии, имитирующей выработку привыкания, аппликацию АХ производили с интервалом 3 мин. После 10-го стимула интервалы между аппликацией АХ возрастали до 5 мин, что имитировало фазу восстановления ответа. Число стимулов для этой фазы составляло от 3 до 10–15 в разных экспериментах.
В контрольных сериях ноотропов не было.
В работе использован дипептид ноопепт (N-фенил-ацетил-L-пролил-глицина этиловый эфир), синтезированный в отделе химии лекарственных средств НИИ фармакологии имени В.В. Закусова [Gudasheva et al., 1996]. Ноопепт и пирацетам растворяли в физрастворе. Затем в проточную камеру объемом 1 мл вводили растворы этих веществ в соответствующих концентрациях. В результате расчетные концентрации ноопепта и пирацетама составляли соответственно 10–9, 10–5 и 10–3 М. Суммарное количество экспериментов при введении ноопепта в концентрации 10–9 М было 8, в концентрации 10–5 М – 11, а пирацетама – 8. Эксперименты проводились с сентября по май.
Мембранный потенциал клеток находился в диапазоне от –76 до –34 мВ. Потенциал фиксации выставлял на уровне –75 мВ.
Статистические методы. Нормированные значения амплитуд АХ-токов пpедcтавлены как cpеднее аpифметичеcкое выборки ± cтандаpтная ошибка cpеднего аpифметичеcкого. Для cтатиcтичеcкой обработки использовали компьютерную пpогpамму SigmaPlot 12.3 (Systat Software, Inc., CША). Непаpаметpичеcкий Mann–Whitney Rank Sum тест использован для cpавнения результатов экcпеpиментальной и контрольной групп. При p ≤≤ 0.05 различия считали cтатиcтичеcки значимыми.
Математическое моделирование. Для анализа экспериментальных данных использовали математическую модель, учитывающую различное расположение рецепторов: на клеточной мембране, в сформированных и рециклированных везикулах [Pivovarov et al., 2013]. В модели учитывались транспорт рецепторов из эндоплазматического ретикулума к мембране и процесс деградации рецепторов. Выбор констант скоростей транспортировки рецепторов проводился на основании существующих экспериментальных данных. Математическое моделирование сводилось к решению системы дифференциальных уравнений, описывающих изменение местоположения рецепторов. Параметрами уравнений являлись скорости изменения местоположения рецепторов. Выходные характеристики модели (расчетные токи, сравниваемые с экспериментальными данными) полагались зависимыми от количества и активности мембранных рецепторов. Расчетные кривые, сходные с экспериментальными кривыми, были получены вследствие изменений параметров уравнений. Выводы о том, на какие процессы воздействуют исследуемые ноотропы, делались на основании того, какие параметры изменяли для получения моделируемых кривых. Поскольку изменения этих параметров в модели отражают изменения соответствующих констант скоростей транспортировки рецепторов.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
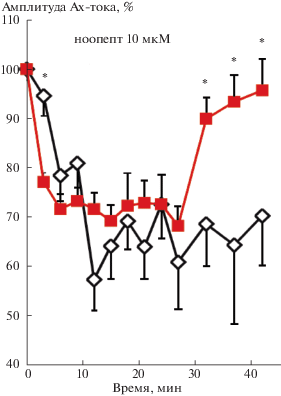
Согласно полученным данным, оба ноотропа по-разному действуют на выработку и уровень депрессии входящего АХ-тока. Ноопепт в концентрации 10 мкМ не оказывает существенного влияния на выработку и уровень депрессии входящего АХ-тока (рис. 2), в то время как при концентрации 1 нМ – депрессия усиливается (рис. 1). При воздействии же пирацетама скорость выработки и уровень депрессии входящего АХ-тока имеют меньшие величины по сравнению с соответствующими контрольными значениями (рис. 3). Общими в поведении всех трех кривых является отсутствие восстановления АХ-тока. Проведенные дополнительные исследования показали, что восстановления не наблюдается в течение нескольких десятков минут.
Рис. 1.
Влияние ноопепта в концентрации 1 нМ на динамику депрессии АХ-тока нейронов на клеточном аналоге привыкания. Представлены суммарные результаты всех экспериментов. По горизонтали – время, мин; по вертикали – амплитуда АХ-тока (среднее ± SEM) в процентах относительно величины АХ-тока в ответ на первую аппликацию АХ в серии. Ромбы – ноопепт (1 нМ), квадраты – без фармакологического воздействия (контроль). Вертикальные линии – ошибка среднего, * – р < 0.05, # – р < 0.01 – уровни значимости различий амплитуд АХ-тока в опыте и контроле (критерий Манна–Уитни).
Fig. 1. Effects of 1nM noopept on the dynamics of the ACh-current depression in a cellular analog of habituation. The cumulative results of all experiments are presented. Abscissa: – time, min. Ordinate: ACh-current amplitude (mean), % to the ACh-current in response to the first ACh application in the series. Rhombus – noopept (1 nM), squares – no drugs (control). Vertical lines – SEM, * – p < 0.05, # – p < 0.01 – significance levels of differences between amplitudes of ACh-currents in the experiment and control.
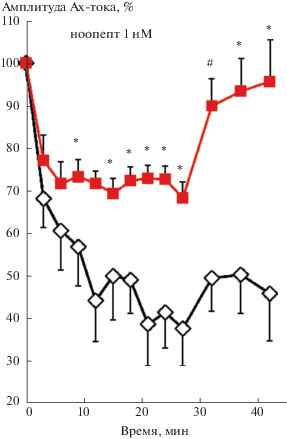
Рис. 3.
Влияние пирацетама в концентрации 1 мМ на динамику депрессии АХ-тока нейронов на клеточном аналоге привыкания. Кружки – пирацетам (1 мМ), квадраты – без фармакологического воздействия (контроль). Остальные обозначения как на рис. 1.
Fig. 3. Effects of 1mM piracetam on the dynamics of the ACh-current depression in a cellular analog of habituation. Circles – peracetam (1 mM), squares – no drugs (control). Other designations indicated as in Fig. 1.
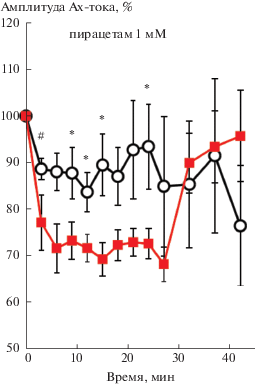
Моделирование воздействия ноопепта концентрации 1 нМ на входящий АХ-ток показало, что расчетную кривую депрессии (рис. 4, кривая Б), аналогичную экспериментальной (с учетом разброса данных), можно получить при уменьшении скорости транспортировки мембранных рецепторов к формирующимся везикулам и скоростей эндо- и экзоцитоза рецепторов соответственно в 1.5 и 2.8 раз.
Рис. 4.
Расчетные кривые влияния ноопепта и пирацетама на динамику депрессии АХ-тока. По горизонтали – время, мин; по вертикали – расчетная амплитуда АХ-тока в процентах относительно расчетной величины АХ-тока в ответ на первую аппликацию АХ в серии. А – в контроле; Б – при воздействии ноопепта (1 нМ); В – при воздействии пирацетама (1 мМ).
Fig. 4. Calculated curves of the effects of 1 nM noopept and 1 mM piracetam on the dynamics of the ACh-current depression. Abscissa: – time, min. Ordinate: calculated ACh-current amplitude, % to the calculated ACh-current in response to the first ACh application. А – control; Б, В – after add of noopept (Б) and piracetam (В).
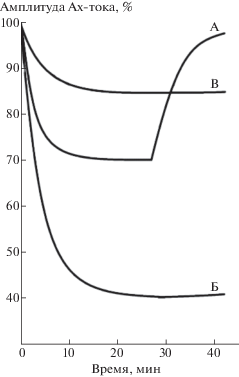
Как показали результаты вычислений (рис. 4, кривая В), совпадение расчетных и экспериментальных кривых депрессии входящего АХ-тока при воздействии пирацетама наблюдается в случае уменьшения скоростей эндо- и экзоцитоза в 2 раза по сравнению с соответствующими значениями для контрольной кривой, если учитывать перемещения рецепторов только на мембране и в примембранных областях. Если же рассматривать также перемещения рецепторов из примембранных областей в область лизосом и вновь синтезированных рецепторов из аппарата Гольджи к мембране, то совпадение расчетных и экспериментальных кривых депрессии входящего АХ-тока наблюдается при уменьшении как скоростей эндо- и экзоцитоза, так и скорости транспортировки рецепторов из аппарата Гольджи в 1.3–1.5 раз по сравнению с соответствующими значениями скоростей для контрольной кривой. Поскольку в этом случае расчетная кривая незначительно отличается от расчетной кривой В (рис. 4), то для простоты восприятия она не показана.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Взятые для исследования депрессии входящего АХ-тока на командных нейронах виноградной улитки концентрации ноопепта находятся в диапазоне концентраций (10–11–10–5 М), в котором обнаружено увеличение жизнеспособности нейронов гиппокампа [Antipova et al., 2016].
Ноопепт. Согласно полученным результатам ноопепт при исследованных концентрациях (1 нМ и 10 мкМ) по-разному действует на депрессию входящего АХ-тока (рис. 1, 2). Это было ожидаемо, поскольку при первой концентрации наблюдалось наибольшее увеличение входящего АХ-тока, а при второй – его недостоверное уменьшение [Разумовская и др., 2018]. Неожиданным стало наблюдаемое для обеих концентраций препарата отсутствие восстановления (или очень медленное восстановление) после окончания аппликации АХ.
Полученная кривая выработки депрессии входящего АХ-тока при воздействии ноопепта концентрации 1 нМ отличается от контрольной кривой временем выработки и уровнем депрессии. Сравнение кривой выработки депрессии при воздействии ноопепта с ранее полученными кривыми воздействия различных блокаторов на депрессию АХ-тока позволяет выделить кривую, которая по скорости выработки и уровню депрессии соответствует нынешней кривой (с учетом разброса значений). Это кривая депрессии АХ-тока, полученная при воздействии эндотала, который является специфическим ингибитором протеинфосфатазы РР2А [Пивоваров и др., 2013б]. Характер поведения обеих кривых (при воздействии ноопепта и эндотала) и сравнимые величины изменения констант скоростей перехода позволяют сделать вывод о возможном влиянии ноопепта на активность РР2А. В нашей работе [Пивоваров и др., 2013б] подробно обсуждается роль РР2А как в транспорте рецепторов из мембраны, так и в их рециклировании. Обращает на себя внимание тот факт, что при наличии эндотала также наблюдается замедленное восстановление токовой кривой после окончания аппликации АХ. Возможно, ноопепт каким-то образом ингибирует эту ПФ и тем самым вызывает усиление депрессии входящего АХ-тока.
Согласно полученным результатам при увеличении концентрации ноопепта до 10 мкМ не наблюдается существенного влияния препарата на выработку и уровень депрессии входящего АХ-тока. Однако на основе этого нельзя сделать вывод о том, что на процессы, лежащие в основе выработки и формирования уровня депрессии, ноопепт не влияет, поскольку не наблюдается восстановления тока после окончания ритмической аппликации АХ. Отсутствие восстановления тока, по-видимому, связано либо с продолжающим преобладанием эндоцитоза рецепторов над их экзоцитозом, либо с уменьшением суммарного количества никотиновых АХ-рецепторов на мембране и в примембранной области. Из этого следует, что и в этом случае ритмическая аппликация АХ при воздействии ноопепта влияет на какие-то внутриклеточные процессы, приводящие к длительному уменьшению количества никотиновых АХ-рецепторов на мембране.
В наших исследованиях по изучению влияния ингибиторов ПФ на депрессию входящего АХ-тока было показано, что в то время как эндотал (специфический ингибитор ПФ РР2А) вызывает усиление депрессии тока, окадаевая кислота (ингибитор как ПФ РР2А, так и РР1) вызывает ослабление депрессии тока [Пивоваров и др., 2013б]. В этой работе подробно обсуждаются процессы, зависящие от активности РР1 и влияющие на транспортировку содержащих рецепторы везикул в примембранной области. Поскольку ингибирование только РР2А приводит к увеличению уровня десенситизации, то делается вывод, что экспериментальная кривая при воздействии окадаевой кислоты является суперпозицией воздействия на эндо- и экзоцитоз рецепторов ингибирования обеих ПФ, разнонаправленно влияющих на примембранные транспортные процессы. Возможно, что ноопепт в концентрации 1 нМ влияет на активацию РР2А, а в концентрации 10 мкМ воздействует дополнительно на какие-то внутриклеточные процессы. В настоящее время не существует других экспериментальных данных относительно внутриклеточных веществ, взаимодействующих с ноопептом, с которыми можно было бы сравнить полученные результаты для обеих концентраций препарата.
Пирацетам. Кривая выработки депрессии входящего АХ-тока при воздействии пирацетама (концентрации 1 мМ) отличается от контрольной кривой меньшими значениями скорости выработки и уровня депрессии (рис. 3). Сравнение кривой выработки депрессии при воздействии пирацетама с ранее полученными кривыми воздействия различных блокаторов на депрессию АХ-тока [Махновский и др., 2011; Пивоваров и др., 2012; Пивоваров и др., 2013а; Пивоваров и др., 2013б] позволяет выделить несколько кривых, которые по скорости выработки и уровню депрессии соответствуют нынешней кривой (с учетом разброса значений). Это кривые депрессии АХ-тока, полученные при воздействиях цитохалазина В, циперметрина, CCT007093 и MLCK-IP-18. Цитохалазин В является одним из токсинов, нарушающих функцию актиновых микрофиламентов цитоскелета, вследствие проникновения через клеточную мембрану и ингибирования полимеризации актина, а MLCK-IP-18 – ингибитор киназы легких цепей миозина. Циперметрин – ингибитор протеинфосфатазы 2В (РР2В), а CCT007093 – селективный ингибитор магний-зависимой сериновой протеинфосфатазы 1D (PPM1D). Если наличие воздействия цитохалазина В и MLCK-IP-18 позволяет сразу сделать вывод о роли транспортных процессов в депрессии АХ-тока, то относительно механизмов влияния данных ПФ на процессы транспортировки рецепторов было высказано несколько предположений [Пивоваров и др., 2013б]. Полученные при математическом моделировании изменения скоростей транспортировки рецепторов при действии пирацетама также лежат в диапазоне изменений соответствующих расчетных значений для кривых депрессии при воздействии выше указанных ингибиторов. Поэтому возможно, что активация мускариновых АХ-рецепторов (приводящая к увеличению внутриклеточной концентрации Са2+ и активации РР2В или через процессы, связанные с белком р53, к активации РРМ1D) активизирует примембранный транспортный процесс АХР. А воздействие пирацетама на белки рецепторного транспорта (поскольку не обнаружено сродства препарата к самим мускариновым АХР [Pugsley et al., 1983]), вероятно, приводит к блокировке выше описанных процессов. Сравнить полученные результаты с существующими данными о воздействии пирацетама на текучесть мембраны [Müller et al., 1997], на ионотропные, лиганд – и потенциал-зависимые каналы, такие как [Na+/Ca2+]/K насосы мембран нейронов и нервно-мышечных синапсов [Malykh, Sadaie, 2010], потенциал-зависимые Са2+ каналы Са2+ V2.2 в периферических и центральных нейронах [Bravo-Martinez et al., 2012] или увеличение потенциала мембраны, повышение уровня образования АТФ, высвобождение проапоптозных факторов [Leuner et al., 2010], проблематично.
Согласно полученным результатам внутриклеточные вещества, на которые воздействуют ноопепт и пирацетам, различны. Возможно, что с этим связано различие концентраций данных ноотропов, вызывающих увеличение входящего АХ-тока. Общими для обоих ноотропов является увеличение на мембране количества АХР вследствие изменения скоростей их примембранного транспорта.
Необходимо отметить, что сравнение кривых депрессии входящего АХ-тока при воздействиях ноопепта и пирацетама и полученных ранее экспериментальных данных о влиянии ингибиторов различных ПК и ПФ на выработку депрессии тока позволяют рассмотреть воздействия этих ноотропов только с точки зрения их ингибирующего влияния на внутриклеточные процессы. Поэтому как для подтверждения этого, так и для определения возможного активизирующего воздействия этих препаратов на какие-то внутриклеточные мишени необходимы дальнейшие исследования.
Из полученных результатов следует, что в случае приема человеком обоих ноотропов при увеличенном выбросе АХ, в течение некоторого времени после приема лекарств возможно изменение реакций, зависящих от активации АХР. Однако на долговременные процессы, зависящие от синтеза мРНК-нейротрофических факторов, таких как NGF и BDNF [Ostrovskaya et al., 2008], этот эффект, полагаем, не будет оказывать влияния.
ЗАКЛЮЧЕНИЕ
Согласно полученным результатам при низкой концентрации ноопепта (1 нМ) депрессия вызванного входящего ацетилхолинового тока в идентифицированных нейронах виноградной улитки усиливается, в то время как при увеличении концентрации препарата (до 10 мкМ) кривая депрессии тока аналогична кривой депрессии в контроле. Это может быть связано с тем, что при низкой концентрации ноопепт влияет на активацию протеинфосфатазы 2А, а увеличение его концентрации приводит к изменению также активности протеинфосфатазы 1.
Пирацетам концентрации 1 мМ ослабляет депрессию входящего ацетилхолинового тока в идентифицированных нейронах виноградной улитки. Наблюдаемое воздействие пирацетама на нейроны, возможно, связано с изменением активности протеинфосфатазы 2В, магний-зависимой сериновой протеинфосфатазы 1D или киназы легких цепей миозина. Для обоих препаратов характерно то, что после прекращения ритмической аппликации ацетилхолина не происходит восстановления прежнего уровня ответа нейрона.
Авторы выражают благодарность Р.У. Островской за предоставленные препараты и С.Б. Ястребовой за помощь в работе.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (грант № 17-00-00052).
Список литературы
Гудашева Т.А., Сколдинов А.П. Стратегия создания дипептидных нейропсихотропных лекарственных препаратов. Экспериментальная и клиническая фармакология. 2003. 66 (2): 15–19.
Иерусалимский В.Н., Захаров И.С., Палихова Т.А., Балабан П.М. Нервная система и картирование нейронов брюхоногого моллюска Helix lucorum L. Журн. высш. нерв. деят. 1992. 42 (6): 1075–1089.
Махновский Д.А., Мурзина Г.Б., Третьякова М.С., Пивоваров А.С. Роль серин/треониновых и тирозиновых протеинкиназ в депрессии холиночувствительности нейронов виноградной улитки на клеточном аналоге привыкания. Журн. высш. нерв. деят. 2011. 61 (4): 459–475.
Мурзина Г.Б., Пивоваров А.С. Модуляция ноопептом вызванного ацетилхолином входящего тока в нейронах виноградной улитки. Биофизика. 2019. 64 (3): 507–514.
Островская Р.У., Мирзоев Т.Х. Фирова Ф.А, Трофимов С.С., Гудашева Т.А., Греченко Т.Н., Гутырчик Е.Ф., Баркова Е.Б. Поведенческий и электрофизиологический анализ холино-позитивного действия ноотропногоацил-пролин дипептида, ГВС-111. Экспериментальная и клиническая фармакология. 2001. 64 (2): 11–14.
Пивоваров А.С., Мурзина Г.Б., Васильева Н.А., Махновский Д.А. Роль актиновых микрофиламентов в депрессии вызванных ацетилхолином токов в нейронах виноградной улитки на клеточном аналоге привыкания. Журн. высш. нервн. деят. 2012. 62 (2): 222–232.
Пивоваров А.С., Мурзина Г.Б., Махновский Д.А., Васильева Н.А., Третьякова М.С. Роль миозинов в депрессии чувствительности нейронов виноградной улитки к ацетилхолину на клеточном аналоге привыкания. Журн. высш. нервн. деят. 2013а. 63 (4): 470–478.
Пивоваров А.С., Мурзина Г.Б., Третьякова М.С., Махновский Д.А. Роль серин/ треониновых и тирозиновых протеинфосфатаз командных нейронов виноград ной улитки на клеточном аналоге привыкания. Журн. высш. нервн. деят. 2013б. 63 (2): 256–268.
Разумовская М.А., Мурзина Г.Б., Островская Р.У., Пивоваров А.С. Модуляция ноопептом и пирацетамом никотиновых рецепторов нейронов виноградной улитки. Журн. высш. нервн. деят. 2018. 68 (4): 537–548.
Antipova T.A., Nikolaev S.V., Ostrovskaya P.U., Gudasheva T.A., Seredenin S.B. Dipeptide piracetam analogue noopept improves viability of hippocampal HT-22 neurons in the glutamate toxicity model. Bull. Exp. Biol. Med. 2016. 161 (1): 58–60.
Bravo-Martínez J., Arenas I., Vivas O., Rebolledo-Antúnez S., Vázquez-García M., Larrazolo A., García D.E. A novel CaV2.2 channel inhibition by piracetam in peripheral and central neurons. Exp. Biol. Med. 2012. 237 (10): 1209–1218.
Gudasheva T.A., Voronina T.A., Ostrovskaya R.U., Rozantsev G.G., Vasilevich N.I., Trofimov S.S., Kravchenko E.V., Skoldinov A.P., Seredenin S.B. Synthesis and antiamnestic activity of a series of N-acylprolyl-containing dipeptides. Eur. J. Med. Chem. 1996. 31 (2): 151–157.
Leuner K., Kurz Ch., Guidetti G., Orgogozo J.M., Müller W.E. Improved mitochondrial function in brain aging and Alzheimer disease – the new mechanism of action of the old metabolic enhancer piracetam. Frontiers in neuroscience Review Article. 2010; 4: article 44. https://doi.org/10.3389/fnins.2010.00044
Malykh A.G., Reza Sadaie M. Piracetam and piracetam–like drugs. From basic science to novel clinical applications to CNS disorders. Drugs. 2010. 70 (3): 287–312.
Müller W.E., Koch S., Scheuer K., Rostock A., Bartsch R. Effects of piracetam on membrane fluidity in the aged mouse, rat, and human brain. Biochem. Pharmacol. 1997. 53 (2): 135–140.
Ostrovskaya R.U., Vahitova J.V., Salimgareeva M.H., Jamidanov R.S., Seredenin S.B. Noopept Stimulates the Expression of NGF and BDNF in Rat Hippocampus. Bull. Exp. Biol. Med. 2008. 14 (2): 334–337.
Pilch H., Muller W.E. Piracetam elevates muscarinic cholinergic receptor density in the frontal cortex of aged but not of young mice. Psychopharmacology. 1988. 9 (4):74–78.
Pivovarov A.S., Murzina G.B., Makhnovsky D.A., Tret’yakova M.S., Vasil’yeva N.A. Mobility of acetylcholine receptors in command Helix lucorum neurons in a cellular analog of habituation. Invert. Neurosci. 2013. 13 (2): 135–150.
Pugsley T.A., Shih Y.H., Coughenoor L., Stewart S.F. Some neurochemical properties of pramiracetam (CI-879), a new cognition enhancing agent. Drug Develop. Res. 1983. 2: 407–420.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова