Журнал высшей нервной деятельности им. И.П. Павлова, 2020, T. 70, № 2, стр. 259-276
ПОЛОВЫЕ РАЗЛИЧИЯ В ОБОРОНИТЕЛЬНОМ ПОВЕДЕНИИ ВЗРОСЛЫХ КРЫС В ОТВЕТ НА РАННИЙ НЕЙРОВОСПАЛИТЕЛЬНЫЙ СТРЕСС
Н. Д. Брошевицкая 1, И. В. Павлова 1, *, М. И. Зайченко 1, М. В. Онуфриев 1, Ю. В. Моисеева 1, Г. А. Григорьян 1
1 Федеральное государственное бюджетное учреждение науки
Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
* E-mail: pavlovfml@mail.ru
Поступила в редакцию 07.10.2019
После доработки 22.11.2019
Принята к публикации 16.12.2019
Аннотация
Ранний провоспалительный стресс, создаваемый путем подкожного введения бактериального липополисахарида (ЛПС) на третий и пятый постнатальные дни, вызывал изменения в оборонительном поведении взрослых крыс, которые зависели от пола животного. У самцов с ранним введением ЛПС условнорефлекторный страх на контекст после выработки классического оборонительного условного рефлекса и рефлекса пассивного избегания проявлялся в большей степени, а его угашение было затруднено по сравнению с контрольными животными. У самок с ранним введением ЛПС не наблюдалось значительных изменений в проявлении страха, однако угашение классического рефлекса облегчалось. Реакция активного двустороннего избегания вырабатывалась с большим трудом и имела большую латентность у самок и особенно у самцов после провоспалительного стресса по сравнению с контрольными животными. После введения ЛПС у взрослых самцов после теста вынужденного плавания наблюдались повышенный уровень IL-1β в сыворотке крови, а у самок – уровень кортикостерона по сравнению с контрольными животными. Таким образом, ранний провоспалительный стресс у самцов способствовал приобретению и препятствовал угашению пассивных оборонительных навыков, но затруднял приобретение активных оборонительных рефлексов. В целом по характеристикам оборонительного поведения взрослых животных самки были более устойчивы к раннему провоспалительному стрессу, чем самцы.
В последние десятилетия особо пристальное внимание уделяется влияниям раннего стресса и других вредных воздействий (инфекции, интоксикации и т.д.) на поведение и здоровье взрослого организма. Согласно представлениям о перинатальном программировании (perinatal programming, [Hodgson, Coe, 2006]), воздействия в определенные временные интервалы в раннем онтогенезе способны вызвать существенные изменения в дальнейшем развитии и поведении взрослых особей. Согласно гипотезе двойного удара (double-hit hypothesis, [Maynard et al., 2001; Walker et al., 2009; Lahiri et al., 2009]), вмешательства в нормальное развитие в раннем онтогенезе создают предрасположенность к появлению психопатологии, которая может проявиться при новом вмешательстве в дальнейшей жизни (“втором ударе”). Обнаружена тесная связь ранних негативных влияний с развитием целого ряда соматических и психоневрологических заболеваний, при этом выявлены существенные половые различия в частоте проявления этих заболеваний. Например, хорошо известно, что мальчики болеют аутизмом в 4–5.1 раза чаще, чем девочки [Custodio et al., 2017]; женщины страдают депрессией и тревожными расстройствами в два раза чаще, чем мужчины [Parker, Brotchie, 2010]. У женщин чаще развивается посттравматический синдром [Kessler et al., 2012], болезнь Альцгеймера [Laws et al., 2018] и аутоиммунные заболевания, а у мужчин – сердечно-сосудистые и инфекционные заболевания. Базовой причиной для многих перечисленных расстройств является нейровоспаление. Пока непонятно, по каким механизмам нейровоспаление, возникающее под влиянием раннего стресса, запускает каскад сложных молекулярных, эпигенетических, биохимических, гормональных, нервно-гуморальных и иных преобразований, что приводит к особым изменениям поведения и развитию специфических психопатологий. Однако одно очевидно: эти преобразования могут иметь существенные половые различия, которые находят свое отражение в реактивности иммунной системы, особенностях внутриклеточного сигналинга, влиянии половых гормонов и гормонов стресса на систему нейровоспаления и т.д. [Berkiks et al., 2019; Tchessalova, Tronson, 2019; Villa et al., 2015; Vegeto et al., 2001].
Прогресс в данной области стал возможным благодаря разработке и применению моделей нейровоспаления в опытах на животных. Среди них наиболее часто используется модель нейровоспаления, вызванная провоспалительным стрессом, индуцированным инъекцией липополисахарида (см. обзор [Григорьян, 2020]). Липополисахариды (ЛПС) являются составными компонентами внешней части мембраны различных грамотрицательных бактерий. Первичными клетками-мишенями для ЛПС являются фагоциты, которые экспрессируют связанный с мембраной антиген CD14 (mCD14) и толл-4 рецепторы. ЛПС-связывающий протеин катализирует переход мономерного ЛПС из агрегатных комплексов к связывающему рецептору CD14 (mCD14) на поверхности фагоцитов, который в свою очередь ведет к высвобождению большого числа эндогенных провоспалительных медиаторов (цитокины, хемокины и др.) через TLR4*MD-2 комплекс [Alexander, Rietschel, 2001].
В литературе имеются сведения о влиянии раннего провоспалительного стресса на оборонительное поведение взрослых животных, результаты достаточно противоречивые [Tchessalova, Tronson, 2019; Kohman et al., 2008; Osborne et al., 2017; Doenni et al., 2017; Tishkina et al., 2016; Bilbo et al., 2006]. Провоспалительный стресс приводил к ослаблению условнорефлекторного страха на контекст, проявляющегося в виде замирания [Bilbo et al., 2006; Tchessalova, Tronson, 2019; Osborne et al., 2017], а также к дефициту в обучении распознаванию нового объекта [Tchessalova, Tronson, 2019; Osborne et al., 2017]. Однако другие авторы отмечают, наоборот, увеличение выражения условнорефлекторного страха на контекст у взрослых крыс после введения ЛПС в раннем онтогенезе [Tishkina et al., 2016]. В других работах не было обнаружено влияния введения ЛПС на 14-й день от рождения на выработку условнорефлекторного страха на контекст или на сигнал у взрослых крыс, но наблюдался дефицит в угашении классического оборонительного рефлекса [Doenni et al., 2017]. После провоспалительного стресса имелись нарушения при обучении в тесте Морриса [Harre et al., 2008] и при обучении активному избеганию [Kohman et al., 2008].
Известно, что в нормальных условиях у интактных животных существуют половые различия в выработке оборонительных условных рефлексов: у самцов, в отличие от самок, легче вырабатывается и дольше угашается классический оборонительный рефлекс и рефлекс пассивного избегания, вместе с тем рефлекс активного избегания вырабатывается более медленно [Павлова и соавт., 2020; Pettersson et al., 2016; Colon et al., 2018; Daviu et al., 2014; Van Haaren et al., 1990; Dalla, Shors, 2009; Maren et al., 1994]. Вопрос о том, как последствия раннего провоспалительного стресса проявятся в оборонительном поведении самцов и самок, изучен мало, и затрагивался только в нескольких работах [Kohman et al., 2008; Tchessalova, Tronson, 2018; Григорьян, 2020 и др.].
Целью настоящей работы было исследование половых различий в оборонительном поведении взрослых крыс аутбредной линии Вистар под влиянием раннего провоспалительного стресса, вызванного введением бактериального липополисахарида. В задачи работы входило изучение влияния неонатального нейровоспаления на выработку активно-оборонительных рефлексов у взрослых самцов и самок, а также выработку и угашение пассивно-оборонительных рефлексов, моделирующих в известной степени возникновение тревожных расстройств и посттравматического синдрома у человека. Кроме того, предполагалось оценить влияние раннего неонатального стресса на болевую чувствительность взрослых крыс и оценить состояние гипоталамо-гипофизарно-надпочечниковой оси и системы провоспалительных цитокинов по уровню стресс-гормона кортикостерона и цитокина IL-1β соответственно.
МЕТОДИКА
Объект исследования. В опытах было использовано 120 крыс линии Вистар в возрасте от 3 до 5 мес (61 самец и 59 самок). Крысята (15 пометов) были выведены в виварии ИВНД и НФ от крыс, полученных из филиала “Столбовая” ФГБУН НЦБМТ ФМБА, Россия. После ссаживания самцов и самок в одни клетки в их рацион питания кроме обычного сухого корма ПК-120 (ОАО “МЕЛЬКОМБИНАТ”) один раз в 2–3 дня добавляли либо куриные крылышки, либо творог, либо сухой корм Pronature (Канада) с содержанием белка 26%. Белковые добавки вводили для увеличения рождаемости и повышения выживаемости крысят. У 33 крысят (4 помета) вызывали провоспалительный стресс путем введения на 3-й и 5-й дни жизни бактериального липополисахарида (ЛПС) в дозе 50 мкг/кг в объеме 10 мкл/г (группа ЛПС). Во время этой процедуры крысят отлучали от матери на 15–20 мин, взвешивали на электронных весах с точностью до 0.01 г и им делали подкожную инъекцию ЛПС в холку с помощью инсулинового шприца. 48 крысятам (5 пометов) в этом же возрасте подкожно вводили физиологический раствор в объеме 10 мкл/г (группа ФИЗ, контроль 1). 39 крысят (6 пометов) оставались интактными, но на 3-й и 5-й дни жизни их также забирали от матери на 20 мин и взвешивали (группа ИНТ, контроль 2). У животных ЛПС группы в раннем онтогенезе стресс был комбинированный – воспаление от введения ЛПС и болевое воздействие от укола. В связи с этим были созданы две контрольные группы – ИНТ и ФИЗ, последняя служила основным контролем для ЛПС группы. В возрасте 25 дней крысят отлучали от матери и разделяли на подгруппы в зависимости от пола. В дальнейшем животных содержали в виварии при обычном 12-часовом световом режиме в свободном доступе к воде и стандартному корму ПК-120 в клетках размером 35 × 55 × 20 см по 4–5 крыс, в одной клетке находились крысы одного пола и, как правило, из одного помета. В экспериментах соблюдали принципы гуманности, изложенные в директивах Европейского Сообщества (2010/63/ЕU), и положения ИВНД и НФ РАН о работе с экспериментальными животными.
Большинство крыс (65 из 120) участвовало во всех экспериментах, у части животных (55 крысы) эксперименты заканчивались после выработки условного рефлекса пассивного избегания, у этих животных проводился иммуноферментный анализ сыворотки крови. Между опытами с разными видами рефлексов периоды отдыха животных составляли в среднем пять дней.
Определение порогов болевых реакций. Опыты проводили в камере Startle and Fear Combined System производства PanLab Harvard apparatus, Spain, 2000. Внутренняя камера размером 24 × 24 × 24 см, куда помещали животное, располагалась на 4 датчиках, фиксирующих движения крысы. Пол камеры представлял собой решетку, на которую подавался ток нарастающей силы (0, 25, 50, 100, 150 и 200 мкА) с межстимульным интервалом 90–120 с, длительностью 0.3 с. В опытах участвовали крысы в возрасте трех месяцев. Реакцию крысы на ток определяли визуально, а также по записи механограммы пола камеры, которую анализировали в интервалах 5 с до, во время и 50 с после стимула. Определяли порог вздрагивания, прыжков, побежки и вокализации в слышимом для человека диапазоне частот. После опыта с определением порогов в течение двух дней проводили угашение страха на обстановку камеры, для чего крыс помещали в камеру на 10 мин. Во всех последующих экспериментах с выработкой условнорефлекторного страха для того, чтобы избежать самовосстановления страха, в данной камере значительно меняли контекст: опилками покрывали пол, стены заклеивали бумагой.
Выработка, тестирование и угашение классического условного оборонительного рефлекса (fear conditioning). Для выработки классического павловского условного оборонительного рефлекса использовали камеру Startle and Fear Combined System производства PanLab Harvard apparatus (Spain, 2000). Эксперименты начинали у крыс в возрасте 3.5 мес. При обучении после 120 с периода обследования камеры животным давали 3 сочетания звука (30 с, 80 дБ, 2000 Гц) и электрокожного болевого раздражения (2 с, 0.8 мА, задержка 28 с от начала действия звука) с 40–50 с межсигнальными интервалами, после чего следовал период последействия в 40 с. Затем через 24 ч после обучения проводили тестирование условнорефлекторного страха (Тест 1), который оценивали по времени замирания. При тестировании животных помещали в тот же контекст на 120 с, после чего предъявляли звук в течение 120 с (80 дБ, 2000 Гц), далее следовал период последействия в 120 с. Далее в двух опытах проводили угашение условнорефлекторного страха, при этом давали по 10 изолированных звуковых стимулов (30 с, 80 дБ, 2000 Гц) без электрокожных раздражений с 20-секундными межсигнальными интервалами. После процедуры угашения тестировали сохранность рефлекса (Тест 2).
Во всех опытах поведение крыс анализировали до (реакции на контекст), во время (на контекст и сигнальный раздражитель) и после действия звука (последействие). Замирание – периоды неподвижности длительностью не менее 2 с, когда можно было наблюдать только дыхательные движения животного, определяли с помощью амплитудного и временного порогов. Амплитудный порог зависел от веса крысы, коэффициента усиления и выставлялся таким образом, чтобы отсечь интервалы с активным движением животного. Обработка проводилась с помощью стандартной программы, прилагающейся к установке фирмы Panlab. Программа позволяла детектировать эпизоды замирания, определять их длительность и рассчитывать процент времени замирания от времени регистрации. Кроме того, для оценки уровня эмоционального напряжения у крыс подсчитывали число дефекаций и уринаций.
Выработка условного рефлекса пассивного избегания (УРПИ) проходила в возрасте 4 мес в темно-светлой камере, состоящей из двух отсеков (аппаратно-программный комплекс Шелтер, ООО “Нейроботикс”, 2017). Детекция положения крысы проводилась с использованием инфракрасного излучения, а также с помощью видеорегистрации. Через 30 с после помещения крысы в светлый отсек (24 см × 24 см × 35 см) открывалась дверца между светлым и темным отсеком (24 см × × 24 см × 35 см) и в течение 180 с у крысы была возможность переходить из одного отсека камеры в другой. В первых двух контрольных опытах измеряли латентный период перехода из светлого отсека камеры в темный и длительность нахождения в темном отсеке. В третьем опыте вырабатывали УРПИ путем подачи тока на пол темного отсека (3 с, 0.8 мА) после захода в него крысы. В 7 последующих опытах, проводившихся в течение семи дней, проверяли сохранность и угашение выработанного навыка, ток не подавался. Определяли латентный период перехода в темный отсек и время пребывания в нем, число заглядываний в темный отсек, количество стоек, актов груминга, дефекаций и уринаций. Выделяли заглядывания с опорой на 1–3 лапы на пол темного отсека и заглядывания с засовыванием только головы в темный отсек. Кроме того, проводили качественную оценку УРПИ в баллах: 5 баллов – крыса не заходит и не заглядывает в темный отсек; 4 балла – крыса не заходит, но заглядывает в темный отсек, засовывая только голову; 3 балла – крыса не заходит, но заглядывает, ставя 1–3 лапы на пол темного отсека; 2 балла – крыса заходит в темный отсек с большей латентностью, чем в контрольных опытах; 1 балл – крыса заходит в темный отсек с такой же латентностью, как в контрольных опытах.
Выработка условного рефлекса активного избегания (УРАИ) начиналась у крыс в возрасте 4.5 мес и проходила в камере, разделенной на два равноценных отсека (24 см × 24 × × 35 см) с проходом (6 × 8 см) между ними (аппаратно-программный комплекс Шелтер, ООО “Нейроботикс”, 2017). Контекст камеры меняли по сравнению с опытами с УРПИ путем размещения панелей с черно-белым геометрическим рисунком на стенах камеры. После 2 мин исследования крысой камеры с посещением обоих отсеков начинали выработку УРАИ. В качестве условного стимула использовали комплексный световой (100 лкс) и звуковой (60 дБ) раздражители, в качестве безусловного стимула – ток на решетку пола (0.4 мА), задержка подачи тока от начала условного стимула составляла 10 с, максимальная длительность тока – 30 с. При переходе крысы в другой отсек стимулы автоматически выключались. Межсигнальные интервалы варьировали от 20 до 60 с. В каждом опыте давалось по 12 сочетаний условных и безусловных стимулов, выработка рефлекса проходила в течение семи дней. Выделяли два вида реакций крысы – реакция избавления (переход в другой отсек после начала действия тока) и реакция избегания (переход до начала действия тока). В каждом опыте подсчитывали долю и латентные периоды реакций избегания и избавления, число межсигнальных реакций, количество дефекаций и уринаций. Доля избегания (избавления) = число реакций избегания (избавления) за опыт/общее число сочетаний за опыт (12).
Иммуноферментный анализ крови. Перед забором крови в возрасте 6 мес проводили дополнительное стрессирование крыс в тесте вынужденного плавания. Для этого теста использовали цилиндры из оргстекла диаметром 20 см и высотой 50 см, которые заполнялись водой 25–26°С на 30 см. Крысы находились в воде 5 мин. Через 20–30 мин после окончания теста крыс умерщвляли декапитацией и собирали периферическую кровь, которую центрифугировали 15 мин при 4°С и 1500 g для получения сыворотки. Аликвоты сыворотки хранили при –80°С до проведения иммуноферментного анализа. Данный вид анализа был проведен у 48 крыс, остальных животных умерщвляли путем введения летальной дозы хлоралгидрата (800 мг/кг).
Для определения уровня кортикостерона в сыворотке крови использовали наборы для иммуноферментного анализа (DRG, Германия), с помощью которых детектировали как свободный, так и связанный с транспортными белками кортикостерон методом конкурентного иммуноферментного анализа. Содержание провоспалительного интерлейкина-1β в сыворотке крови определяли с помощью наборов производства R&D Systems (США) согласно инструкции производителя.
Статистическая обработка результатов. При обработке результатов использовали стандартную программу STATISTICA 8.0. Распределение исследованных параметров было проверено на нормальность по критерию Колмогорова–Смирнова (Basic Statistics, раздел Descriptive Statistics). Если анализируемый параметр удовлетворял данному критерию, то при сопоставлении групп крыс использовали дисперсионный анализ ANOVA, раздел factorial ANOVA, Repeated measures ANOVA. При post-hoc анализе применяли критерий Fisher LSD. Различия считали статистически значимыми при р < 0.05, отмечали наличие тенденции при 0.05 ≤ р ≤ 0.1. Во всех экспериментах анализировали влияние факторов “ПОЛ” и “ГРУППА” крыс, кроме того, в отдельных опытах учитывали факторы № ТЕСТА/ОПЫТА, ИНТЕРВАЛ ВРЕМЕНИ. При отсутствии нормальности распределения поведенческих параметров использовали Mann-Whitney U тест (Nonparametric Statistics). При сравнении процентных соотношений использовали 2 × 2 Table (Nonparametric Statistics), применяли критерий χ2. Данные на рисунках и в таблицах представлены в виде средних значений ± ошибки средних.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Вес крыс разных групп. Вес крыс в группе ЛПС не отличался от групп ИНТ или ФИЗ в возрасте 3 дня (до первого введения ЛПС), 5 дней (перед вторым введением), в 1 мес и 3 мес перед началом экспериментов (табл. 1). Введение ЛПС или физиологического раствора вызывало небольшое замедление прироста веса (2.4–2.9 г) крысят в 5 дней по сравнению с 3-м днем, в группе ИНТ прирост был больше (4.1–4.5 г). В возрасте 3 мес возникали половые различия в весе животных, самцы весили больше самок.
Таблица 1.
Вес крысят разных групп в возрасте 3 дня (до введения ЛПС), 5 дней (перед вторым введением), в 1 и 3 мес Table 1. Weight of rats of different groups at the age of 3 days (before the administration of LPS), 5 days (before the second injection), in 1 and 3 months
| Возраст | Группа крыс | Вес самцов, г | Вес самок, г |
|---|---|---|---|
| 3 дня | ИНТ | 7.3 ± 0.6 | 6.9 ± 0.4 # |
| ФИЗ | 7.8 ± 0.3 | 7.8 ± 0.3 # | |
| ЛПС | 7.8 ± 0.3 | 7.5 ± 0.3 | |
| 5 дней | ИНТ | 11.8 ± 0.8 | 11.0 ± 0.7 |
| ФИЗ | 10.7 ± 0.3 | 10.2 ± 0.3 | |
| ЛПС | 10.4 ± 0.3 | 10.3 ± 0.4 | |
| 1 мес | ИНТ | 79.5 ± 2.8* | 76.6 ± 2.6 |
| ФИЗ | 72.6 ± 2.2* | 72.0 ± 2.5 | |
| ЛПС | 80.0 ± 2.4 | 73.4 ± 2.3 | |
| 3 мес | ИНТ | 302.2 ± 8.0 $ | 227.1 ± 7.4 $ |
| ФИЗ | 323.6 ± 6.0 $ | 230.5 ± 7.1 $ | |
| ЛПС | 317.6 ± 6.7 $ | 220 ± 6.7 $ |
Примечание: * – статистически значимые различия между группами крыс в одном возрасте (p < 0.05, Mann-Whitney U Test), # – тенденция. $ – различия между самцами и самками внутри группы. Note: * – statistically significant differences between groups of rats at the same age (p < 0.05, Mann-Whitney U Test), # – trend. $ – differences between males and females within a group.
Влияние провоспалительного стресса на болевую чувствительность крыс. В табл. 2 представлены значения порогов различных болевых реакций у крыс трех разных групп. Анализ с помощью Factorial ANOVA обнаружил влияние фактора ПОЛ на порог вздрагивания (F1,66 = 6.85, р = 0.019) и побежек (F1,40 = 11.89, р < 0.001), при этом у самок по сравнению с самцами наблюдались более низкие пороги, как это отмечалось ранее [Павлова и соавт., 2020]. На порог прыжков и вокализации в слышимом для человека диапазоне частот фактор ПОЛ не оказывал влияния. Фактор ГРУППА крыс не оказывал существенного влияния ни на один из анализируемых видов болевых порогов (для вздрагивания р = 0.276, прыжков р = 0.749, побежек р = 0.713, вокализации р = 0.206). Таким образом, ранний провоспалительный стресс существенным образом не влиял на болевую чувствительность взрослых крыс.
Таблица 2.
Пороги различных болевых реакций крыс в группах ИНТ, ФИЗ и ЛПС Table 2. The thresholds of the different pain responses of the rats in ИНТ, ФИЗ and ЛПС groups
| Пол | Группа | Порог (мкА) | |||
|---|---|---|---|---|---|
| вздрагивания | прыжков | побежки | вокализации | ||
| Самцы | ИНТ | 30.6 ± 3.8 | 122.2 ± 12.1 | 137.5 ± 12.5 | 58.3 ± 15.3 |
| ФИЗ | 39.1 ± 2.5 | 122.5 ± 9.2 | 133.0 ± 14.4 | 70.0 ± 10.3 | |
| ЛПС | 35.0 ± 3.6 | 108.3 ± 30.0 | 150.0 ± 18.3 | 37.5 ± 14.5 | |
| Самки | ИНТ | 27.1 ± 3.3 | 100.0 ± 14.4 | 70.5 ± 12.5 | 45.8 ± 13.3 |
| ФИЗ | 29.5 ± 3.4 | 81.8 ± 10.2 | 100.0 ± 15.4 | 77.3 ± 13.8 | |
| ЛПС | 25.0 ± 3.8 | 112.5 ± 15.7 | 88.9 ± 25.4 | 72.2 ± 15.3 | |
Выработка, тестирование и угашение классического условного оборонительного рефлекса. Анализ с помощью Factorial ANOVA выработки условного оборонительного рефлекса (рис. 1 (а)) обнаружил влияние фактора ГРУППА крыс (F2,796 = 3.9, р = 0.021), ИНТЕРВАЛ ВРЕМЕНИ (F6,796 = 178.7, p < 0.000) и взаимодействие факторов ГРУППА/ПОЛ (F2,796= 4.2, р = 0.015). Влияние фактора ПОЛ проявилось на уровне тенденции (F1,796 = 3.6, р = 0.057). Post hoc анализ показал (рис. 1 (а)), что до первого болевого стимула (интервалы До и Зв1) различий в уровне замирания между группами крыс не наблюдалось. Во время второго условного стимула и после окончания сочетаний продолжительность замирания у самок группы ЛПС и ФИЗ была достоверно больше, чем у животных ИНТ группы, что можно рассматривать как свидетельство влияния болевой стимуляции от укола в неонатальный период. Однако различий между ЛПС и ФИЗ группами обнаружено не было. Таким образом, ранний провоспалительный стресс не оказал существенного влияния на процесс выработки классического оборонительного рефлекса.
Рис. 1.
Влияние раннего нейровоспалительного стресса на выработку и проявление классического оборонительного условного рефлекса. (а) – выработка рефлекса, (б) – Тест 1 (через сутки после выработки рефлекса). По вертикали – процент времени замирания, по горизонтали – различные интервалы времени в опыте (До – до действия звука, Зв 1–3 – 1–3 применение звука, После – после звука, МС1-2 – 1 и 2 межсигнальный интервал) * – статистически значимые различия между группой ЛПС и группой ИНТ, @ – между группой ЛПС и ФИЗ (р < 0.05, post hoc анализ, Factorial ANOVA), # – тенденция (0.05 ≤ р ≤ 0.1). Остальные обозначения как на рис. 1.
Fig. 1. The influence of neuroinflammatory stress on elaboration and manifestation of the classical defensive conditioned reflex (fear conditioning). (а) – acquisition of the reflex, (б) – Test 1 (24 hours after the reflex acquisition). On vertical axis – a percentage of freezing time, on horizontal axis – the timing of the experiment (До – before action of a sound, Зв 1–3 – 1–3 applications of a sound, После – after termination of a sound, МС1-2 – 1 and 2 intersignal interval). * – the significant differences between LPS and naïve groups, @ – between LPS and saline groups (р < 0.05, post hoc analyses, Factorial ANOVA), # – tendency (0.05 ≤ р ≤ 0.1). The rest designations are the same as in Fig. 1.
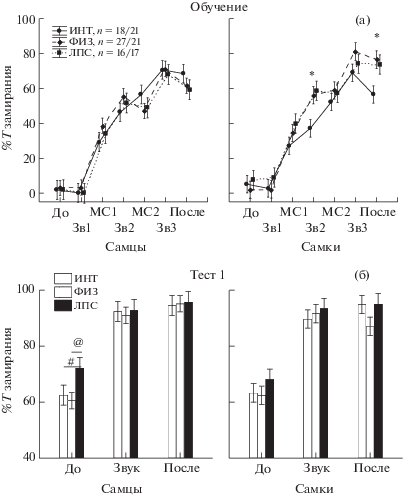
В Тесте 1 через 24 ч после обучения на время замирания оказывал влияние фактор ГРУППА (F2,342 = 3.18, p = 0.042), ИНТЕРВАЛ ВРЕМЕНИ (F2,342=134.2, p < 0.000), фактор ПОЛ не влиял (F1,342 = 0.6, р = 0.439). Детальный анализ поведения по интервалам времени (post hoc анализ) в Тесте 1 показал (рис. 1 (б)), что самцы группы ЛПС замирали на большее время (р < 0.05) в условиях только контекста в интервале до действия звука, чем самцы группы ФИЗ, различие с группой ИНТ проявлялось на уровне тенденции (0.05 < p < 0.1). В ответ на сигнальный раздражитель время замирания у самцов разных групп не отличалось. У самок в Тесте 1 различий по уровню замирания между разными группами крыс не было обнаружено, как в условиях контекста, так и при действии сигнального раздражителя. Таким образом, у самцов группы ЛПС условнорефлекторный страх в ответ на обстановку камеры проявлялся в большей степени, чем у контрольных крыс.
Из других анализируемых показателей поведения крыс межгрупповые различия наблюдались только по числу уринаций, у самцов в группе ЛПС число уринаций в Тесте 1 было меньше, чем в группе ИНТ (р = 0.037, post hoc анализ), с группой ФИЗ различий не было обнаружено. Это свидетельствовало о некотором парадоксальном реагировании, несмотря на большее время замирания у этой группы, вегетативная реактивность была снижена.
Для оценки эффективности угашения рефлекса проводили сопоставление результатов Теста 1 (после обучения) и Теста 2 (после угашения) с помощью Repeated measures ANOVA (рис. 2 (а)). Было выявлено влияние факторов ПОЛ (F1,455 = 19.5, р < 0.001), ТЕСТ (F1,455 = 1080, р < 0.001) и взаимодействие факторов ГРУППА/ПОЛ/ТЕСТ (F2,455 = 9.5, р < < 0.001). Post hoc анализ показал, что в Тесте 2 происходило значимое снижение времени замирания у всех групп крыс, т.е. угашение было эффективным (на рис. 2 (а) об этом свидетельствуют стрелки). Кроме того, в Тесте 2 самцы группы ЛПС в целом (при пребывании в условиях только контекста, а также при действии сигнального раздражителя без болевой стимуляции) замирали большее время, чем самцы ИНТ и ФИЗ групп (р < 0.05). Самки группы ЛПС в Тесте 2, наоборот, в целом замирали меньшее время, чем самки ИНТ и ФИЗ групп (р < 0.05). В Тесте 2 самки в группах ФИЗ и ЛПС замирали на меньшее время, чем самцы в аналогичных группах (р < 0.05).
Рис. 2.
Влияние раннего нейровоспалительного стресса на угашение классического оборонительного условного рефлекса. (а) – сопоставление результатов Теста 1 и 2, ↓ – снижение показателей в Тесте 2 по сравнению с Тестом 1 (р < 0.05, Repeated measures ANOVA). (б) и (в) – два сеанса угашения, (г) – Тест 2 (после процедуры 2-дневного угашения). По вертикали – процент времени замирания от времени регистрации, по горизонтали – на (а) – номер теста, на (б) и (в) – номер применения звука при угашении (промежуточные точки – межсигнальные интервалы), на (г) – интервалы времени в опыте (До – до действия звука, Звук – во время, После – после действия звука). * – статистически значимые различия между группой ЛПС и группой ИНТ, @ – между группой ЛПС и ФИЗ (р < 0.05, post hoc анализ), # – тенденция (0.05 < р < 0.1). Остальные обозначения как на рис. 1.
Fig. 2. The influence of the neuroinflammatory stress on extinction of fear conditioning. (а) – the comparison of Test 1 and Test 2 at retention of habit. ↓ – decrease of parameters in Test 2 compared with Test 1 (р < 0.05, Repeated measures ANOVA). (б) and (в) – the data for two days of extinction, (г) – Test 2 (after two days of extinction). On vertical axis – a percentage of freezing time, on horizontal axis – on (а) – the number of test, on (б) and (в) – the number of sound application at extinction, on (г) – the time intervals of the experiment (До – before sound, Звук – during sound, После – after termination of sound). * – the significant differences between LPS and naïve groups, @ – between LPS and saline groups (р < 0.05, Factorial ANOVA), # – tendency (0.05 ≤ р ≤ 0.1). The rest designations are the same as in Fig. 1.
Анализ времени замирания крыс в процессе первого и второго сеанса угашения (рис. 2 (б), (в)) с помощью Factorial ANOVA выявил влияние фактора ПОЛ (F1.2394 = 14.09, р < 0.001 для первого дня и F1,2394 = 85.88, р < 0.001 для второго дня). Фактор ГРУППА крыс оказывал влияние только при первом угашении (F2,2394 = 12.8, р < 0.001). Взаимодействие факторов ГРУППА/ПОЛ наблюдалось при первом (F2,2394 = = 5.09, р = 0.006) и втором сеансах угашения (F2,2394 = 14.66, р < 0.001). Post hoc анализ показал, что самцы группы ЛПС замирали на большее время, чем самцы контрольных групп, начиная с 7–8 применения звука при первом и втором сеансах угашения. Самки группы ЛПС также замирали больше, чем контрольные группы при первом угашении, однако при втором угашении различия исчезали, и при шестом применении звука в этом сеансе они замирали меньше, чем интактные самки (рис. 2 (б), (в)).
Подробный анализ в Тесте 2 по интервалам (рис. 2 (г)) с помощью Factorial ANOVA выявил влияние фактора ПОЛ (F1,341 = 34.13, р < 0.001) и взаимодействие факторов ПОЛ/ГРУППА (F2,341 = 6.99, р = 0.001). При этом у самцов ЛПС группы время замирания в ответ на сигнальный раздражитель было несколько больше (тенденция, р = 0.060), чем у самцов ИНТ группы. У самок группы ЛПС время замирания было меньше, чем у самок ИНТ (р = 0.009) и ФИЗ групп (тенденция, р = = 0.081) в ответ на сигнальный раздражитель, и по сравнению с ФИЗ группой (р = 0.041) в условиях контекста.
Таким образом, угашение классического условного оборонительного рефлекса у самцов группы ЛПС было затруднено, а у самок группы ЛПС, наоборот, проходило быстрее, чем у контрольных групп, как в ответ на контекст, так и на сигнал. Влияние ЛПС на угашение условнорефлекторного страха зависело от пола животных.
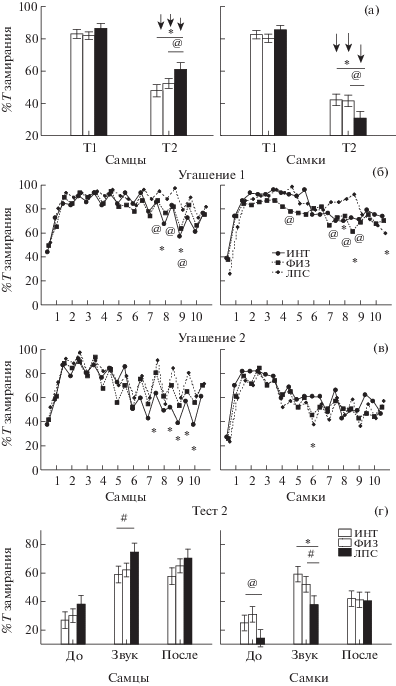
Выработка и угашение условного рефлекса пассивного избегания. Выработка УРПИ и тестирование сохранности навыка только в одном (первом после получения электрошока) опыте были проведены у всех крыс. У половины (67 крыс) кроме этого было исследовано угашение УРПИ в течение последующих 7 дней, на рис. 3 (а) представлены данные по этим животным. Преобладающее большинство крыс всех групп успешно выработали УРПИ (рис. 3 (б)). Межгрупповые различия в первом опыте по числу крыс, входящих в темный отсек, проявились на уровне тенденций, а по латентным периодам – не наблюдались (рис. 3 (а), (б)). Вместе с тем у самцов имелись различия в особенностях проявления УРПИ в первом опыте (рис. 3 (в)): у крыс группы ЛПС значительно чаще (р < 0.05, критерий χ2) рефлекс оценивали на 5 баллов (94%), чем у ИНТ (44%) и ФИЗ (67%) групп. У самок разных групп такого различия в качестве УРПИ не было обнаружено. В группах ФИЗ и ЛПС крыс имелись межполовые различия в качестве УРПИ: у самцов рефлекс на 5 баллов проявлялся чаще, чем у самок аналогичных групп. Таким образом, у самцов ЛПС группы условнорефлекторный страх после обучения проявлялся в большей степени, чем у самцов контрольных групп. У самок введение ЛПС существенно не повлияло на выработку УРПИ.
Рис. 3.
Влияние раннего нейровоспалительного стресса на выработку и угашение условного рефлекса пассивного избегания. (а) – средняя латентность входа в темный отсек от момента открывания дверцы в группах ИНТ, ФИЗ и ЛПС. По горизонтали – номер опыта (-2, -1 – до выработки рефлекса, 0 – день обучения, 1–7 – при угашении рефлекса). (б) – процент крыс с УРПИ на 1 и 2 балла в первом опыте после обучения (заходят в темный отсек). (в) – процент крыс с УРПИ на пять баллов в первом опыте после обучения (не заходят и не заглядывают в темный отсек). (г) – распределение крыс в зависимости от дня первого захода в темный отсек после обучения. * – статистически значимые различия между группой ЛПС и группой ИНТ, @ – между группой ЛПС и ФИЗ (р < 0.05, на (а) – Mann–Whitney U тест, на (б)–(г) – критерий χ2 , 2 × 2 Table). # – тенденция (0.05 ≤ р ≤ 0.1). $ – статистически значимые внутригрупповые различия (самцы/самки). Остальные обозначения как на рис. 1.
Fig. 3. The influence of the neuroinflammatory stress on acquisition and extinction of the passive avoidance reaction. (а) – the mean latency of entry into the dark part of the chamber after opening a door by the naïve, saline and LPS groups. On horizontal axis – a number of the experiment (-2, -1 – before acquisition, 0 – during learning, 1–7 – at extinction). (б) – the percentage of rats with passive avoidance reactions performed on 1 and 2 scores at the first experiment after learning (enter into the dark compartment). (в) – the percentage of rats with passive avoidance reactions performed 5 scores in the first experiment after learning (do not enter and do not look into the dark compartment). (г) – distribution of rats depending on the day of the first entry into the dark compartment after learning. * – the significant differences between LPS and naïve groups, @ – between LPS and saline groups (р < 0.05, on (а) – Mann–Whitney U test, (б)–(г) – criterion χ2 , 2 × 2 Table). # – tendency (0.05 ≤ р ≤ 0.1). $ – the significant differences within groups (males/females). The rest designations are the same as in Fig. 1.
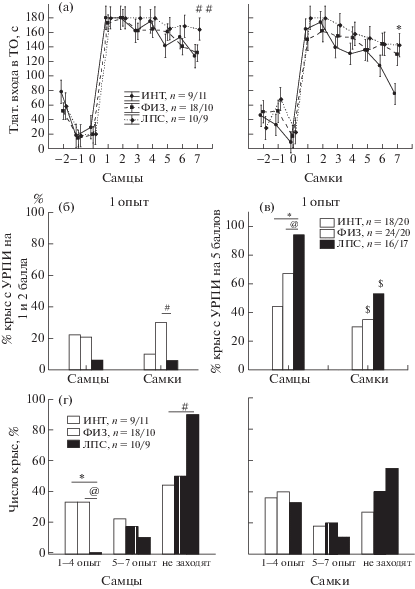
Угашение УРПИ у самцов группы ЛПС было затруднено (рис. 3 (а), (г)). Латентность входа в темный отсек у самцов группы ЛПС в седьмом опыте была несколько больше, чем у группы ФИЗ и ИНТ (рис. 3 (а)). Судя по гистограмме распределения крыс в зависимости от дня первого захода в темный отсек (рис. 3 (г)), самцы группы ЛПС совсем не заходили с 1 по 4 опыт в отличие от групп ИНТ и ФИЗ, в которых 33% самцов начинали заходить в темный отсек. За все время угашения 90% самцов группы ЛПС ни разу не зашли в темный отсек, в контрольных группах таких животных было только 44 (ИНТ) и 50% (ФИЗ). У самок в зависимости от дня первого захода в темный отсек не было обнаружено различий между группами ИНТ, ФИЗ и ЛПС (рис. 3 (г)), ни разу не зашло в темный отсек 27% самок ИНТ группы, 40% самок ФИЗ группы и 55% самок ЛПС группы. Угашение УРПИ было эффективно во всех подгруппах крыс, за исключением самцов ЛПС группы, о чем свидетельствовало сопоставление процента крыс входящих в темный отсек в первом и седьмом опытах. Латентный период входа в темный отсек в седьмом опыте был больше у самок группы ЛПС, чем у группы ИНТ, различий между группами ЛПС и ФИЗ не обнаружилось (рис. 3 (а)). Таким образом, у самцов группы ЛПС угашение УРПИ проходило медленнее, чем у контрольных животных. У самок введение ЛПС не оказало существенного влияния на скорость угашения по сравнению с контрольными животными.
Из других анализируемых показателей поведения крыс фактор ГРУППА оказывал влияние только на число уринаций (F2,800 = 10.75, p < 0.001), кроме того, было обнаружено взаимодействие факторов ПОЛ/ГРУППА (F2,800 = = 5.12, p = 0.006). Post hoc анализ показал, что у самцов группы ЛПС было меньше уринаций с 0 по 7 опыт, у самок различий между группами не наблюдалось. Полученные данные свидетельствуют о снижении вегетативной реактивности при выработке и угашении УРПИ у самцов группы ЛПС.
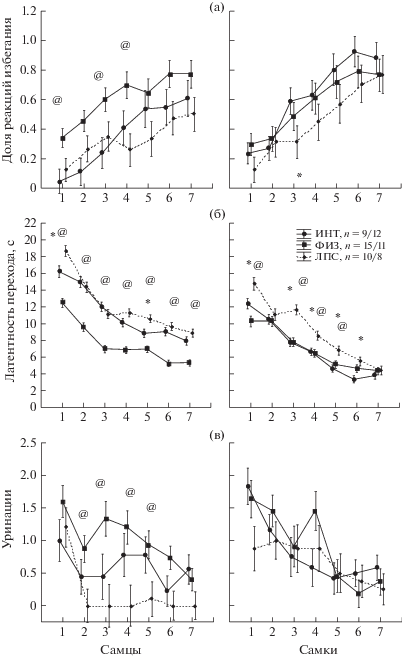
Выработка условного рефлекса двустороннего активного избегания. В отдельные дни в основном в начале обучения доля реакций избегания у группы ЛПС была ниже, чем у одной из контрольных групп (1, 3, 4-й день у самцов, 3 день у самок, р < 0.05, Mann-Whitney U-тест, рис. 4 (а)). На латентность перехода между отсеками существенное влияние оказывали факторы ГРУППА (F2,774 = 47.9, р < 0.001) и ПОЛ (F1,774 = 96.0, р < 0.001) животных, а также наблюдалось взаимодействие между ними (F2,774 = 17.0, р < 0.001). Post hoc анализ показал (рис. 4 (б)), что у самцов группы ЛПС латентность перехода между отсеками была больше, чем у самцов группы ФИЗ (во всех опытах) и группы ИНТ (в первом и пятом опытах). У самок группы ЛПС латентность перехода между отсеками была больше, чем у самок группы ИНТ и ФИЗ (в первом и третьем-шестом опыте). В группах ЛПС и ИНТ имелись половые различия, у самцов латентные периоды переходов были больше, чем у самок. На число уринаций оказывали влияние факторы ГРУППА крыс (F2,59 = 11.29, р < 0.001) и ПОЛ (F1,59 = 5.29, р = 0.025), также наблюдалось взаимодействие между этими факторами (F2,59 = 3.41, р = 0.040). Post hoc анализ показал (рис. 4 (в)), что у самцов группы ЛПС число уринаций было меньше, чем у группы ФИЗ (со второго по шестой опыт) и у группы ИНТ (четвертый–пятый опыты). У самок различий между группами крыс по числу уринаций не наблюдалось. На другие анализируемые показатели поведения (долю реакций избавления, число дефекаций, число межсигнальных переходов) введение ЛПС не оказывало влияния. Таким образом, нейровоспалительный стресс в раннем возрасте с помощью введения ЛПС приводил к увеличению латентности переходов между двумя отсеками у самцов и самок, а также к уменьшению вегетативной реактивности у самцов.
Рис. 4.
Влияние раннего нейровоспалительного стресса на выработку рефлекса активного избегания. По оси абсцисс – № опыта, по оси ординат на (а) – доля реакций избегания, на (б) – латентность перехода между отсеками, на (в) – число уринаций за опыт. * – статистически значимые отличия между группой ЛПС и группой ИНТ, @ – между группой ЛПС и ФИЗ (р < 0.05, на (а) – Mann–Whitney U тест, на (б), (в) – post hoc анализ, Factorial ANOVA), # – тенденция (0.05 < р < 0.1). n – число крыс в группе (самцы/самки). Остальные обозначения как на рис. 1.
Fig. 4. The influence of the early neuroinflammatory stress on elaboration of the two way active avoidance reaction. On abscissa – a serial number of the experiment, on ordinate – (а) – the mean probability of the avoidance reaction, (б) – the latency of transition between compartments, (в) – a number of urinations in the experiment. * – the significant differences between LPS and naïve groups, @ – between LPS and saline groups (р < 0.05, on (а) – Mann–Whitney U test, on (б), (в) – Factorial ANOVA), # – tendency (0.05 < р < 0.1). n – the number of rats in the group (males/females). The rest designations are the same as in Fig. 1.
Влияние ЛПС на уровень кортикостерона и IL-1β. Проведенный иммуноферментный анализ сыворотки крови, взятой через 20–30 мин после стрессового воздействия (тест вынужденного плавания) у крыс в возрасте 6 мес показал (рис. 5 (а)), что на уровень кортикостерона существенное влияние оказывал фактор ПОЛ (F1,42 = 55.78, p < 0.001). У самок всех групп уровень кортикостерона был выше, чем у самцов (р < 0.05, post hoc анализ). Фактор ГРУППА крыс оказывал слабое влияние на уровень кортикостерона в виде тенденции (F2,42 = 2.71, p = 0.078). Только у самок группы ЛПС уровень кортикостерона был выше, чем у интактной группы (post hoc анализ).
Рис 5.
Влияние раннего провоспалительного стресса на уровни кортикостерона (a) и ИЛ-1β (б) в сыворотке крови у взрослых самцов и самок после теста Порсолта. По горизонтали – пол крыс. * – статистически значимые различия между группой ЛПС и группой ИНТ, @ – между группой ЛПС и ФИЗ (р < 0.05, post hoc анализ Factorial ANOVA). Остальные обозначения как на рис. 1.
Fig. 5. The influence of the early proinflammatory stress on corticosterone (а) and IL-1β (б) levels in the blood serum of adult males and females after Porsolt test. On horizontal axis – the sex of rats. * – the significant differences between LPS and naïve groups, @ – between LPS and saline groups (р < < 0.05, post hoc analysis Factorial ANOVA). The rest designations are the same as in Fig. 1.
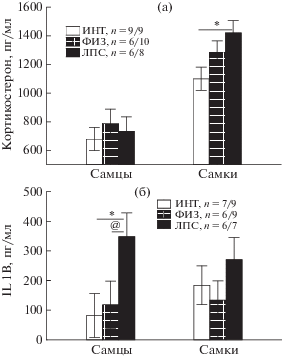
На уровень IL-1β влияние оказывал фактор ГРУППА крыс (F2,38 = 3.81, p = 0.031). Post hoc анализ показал, что у самцов группы ЛПС уровень IL-1β был выше, чем у самцов контрольных групп (рис. 5 (б)). У самок значимых различий в уровне IL-1β у разных групп крыс не было обнаружено.
Таким образом, ранний провоспалительный стресс оказывал разное влияние на реактивность гипоталамо-гипофизарно-надпочечниковой оси и биосинтез провоспалительного цитокина после эмоционального стресса у взрослых самцов и самок: у самцов в возрасте 6 мес повышался уровень провоспалительного цитокина IL-1β, а у самок – уровень кортикостерона.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В настоящей работе ранний провоспалительный стресс оказывал сходное влияние на выработку и угашение двух форм пассивных оборонительных рефлексов – классического оборонительного рефлекса и рефлекса пассивного избегания, причем воздействие на самцов и самок существенно различалось. У самцов провоспалительный стресс приводил к увеличению проявления условнорефлекторного страха на контекст при классическом рефлексе и проявления УРПИ при тестировании через 24 ч после обучения, у самок – не оказывал значимого влияния. Угашение этих форм рефлексов у самцов после провоспалительного стресса было затруднено, у самок – облегчалось при классическом рефлексе или оставалось без изменений по сравнению с контролем при УРПИ.
Проведенное исследование болевой чувствительности к электрическому току по методике flinch-jump не выявило влияние введения ЛПС в раннем онтогенезе на пороги болевых реакций у взрослых крыс. Ранее также не было обнаружено влияния введения ЛПС на 14-день от рождения на пороги болевых реакций крыс в тесте на горячей пластинке [Doenni et al., 2017]. Эти данные свидетельствуют о том, что изменения в условнорефлекторной деятельности под влиянием ЛПС не связаны с изменением болевой чувствительности крыс.
В литературе имеются сведения о влиянии раннего провоспалительного стресса на проявление условнорефлекторного страха и память, причем данные достаточно противоречивые. Большинство работ свидетельствуют о нарушении гиппокамп-зависимых условных рефлексов – условнорефлекторного страха на контекст, но не на сигнал [Bilbo et al., 2006; Harre et al., 2008; Tchessalova, Tronson, 2019], а также о нарушении памяти о предметах при распознавании новых/знакомых объектов [Tchessalova, Tronson, 2019]. В некоторых работах [Tishkina et al., 2016], также как и в наших опытах, провоспалительный стресс, создаваемый путем введения ЛПС самцам на третий и пятый дни после рождения, приводил, наоборот, к увеличению проявления условнорефлекторного страха на контекст, но не на звук. Известно, что другие виды раннего стресса могут также приводить к увеличению проявления условнорефлекторного страха на контекст. Например, стресс, создаваемый путем нанесения неизбегаемых ударов током на 17-й день от рождения, приводил к увеличению условнорефлекторного страха в разные периоды жизни [Quinn et al., 2014]. Стресс в подростковом возрасте, создаваемый путем предъявления запаха хищника крысе, находящейся на приподнятой платформе, приводил к увеличению проявления условнорефлекторного страха на звук и нарушению его угашения у взрослых самцов [Toledo-Rodriguez, Sandi, 2007].
Существенные половые различия во влиянии раннего провоспалительного стресса проявились в нашей работе при угашении классического оборонительного рефлекса и УРПИ. Необходимо отметить, что в норме угашение условнорефлекторного страха быстрее проходит у интактных самок, чем у самцов [Daviu et al., 2014; Павлова и соавт., 2020]. Возникает вопрос, почему у самок, получавших ЛПС в раннем возрасте, условнорефлекторный страх при классическом условном рефлексе угашается даже быстрее, чем у контрольных самок? Одно из возможных объяснений может быть связано с нарушением у них механизмов сигнальной и контекстуальной памяти. Действительно, известно, что острое введение ЛПС взрослым животным ведет к ухудшению памяти [Czerniawski et al., 2015; Cunningham, Sanderson, 2008; Pugh et al., 1998], что происходит, вероятно, за счет выделяемых микроглией и другими клетками провоспалительных цитокинов и хемокинов. Например, показано, что микроинъекция цитокина IL-6 непосредственно в миндалину приводила к ухудшению выработки и нарушению угашения условнорефлекторного страха на звук [Hao et al., 2014]. Предотвращение активации микроглии и снижение продукции цитокинов уменьшает нарушение памяти [Williamson et al., 2011]. После инфекции в раннем онтогенезе клетки микроглии, богатые CD11b+, являющиеся источником IL-1β, увеличивают свою чувствительность и продукцию цитокина [Williamson et al., 2011]. Цитокины могут влиять на память не только прямо, но и опосредованно, вызывая снижение активности трофических факторов, в частности, BDNF, играющего важную роль в синаптической пластичности и памяти [Andero et al., 2014]. Причем надо помнить, что активность BDNF в гиппокампе и миндалине находится также под влиянием половых гормонов [Scharfman, MacLusky, 2014].
Кроме того, в электрофизиологических исследованиях на срезах мозга было показано, что введение ЛПС в раннем онтогенезе приводит к дефициту длительной потенциации в поле СА1 гиппокампа крыс в возрасте 1 мес, т.е. влияет на синаптическую пластичность [Tishkina et al., 2016]. Интересно отметить, что у самок после раннего провоспалительного стресса по сравнению с самцами наблюдается более выраженный дефицит длительной посттетанической потенциации в гиппокампе [Кудряшова и соавт., 2018]. Нарушение пластичности в гиппокампе после введения ЛПС может быть связано с уменьшением экспрессии некоторых субъединиц NMDA рецепторов [Harre et al., 2008], а также накоплением кортикостерона и IL-6 в гиппокампе [Onufriev et al., 2017].
Существуют определенные трудности для объяснения более длительного угашения условнорефлекторного страха у самцов после введения ЛПС. Ранее также наблюдали увеличение времени угашения условнорефлекторного страха на звуковой сигнал у взрослых крыс после введения ЛПС на 14-й день от рождения [Doenni et al., 2017]. Кроме того, происходило увеличение экспрессии cFos генов в центральном ядре миндалины, на основании чего предполагалось, что такая повышенная активация миндалины могла быть причиной нарушений в угашении страха [Doenni et al., 2017]. Необходимо отметить, что влияние раннего нейровоспалительного стресса на самцов может служить моделью для возникновения тревожных расстройств и посттравматического стрессового расстройства. При этих заболеваниях, широко распространенных в клинике у человека, как известно, нарушаются механизмы угашения страха.
Полученные в настоящей работе данные о существенных половых различиях во влиянии введения ЛПС на оборонительное условнорефлекторное поведение связаны, по-видимому, с тем, что нейровоспалительный процесс протекает по-разному у самцов и самок [Григорьян, 2020; Klein, Flanagan, 2016]. Известно, что сразу после введения ЛПС происходит появление болезненного состояния (sickness behavior) и параллельно повышается уровень провоспалительных цитокинов в мозге [Claypoole et al., 2017; Cai et al., 2016], причем самцы демонстрируют более выраженное болезненное состояние и большие изменения температуры тела, чем самки [Cai et al., 2016]. В литературе имеются сведения о том, что эстрогены способны оказывать противовоспалительное влияние. Известно, что эстрогены ускоряют протекание воспалительного процесса в сторону его деактивации, большая роль при этом отводится противовоспалительному IL-4 [Villa et al., 2015]. Эстрогены также могут затормозить выработку провоспалительных цитокинов [Najjar et al., 2018]. Эти факты могут объяснить полученный нами невысокий уровень IL-1β у самок в 6 мес.
У самцов и самок могут различаться набор выделяемых цитокинов, их локализация и клеточный источник при нейровоспалении. Например, показано, что у самок интраназальное введение ЛПС вызывает большую, чем у самцов экспрессию в гиппокампе и стволе мозга IL-6 и TNFα [Tonelli et al., 2008]. При нейровоспалении, вызванном ишемическим инсультом, у самок по сравнению с самцами повышается продукция противовоспалительного цитокина IL-4, а также увеличивается экспрессия рецепторов к IL-4 и IL-10 на глиальных клетках [Bodhankar et al., 2015]. Повышение уровня цитокинов после экспериментального инфаркта миокарда у крыс, создаваемого путем пережатия артерии, происходило в префронтальной коре только у самцов, но не самок [Najjar et al., 2018]. Половые различия наблюдаются в морфологии и работе глиальных клеток после нейровоспаления. Так, введение ЛПС на 14-й день от рождения приводило к увеличению числа микроглиальных клеток в дорзальном и вентральном гиппокампе, причем у самок были большие изменения, чем у самцов [Berkiks et al., 2019]. Число астроцитов увеличивалось у самок, но уменьшалось у самцов. У самцов микроглия является источником цитокинов при нейровоспалении, их экспрессия увеличивается после стресса, у самок не происходит увеличения выделения цитокинов из микроглии [Fonken et al., 2018]. На сегодняшний день трудно сказать, какие конкретно цитокины и каким образом (через активацию внутриклеточных сигнальных путей, взаимодействие с половыми гормонами, факторами роста и т.д.) оказывают дифференцированное влияние на механизмы памяти у самцов и самок.
Согласно гипотезе Г.А. Григорьяна [2020], существенные различия в реакциях на повторные стрессы у самцов и самок вызваны тем, что первичные стрессы (priming) разной природы в раннем неонатальном периоде в зависимости от ряда условий (времени применения стресса, его характера и силы, дозы ЛПС и др.) приводят к сенситизации или десенситизации нейровоспалительной системы. Причем для самцов в большей степени характерна сенситизация, а для самок десенситизация процессов нейровоспаления [Fonken et al., 2018]. Явление десенситизации (“эндотоксической толерантности”) может происходить при повторных применениях ЛПС и/или других стрессов [Vergadi et al., 2018; Valles et al., 2005; Lehner, Hartung, 2002]. Проведенный нами иммуноферментный анализ сыворотки крови у крыс в 6 мес показал, что сенситизация нейровоспаления у самцов группы ЛПС проявилась в повышенном уровне провоспалительного цитокина IL 1β после стрессирующего воздействия, у самок сенситизация не наблюдалась, уровень цитокина не отличался от контроля.
При выработке активного избегания у крыс группы ЛПС, как у самцов, так и самок наблюдались некоторые трудности в обучении и увеличение латентностей переходов между отсеками. Внутри ЛПС группы у самцов латентности переходов были больше, чем у самок. Ранее также было показано, что неонатальное введение ЛПС на четвертый и пятый день жизни могло нарушать обучение активному избеганию у взрослых крыс [Kohman et al., 2008]. Введение ЛПС непосредственно перед сеансами обучения активному избеганию у взрослых животных также приводило к дефициту в обучении [Sparkman et al., 2005]. Как известно, выработка УРАИ состоит из двух фаз – выработки реакции избавления (escape), когда животное перебегает на безопасную половину камеры после получения болевого электрического раздражения, и выработки реакции избегания (avoidance), при которой животное во время действия условного раздражителя успевает перебежать на безопасную половину камеры и избежать получение тока. Согласно двухфакторной теории избегания (см. детально в обзоре [Cain, 2019]) фаза избавления сопровождается сильным страхом, который постепенно ослабевает по мере выработки реакции избегания. Трудности с появлением реакций избегания у самцов ЛПС группы могут свидетельствовать о проявлении у них страха в большей степени, чем у контрольных животных. Подтверждают это предположение наши данные о большем проявлении у самцов условнорефлекторного страха на контекст в виде замирания при классическом условном рефлексе после введения ЛПС.
Одним из проявлений действия ЛПС, как показали наши результаты на всех трех моделях оборонительного поведения, является уменьшение у самцов ЛПС группы числа уринаций. У интактных самцов по сравнению с самками наблюдалось больше уринаций при тестировании в “открытом поле”, причем их число увеличивалось в возрасте 3 мес после полового созревания крыс по сравнению с 1 мес [Павлова и соавт., 2020]. Вероятно, повышенное число уринаций отражает не только высокий уровень эмоционального напряжения, но и социальную активность самцов, связанную с мечением территории. Возможно, снижение числа уринаций после введения ЛПС связано с изменениями в социальном поведении самцов, что требует специального исследования. Известно, депрессивноподобное поведение у взрослых животных, возникающее после раннего стресса, сопровождается уменьшением социальных взаимодействий [Fonken et al., 2018].
ВЫВОДЫ
1. Процесс выработки классического оборонительного условного рефлекса у взрослых самцов и самок, получавших на третий и пятый дни жизни подкожное введение ЛПС, не отличался от контрольных животных. У самцов при тестировании через сутки после обучения проявление условнорефлекторного страха на контекст, оцениваемое по реакции замирания, было выше, чем у контрольных животных. У самок, получавших ЛПС, различий с контрольными группами животных не наблюдалось.
2. После угашения классического оборонительного рефлекса у самцов, получавших ЛПС, условнорефлекторный страх на звуковой сигнал оставался более выраженным, чем у контрольных животных. У самок ЛПС группы, наоборот, страх был менее выраженным, чем у контрольных животных, причем, как в условиях контекста, так и при действии сигнального раздражителя.
3. Условная реакция пассивного избегания была более выражена и труднее угашалась у самцов, получавших ЛПС, чем у контрольных животных. У самок после введения ЛПС не было существенных различий в выработке и угашении условной реакции пассивного избегания по сравнению с контрольными животными.
4. При выработке активного избегания у крыс группы ЛПС, как у самцов, так и самок наблюдались некоторые трудности в обучении и увеличение латентностей переходов между отсеками по сравнению с контрольными животными. В пределах ЛПС группы у самцов латентности переходов были больше, чем у самок.
5. Введение ЛПС в раннем возрасте приводило у взрослых самцов, но не у самок, к увеличению уровня IL-1β в крови после повторного стрессового воздействия по сравнению с самцами контрольных групп. У самок, но не у самцов, после неонатального ЛПС увеличивался уровень кортикостерона в крови после повторного стресса.
6. У самцов введение ЛПС в раннем онтогенезе приводит к облегчению выработки пассивно-оборонительных реакций и затруднению их угашения, а также ухудшению выработки активно-оборонительных реакций. По характеристикам оборонительного поведения взрослых животных самки были более устойчивы к раннему провоспалительному стрессу, чем самцы.
Работа частично поддержана грантами РФФИ (проекты № 19-015-00129A и №19-34-90022) и средствами государственного бюджета по госзаданию на 2019–2021 годы (№ г.р. АААА-А17-117092040002-6).
Список литературы
Григорьян Г.А. Половые различия в поведении и биохимических маркерах у животных в ответ на нейровоспалительный стресс. Успехи Физиол. Наук. 2020. 51 (1): 1–15.
Кудряшова И.В., Тишкина А.О., Гуляева Н.В. Неонатальный провоспалительный стресс и дефицит индукции долговременной потенциации в гиппокампе крыс: гендерные различия. Журн. высш. нервн. деят. им. И.П. Павлова. 2018. 68 (4): 524–536.
Павлова И.В., Брошевицкая Н.Д., Онуфриев М.В., Моисеева Ю.В. Половые различия в тревожности и оборонительном поведении крыс Вистар. Журн. высш. нервн. деят. им. И.П. Павлова, 2020. 70 (2): 243–258.
Alexander C., Rietschel E.T. Bacterial lipopolysaccharides and innate immunity. J. Endotoxin. Res. 2001. 7 (3): 167–202.
Andero R., Choi D.C., Ressler K.J. BDNF-TrkB receptor regulation of distributed adult neural plasticity, memory formation, and psychiatric disorders. In: Progress in Molecular Biology and Translational Science. Ed. Shenoy S.K. 2014. 169–192.
Berkiks I., Garcia-Segura L.M., Nassiri A., Mesfioui A., Ouichou A., Boulbaroud S., Bahbiti Y., Lopez-Rodriguez A.B., Hasnaoui E., El Hessni A. The sex differences of the behavior response to early Life immune stimulation: Microglia and astrocytes involvement. Physiol. Behav. 2019. 199: 386–394.
Bilbo S.D., Rudy J.W., Watkins L.R., Maier S.F. A behavioural characterization of neonatal infection-facilitated memory impairment in adult rats. Behav. Brain Res. 2006. 169 (1): 39–47.
Bodhankar S., Lapato A., Chen Y., Vandenbark A.A., Saugstad J.A., Offner H. Role for microglia in sex differences after ischemic stroke: importance of M2. Metab. Brain Dis. 2015 (30): 1515–1529.
Cai K.C., van Mil S., Murray E., Mallet J.F., Matar C., Ismail N. Age and sex differences in immune response following LPS treatment in mice. Brain Behav. Immun. 2016. 58: 327–337.
Cain C.K. Avoidance problems reconsidered. Opin. Behav. Sci. 2019. 26: 9–17.
Claypoole L.D., Zimmerberg B., Williamson L.L. Neonatal lipopolysaccharide treatment alters hippocampal neuroinflammation, microglia morphology and anxiety-like behavior in rats selectively brad for an infantile trait. Brain Behav. Immun. 2017. 59: 135–146.
Colon L., Odynocki N., Santarelli A., Poulos A.M. Sexual differentiation of contextual fear responses. Learn. Mem. 2018. 25 (5): 230–240.
Czerniawski J., Guzowski J.F. Acute neuroinflammation impairs context discrimination memory and disrupts pattern separation processes in hippocampus. J. Neurosci. 2014. 34: 12470–12480.
Cunningham C., Sanderson D.J. Malaise in the water maze: untangling the effects of LPS and IL-1beta on learning and memory. Brain Behav. Immun. 2008. 22: 1117–1127.
Custódio C.S., Mello B.S.F., Filho A.J.M.C., de Carvalho Lima C.N., Cordeiro R.C., Miyajima F., Réus G.Z., Vasconcelos S.M.M., Barichello T., Quevedo J., de Oliveira A.C., de Lucena D.F., MacedoD.S. Neonatal immune challenge with lipopolysaccharide triggers long-lasting sex- and age related behavioral and immune/neurotrophic alterations in mice: relevance to autism spectrum disorders. Mol. Neurobiol. 2018. 55 (5): 3775–3788.
Dalla C., Shors T.J. Sex differences in learning processes of classical and operant conditioning. Physiol. Behav. 2009. 97 (2): 229–238.
Daviu N., Andero R., Armario A., Nadal R. Sex differences in the behavioral and hypothalamic-pituitary-adrenal response to contextual fear conditioning in rats. Horm. Behav. 2014. 66 (5): 713–723.
Doenni V.M., Song C.M., Hill M.N., Pittman Q.J. Early-life inflammation with LPS delays fear extinction in adult rodents. Brain Behav. Immun. 2017. 63: 176–185.
Fonken L.K., Frank M.G., Gaudet A.D., D’Angelo H.M., Daut R.A., Hampson E.C., Ayala M.T., Watkins L.R., Maier S.F. Neuroinflammatory priming to stress is differentially regulated in male and female rats. Brain Behav. Immun. 2018. 70: 257–267.
Hao Y., Jing H., Bi Q., Zhang J., Qin L., Yang P. Intra-amygdala microinfusion of IL-6 impairs the auditory fear conditioning of rats via JAK/STAT activation. Behav. Brain Res. 2014. 275: 88–95.
Harre E.M., Galic M.A., Mouihate A., Noorbakhsh F., Pittman Q.J. Neonatal inflammation produces selective behavioral deficits and alters N-metyl-D-aspartate receptor subunit mRNA in the adult rat brain Eur. J. Neurosci. 2008. 27 (3): 644–653.
Hodgson D.M., Coe C.L. Perinatal Programming: Early Life Determinants of Adult Health and Disease. 2006. Taylor and Francis, UK.
Kessler R.C., Petukhova M., Sampson N.A., Zaslavsky A.M., Wittchen H.U. Twelve-month and lifetime prevalence and lifetime morbid risk of anxiety and mood disorders in the United States. Int. J. Methods Psychiatr. Res. 2012. 21 (3): 169–184.
Klein S.L., Flanagan K.L. Sex differences in immune responses. Nat. Rev. Immunol. 2016. 16 (10): 626–638.
Kohman R.A., Tarr A.J., Sparkman N.L., Bogale T.M., Boehm G.W. Neonatal endotoxin exposure impairs avoidance learning and attenuates endotoxin-induced sickness behavior and central IL-1beta gene transcription in adulthood. Behav. Brain Res. 2008. 194 (1): 25–31.
Lahiri D.K., Maloney B., Zawia N.H. The LEARn model: an epigenetic explanation for idiopathic neurobiological diseases. Mol Psychiatry. 2009. 14 (11): 992–1003.
Laws K.R., Irvine K., Gale T.M. Sex differences in Alzheimer’s disease. Curr. Opin. Psychiatry. 2018. 31(2):133–139.
Lehner M.D., Hartung T. Endotoxin tolerance-mechanisms and beneficial effects in bacterial infection. Rev Physiol. Biochem. Pharmacol. 2002. 144: 95–141.
Maren S., De Oca B., Fanselow M.S. Sex differences in hippocampal long-term potentiation (LTP) and Pavlovian fear conditioning in rats: positive correlation between LTP and contextual learning. Brain Behav. Immun. 2003. 17 (1): 20–27.
Maynard T.M., Sikich L., Lieberman J.A., Lamantia A.S. Neural development, cell—cell signaling, and the ‘‘Two-Hit’’ hypothesis of schizophrenia. 2001. Schizophr. Bull. 27, 457–476.
Najjar F., Ahmad M., Lagace D., Leenen F.H.H. Sex differences in depression-like behavior and neuroinflammation in rats post MI: role of estrogens. Am. J. Physiol. Heart Circ. Physiol. 2018. https://doi.org/10.1152/ajpheart.00615.2017
Onufriev M.V., Freiman S.V., Peregud D.I., Kudryashova I.V., Tishkina A.O., Stepanichev M.Y., Gulyaeva N.V. Neonatal Proinflammatory Stress Induces Accumulation of Corticosterone and Interleukin-6 in the Hippocampus of Juvenile Rats: Potential Mechanism of Synaptic Plasticity Impairments. Biochemistry (Mosc). 2017. 82 (3): 275–281.
Osborne B.F., Caulfield J.I., Solomotis S.A., Schwarz J.M. Neonatal infection produces significant changes in immune function with no associated learning deficits in juvenile rats. Dev. Neurobiol. 2017. 77 (10): 1221–1236.
Parker G1, Brotchie H. Gender differences in depression. Int Rev Psychiatry. 2010; 22 (5): 429–436.
Pettersson R., Hagsater S.M., Eriksson E. Serotonine depletion eliminates sex differences with respect to context-conditioned immobility in rat. Psychopharmacology. 2016. 233 (8): 1513–1521.
Pugh C.R., Kumagawa K., Fleshner M., Watkins L.R., Maier S.F., Rudy J.W. Selective effects of peripheral lipopolysaccharide administration on contextual and auditory-cue fear conditioning. Brain Behav. Immun. 1998. 12: 212–229.
Quinn J.J., Skipper R.A., Claflin D.I. Infant stress exposure produces persistent enhancement of fear learning across development. Dev. Psychobiol. 2014. 56 (5): 1008–1016.
Scharfman H.E., MacLusky N.J. Differential regulation of BDNF, synaptic plasticity and sprouting in the hippocampal mossy fiber pathway of male and female rats. Neuropharmacology. 2014. 76(Pt C): 696–708.
Sparkman N.L., Kohman R.A., Garcia A.K., Boehm G.W. Peripheral lipopolysaccharide administration impairs two-way active avoidance conditioning in C57BL/6J mice. Physiol. Behav. 2005. 85: 278–288.
Tchessalova D., Tronson N.C. Memory deficits in males and females long after subchronic immune challenge. Neurobiol. Learn. Mem. 2019. 158: 60–72.
Tishkina A., Stepanichev M., Kudryashova I., Freiman S., Onufriev M., Lazareva N., Gulyaeva N. Neonatal proinflammatory challenge in male Wistar rats: Effects on behavior, synaptic plasticity, and adrenocortical stress response. Behav. Brain Res. 2016. 304: 1–10.
Toledo-Rodriguez M., Sandi C. Stress before puberty exerts a sex- and age- related impact on auditory and contextual fear conditioning in the rat. Neural. Plast. 2007. 2007:71203.
Tonelli L.H., Holmes A., Postolache T.T. Intranasal immune challenge induces sex-dependent depressive-like behavior and cytokine expression in the brain. Neuropsychopharm. 2008. 33: 1038–1048.
Vallès A., Martí O., Armario A. Mapping the areas sensitive to long-term endotoxin tolerance in the rat brain: a c-fos mRNA study J. Neurochem. 2005. 93 (5): 1177–1188.
Van Haaren F., Hest A., Heinsbroek. R. P. W. Behavioral differences between male and female rats: effects of gonadal hormones on learning and memory. Neurosci. Biobehav. Reviews. 1990. 14: 23–33.
Vegeto E., Bonincontro C., Pollio G., Sala A., Viappiani S., Nardi F., Brusadelli A., Viviani B., Ciana P., Maggi A. Estrogen prevents the lipopolysaccharide-induced inflammatory response in microglia. J. Neurosci. 2001. 21 (6): 1809–1818.
Vergadi E., Vaporidi K., Tsatsanis C. Regulation of endotoxin tolerance and compensatory anti-inflammatory response syndrome by non-coding RNAs. Front. Immunol. 2018. 9: 2705.
Villa A., Rizzi N., Vegeto E., Ciana P., Maggi A. Estrogen accelerates the resolution of inflammation in macrophagic cells. Sci. Rep. 2015. 5: 15224.
Walker A.K., Nakamura T., Byrne R.J., Naicker S., Tynan R.J., Hunter M., Hodgson D.M. Neonatal lipopolysaccharide and adult stress exposure predisposes rats to anxiety-like behaviour and blunted corticosterone responses: Implications for the double-hit hypothesis. Psychoneuroendocrinology, 34 (10), 1515–1525.
Williamson L.L., Sholar P.W., Mistry R.S., Smith S.H., Bilbo S.D. Microglia and memory: modulation by early-life infection. J. Neurosci. 2011. 31 (43): 15511–15521.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


