Журнал высшей нервной деятельности им. И.П. Павлова, 2020, T. 70, № 3, стр. 326-340
ФОРМИРОВАНИЕ И ИЗВЛЕЧЕНИЕ АССОЦИАТИВНОЙ ПАМЯТИ НА КОМПЛЕКСНЫЙ СИГНАЛ У МЫШЕЙ: СПЕЦИФИЧЕСКОЕ УЧАСТИЕ НЕЙРОНОВ ОБЛАСТИ СА1 ГИППОКАМПА
О. И. Ивашкина 1, 2, 3, *, К. А. Торопова 1, 2, 3, 4, М. А. Рощина 4, К. В. Анохин 2, 3, 4
1 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
2 Институт перспективных исследований мозга, Московский государственный университет им. М.В. Ломоносова
Москва, Россия
3 Научно-исследовательский институт нормальной физиологии им. П.К. Анохина
Москва, Россия
4 Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
* E-mail: oivashkina@gmail.com
Поступила в редакцию 02.12.2019
После доработки 14.12.2019
Принята к публикации 16.12.2019
Аннотация
Большинство значимых событий окружающей среды имеет сложную сенсорную природу. Интеграция мозгом мультимодальной информации о таких комплексных сигналах рассматривается рядом авторов как биологическая функция самых ранних форм сознания. В настоящей работе мы использовали модель ассоциативного обучения у мышей, в которой электрокожное раздражение сочетали с комплексным условным сигналом, состоящим из одновременно предъявляемых светового и звукового стимулов. Нами было показано, что мыши успешно обучаются и формируют долговременную память в задаче условно-рефлекторного замирания на такой комплексный условный сигнал. Для исследования вопроса о нейронных субстратах этой памяти мы провели иммуногистохимическое картирование нейронной экспрессии гена c-fos в гиппокампе и ассоциативной ретросплениальной коре. Мы обнаружили, что только область СА1 гиппокампа, но не другие его области и ретросплениальная кора, активируется при извлечении ассоциативной памяти о комплексном условном сигнале, но не его компонентах. Кроме того, для области СА1 нами была обнаружена сильная положительная корреляция между уровнем замирания при извлечении памяти и количеством нейронов, активированных извлечением памяти. Таким образом, можно предположить, что область СА1 гиппокампа специфически вовлечена в формирование и извлечение ассоциативной памяти о комплексных сигналах естественной среды.
ВВЕДЕНИЕ
Обучение на комплексные условные сигналы (КУС) занимает особое место в исследованиях ассоциативной памяти. Будучи описанным на заре изучения условных рефлексов [Палладин, 1906; Перельцвейг, 1907; Zeliony, 2010], оно являлось объектом непрерывного внимания И.П. Павлова в качестве проявления “синтетической деятельности мозга” [Павлов, 1949]. Г. Разран, первым из американских исследователей приступивший в конце 1930-х годов к систематическому анализу этого феномена, обозначенного им как конфигурационное обусловливание (configural conditioning), провел обзор более 750 экспериментов, выполненных до этого в лабораториях И.П. Павлова, Н.И. Красногорского, А.Г. Иванова-Смоленского, И.С. Берита-швили, В.М. Бехтерева и других российских авторов [Razran, 1939a]. Следуя логике И.П. Павлова об обучении на КУС как синтетической деятельности мозга, Разран интерпретировал его в качестве гештальтного процесса [Razran, 1939b] и признака наличия порогового сознания (liminal consciousness) [Razran, 1971]. Несколько лет назад эта линия аргументации оформилась в гипотезу об обучении на КУС как филогенетически самом раннем проявлении сознания, а также факторе его дальнейшей эволюции [Bronfman et al., 2016; Feinberg, Mallatt, 2016; Ginsburg, Jablonka, 2019]. Данная гипотеза “неограниченного ассоциативного обучения” (Unlimited Associative Learning – UAL) выдвигает обучение на КУС на роль маркера минимального сознания у различных видов животных [Bronfman et al., 2016]. В связи с этим особое значение начинает играть понимание нервных субстратов и нейробиологических механизмов данного вида обучения.
Сам И.П. Павлов полагал, что синтез сложных раздражений происходит в особых “комбинационных центрах” коры больших полушарий головного мозга [И.П. Павлов, 1949, т. 3, с. 288], и последующие эксперименты с экстирпацией различных отделов коры на кошках, собаках и обезьянах были направлены на поиски локализации этих ключевых центров [Воронин, 1948; Адрианов, 1961; Батуев, 1964]. Однако методы удаления обширных зон неокортекса не позволяют с достаточной точностью исследовать системные и клеточные механизмы интегративной деятельности мозга при формировании и извлечении памяти на КУС. Гораздо более высоким разрешением обладают современные подходы в нейробиологии, основанные на молекулярном маркировании и ex vivo или in vivo визуализации активности нейронов мозга в когнитивных задачах [Саидов, Анохин, 2017; Рощина и др. 2017; Ивашкина и др., 2018]. Многие из них, однако, осуществимы лишь на генетически модифицированных трансгенных животных, как правило, мышах, что ведет к необходимости переноса на этих животных моделей обучения с использованием КУС.
Подобные исследования ассоциативного обучения на мышах и крысах в последние десятилетия чаще всего проводят с использованием модели выработки условно-рефлекторного замирания (УРЗ), в которой отдельный сенсорный стимул или обстановка обучения, выступающие как условный сигнал, сочетаются и ассоциируются с неприятным воздействием – нанесением электрокожного раздражения (ЭКР) на лапы, являющимся безусловным стимулом [Bourtchouladze et al., 1998; Зворыкина, Анохин, 2003; Муравьева, Анохин, 2006; Ивашкина и др., 2015; Ивашкина и др., 2016; Торопова и др., 2018; Торопова, Анохин, 2018].
Ранее на крысах была показана возможность выработки УРЗ на КУС, состоящий из нескольких одновременно предъявляемых стимулов разной сенсорной модальности [Debiec et al., 2013; Jones et al., 2013; Yadav et al., 2013], в частности светового и звукового стимулов [Jones et al., 2013]. В настоящей работе мы использовали аналогичную модель обучения УРЗ на одновременный комплекс светового и звукового стимулов на мышах для проверки вопроса о возможности формирования у них долговременной ассоциативной памяти о КУС, а также начала исследования системных и клеточных основ этой памяти, в частности вовлечения в нее нейронов ретросплениальной области неокортекса и гиппокампа.
Ретросплениальная кора была выбрана нами в связи тем, что у крыс и мышей она является одной из крупнейших корковых ассоциативных областей и по накапливающимся в последние годы данным играет критическую роль в интеграции мультисенсорных и пространственных сигналов [Минеева и др., 2019; Todd et al., 2019], вовлекаясь, в частности, в формирование ассоциативной памяти на обстановку и условные сигналы [Keene, Bucci, 2008; Corcoran et al., 2016; Todd et al., 2016, 2017, 2019; Sigwald et al., 2019]. Активность гиппокампа мы исследовали потому, что в экспериментах на крысах извлечение памяти на КУС сопровождалось специфической активацией области СА1 гиппокампа [Jones et al., 2013], а также в связи с тем, что гиппокамп необходим для формирования памяти о комплексной обстановке, при этом память об одиночном условном звуковом сигнале формируется без участия гиппокампа [Selden et al., 1991; Kim, Fanselow, 1992; Phillips, LeDoux, 1992], что позволяет предполагать его важную роль в кодировании именно комплексных воспоминаний. Эти две области мозга реципрокно связаны: ретросплениальная кора посылает информацию в гиппокамп через проекции в энторинальную кору и непосредственно в субикулум и получает входы от нейронов СА1 гиппокампа как напрямую, так и через энторинальную кору [Sugar et al., 2011].
МЕТОДИКА
Животные
В экспериментах использовали самцов мышей линии С57Bl/6 в возрасте 8–10 нед (питомник “Столбовая”). Животных содержали по 5 особей в индивидуально-вентилируемых клетках с постоянным доступом к воде и корму при световом цикле 12:12 ч. Эксперименты проводили в светлое время цикла. Исследования проводили в соответствии с требованиями приказа № 267 МЗ РФ (19.06.2003 г.), а также с постановлением локального этического комитета по вопросам биомедицинских исследований НИЦ “Курчатовский институт” (Протокол № 1 от 09.07.2015).
Процедура обучения УРЗ на КУС и тестирования памяти
Обучение УРЗ на КУС и тестирование этой ассоциативной памяти проводили при помощи установки Video Fear Conditioning System (MED Associates Inc.) и компьютерной программы Video Freeze v 2.5.5.0 (MED Associates Inc.). При обучении и в ходе тестов проводили видеорегистрацию поведения мышей и автоматически определяли число и продолжительность актов замирания. Замиранием считали полное отсутствие любых движений мыши, кроме дыхательных. Подачу звуковых стимулов и ЭКР осуществляли автоматически при помощи встроенного в установку динамика и стимулятора под управлением программы Video Freeze. Световые стимулы подавали при помощи системы, состоящей из светового стимулятора (светодиодного фонаря) и аудиоплеера. Управляющая программа, записанная в формате mp3, подавалась через аудиоплеер на фонарь, позволяя предъявлять мышам световые стимулы различной длительности, частоты и мощности. Фонарь был установлен на одну из стен экспериментальной камеры в установке. Диаметр излучателя фонаря составлял 1.8 см. Освещенность в камере при включении фонаря составляла 27 Люкс. Синхронизацию программы светового стимулятора с программой Video Freeze осуществляли вручную.
Процедура обучения УРЗ на КУС заключалась в следующем: мышей помещали в новую обстановку (А), которую они могли свободно обследовать в течение 3 мин. Обстановка А представляла собой в камеру 30 × 23 × × 21 см с тремя непрозрачными (металлическими) и одной прозрачной (плексигласовой) стенками и электродным полом. Камера освещалась только источником ближнего инфракрасного света, необходимого для видеорегистрации поведения. Перед помещением в установку каждого следующего животного камеру протирали 55% раствором этилового спирта. Через 3 мин после начала экспериментальной сессии синхронно подавали пять двухсекундных повторов чистого звукового тона (громкость 80 дБ, частота 9 кГц, время нарастания/спада 30 мс) и голубого мигающего света (частота 5 Гц) с промежутками между включениями 2 с – именно этот сигнал считался КУС. На последнем двухсекундном включении тона и света подавали ЭКР силой 0.75 мА и длительностью 2 с. Такое сочетание КУС и ЭКР повторяли семь раз с промежутками 40–60 с. После последнего сочетания животных оставляли в экспериментальной камере еще на 60 с, а затем возвращали в домашнюю клетку. С контрольными животными (группа “КУС без ЭКР”) проводили аналогичные процедуры, но не наносили ЭКР.
Тестирование памяти о КУС проводили через 7 дней после обучения. При этом животных помещали в обстановку Б, значительно отличающуюся от обстановки обучения А. Обстановка Б представляла собой камеру, разделенную по диагонали синей пластиковой вставкой от пола до потолка таким образом, чтобы пространство представляло собой прямоугольный треугольник со сторонами 30 × 23 см, высота камеры была равна 21 см. Электродный пол был закрыт гладкой пластиковой вставкой, поверх которой был насыпан чистый гранулированный кукурузный наполнитель (Rehofix, J. Rettenmaier & Söhne GmbH + Co KG), аналогичный наполнителю в домашних клетках у мышей. Камера освещалась только источником ближнего инфракрасного света, необходимого для видеорегистрации поведения. Перед помещением в установку каждого следующего животного камеру протирали 2.5% раствором уксусной кислоты. Тестирование состояло из 3 мин обследования обстановки Б и 3 мин предъявления КУС.
Оценка нейрональной экспрессии c-fos в структурах мозга
Оценку активности структур мозга мышей проводили путем анализа экспрессии немедленного раннего гена с-fos, который, кодируя транскрипционный фактор с-Fos, является маркером геномной активности нейронов [Guzowski et al., 2005].
Животных умерщвляли путем транспозиции шейных позвонков через 90 мин после окончания обучения или тестирования; мышей группы “ДК” (домашняя клетка) забирали непосредственно из домашних клеток и умерщвляли без дополнительных воздействий. Мозг мышей извлекали из черепа и замораживали в парах жидкого азота. Полученные на криостате срезы толщиной 20 мкм фиксировали в 4% параформальдегиде, а затем проводили иммуногистохимическое выявление белка с-Fos. Для этого использовали первичные поликлональные антитела кролика против белка c-Fos (sc-52, Santa Cruz Biotechnology, разведение 1:500) и вторичные антитела лошади против белков кролика, конъюгированные с авидин-биотиновым комплексом (ImPRESS reagent kit anti-rabbit, Vector Laboratories). Окрашивание срезов проводили 0.06% раствором диаминобензидина (Sigma Aldrich).
Срезы оцифровывали под микроскопом Olympus VS110 (камера Olympus XC10) при увеличении 10× с помощью программы VS-ASW FL 2.4 (Olympus Soft Imaging Solutions GmbH). Обработку полученных изображений проводили в программе Photoshop CS2 v.9.0.2 (Adobe Systems Inc.). Подсчет с-Fos-положительных клеток осуществляли в программе Image-Pro Plus 3.0 (Media Cybernetics). Положительные клетки определяли автоматически с использованием двух параметров: размера частиц и порогового уровня интенсивности окраски частиц по черно-белой шкале, выше которого все клетки считали с-Fos-положительными (Fos+). Подсчитывали количество положительных клеток в структуре на каждом срезе, а также площадь структуры на каждом срезе. Для каждой из выбранных структур в анализ брали по три среза с одного уровня. Координаты структур определяли с помощью стереотаксического атласа мозга мыши [Franklin, Paxinos, 2007]. Анализировали следующие структуры мозга: области СА1, СА3 и зубчатую фасцию (ЗФ) дорсального гиппокампа, а также гранулярную и дисгранулярную области ретросплениальной коры (гРСК и дгРСК соответственно) на уровне – 1.46 мм от брегмы.
Исследование экспрессии с-fos в мозге мышей при формировании ассоциативной памяти о КУС
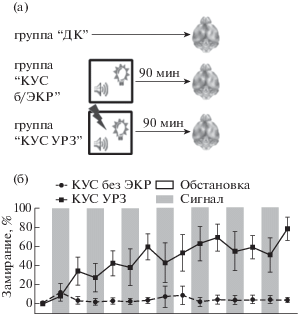
В данном эксперименте были использованы следующие группы животных: “ДК” (n = 10), “КУС без ЭКР” (n = 10), которым проводили все экспериментальные процедуры, кроме нанесения ЭКР и “КУС УРЗ” (n = 12), которых обучали УРЗ на КУС. Для животных групп “КУС без ЭКР” и “КУС УРЗ” проводили оценку показателей замирания при обучении, а также последующую оценку экспрессии с-fos в гиппокампе и ретросплениальной коре (рис. 1(а)).
Рис. 1.
Мыши успешно обучаются УРЗ на КУС. (a) – общая схема эксперимента; (б) – динамика замирания животных при обучении в задаче УРЗ на КУС, а также у животных контрольной группы, не получавшей ЭКР.
Fig. 1. Successful fear conditioning for CCS in mice. (a) – scheme of experiment; (б) – dynamics of freezing during CCS fear conditioning and in control mice that did not receive footshock. ДК – home cage control (HC), КУС без ЭКР – CCS no footshock group, КУС УРЗ – CCS fear conditioning (CCS FC), Обстановка – context, Сигнал – signal.
Исследование экспрессии с-fos в мозге мышей при извлечении ассоциативной памяти о КУС
В данном эксперименте были использованы следующие группы животных: “ДК” (n = 13); “КУС без ЭКР” (n = 11), которым проводили все экспериментальные процедуры, кроме нанесения ЭКР; “КУС УРЗ” (n = 11), которых обучали УРЗ на КУС. Для животных групп “КУС без ЭКР” и “КУС УРЗ” проводили оценку показателей замирания при обучении и тестировании, а также оценку экспрессии с-fos в гиппокампе и ретросплениальной коре. Кроме того, при оценке специфичности экспрессии немедленного раннего гена с-fos при извлечении памяти о КУС также проводили сопоставление с дополнительными группами животных: “Звук без ЭКР” (n = 11) – мыши, которым при обучении и тестировании предъявляли только звуковой сигнал и не наносили ЭКР; “Свет без ЭКР” (n = 12) – животные, которым при обучении и тестировании предъявляли только световой сигнал и не наносили ЭКР; “Звук УРЗ” (n = 11) – мыши, которых обучали и тестировали на звуковой условный сигнал; “Свет УРЗ” (n = 12) – мыши, которых обучали и тестировали на световой условный сигнал; “КУС УРЗ: звук” (n = 12) – животные, которых обучали на КУС, а тестировали только на звуковой компонент условного сигнала и “КУС УРЗ: свет” (n = 11) – животные, которых обучали на КУС, а тестировали только на световой компонент условного сигнала. Сигналы и протоколы обучения и тестирования памяти при этом были аналогичными описанным выше.
Для анализа специфичности экспрессии при извлечении памяти о КУС проводили расчет индекса ассоциативности: для этого из индивидуальных значений плотности Fos+ клеток у животных групп “КУС УРЗ”, “КУС УРЗ: звук” и “КУС УРЗ: свет” вычитали среднегрупповое значение плотности Fos+ клеток животных группы “КУС без ЭКР”; из индивидуальных значений плотности Fos+ клеток у животных группы “Звук УРЗ” вычитали среднегрупповое значение плотности Fos+ клеток животных группы “Звук без ЭКР”; из индивидуальных значений плотности Fos+ клеток у животных группы “Свет УРЗ” вычитали среднегрупповое значение плотности с-Fos-положительных клеток животных группы “Свет без ЭКР”.
Статистическая обработка данных
Статистическую обработку данных проводили с помощью статистического пакета GraphPad Prism 8.0. (GraphPad Software). Использовали однофакторный или двухфакторный дисперсный анализ ANOVA и апостериорные критерии Тьюки и Сидака, а также одновыборочный t-критерий и корреляционный анализ по Пирсону. Для анализа вариабельности использовали критерии однородности дисперсий Брауна-Форсайта и Фишера. Значимыми считали различия при p < 0.05. Данные на графиках представлены как среднее ±95% доверительный интервал.
В работе было использовано оборудование ресурсного центра нейрокогнитивных исследований (РЦ НКИ) Курчатовского комплекса НБИКС-технологий.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Экспрессия c-fos при формировании ассоциативной памяти о КУС
Мыши успешно обучались в задаче УРЗ на КУС: на рис. 1 (б) представлена кривая обучения у животных группы “КУС УРЗ” и контрольной группы “КУС без ЭКР”. Животные контрольной группы практически не демонстрировали замирания при обследовании новой обстановки и предъявлении КУС во время обучения. При этом животные группы “КУС УРЗ” не отличались от контрольных до первого сочетания КУС и ЭКР включительно, а затем демонстрировали значимо более высокий уровень замирания при предъявлении КУС, чем контрольные мыши (фактор “группа”: F (1, 20) = 126.1, p < 0.0001; фактор “время”: F (6.142, 122.8) = 10.74, p < 0.0001; взаимодействие факторов: F (14, 280) = 11.27, p < 0.0001; сравнение групп “КУС без ЭКР” и “КУС УРЗ” до подачи первого КУС и при первом предъявлении КУС: p = 0.9995, в остальные интервалы предъявления КУС: p < 0.05).
Нами была проанализирована плотность Fos+ клеток в ретросплениальной коре (рис. 2 (а)) и гиппокампе (рис. 2 (б)) мышей групп “КУС без ЭКР” и “КУС УРЗ”, а также группы “ДК”, выступавшей в качестве контрольной для оценки базового уровня экспрессии с-fos в мозге, при формировании памяти о КУС. Во всех исследованных структурах, кроме зубчатой фасции гиппокампа, было обнаружено значимое повышение плотности Fos+ клеток как у группы “КУС без ЭКР”, так и у группы “КУС УРЗ” по сравнению с базовым уровнем в группе “ДК” (гРСК: F (2, 30) = 8.728, p = 0.0010, попарные сравнения с “ДК”: p < 0.01; дгРСК: F (2, 30) = = 10.22, p = 0.0004, попарные сравнения с “ДК”: p < 0.01; СА1: F (2, 29) = 4.738, p = = 0.0166, попарные сравнения с “ДК”: p < 0.05; СА3: F (2, 28) = 8.458, p = 0.0013, попарные сравнения с “ДК”: p < 0.01; ЗФ: F (2, 27) = = 0.9472, p = 0.4003). При этом группы “КУС без ЭКР” и “КУС УРЗ” ни в одной из исследованных областей не различались между собой (для сравнений “КУС без ЭКР” и “КУС УРЗ” во всех областях: p > 0.5).
Рис. 2.
c-fos активность различных областей мозга мышей при формировании ассоциативной памяти о КУС. (а) – плотность Fos+ клеток в ретросплениальной коре; (б) – плотность Fos+ клеток в дорсальном гиппокампе. гРСК – гранулярная область ретросплениальной коры; дгРСК – дисгранулярная область ретросплениальной коры; СА1 – область СА1 гиппокампа; СА3 – область СА3 гиппокампа; ЗФ – зубчатая фасция гиппокампа. * – p < 0.05, ** – p < 0.01, *** – p < 0.005 по сравнению с группой “ДК”, апостериорный критерий Тьюки.
Fig. 2. c-fos activity patterns of various brain areas during the CCS associative memory formation. (a) – density of Fos+ cells in the retrosplenial cortex; (б) – density of Fos+ cells in the dorsal hippocampus. Group abbreviations as in fig. 1. гРСК – retrosplenial granular cortex (RSG); дгРСК – retrosplenial disgranular cortex (RSD); СА1 – field CA1 of the hippocampus; СА3 – field CA3 of the hippocampus; ЗФ – dentate gyrus (DG). * – p < 0.05, ** – p < 0.01, *** – p < 0.005 compared to the “ДК” (homecage) group, Tukey’s multiple comparisons test.

Таким образом, нами было показано, что мыши успешно обучаются на КУС, однако нейронная активность гиппокампа и ретросплениальной коры по экспрессии с-fos при формировании ассоциативной памяти не отличается от таковой при знакомстве животных с КУС без последующего подкрепления. Из этого можно заключить, что гиппокамп и ретросплениальная кора не вовлекаются специфическим образом в формирование ассоциации КУС с ЭКР.
Экспрессия c-fos при извлечении ассоциативной памяти о КУС
Тестирование памяти через 7 дней после обучения показало, что животные группы “КУС УРЗ” сформировали устойчивую долговременную память о КУС, которая выражалась в значимом повышении уровня замирания обученных животных при предъявлении КУС как по сравнению с замиранием при обследовании обстановки Б, так и по сравнению с группой “КУС без ЭКР” (фактор “группа”: F (1, 20) = 60.07, p < 0.0001, фактор “эпизод тестирования”: F (1, 20) = 186.9, p < 0.0001, взаимодействие факторов: F (1, 20) = = 163.8, p < 0.0001; сравнение групп “КУС УРЗ” и “КУС без ЭКР” до предъявления КУС: p = 0.1239, сравнение групп “КУС УРЗ” и “КУС без ЭКР” при предъявлении КУС: p < < 0.0001, сравнение уровня замирания у группы “КУС УРЗ” при предъявлении КУС с уровнем до этого: p < 0.0001) – рис. 3 (а).
Рис. 3.
Поведение мышей и c-fos активность различных областей мозга при формировании ассоциативной памяти о КУС. (а) – результаты тестирования памяти о КУС; (б) – плотность Fos+ клеток в ретросплениальной коре; (в) – плотность Fos+ клеток в гиппокампе. Обозначения областей мозга как на рис. 2. ++++ – p < 0.0001 по сравнению с замиранием группы “КУС УРЗ” до КУС, #### – p < 0.0001 по сравнению с замиранием группы “КУС без ЭКР” при предъявлении КУС, апостериорный критерий Сидака; * – p < 0.05, *** – p < 0.005, **** – p < 0.0001 по сравнению с группой “ДК”, # – p = 0.0306 по сравнению с группой “КУС без ЭКР”, апостериорный критерий Тьюки.
Fig. 3. Mice behavior and c-fos activity patterns of various brain areas during the CCS associative memory retrieval. (a) – CCS memory test results; (б) – density of Fos+ cells in the retrosplenial cortex; (в) – density of Fos+ cells in the hippocampus. Group abbreviations as in fig. 1. До КУС – before CCS. Brain areas abbreviations as in fig. 2. ++++ – p < 0.0001 compared to “CCS FC” freezing before CCS, #### – p < 0.0001 compared to “CCS no footshock” freezing during CCS, Sidak’s multiple comparisons test; * – p < 0.05, *** – p < 0.005, **** – p < 0.0001 compared to the “HC” group, # – p = 0.0306 compared to “CCS no footshock”, Tukey’s multiple comparisons test.

При анализе количества Fos+ клеток при извлечении памяти о КУС во всех исследованных структурах, кроме зубчатой фасции гиппокампа, было обнаружено значимое повышение плотности положительных клеток как у группы “КУС без ЭКР”, так и у группы “КУС УРЗ” по сравнению с группой “ДК” (F (2, 30) = 18.47, p < 0.0001, попарные сравнения с “ДК”: p = 0.0001; дгРСК: F (2, 30) = 20.69, p < 0.0001, попарные сравнения с “ДК”: p < < 0.0001; СА1: F (2, 32) = 17.47, p < 0.0001, попарные сравнения с “ДК”: p < 0.05; СА3: F (2, 32) = 25.61, p < 0.0001, попарные сравнения с “ДК”: < 0.0001; ЗФ: F (2, 32) = 2.123, p = = 0.1363). При этом в области СА1 гиппокампа также наблюдалось значимое повышение плотности Fos+ клеток у группы “КУС УРЗ” по сравнению с группой “КУС без ЭКР” (p = = 0.0306). У других проанализированных областей различий между группами “КУС УРЗ” и “КУС без ЭКР” обнаружено не было (в гРСК, дгРСК и СА3: p > 0.15).
Таким образом, нами было показано, что в результате обучения УРЗ на КУС у мышей формируется устойчивая долговременная ассоциативная память, которая сохраняется в течение по крайней мере 7 дней. При этом извлечение этой ассоциативной памяти сопровождается специфической активацией нейронов области СА1 гиппокампа, но не других зон гиппокампа или ретросплениальной коры.
Активация области СА1 гиппокампа сопровождает извлечение ассоциативной памяти только о полном КУС
На основании данных о функциях гиппокампа как области мозга, осуществляющей интеграцию мультимодальной информации о различных стимулах внешней среды и формирующей единую репрезентацию этой среды [Rudy, O’Reilly, 2001; Matus-Amat et al., 2004], а также необходимой для формирования и извлечения ассоциативной памяти [Strekalova et al., 2003; Pevzner, Guzowski, 2014; Eichenbaum, 2017], мы предположили, что обнаруженная нами активация области СА1 гиппокампа в группе “КУС УРЗ” при извлечении памяти связана со свойствами КУС как мультимодального условного сигнала и его способностью предсказывать ЭКР для животного.
Чтобы проверить это предположение, мы использовали дополнительные группы мышей, которых обучали на отдельные звуковые и световые условные сигналы и через 7 дней извлекали память о них (группы “Звук УРЗ” и “Свет УРЗ” соответственно), а также животных, которых обучали на КУС, но при тестировании предъявляли только один из его компонентов – звуковой или световой (группы “КУС УРЗ: звук” и “КУС УРЗ: свет” соответственно). Данные дополнительные группы мышей позволили нам проконтролировать предположение о важности мультимодальности условного сигнала для активации области СА1.
На рис. 4 (а) представлены данные сравнения индекса ассоциативности (то есть вычитания из индивидуальных значений плотности Fos+ клеток у животных групп “УРЗ” среднегруппового значения плотности Fos+ клеток групп “без ЭКР”) у перечисленных выше пяти групп мышей. Было показано, индекс ассоциативности различался между исследованными группами и был значимо повышен у группы “КУС УРЗ” по сравнению с группой “Звук УРЗ” (F (4, 52) = 3.086, p = = 0.0236, сравнение “КУС УРЗ” и “Звук УРЗ”: p = 0.0153). При этом у группы “КУС УРЗ”, но не у других исследованных групп, индекс ассоциативности также был значимо выше нулевого значения, соответствующего плотности Fos+ клеток у необученных животных, которым предъявляли КУС (“КУС УРЗ”: p = 0.0420; “Звук УРЗ”: p = 0.0638; “Свет УРЗ”: p = 0.9943; “КУС УРЗ: звук”: p = = 0.3769; “КУС УРЗ: свет”: p = 0.7693). Таким образом, специфическая активация области СА1 происходила только у животных, обученных на КУС, при извлечении памяти полным КУС, но не его компонентами и не дискретными световым и звуковым условными сигналами.
Рис. 4.
Область СА1 гиппокампа специфически вовлекается в извлечение ассоциативной памяти о КУС. (а) – индекс ассоциативности для пяти групп мышей, обученных на КУС и отдельные световой и звуковой условные сигналы; (б) – плотность Fos+ клеток в области СА1 гиппокампа у мышей, которым КУС предъявляли без подкрепления; (в) – корреляция плотности Fos+ клеток в области СА1 гиппокампа и уровня замирания при извлечении ассоциативной памяти о КУС у группы “КУС УРЗ”. СА1 – область СА1 гиппокампа; r – коэффициент корреляции по Пирсону; p – уровень значимости корреляции. + – p = 0.0153 при сравнении групп “КУС УРЗ” и “Звук УРЗ”, * – p < 0.05, ** – p < 0.01 по сравнению с группой “ДК”, апостериорный критерий Тьюки; # – p = 0.0420 при сравнении индекса ассоциативности с нулевым уровнем у группы “КУС УРЗ”, одновыборочный t-критерий.
Fig. 4. CA1 region of the hippocampus is specifically involved in the retrieval of CCS associative memory. (a) – the associativity index for five groups of mice trained to CCS and discrete light and sound condition signals; (б) – density of Fos+ cells in the hippocampal CA1 of mice received CCS without reinforcement; (в) – correlation of Fos+ cells density in the hippocampal CA1 and the level of freezing during CCS associative memory retrieval in “CCS FC” mice. CA1 – field CA1 of the hippocampus. Звук УРЗ – sound fear conditioning (Sound FC), Свет УРЗ – light fear conditioning (Light FC), КУС УРЗ: звук – sound retrieval after CCS fear conditioning (CCS FC: sound), КУС УРЗ: свет – light retrieval after CCS fear conditioning (CCS FC: light), КУС УРЗ: КУС – CCS retrieval after CCS fear conditioning (CCS FC: CCS), ДК – home cage control (HC), Свет б/ЭКР – light no footshock group, Звук б/ЭКР – sound no footshock group, КУС б/ЭКР – CCS no footshock group, КУС без ЭКР – CCS no footshock group, КУС УРЗ – CCS fear conditioning (CCS FC). r – Pearson’s correlation coefficient; p is the significance level for correlation. + – p = 0.0153 comparing “CCS FC” and “Sound FC”, * – p < 0.05, ** – p < 0.01 compared to the “HC” group, Tukey’s multiple comparisons test; # – p = 0.0420 comparing the associativity index with zero level in “CCS FC” mice, one sample t test.
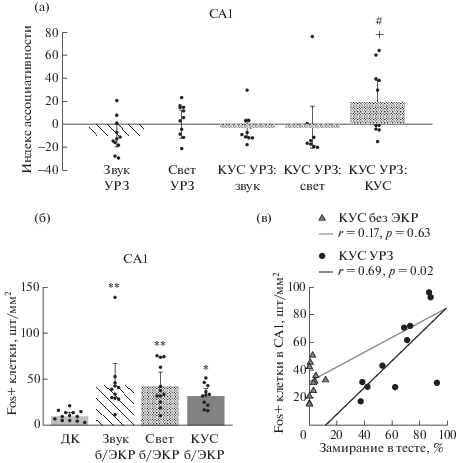
Далее нами было проверено, наблюдается ли такая же специфическая активация области СА1 при извлечении памяти у животных, которым КУС предъявляли без подкрепления. Для этого также были использованы дополнительные группы животных, которым предъявляли дискретные световой или звуковой сигналы и не сочетали их с ЭКР (рис. 4 (б)). При этом анализ экспрессии с-fos в области СА1 показал, что в группах “Звук без ЭКР”, “Свет без ЭКР” и “КУС без ЭКР” плотность Fos+ клеток была значимо повышена по сравнению с группой “ДК” и не различалась между собой (F (3, 43) = 7.359, p = 0.0004; попарные сравнения с “ДК”: p < 0.05, попарные сравнения “Звук без ЭКР”, “Свет без ЭКР” и “КУС без ЭКР” между собой: p > 0.4). То есть для специфической активации области СА1 было необходимо наличие ассоциативной памяти о связи КУС и ЭКР, а знакомства с КУС без подкрепления было недостаточно.
Таким образом, мы показали, что специфическая активация области СА1 наблюдается только при извлечении ассоциативной памяти о полном КУС, но не отдельных его компонентах.
Количество с-Fos-положительных клеток в области СА1 гиппокампа коррелирует с поведением животных при извлечении памяти о КУС
Выше нами было показано, что из всех исследованных структур мозга только область СА1 активируется специфически в связи с извлечением памяти о КУС. Поэтому нами был поставлен вопрос о том, отражает ли уровень активности области СА1 поведение мышей при извлечении памяти о КУС. Для этого был проведен корреляционный анализ данных по поведению мышей групп “КУС УРЗ” и “КУС без ЭКР” при тестировании памяти о КУС и активности области СА1 гиппокампа (рис. 4 (в)). В результате анализа была показана значимая корреляция между уровнем замирания и количеством Fos+ клеток в СА1 только для группы “КУС УРЗ” (r = = 0.6866, p = 0.0196), но не у группы “КУС без ЭКР” (r = 0.1652, p = 0.6275). Таким образом, мы показали, что корреляция активности нейронов области СА1 и поведения животных при извлечении памяти характерна только для животных, сформировавших ассоциативную память о КУС.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В настоящей работе мы исследовали измеряемую по экспрессии немедленного раннего гена с-fos активацию нейронов гиппокампа и ретросплениальной коры при формировании ассоциативной памяти на КУС, а также при извлечении такой памяти. При этом нами была использована методика обучения мышей УРЗ на КУС, состоявший из предъявляемых одновременно светового и звукового стимулов. Ранее подобную методику обучения на грызунах использовали только в нескольких работах.
В работе Jones и соавт. [Jones еt al., 2013] были исследованы свойства памяти о КУС на крысах. Комплексный сигнал состоял из светового компонента (включение белого светодиода на 20 с) и звукового компонента (чистый тон 80 дБ, 5 кГц, 20 с). Данный комплексный сигнал предъявляли крысам три раза, каждый раз подкрепляя его нанесением ЭКР (0.7 мА, 0.5 с). Таким образом, в работе применяли протокол обучения, сопоставимый с использованным нами. Было показано, что крысы успешно формируют долговременную память о КУС при тестировании через сутки после обучения [Jones еt al., 2013]. Тестирование памяти на более поздних сроках при этом не проводили. Была также исследована возможность формирования памяти о КУС на мышах [Yadav et al., 2013]. Авторами было показано, что при обучении УРЗ на звуковой стимул (85 дБ, 3 кГц, 30 с), либо на световой стимул (немигающий белый свет, 30 с), либо на КУС, состоявший из светового и звукового стимулов, у мышей формируется реакция замирания на комплексный сигнал, выявляемая в тесте через 24 ч [Yadav et al., 2013]. Таким образом, наши результаты согласуются с данными литературы и подтверждают возможность успешного формирования ассоциативной памяти о КУС в задаче УРЗ у мышей. Кроме того, мы показали, что ассоциативная память на КУС сохраняется у животных достаточно долго, так как она может быть извлечена и через 7 дней. Значимость этого факта заключается в том, что от “возраста” памяти зависят как ее поведенческие проявления, так и нейрональные субстраты, поддерживающие данную память [Todd et al., 2016; Doron, Goshen, 2018].
Известно, что гиппокамп и ретросплениальная кора вовлечены в формирование и извлечение ассоциативной памяти в задаче выработки УРЗ [Keene, Bucci, 2008; Robinson et al., 2012; Bergstrom, 2016; Corcoran et al., 2016; Eichenbaum, 2017]. Однако большинство работ по изучению этих структур мозга в модели УРЗ касаются сигнальной памяти на обстановку, тогда как исследований, посвященных вовлечению этих областей в память на дискретные условные сигналы, крайне мало. В одной из них [Todd et al., 2016] было показано, что инактивация или разрушение ретросплениальной коры перед тестированием “старой” памяти на условный звуковой сигнал нарушает ассоциативное замирание в задаче УРЗ. Интересно, однако, что при формировании или извлечении ассоциативной памяти об одиночном условном звуковом сигнале в ретросплениальной коре не происходит повышения экспрессии с-fos по сравнению с животными, которым этот звуковой стимул предъявляли без подкрепления [Cho et al., 2017]. Это согласуется с результатами, полученными нами с использованием КУС: количество Fos+ клеток в ретросплениальной коре при формировании и извлечении памяти увеличивалось у групп “КУС УРЗ” и “КУС без ЭКР” по сравнению с мышами группы “Домашняя клетка”, однако это увеличение не было специфическим для ассоциации между комплексным сигналом и подкреплением, так как различий между группами “КУС УРЗ” и “КУС без ЭКР” мы не обнаружили. Таким образом, хотя ретросплениальная кора рассматривается в качестве зоны, в клетках которой происходит интеграция возбуждения разных модальностей [Минеева и др., 2019; Todd et al., 2019], наши данные не указывают на специфическое вовлечение ее нейронов в ассоциацию КУС с подкрепляющим воздействием.
Роли гиппокампа в конфигурационном обучении посвящена большая и достаточно противоречивая литература [Schmajuk et al., 1993; Rudy, Sutherland, 1995; Berens, Bird, 2017; Duncan et al., 1918]. Достаточно устоявшейся в ней является точка зрения, что гиппокамп является ключевой структурой для формирования как нейтральной памяти об обстановке, так и ассоциативного обучения УРЗ на обстановку и последующего извлечения этой ассоциации [Rudy, O’Reilly, 2001; Matus-Amat et al., 2001; Strekalova et al, 2003; Gross, Canteras, 2012; Chang, Liang, 2017; Eichenbaum, 2017]. С другой стороны, согласно большинству работ, гиппокамп, в том числе область СА1, не необходим (по данным разрушения или инактивации) и не активируется (по данным об экспрессии немедленных ранних генов) в задаче УРЗ при обучении и извлечении памяти о дискретных моносенсорных условных сигналах [Phillips, LeDoux, 1992; Hall et al., 2001; Mei et al., 2005; Sutherland et al., 2008; Chen et al., 2016; Cho et al., 2017]. С этим согласуются полученные нами данные о том, что различные области гиппокампа не активируются специфическим образом при извлечении ассоциативной памяти о дискретных моносенсорных условных сигналах. Однако одновременно нами было показано, что СА1 нейроны гиппокампа специфически активны при извлечении ассоциативной памяти о КУС, состоящем из светового и звукового компонентов. Этот факт согласуется с полученными ранее результатами об увеличении количества Fos+ клеток в области СА1 при извлечении ассоциативной памяти о КУС у крыс [Jones еt al., 2013].
В совокупности эти данные позволяют рассматривать КУС занимающим промежуточное положение между комплексным обстановочным условным сигналом и условным сигналом единственной сенсорной модальности: с одной стороны, КУС, как и обстановка, состоит из нескольких компонентов разной сенсорной модальности, которые только в совокупности предсказывают подкрепление; с другой стороны, КУС все же сохраняет свойство дискретного условного раздражителя, так как подается в ограниченные временные промежутки при обучении и может быть выделен животными из обстановки. Последнее подтверждается полученными нами данными о тестировании памяти о КУС в новой обстановке Б. При этом показанный нами факт специфической активации СА1 нейронов при извлечении памяти о КУС приближает его скорее к синтетической обстановочной памяти, чем о дискретном моносенсорном условном сигнале.
Заслуживает при этом внимания, что гиппокамп все же может быть необходим для формирования и извлечения памяти на дискретный моносенсорный условный сигнал, но только в специальных условиях: в том случае, если в задаче УРЗ между прекращением действия дискретного звукового условного сигнала и ЭКР проходит значительное время (15–40 с) [Raybuck, Lattal, 2011; Lugo et al., 2014; Zhang et al., 2019], т.е. вырабатывается следовой условный рефлекс. Считается, что в этом случае вовлечение гиппокампа необходимо для поддержания в памяти комплексной сцены, в которую в качестве компонента включен дискретный звуковой сигнал, для последующей ассоциации через несколько десятков секунд этой синтетической репрезентации с ЭКР [Lugo et al., 2014].
Таким образом, анализ наших собственных данных в совокупности с данными литературы приводит нас к выводу о вовлечении области СА1 гиппокампа в формирование и извлечение ассоциативной памяти с участием комплексных сигналов самой различной природы. Критическим при этом, по-видимому, является то, что составляющие сигналы должны быть интегрированы и сохранены в памяти как единый образ независимо от того, принято ли относить их к обстановочным или к традиционным дискретным условным сигналам.
Вопрос об идентификации клеток, сохраняющих эту память в мозге млекопитающих, требует дальнейшего исследования методами молекулярной нейробиологии, маркирующими нейроны, активные в когнитивных задачах [Саидов, Анохин, 2017; Рощина и др., 2017; Ивашкина и др., 2018]. Связанные с КУС пластические изменения, как показывают наши данные, следует искать в нейронах не только неокортекса, но и области СА1 гиппокампа. На роль такой активности, помимо уже упомянутой выше специфичности активации нейронов СА1 при извлечении КУС, указывает также и проведенный нами корреляционный анализ активации структур мозга и поведения животных при извлечении памяти о КУС. Он выявил, что только для извлечения ассоциативной памяти характерна корреляция уровня активности области СА1 гиппокампа с уровнем замирания животных. Наличие такой корреляции между поведением и активностью нейронов области СА1 позволяет предположить причинную роль данной структуры в воспроизведении ассоциативной памяти о КУС.
Функциональное назначение активности нейронов СА1 в рамках системной активности мозга можно предположить исходя из исследования Tanaka и соавт. [Tanaka et al., 2014]. В их работе в нейроны СА1, генетически захваченные по экспрессии c-fos в сеансе выработки УРЗ на обстановку, вводили археродопсиновый оптогенетический конструкт, позволявший избирательно вытормаживать эти нейроны в момент тестирования обстановочного УРЗ. Это ингибирование не только нарушало УРЗ у животных, но и селективно подавляло активацию генетически помеченных при обучении нейронов ретросплениальной, латеральной энторинальной и периринальной коры [Tanaka et al., 2014]. Это свидетельствует о том, что активирующиеся во время обучения на комплексный стимул нейроны СА1 и неокортекса составляют единую энграмму. Функция нейронов СА1 в ней, по-видимому, состоит в том, что их пластичность при обучении способна связать и далее при частичном входе обеспечить реактивацию всей корковой репрезентации обстановочной сцены или комплекса дискретных сигналов [Teyler, DiScenna, 1986; Teyler, Rudy, 2007; Tanaka, McHugh, 2018]. Наши данные указывают также на то, что активность СА1 нейронов отражает и сигнальное значение предъявляемого комплексного раздражителя.
ВЫВОДЫ
1. Мыши способны к обучению и формированию долговременной ассоциативной памяти о комплексном условном сигнале, состоящем из звукового и светового компонентов. Эта память сохраняется, по крайней мере, в течение 7 дней после обучения.
2. Для извлечения ассоциативной памяти о комплексном условном сигнале характерна специфическая активация нейронов поля СА1 гиппокампа по экспрессии немедленного раннего гена c-fos. При этом данная активность поля СА1 коррелирует с оборонительным поведением животных при извлечении ассоциативной памяти.
3. Такой активации экспрессии c-fos в поле СА1 не происходит при извлечении ассоциативной памяти о дискретных моносенсорных условных сигналах или моносенсорных компонентах комплексного условного сигнала, а также при извлечении памяти о неподкрепленном комплексном условном сигнале.
4. Ретросплениальная кора, а также поле СА3 и зубчатая фасция гиппокампа по показателю экспрессии c-fos не вовлекаются специфически в формирование или извлечение памяти о комплексном условном сигнале.
5. На основании полученных результатов мы считаем, что активация поля СА1 происходит в связи с извлечением из памяти сложной ассоциации комплексного условного сигнала и электрокожного раздражения, и является необходимой для проявления памяти о комплексном условном сигнале в поведении животного.
Исследование выполнено при поддержке Российского фонда фундаментальных исследований в рамках проекта № 17-04-02054.
Список литературы
Адрианов О.С. Структура условных рефлексов на комплексные одновременные условные раздражители. Журн. высш. нервн. деят. им. И.П. Павлова, 1961. 11. 1019–1025.
Батуев А.С. К механизмам взаимодействия зрительного и слухового анализаторов. Журн. высш. нервн. деят. им. И.П. Павлова, 1964. 14 (5): 834–846.
Воронин Л.Г. Анализ и синтез сложных раздражителей нормальными и поврежденными полушариями головного мозга собаки. Экспериментальное исследование. 1948. М.: АМН СССР.
Зворыкина С.В., Анохин К.В. Исследование топографии с-fos-экспрессирующих нейронов в неокортексе мышей при обучении условнорефлекторному замиранию. Журн. высш. нервн. деят. им. И.П. Павлова, 2003. 53 (4): 518–522.
Ивашкина О.И., Торопова К.А., Иванова А.А., Чехов С.А., Анохин К.В. Волновая экспрессия белков с-Fos и Arc в нейронных популяциях гиппокампа в ответ на одиночный эпизод нового опыта. Бюлл. эксп. биол. мед. 2015. 160 (12): 689–692.
Ивашкина О.И., Торопова К.А., Рощина М.В., Анохин К.В. Выработка условной реакции страха на световой стимул у мышей: сопоставление с обучением на звуковой стимул. Журн. высш. нервн. деят. им. И.П. Павлова, 2016. 66 (4): 1–6.
Ивашкина О.И., Воробьева Н.С., Груздева А.М., Рощина М.А., Торопова К.А., Анохин К.В. Когнитивная индексация нейронов: Cre-управляемое генетическое маркирование и изучение клеток, участвующих в обучении и памяти. Acta Naturae. 2018. 10 (2): 40–51.
Минеева О.А., Безряднов Д.В., Чехов С.А., Сварник О.Е., Анохин К.В. Интегративные функции ретросплениальной коры: данные анатомии, коннектомики и клеточной электрофизиологии у крыс. Анналы клинич. и эксперим. неврологии. 2019. 13 (1): 47–54.
Муравьева Е.В., Анохин К.В. Участие синтеза белка в реконсолидации памяти в разное время после обучения условно-рефлекторному замиранию у мышей. Журн. высш. нерв. деят. им. И.П. Павлова, 2006. 56 (2): 274–282.
Павлов И.П. Полное собрание трудов. В 5 томах. Ред. Л.А. Орбели М.-Л.: Изд-во АН СССР, 1949.
Палладин А.В. Образование искусственных условных рефлексов из суммы раздражений. Труды общества русских врачей в СПб. 73 (1906): 393–401.
Перельцвейг И.Я. Материалы к учению об условных рефлексах. Диссертация СПб., 1907.
Рощина М.А., Ивашкина О.И., Анохин К.В. Новые подходы в когнитивной нейробиологии: методы двухфотонной in vivo визуализации когнитивно активных нейронов. Журн. высш. нерв. деят. им. И.П. Павлова, 2017. 62 (2): 141–149.
Саидов Х.М., Анохин К.В. Новые подходы в когнитивной нейробиологии: методы молекулярного маркирования и ex vivo визуализации когнитивно активных нейронов. Журн. высш. нерв. деят. им. И.П. Павлова, 2017. 67 (3): 259–272.
Торопова К.А., Анохин К.В. Моделирование посттравматического стрессового расстройства у мышей: нелинейная зависимость от силы травматического воздействия. Журн. высш. нерв. деят. им. И.П. Павлова, 2018. 68 (3): 378–394.
Торопова К.А., Трошев Д.В., Ивашкина О.И., Анохин К.В. Активация экспрессии c-Fos в ретросплениальной коре, но не гиппокампе, сопровождает формирование ассоциации между обстановкой и безусловным стимулом и ее последующее извлечение у мышей. Журн. высш. нерв. деят. им. И.П. Павлова, 2018. 68 (6): 759–774.
Bergstrom H.C. The neurocircuitry of remote cued fear memory. Neurosci. Biobehav. Rev. 2016. 71: 409–417.
Berens S.C., Bird C.M. The role of the hippocampus in generalizing configural relationships. Hippocampus. 2017. 27 (3): 223–228.
Bourtchouladze R., Abel T., Berman N., Gordon R., Lapidus K., Kandel E.R. Different Training Procedures Recruit Either One or Two Critical Periods for Contextual Memory Consolidation, Each of Which Requires Protein Synthesis and PKA. Learn Mem. 1998. 5 (4): 365–374.
Bronfman Z.Z., Ginsburg S., Jablonka E. The transition to minimal consciousness through the evolution of associative learning. Front Psychol. 2016. 22 (7): 1954 eCollection 2016.
Chang S.D., Liang K.C. The hippocampus integrates context and shock into a configural memory in contextual fear conditioning. Hippocampus. 2017. 27 (2): 145–155.
Chen V.M., Foilb A.R., Christianson J.P. Inactivation of ventral hippocampus interfered with cued-fear acquisition but did not influence later recall or discrimination. Behav. Brain Res. 2016. 296: 249–253.
Cho J.H., Rendall S.D., Gray J.M. Brain-wide maps of Fos expression during fear learning and recall. Learn. Mem. 2017. 24 (4): 169–181.
Corcoran K.A., Frick B.J., Radulovic J., Kay L.M. Analysis of coherent activity between retrosplenial cortex, hippocampus, thalamus, and anterior cingulate cortex during retrieval of recent and remote context fear memory. Neurobiol. Learn. Mem. 2016. 127: 93–101.
Debiec J., Diaz-Mataix L., Bush D.E., Doyère V., LeDoux J.E. The selectivity of aversive memory reconsolidation and extinction processes depends on the initial encoding of the Pavlovian association. Learn. Mem. 2013. 20 (12): 695–699.
Doron A., Goshen I. Investigating the transition from recent to remote memory using advanced tools. Brain Res Bull. 2018. 141: 35–43.
Duncan K., Doll B.B., Daw N.D., Shohamy D. More than the sum of its parts: A role for the hippocampus in configural reinforcement learning. Neuron. 2018. 98 (3): 645–657.
Eichenbaum H. On the integration of space, time, and memory. Neuron. 2017. 95 (5): 1007–1018.
Feinberg T.E., Mallatt J. The nature of primary consciousness: a new synthesis. Conscious. Cogn. 2016. 43: 113–127.
Franklin K.B.J., Paxinos G. The mouse brain in stereotaxic coordinates. 3rd ed. New York: Academic Press. 2007.
Ginsburg S., Jablonka E. The Evolution of the Sensitive Soul: Learning and the Origins of Consciousness. MIT Press, Cambridge, MA, 2019.
Gross C.T., Canteras N.S. The many paths to fear. Nat. Rev. Neurosci. 2012. 13 (9): 651–658.
Guzowski J.F., Timlin J.A., Roysam B., McNaughton B.L., Worley P.F., Barnes C.A. Mapping behaviorally relevant neural circuits with immediate-early gene expression. Curr. Opin. Neurobiol. 2005. 15 (5): 599–606.
Hall J., Thomas K.L., Everitt B.J. Cellular imaging of zif268 expression in the hippocampus and amygdala during contextual and cued fear memory retrieval: selective activation of hippocampal CA1 neurons during the recall of contextual memories. J. Neurosci. 2001. 21 (6): 2186–2193.
Jones C.E., Ringuet S., Monfils M.H. Learned together, extinguished apart: reducing fear to complex stimuli. Learn. Mem. 2013. 20 (12): 674–685.
Keene C.S., Bucci D.J. Contributions of the retrosplenial and posterior parietal cortices to cue-specific and contextual fear conditioning. Behav. Neurosci. 2008. 122 (1): 89–97.
Kim J.J., Fanselow M.S. Modality-specific retrograde amnesia of fear. Science. 1992. 256: 675–677.
Lugo J.N., Smith G.D., Holley A.J. Trace fear conditioning in mice. J. Vis. Exp. 2014. 85.
Matus-Amat P., Higgins E.A., Barrientos R.M., Rudy J.W. The role of the dorsal hippocampus in the acquisition and retrieval of context memory representations. J. Neurosci. 2004. 24 (10): 2431–2439.
Mei B., Li C., Dong S., Jiang C.H., Wang H., Hu Y. Distinct gene expression profiles in hippocampus and amygdala after fear conditioning. Brain Res. Bull. 2005. 67 (1–2): 1–12.
Pevzner A., Guzowski J.F. Immediate-early gene transcriptional activation in hippocampus CA1 and CA3 does not accurately reflect rapid, pattern completion-based retrieval of context memory. Learn. Mem. 2014. 22 (1): 1–5.
Phillips R.G., LeDoux J.E. Differential contribution of amygdala and hippocampus to cued and contextual fear conditioning. Behav. Neurosci. 1992. 106: 274–285.
Raybuck J.D., Lattal K.M. Double dissociation of amygdala and hippocampal contributions to trace and delay fear conditioning. PLoS One. 2011. 6 (1): e15982.
Razran G.H.S. Studies in Configural Conditioning: I. Historical and Preliminary Experimentation. Journal of General Psychology. 1939a. 21 (2): 307–330.
Razran G.H.S. Studies in Configural Conditioning: IV. Gestalt Organization and Configural Conditioning. J. Psychol. 1939b. 7 (1): 3–16.
Razran G.H.S. Mind in Evolution: An East-West Synthesis of Learned Behavior and Cognition. Houghton Mifflin, 1971.
Robinson S., Poorman C.E., Marder T.J., Bucci D.J. Identification of functional circuitry between retrosplenial and postrhinal cortices during fear conditioning. J. Neurosci. 2012. 32 (35): 12076–12086.
Rudy J.W., Sutherland R.J. Configural association theory and the hippocampal formation: an appraisal and reconfiguration. Hippocampus. 1995. 5 (5): 375–389.
Rudy J.W., O’Reilly R.C. Conjunctive representations, the hippocampus, and contextual fear conditioning. Cogn. Affect. Behav. Neurosci. 2001. 1 (1): 66–82.
Schmajuk N.A., Blair H.T. Stimulus configuration, spatial learning, and hippocampal function. Behav Brain Res. 1993. 59 (1–2): 103–117.
Selden N.R., Everitt B.J., Jarrard L.E., Robbins T.W. Complementary roles for the amygdala and hippocampus in aversive conditioning to explicit and contextual cues. Neuroscience. 1991. 42 (2): 335–350.
Sigwald E.L., Bignante E.A., de Olmos S., Lorenzo A. Fear-context association during memory retrieval requires input from granular to dysgranular retrosplenial cortex. Neurobiol. Learn. Mem. 2019. 163: 107036.
Strekalova T., Zorner B., Zacher C., Sadovska G., Herdegen T., Gass P. Memory retrieval after contextual fear conditioning induces c-Fos and JunB expression in CA1 hippocampus. Genes Brain Behav. 2003. 2: 3–10.
Sugar J., Witter M.P., van Strien N.M., Cappaert N.L. The retrosplenial cortex: intrinsic connectivity and connections with the (para)hippocampal region in the rat. An interactive connectome. Front Neuroinform. 2011. 5: 7. eCollection 2011. https://doi.org/10.3389/fninf.2011.00007
Sutherland R.J., O’Brien J., Lehmann H. Absence of systems consolidation of fear memories after dorsal, ventral, or complete hippocampal damage. Hippocampus. 2008. 18 (7): 710–718.
Tanaka K.Z., Pevzner A., Hamidi A.B., Nakazawa Y., Graham J., Wiltgen B.J. Cortical representations are reinstated by the hippocampus during memory retrieval. Neuron. 2014. 84: 347–354.
Tanaka K.Z., McHugh T.J. The hippocampal engram as a memory index. J. Exp. Neurosci. 2018. 12: 1179069518815942.
Teyler T.J., DiScenna P. The hippocampal memory indexing theory. Behav Neurosci. 1986. 100: 147–154.
Teyler T.J., Rudy J.W. The hippocampal indexing theory and episodic memory: updating the index. Hippocampus. 2007. 17 (12): 1158–1169.
Todd T.P., Mehlman M.L., Keene C.S., DeAngeli N.E., Bucci D.J. Retrosplenial cortex is required for the retrieval of remote memory for auditory cues. Learn. Mem. 2016. 23: 278–288.
Todd T.P., DeAngeli N.E., Jiang M.Y., Bucci D.J. Retrograde amnesia of contextual fear conditioning: Evidence for retrosplenial cortex involvement in configural processing. Behav. Neurosci. 2017. 131 (1): 46–54.
Todd T.P., Fournier D.I., Bucci D.J. Retrosplenial cortex and its role in cue-specific learning and memory. Neurosci. Biobehav. Rev. 2019. 107: 713–728.
Yadav R., Hillman B.G., Gupta S.C., Suryavanshi P., Bhatt J.M., Pavuluri R., Stairs D.J., Dravid S.M. Deletion of glutamate delta-1 receptor in mouse leads to enhanced working memory and deficit in fear conditioning. PLOS One. 2013. 8 (4): e60785.
Zhang L., Chen X., Sindreu C., Lu S., Storm D.R., Zweifel L.S., Xia Z. Dynamics of a hippocampal neuronal ensemble encoding trace fear memory revealed by in vivo Ca2+ imaging. PLoS One. 2019. 14 (7): e0219152.
Zeliony G.P. Contributions a l’analyse des excitants complexes des reflexes conditionnels. Archives de Sciences Biologiques. 1910. 15: 437–453.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


