Журнал высшей нервной деятельности им. И.П. Павлова, 2020, T. 70, № 3, стр. 422-432
РЕАКТИВНОСТЬ МЮ-РИТМА ЭЭГ ПРИ НАБЛЮДЕНИИ И ВЫПОЛНЕНИИ ДЕЙСТВИЙ У ДЕТЕЙ РАННЕГО ВОЗРАСТА, ИМЕЮЩИХ РАЗНЫЙ УРОВЕНЬ РАЗВИТИЯ РЕЦЕПТИВНОЙ РЕЧИ
А. А. Михайлова 1, *, Л. С. Орехова 1, Ю. О. Дягилева 1, Т. И. Мухтаримова 1, В. Б. Павленко 1
1 Крымский федеральный университет им. В.И. Вернадского
Симферополь, Россия
* E-mail: anna.kulenkova@gmail.com
Поступила в редакцию 17.12.2019
После доработки 10.02.2020
Принята к публикации 26.02.2020
Аннотация
Изучали особенности реактивности мощности ЭЭГ в индивидуально определенном частотном диапазоне мю-ритма в центральных, фронтальных и теменных отведениях ЭЭГ у детей в условиях наблюдения за мнимым действием, реальным действием и при выполнении ребенком самостоятельного действия. В исследовании приняли участие 39 детей в возрасте от 17 до 41 мес. Дисперсионный анализ мощности ЭЭГ в диапазоне мю-ритма продемонстрировал значимую десинхронизацию в центральных, фронтальных и теменных отведениях ЭЭГ в условиях наблюдения и выполнения действий. Ситуация “наблюдение реального действия” сопровождалась бóльшей десинхронизацией мощности в диапазоне мю-ритма в медианном фронтальном (Fz) и медианном париетальном (Pz) локусах по сравнению с ситуацией “наблюдение мнимого действия”. C целью определения роли “системы зеркальных нейронов” в процессах освоения речи анализировали особенности реактивности мю-ритма ЭЭГ у детей с разным уровнем развития рецептивной речи, определенного с использованием теста Бейли. Выявлено, что у детей с высоким уровнем по шкале “рецептивная речь” отмечается бо́льшая десинхронизация мощности ЭЭГ в диапазоне мю-ритма в условиях наблюдения за реальным действием в лобном (F3) и теменном (P3) локусах левого полушария по сравнению с детьми со средним уровнем по данной шкале. Результаты исследования указывают, что дети, которые демонстрируют более высокий уровень активации “системы зеркальных нейронов”, обладают более высоким уровнем понимания речи.
ВВЕДЕНИЕ
В настоящее время актуальным направлением исследований нейронаук стало изучение “системы зеркальных нейронов” (СЗН) мозга [см. обзор Лебедева и др., 2017]. Наличие такой системы у человека лежит в основе так называемой “гипотезы прямого соответствия” (“direct-matching hypothesis”): понимание действий индивидом облегчается тем, что наблюдение за действием активирует ту же самую нейронную сеть, которая необходима для выполнения этого действия [Rizzolatti et. al., 2001]. Так, предполагается, что СЗН отвечает за имплицитное понимание действия и активируется при восприятии целенаправленных действий окружающих [Iacoboni, 2009]. Также с помощью СЗН человек может предвосхищать действия других людей, не прибегая к сложным сознательным умозаключениям [Рамачандран, 2017]. Выдвинуты предположения и в ряде исследований показано, что СЗН играет решающую роль в реализации многих социальных феноменов, таких как эмпатия, обучение путем подражания, построение модели психического состояния другого человека [Buccino, 2004; Keysers, Gazzola, 2007; Iacoboni, 2009; Khalil et al., 2018; Лебедева и др., 2018]. Так же предполагают, что СЗН играет ключевую роль в процессах формирования и восприятия речи [Рамачандран, 2017].
Физиологическим маркером активности СЗН принято считать десинхронизацию сенсомоторного мю-ритма при восприятии действий окружающих [Fox, 2016; Debnath et al., 2019]. Мю-ритм традиционно регистрируется в моторных и сенсомоторных регионах коры. В целом области неокортекса, отвечающие за организацию и восприятие движений, включают в себя премоторную кору, соматосенсорную кору и нижнюю теменную дольку [см. обзор Jeon, 2018]. Исходя из этого, многие авторы анализируют эффекты десинхронизации (снижение мощности) ЭЭГ в диапазоне частот мю-ритма во фронтальных, центральных и теменных локусах [Avanzini et al., 2012; Кайда и др., 2019]. Особую актуальность изучение реактивности мю-ритма приобрело в связи с исследованиями источников электрофизиологической активности мозга, выделяемых при управлении интерфейсом мозг-компьютер, основанном на распознавании паттернов ЭЭГ при воображении движений [Керечанин и др., 2019].
Несмотря на значительное количество исследований, посвященных изучению десинхронизации мю-ритма у взрослых, существует лишь небольшое количество аналогичных исследований, проведенных с участием маленьких детей. Так, было показано, что у детей уже в возрасте восьми месяцев в процессе наблюдения за взрослым, который перемещает игрушку, происходила десинхронизация мю-ритма в частотной полосе 5–9 Гц [Nyström, 2011]. У детей в возрасте трех лет наблюдалось сходное снижение мю-ритма в частотной полосе 6–9 Гц в левой и правой соматосенсорной коре в ситуации выполнения ребенком действий и в процессе наблюдения за выполнением действий матерью [Liao et al., 2015]. У детей в возрасте одного года было отмечено более значимое снижение мю-ритма, когда они наблюдали за тем, как экспериментатор совершает необычное действие (подносит телефон ко рту) по сравнению с обычным (подносит телефон к уху) [Stapel et al., 2010]. Следует отметить, что десинхронизацию мю-ритма связывают с уже существующим опытом определенных действий у детей в младенческом и раннем возрасте. Обнаружено, что десинхронизация мю-ритма во время наблюдения за хватательными движениями была связана с тем, что младенцы сами могли реализовать такие движения и, очевидно, понимали их цель [Cannon et al., 2016]. V. Reid и соавт. [Reid et al., 2011] выявили значимое падение мю-ритма у малышей в возрасте 14 мес, когда экспериментатор подражал действиям детей (что можно интерпретировать как наблюдение за известными действиями), но не в ситуации, когда он совершал сложные действия, которые ранее не были включены в моторный опыт ребенка. Нужно, однако, отметить, что в большинстве уже имеющихся исследований с участием детей раннего возраста не учитывается индивидуальный частотный диапазон мю-ритма ЭЭГ, который может значительно отличаться у разных детей даже одной возрастной группы.
Особый интерес представляет изучение роли СЗН в процессах освоения речи, поскольку, с одной стороны, предполагается, что СЗН лежит в основе познания человеком окружающей социальной среды [Рамачандран, 2017], а с другой – качество развития речевой функции в раннем возрасте значимо влияет на становление других высших психических функций – памяти, внимания, мышления и т.д. [Ермолина, 2010]. Существуют лишь единичные исследования в этой области с участием маленьких детей, и они в основном направлены на изучение специфики изменения мю-ритма как индикатора активности СЗН в процессе восприятия речевых стимулов. Так, установлено, что у малышей 18 и 24 мес восприятие предложений, обозначающих действия, сопровождается падением мощности центрального мю-ритма (6–10 Гц) [Antognini, Daum, 2017].
В связи с вышеизложенным, целью настоящей работы было, с одной стороны, изучить реактивность ЭЭГ в индивидуально определенном частотном диапазоне мю-ритма у детей раннего возраста в условиях наблюдения за действиями другого человека и при выполнении ребенком самостоятельного действия, и, с другой стороны, выявить особенности этих реакций у детей с разным уровнем развития рецептивной речи.
МЕТОДИКА
В исследовании приняли участие 39 детей (12 мальчиков и 27 девочек) в возрасте от 17 до 41 мес. Средний возраст детей составил 30.6 ± ± 0.9 мес. В обследованные группы не были включены дети с массой тела при рождении менее 2.5 кг, с наличием генетических заболеваний, с заболеваниями ЦНС, а также левши (с очевидным преобладанием левой руки при манипуляциях с предметами и при рисовании). В группу для исследования дети были набраны с помощью объявлений, размещенных в детских садах г. Симферополя. Родителям этих детей были предоставлены все необходимые сведения о процедуре исследования, и они дали письменное согласие на участие ребенка в экспериментах. Настоящее исследование соответствовало этическим принципам Хельсинкской декларации 1964 г. и было одобрено этическим комитетом Крымского федерального университета им. В.И. Вернадского.
Обследование проходило в течение двух дней. В первый день устанавливали контакт с ребенком, стараясь снизить его тревогу в незнакомой ситуации, и проводили часть психологических тестов. Во второй день завершали психологическое тестирование и регистрировали ЭЭГ.
Оценка уровня развития восприятия речи. Уровень речевого развития детей оценивали с помощью тест-системы Бейли (BSID-III) [Bayley, 2006]. Данная тест-система содержит задания возрастающей сложности, позволяющие оценить умственное, речевое (как рецептивное, так и экспрессивное) и моторное развитие детей в возрасте от 16 дней до 42 мес. Для оценки уровня развития понимания речи (показатель “рецептивная речь”) детям давалась словесная инструкция показать на рисунках и предъявляемых игрушках характеристики и категории объектов (большой, маленький, виды одежды, части тела), изображенные действия, а также самому выполнить простую последовательность действий. Во время тестирования оценивалось: понимает ли ребенок названия и использование объектов, местоимения, предлоги, причастия, формы единственного и множественного числа, отрицания в предложениях и т.п. Учитывались полнота и точность выполнения задания. Для каждого возраста (с точностью до месяца) предназначался свой набор заданий. Результат тестирования с помощью специальных таблиц переводился в относительные единицы (баллы), которые показывали уровень выполнения предъявленных задач по сравнению с группой детей данного возраста. По шкале “рецептивная речь” ребенок мог набрать от 1 до 19 баллов.
Регистрация и анализ ЭЭГ. Исходную (фоновую) ЭЭГ регистрировали в состоянии устойчивого зрительного внимания (УЗВ) ребенка при просмотре видеозаписи вращающегося мяча (продолжительность записи 20–30 с). При этом ребенка просили посидеть спокойно, глядя на мячик. Затем проводили регистрацию ЭЭГ в трех экспериментальных условиях (модификация методики [Nyström, 2011]):
1. “Наблюдение мнимого действия” – ребенок наблюдает, как экспериментатор проводит рукой по установленной на столе горке (3 повторения по 5 с). Считается, что ребенок не видит в этом действии реальной цели [Nyström, 2011].
2. “Наблюдение реального действия” – ребенок наблюдает, как экспериментатор сталкивает с горки игрушечную машинку (3 повторения по 5 с).
3. “Выполнение действия” – экспериментатор ставит горку с машинкой перед ребенком и ребенок сам ее сталкивает (3 повторения по 5 с).
ЭЭГ регистрировали с помощью электроэнцефалографа Мицар-ЭЭГ-10/70-201 монополярно в соответствии с международной системой “10-20” в лобных, центральных, височных, теменных и затылочных отведениях. В рамках настоящего исследования проводили анализ характеристик ЭЭГ в следующих отведениях: F3, Fz, F4, C3, Cz, C4, P3, Pz, P4. Указанные регионы выбраны как области интереса на основании данных литературы о целесообразности анализа мю-ритма у детей не только в центральных, но и во фронтальных и теменных областях [Marshall et al., 2011; Warreyn, 2013]. В качестве референтного использовался объединенный ушной электрод. Во время записи ЭЭГ велась аудио- и видеорегистрация. Для исключения отрезков ЭЭГ с артефактами от мышечной активности регистрировали электромиограмму (ЭМГ) от хлорсеребряных электродов, расположенных на поверхности кожи над фронтальной мышцей лба. Сигнал ЭМГ фильтровался в диапазоне 10–100 Гц. Участки записей ЭЭГ с амплитудой более 250 мкВ, сопровождающиеся движениями глаз, а также отрезки, содержащие большое количество артефактов, связанных с активацией ЭМГ мышц лба, исключались из обработки.
Анализировались отрезки ЭЭГ длительностью по 5 с в трех описанных выше экспериментальных условиях. Начало фрагмента располагалось за 2.5 с до момента прикосновения руки экспериментатора к горке или к машинке, а также прикосновения ребенка к машинке. Завершение отрезка – через 2.5 с после этого момента. Указанные фрагменты ЭЭГ подвергались быстрому преобразованию Фурье с эпохой анализа 2.5 с и взаимным перекрытием эпох 50%. Применялось сглаживание окном Блэкмана. Учитывая три повторения каждой ситуации для каждого экспериментального условия, в сумме анализировались отрезки ЭЭГ общей продолжительностью по 15 с. Для анализа исходной ЭЭГ использовался фрагмент 20–30 с.
На спектре ЭЭГ в отведении С3 в условиях УЗВ выявляли пик мощности в диапазоне 5–10 Гц, который исчезал во время совершения ребенком самостоятельного движения рукой. Для каждого отдельного испытуемого на усредненный по последовательным эпохам спектр ЭЭГ, зарегистрированной в ситуациях УЗВ, накладывался усредненный по трем повторениям спектр ЭЭГ, зарегистрированной в условиях “Выполнения действия”. За границы анализируемого диапазона принимали точки пересечения спектров. Данную компоненту альфа-ритма, демонстрирующую супрессию мощности в ситуации двигательной активности, рассматривают как сенсомоторный или мю-ритм [Thorpe et al., 2016]. Для индивидуально-определенной частотной полосы мю-ритма рассчитывали мощность, которую подвергали логарифмированию для нормализации распределения (lg мкВ2).
Для сравнения реакций десинхронизации у детей с разным уровнем восприятия речи рассчитывали индексы реактивности (ИР) мю-ритма в соответствии с формулой [k = = (B/A) – 1], где k – коэффициент реактивности мю-ритма, B – мощность мю-ритма в экспериментальной ситуации, A – мощность мю-ритма в фоновой ситуации. В зависимости от экспериментальных условий “Наблюдение мнимого действия”, “Наблюдение реального действия”, “Выполнение действия”, которые соотносились с фоновой ситуацией УЗВ, рассчитывались следующие индексы реактивности: ИР-1, ИР-2, ИР-3 соответственно.
Значения ИР > 0 свидетельствуют об увеличении мощности мю-ритма в экспериментальной ситуации по сравнению с фоновым уровнем (синхронизация), а ИР < 0 – о снижении мощности мю-ритма (десинхронизация).
Для статистической обработки использовали программу STATISTICA v.10. Результаты измерений представляли как средние значения ± стандартная ошибка среднего. Различия детей по возрасту в группах со средним и высоким уровнем развития восприятия речи анализировали с использованием однофакторного дисперсионного анализа ANOVA. Изменения мощности мю-ритма во всех экспериментальных ситуациях относительно друг друга и по отношению к УЗВ анализировали с помощью ANOVA с повторными измерениями (repeated measures) с факторами СИТУАЦИЯ (2 уровня), ЛОКУС/9/ (уровни: 9 отведений) и СИТУАЦИЯ × ЛОКУС. Для оценки эффектов изменений мощности мю-ритма в каждом из девяти локусов ЭЭГ использовался метод априорных контрастов (оценка F-распределения). Значимость межгрупповых различий ИР мю-ритма у детей со средним и высоким уровнем развития рецептивной речи определяли с учетом внутрисубъектного фактора ЛОКУС/9/ и межсубъектного фактора ГРУППА (2 уровня: средний и высокий уровень развития рецептивной речи) и взаимодействия этих факторов.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Показатель понимания речи (шкала “рецептивная речь”). Исследуемые дети составили две группы: со средним (8–12 баллов) и высоким (13–19 баллов) уровнем по шкале “рецептивная речь” теста Бэйли. В обеих группах дети не отличались по возрасту (F1, 37 = = 0.27, р = 0.60). Группу детей со средним уровнем понимания речи составили 13 детей (7 мальчиков и 6 девочек), а группу детей с высоким уровнем – 26 детей (5 мальчиков и 21 девочка).
Показатели мю-ритма ЭЭГ. Среднее значение пиковой частоты индивидуально определенного мю-ритма для всей совокупности испытуемых составило 7.8 ± 0.1 Гц. Среднее значение нижней границы частотного диапазона мю-ритма составило 6.9 ± 0.1 Гц, верхней границы – 8.8 ± 0.1 Гц. Частота пика мю-ритма у детей с разным уровнем развития рецептивной речи значимо не отличалась (F1, 37 = = 0.33, р = 0.25).
Реактивность мю-ритма ЭЭГ в ситуациях “Наблюдение мнимого действия”, “Наблюдение реального действия”, “Выполнение действия” относительно ситуации УЗВ. Результаты анализа repeated measures ANOVA изменений мощности ЭЭГ в частотном диапазоне мю-ритма в ситуациях “Наблюдение мнимого действия”, “Наблюдение реального действия”, “Выполнение действия” относительно ситуации УЗВ с учетом локуса отведения представлены в табл. 1. Выявлено, что на мощность ЭЭГ в диапазоне мю-ритма значимо влияют факторы СИТУАЦИЯ и ЛОКУС. Метод априорных контрастов показал, что у детей мощность ЭЭГ в диапазоне мю-ритма во всех экспериментальных ситуациях значимо снижается в большинстве локусов (рис. 1). Взаимодействия между факторами СИТУАЦИЯ × ЛОКУС во всех сравниваемых ситуациях не имели значимого эффекта.
Таблица 1.
Результаты дисперсионного анализа изменений мощности ЭЭГ в диапазоне мю-ритма в ситуациях “Наблюдение мнимого действия”, “Наблюдение реального действия” и “Выполнение действия” относительно исходной записи в условиях устойчивого зрительного внимания (УЗВ) Table 1. ANOVA results for the EEG mu rhythm power changes under conditions of “Fake action observation”, “Real action observation” and “Action execution”, relative to the baseline condition of a sustained visual attention (УЗВ)
| Сравниваемые ситуации | СИТУАЦИЯ | ЛОКУС | СИТУАЦИЯ × ЛОКУС | |||
|---|---|---|---|---|---|---|
| F1, 38 | p | F8, 304 | p | F8, 304 | P | |
| “Наблюдение мнимого действия” и УЗВ | 34.74 | <0.001 | 8.03 | <0.001 | 1.06 | 0.39 |
| “Наблюдение реального действия” и УЗВ | 74.01 | <0.001 | 5.26 | <0.001 | 0.56 | 0.81 |
| “Выполнение действия” и УЗВ | 56.41 | <0.001 | 9.04 | <0.001 | 1.01 | 0.42 |
Рис. 1.
Мощность ЭЭГ (Р, lg мкВ2) в диапазоне мю-ритма в ситуациях устойчивого зрительного внимания (1), наблюдения мнимого действия (2), наблюдения реального действия (3) и выполнения ребенком самостоятельного действия (4). Звездочками отмечены случаи достоверных различий между исходной ситуацией (белые столбцы) и ситуацией наблюдения и выполнения движений (серые столбцы), выявленные методом априорных контрастов (* – р < 0.05). Темными кружками отмечены случаи достоверных различий между ситуациями 2 и 3, выявленные методом априорных контрастов (* – р < 0.05).
Fig. 1. The EEG mu rhythm powers (Р, lg μV2) under conditions of a sustained visual attention (1), fake action observation (2), real action observation (3) and independent action execution (4). The asterisk symbols indicate the cases of significant differences between the baseline (white columns) condition and the conditions of action observation and execution (gray columns), estimated by a priori contrasts (* – р < 0.05). Dark circles indicate the cases of significant differences between the conditions 2 and 3, estimated by a priori contrasts (* – р < 0.05).
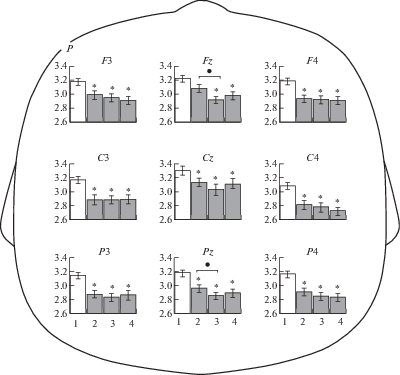
Сравнение реактивности мю-ритма ЭЭГ в экспериментальных ситуациях. Для определения, какие именно условия вызывают наибольшее снижение мощности мю-ритма, мы провели сравнение параметров ЭЭГ в трех экспериментальных ситуациях. Результаты анализа repeated measures ANOVA представлены в табл. 2. Выявлено значимое влияние факторов СИТУАЦИЯ и ЛОКУС при сравнении мощности мю-ритма в ситуациях “Наблюдение реального действия” относительно ситуации “Наблюдение мнимого действия”. Использование метода априорных контрастов выявило локусы, в которых падение мощности мю-ритма у детей в данных экспериментальных ситуациях значимо отличалось. Так, в ситуации “Наблюдение реального действия” мощность мю-ритма во фронтальном и париетальном отведениях была значимо меньше по сравнению с ситуацией “Наблюдение мнимого действия” (см. рис. 1).
Таблица 2.
Результаты дисперсионного анализа различий в мощности ЭЭГ в диапазоне мю-ритма в ситуациях “Наблюдение мнимого действия”, “Наблюдение реального действия” и “Выполнение действия” Table 2. ANOVA results for the EEG mu rhythm power differences under conditions of “Fake action observation”, “Real action observation” and “Action execution”
| Сравниваемые ситуации | СИТУАЦИЯ | ЛОКУС | СИТУАЦИЯ × ЛОКУС | |||
|---|---|---|---|---|---|---|
| F1, 38 | p | F8, 304 | p | F8, 304 | p | |
| “Наблюдение мнимого действия” и “Наблюдение реального действия” | 4.21 | 0.04 | 7.19 | <0.001 | 0.97 | 0.45 |
| “Наблюдение мнимого действия” и “Выполнение действия” | 1.08 | 0.30 | 10.31 | <0.001 | 0.52 | 0.83 |
| “Наблюдение реального действия” и “Выполнение действия” | 0.08 | 0.78 | 8.66 | <0.001 | 0.77 | 0.62 |
При анализе мощности ЭЭГ в диапазоне мю-ритма в ситуации “Наблюдение мнимого действия” и “Наблюдение реального действия” относительно ситуации “Выполнение действия” выявлено значимое влияние лишь фактора ЛОКУС. Статистически значимого взаимодействия факторов СИТУАЦИЯ × ЛОКУС в трех экспериментальных ситуациях выявлено не было.
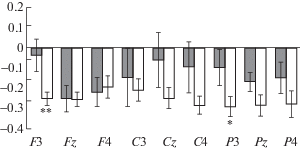
Реактивность ЭЭГ в диапазоне мю-ритма в трех экспериментальных ситуациях у детей с разным уровнем понимания речи. В табл. 3 представлены результаты дисперсионного анализа ИР ЭЭГ в диапазоне мю-ритма в ситуациях “Наблюдение мнимого действия”, “Наблюдение реального действия” и “Выполнение действия” относительно ситуации УЗВ в зависимости от факторов ГРУППА (дети со средним и высоким уровнем развития рецептивной речи) и ЛОКУС. Выявлено значимое влияние фактора ГРУППА на ИР-2. Гистограммы, демонстрирующие ИР мощности ЭЭГ в диапазоне мю-ритма в ситуации “Наблюдение реального действия” относительно УЗВ в сравнении между группами детей с разным уровнем понимания речи представлены на рис. 2. Метод априорных контрастов показал, что у детей с высокими показателями по шкале “рецептивная речь” в условиях наблюдения реального действия в лобном и теменном локусах левого полушария отмечается значимо бо́льшая десинхронизация мощности ЭЭГ в диапазоне мю-ритма по сравнению с группой детей со средним уровнем развития рецептивной речи.
Таблица 3.
Результаты дисперсионного анализа индексов реактивности ЭЭГ в диапазоне мю-ритма в зависимости от факторов ГРУППА (дети с высоким и средним уровнем развития рецептивной речи) и ЛОКУС (9 отведений ЭЭГ) Table 3. ANOVA results for the EEG mu rhythm power reactivity indices with the main effects of GROUP (children with high and average levels of receptive speech development) and LOCUS (9 EEG loci) factors
| Индексы реактивности | ГРУППА | ЛОКУС | ГРУППА × × ЛОКУС | |||
|---|---|---|---|---|---|---|
| F1, 37 | p | F8, 296 | p | F8, 296 | p | |
| ИР-1 | 3.17 | 0.08 | 0.83 | 0.57 | 1.71 | 0.09 |
| ИР-2 | 4.1 | 0.05 | 0.67 | 0.71 | 1.08 | 0.37 |
| ИР-3 | 1.94 | 0.17 | 1.04 | 0.40 | 0.87 | 0.54 |
Примечание: ИР-1, ИР-2, ИР-3 – индексы реактивности для ситуаций “Наблюдение мнимого действия”, “Наблюдение реального действия”, “Выполнение действия” соответственно. Note: ИР-1, ИР-2, ИР-3 – reactivity indices for the conditions of “Fake action observation”, “Real action observation” and “Action execution”, respectively.
Рис. 2.
Индексы реактивности ЭЭГ в диапазоне мю-ритма в группах детей со средним (серые столбцы) и высоким (белые столбцы) уровнем развития рецептивной речи в условии наблюдения реального действия относительно устойчивого зрительного внимания. Звездочками отмечены случаи достоверных различий между группами, выявленные методом априорных контрастов (* – p < 0.05, ** – p < 0.01).
Fig. 2. The EEG mu rhythm power reactivity indices in the groups of children who have an average (gray columns) and a high (white columns) level of receptive speech development under condition of a real action observation compared to the sustained visual attention condition. The asterisk symbols indicate the cases of significant differences between the groups, estimated by a priori contrasts (* – р < 0.05, ** – p < 0.01).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Анализ реактивности мю-ритма ЭЭГ при наблюдении и выполнении действий у детей раннего возраста выявил значимое падение мощности данного ритма в ситуациях наблюдение за мнимым и реальным действием и при выполнении ребенком самостоятельного действия относительно ситуации УЗВ. Полученные данные по особенностям десинхронизации мю-ритма при выполнении действия и наблюдения за действием согласуются с результатами исследований других авторов [см. обзор Marshall, Meltzoff, 2011; Saby et al., 2013; Cannon et al., 2016; Filippi et al., 2016]. Как и в нашем исследовании, в ряде работ анализу подвергается ЭЭГ в частотной полосе мю-ритма не только в центральных, но и в лобных и теменных отведениях [Warreyn et al., 2013, Bowman et al., 2017; Upshaw, 2016]. Так, в работе с участием детей в возрасте 1.5–2.5 лет [Warreyn et al., 2013] при выполнении и наблюдении действий выявлена десинхронизация ритма ЭЭГ в лобных, центральных и теменных отведениях, максимально выраженная в частотном диапазоне 5.37–9.77 Гц, и доказано, что данный ритм по своим функциональным характеристикам не аналогичен затылочному альфа-ритму, а представляет собой мю-ритм.
В нашем исследовании мы использовали дополнительную экспериментальную ситуацию “наблюдение мнимого действия”. В этом случае ребенок наблюдал движение руки экспериментатора, которое было подобным движению в ситуации “наблюдение реального действия”, но без наличия игрушечной машинки. Мы считаем, что ребенок не мог понять цели этого действия. Анализ десинхронизации мю-ритма в этих двух ситуациях наблюдения позволяет, на наш взгляд, определить, связан ли мю-ритм с пониманием действия ребенком, или десинхронизация данного ритма связана с восприятием движений руки. На сегодняшний день существует некоторое противоречие в этом вопросе. Так, в исследованиях V. Southgate и соавт. [Southgate et al., 2010] показана большая десинхронизация мю-ритма при наблюдении за целенаправленным действием, поэтому авторы данных исследований приходят к выводу, что мю-ритм кодирует понимание ребенком цели действия. При этом наибольшая десинхронизация мю-ритма была зафиксирована в период времени, когда наблюдаемое действие было явно направлено на цель, но сама цель не была достигнута. Авторы связывают данный феномен со способностью младенцев прогнозировать действия других. J. Sommerville и A. Woodward [Sommerville, Woodward, 2005] обнаружили, что 10-месячные младенцы определяют целенаправленность действий, но только тех, которые ими уже освоены. E. Cannon и соавт. [Cannon et al., 2016] также выявили, что десинхронизация мю-ритма во время наблюдения за хватательными движениями была связана с тем, в какой степени младенцы определяли цель действия и сами могли реализовать хватательные движения. В работе P. Warreyn и соавт. [Warreyn et al., 2013] получены противоположные результаты: показана большая десинхронизация мю-ритма при наблюдении за нецеленаправленным действием. Авторы этого исследования делают вывод, что мю-ритм связан с восприятием самого движения и в меньшей мере отражает намерение действия.
В настоящем исследовании обнаружено, что наблюдение за целенаправленным действием вызывает у детей большую десинхронизацию мю-ритма по сравнению с ситуацией наблюдения мнимого действия. Таким образом, полученные результаты подтверждают гипотезу о том, что изменения мю-ритма отражают активность нейронных сетей, обеспечивающих понимание намерений и действий окружающих.
Следует отметить, что наблюдение за реальным действием вызывает бо́льшую десинхронизацию мю-ритма по сравнению с ситуацией наблюдения за мнимым действием в медианном лобном и медианном париетальном локусах. Мы считаем, что такая десинхронизация мю-ритма в лобном и теменном отведениях может отражать как активацию процессов внимания, так и вовлечение СЗН, которые локализованы в указанных корковых регионах [Лебедева и др., 2018].
Следующим этапом нашего исследования был анализ реактивности мю-ритма у детей с разным уровнем развития рецептивной речи. Нами установлено, что у детей с высоким уровнем развития рецептивной речи наблюдается бо́льшее падение мощности мю-ритма в ситуации наблюдения за реальным действием по сравнению с группой детей, имеющих лишь средний уровень развития рецептивной речи.
В ряде исследований, выполненных с участием взрослых испытуемых, показано, что сенсомоторная система участвует в обработке речевой информации [Buccino et al., 2005; Hauk et al., 2004; Mollo et al., 2016; Moreno et al., 2013]. В частности, была выявлена сходная ЭЭГ-активность как во время выполнения и наблюдения действий, так и при прослушивании глаголов-действий [Moreno et al., 2013]. В то же время в гораздо меньшей степени изучена взаимосвязь между активацией сенсомоторных нейронных систем и восприятием речи у детей раннего возраста. Этой проблеме посвящены лишь единичные противоречивые исследования. Так, в исследовании P. Warreyn и соавт. [Warreyn et al., 2013] не было выявлено связи между десинхронизацией мю-ритма и языковыми навыками ребенка. Другие исследователи [Antognini, Daum, 2017] показали значительное подавление мю-ритма во время наблюдения за действиями и восприятии соответствующих глаголов действия у ребенка в возрасте 18 и 24 мес. Авторы делают предположение о том, что сенсомоторная система участвует в обработке разномодальной информации (речевой и моторной).
В настоящем исследовании впервые показаны различия в уровне десинхронизации мю-ритма во время наблюдения за действием и его выполнением у детей с разным уровнем развития рецептивной речи. Результаты нашей работы позволяют предположить, что уровень развития сенсомоторной системы (отражающийся в уровне десинхронизации мю-ритма при наблюдении за действием) определяет уровень развития рецептивной речи ребенка. О том, что развитие сенсомоторной системы является первичным по отношению к становлению речи, могут свидетельствовать результаты следующих исследований. В шесть месяцев, т.е. в доречевой период развития, ребенок уже воспринимает определенные движения как действия, направленные на достижение целей [Biro, Leslie, 2007; Daum et al., 2009; Luo, Johnson, 2009]. При этом ряд исследований убедительно доказывают, что понимание действий и их целей в этом периоде развития ребенка связано с активностью сенсомоторной системы ребенка [Marshall et al., 2011; Nyström et al., 2011; Southgate et al., 2009].
В своей обзорной работе G. Rizzolatti и C. Sinigaglia [Rizzolatti, Sinigaglia, 2010] пришли к выводу о том, что СЗН позволяет понять конкретные цели действия и эмоции других людей. Однако это не значит, что “зеркальной” обработки действий достаточно для их полного понимания. Такое понимание действий, эмоций или состояния другого является многоуровневым процессом. Первый уровень включает в себя определение того, какой результат является целью наблюдаемого действия и какие эмоции или эмоциональные состояния переживают другие люди. Последующие уровни могут включать в себя представление о широком круге психических состояний других (например, убеждений, желаний, намерений и т.д.). Осознание психических состояний других активирует предполагаемую “сеть чтения мыслей” (“mind-reading network”), которая включает в себя префронтальную кору, переднюю поясную извилину и височно-теменной узел [см. обзор Khalil et al., 2018]. Поэтому те дети-участники нашего исследования, которые демонстрировали бо́льшую десинхронизацию мю-ритма и имели более высокий уровень активации СЗН, могли лучше понимать намерения и цели действий окружающих. У таких детей лучше развито общее пространство действий со взрослыми и эффективнее протекают процессы обучения, что и обеспечивает более высокий уровень понимания речи.
Настоящее исследование в определенной мере расширяет наше понимание роли сенсомоторной системы в обеспечении речевого развития ребенка. Мы также считаем, что полученные данные, отражающие особенности реактивности мю-ритма у детей раннего возраста, могут быть использованы в сеансах биологической обратной связи, в том числе с экзоскелетом руки, управляемым по параметрам мю-ритма ЭЭГ. Логично предположить, что применение таких сеансов будет способствовать улучшению моторного и одновременно речевого развития ребенка.
ВЫВОДЫ
1. У детей раннего возраста в условиях наблюдения мнимого действия, реального действия и при выполнении ребенком самостоятельного действия выявлена десинхронизация мощности ЭЭГ в диапазоне мю-ритма в центральных, фронтальных и теменных отведениях.
2. Условие наблюдения реального действия по сравнению с условием наблюдения мнимого действия сопровождается в медианных фронтальном (Fz) и париетальном (Pz) локусах значимо бо́льшей десинхронизацией мощности ЭЭГ в диапазоне мю-ритма.
3. Дети с высоким уровнем понимания речи демонстрируют бо́льшую десинхронизацию мощности ЭЭГ в диапазоне мю-ритма в условиях наблюдения реального действия в лобном (F3) и теменном (P3) локусах левого полушария по сравнению с детьми со средним уровнем понимания речи. Таким образом, высокий уровень активации СЗН у детей раннего возраста благоприятствует развитию понимания речи.
Исследования выполнены с использованием оборудования ЦКП “Экспериментальная физиология и биофизика” КФУ им. В.И. Вернадского и при финансовой поддержке Министерства науки и высшего образования Российской Федерации (Уникальный идентификатор проекта RFMEFI60519X0186).
Список литературы
Ермолина Н.И. Особенности развития некоторых высших психических функций у детей раннего возраста в современных условиях. Наука о человеке: гуманитарные исследования. 2010. 5: 134–140.
Кайда А.И., Махин С.А., Эйсмонт Е.В., Павленко В.Б. Возрастная динамика и топография реактивности индивидуального мю-ритма ЭЭГ у детей 4–14 лет. Вестник Томского государственного университета. Биология. 2019. 45: 106–127.
Керечанин Я.В., Гусек Д., Бобров П.Д., Федотова И.Р., Фролов А.А. Источники электрической активности областей мозга, вовлеченных в воображение движений. Журнал высшей нервной деятельности им. И.П. Павлова. 2019. 69 (6): 711–725.
Лебедева Н.Н., Зуфман А.И., Мальцев В.Ю. Система зеркальных нейронов мозга: ключ к обучению, формированию личности и пониманию чужого сознания. Успехи физиологических наук. 2017. 48 (4): 16–28.
Лебедева Н.Н., Каримова Е.Д., Карпычев В.В., Мальцев В.Ю. Зеркальная система мозга при наблюдении, выполнении и представлении моторных задач – нейрофизиологическое отражение восприятия чужого сознания. Журнал высшей нервной деятельности им. И.П. Павлова. 2018. 68 (2): 204–215.
Рамачандран В.С. Мозг рассказывает: Что делает нас людьми. М.: Карьера Пресс, 2017. 422 с.
Antognini K., Daum M. Toddlers show sensorimotor activity during auditory verb processing. Neuropsychologia. 2017. https://doi.org/10.1016/j.neuropsychologia.2017.07.022
Avanzini P., Fabbri-Destro M., Dalla Volta R., Daprati E., Rizzolatti G., Cantalupo G. The dynamics of sensorimotor cortical oscillations during the observation of hand movements: an EEG study. PLoS One. 2012. 7 (5): e37534.
Bayley N. Bayley scales of infant and toddler development, Third edition, San Antonio, TX: Harcourt Assessment. 2006.
Biro S., Leslie A.M. Infants’ perception of goal-directed actions: Development 4 through cue-based bootstrapping. Developmental Science. 2007. 10 (3): 379–398.
Bowman L.C., Thorpe S.G., Cannon E.N., Fox N.A. Action mechanisms for social cognition: behavioral and neural correlates of developing Theory of Mind. Dev. Sci. 2017. 20 (5). https://doi.org/10.1111/desc.12447
Buccino G. Neural circuits underlying imitation learning of hand actions: an event-related fMRI study. Neuron. 2004. 42 (2): 323–334.
Buccino G., Riggio L., Melli G., Binkofski F., Gallese V., Rizzolatti G. Listening to action-related sentences modulates the activity of the motor system: A combined TMS and behavioral study. Cognitive Brain Research. 2005. 24 (3): 355–363.
Cannon E.N., Simpson E.A., Fox N.A., Vanderwert R.E., Woodward A.L., Ferrari P.F. Relations between infants' emerging reach-grasp competence and event-related desynchronization in EEG. Dev. Sci. 2016. 19: 50–62.
Daum M.M., Prinz W., Aschersleben G. Means-end behavior in young infants: The interplay of action perception and action production. Infancy. 2009. 14 (6): 613–640.
Debnath R., Salo V.C., Buzzell G.A., Yoo K.H., Fox N.A. Mu rhythm desynchronization is specific to action execution and observation: Evidence from time-frequency and connectivity analysis. NeuroImage. 2019. 184: 496–507.
Filippi C., Cannon E.N., Fox N., Thorpe S., Ferrari P.F., Woodward A. Motor system activation predicts goal imitation in 7-month-old infants. Psychol. Sci. 2016. 27 (5): 675–684.
Fox N.A., Bakermans-Kranenburg M.J., Yoo K.H., Bowman L.C., Cannon E.N., Vanderwert R.E., Ferrari P.F., van IJzendoorn M.H. Assessing human mirror activity with EEG mu rhythm: A meta-analysis. Psychol. Bull. 2016. 142 (3): 291–313.
Hauk O., Johnsrude I., Pulvermüller F. Somatotopic representation of action words in human motor and premotor cortex. Neuron. 2004. 41 (2): 301–307.
Iacoboni M. Imitation, empathy, and mirror neurons. Annual Review of Psychology. 2009. 60 (1): 653–670.
Jeon H., Lee S.H. From neurons to social beings: short review of the mirror neuron system research and its socio-psychological and psychiatric implications. Clin. Psychopharmacol. and Neurosci. 2018. 16 (1): 18–31.
Keysers C., Gazzola V. Integrating simulation and theory of mind: from self to social cognition. Trends in Cognitive Sciences. 2007. 11 (5): 194–196.
Khalil R., Tindle R., Boraud T., Moustafa A.A., Karim A.A. Social decision making in autism: On the impact of mirror neurons, motor control, and imitative behaviors. CNS Neurosci. Ther. 2018. 24: 669–676.
Liao Y., Acar Z.A., Makeig S., Deak G. EEG imaging of toddlers during dyadic turn-taking: Mu-rhythm modulation while producing or observing social actions. NeuroImage. 2015. 112: 52–60.
Luo Y., Johnson S.C. Recognizing the role of perception in action at 6 months. Developmental Science. 2009. 12 (1): 142–149.
Marshall P.J., Meltzoff A.N. Neural mirroring systems: Exploring the EEG mu rhythm in human infancy. Developmental Cognitive Neuroscience. 2011. 1: 110–123.
Marshall P.J., Young T., Meltzoff A.N. Neural correlates of action observation and execution in 14-month-old infants: An event-related EEG desynchronization study. Developmental Science. 2011. 14 (3): 474–480.
Mollo G., Pulvermüller F., Hauk O. Movement priming of EEG/MEG brain responses for action-words characterizes the link between language and action. Cortex. 2016. 74: 262–276.
Moreno I., de Vega M., Leon I. Understanding action language modulates oscillatory mu and beta rhythms in the same way as observing actions. Brain and Cognition. 2013. 82 (3): 236–242.
Nyström P., Ljunghammar T., Rosander K., von Hofsten C. Using mu rhythm desynchronization to measure mirror neuron activity in infants. Developmental Science. 2011. 14: 327–335.
Reid V.M., Striano T., Iacoboni M. Neural correlates of dyadic interaction during infancy. Developmental Cognitive Neuroscience. 2011. 1: 124–130.
Rizzolatti G., Fogassi L., Gallese V. Neurophysiological mechanisms underlying the understanding and imitation of action. Nature Reviews Neuroscience. 2001. 2 (9): 661–670.
Rizzolatti G., Sinigaglia C. The functional role of the parieto-frontal mirror circuit: interpretations and misinterpretations. Nat. Rev. Neurosci. 2010. 11: 264–274.
Saby J.N., Meltzoff A.N., Marshall P.J. Infants’ somatotopic neural responses to seeing human actions: I’ve got you under my skin. PLoS One. 2013. 8 (10): e77905.
Sommerville J.A., Woodward A.L. Infants’ sensitivity to the causal features of means–end support sequences in action and perception. Infancy. 2005. 8: 119–145.
Southgate V., Johnson M.H., El Karoui I., Csibra G. Motor system activation reveals infants’ on-line prediction of others’ goals. Psychological Science. 2010. 21: 355–359.
Southgate V., Johnson M.H., Osborne T., Csibra G. Predictive motor activation during action observation in human infants. Biology Letters. 2009. 5 (6): 769–772.
Stapel J.C., Hunnius S., van Elk M., Bekkering H. Motor activation during observation of unusual versus ordinary actions in infancy. Social Neuroscience. 2010. 5: 451–460.
Thorpe S.G., Cannon E.N., Fox N.A. Spectral and source structural development of mu and alpha rhythms from infancy through adulthood. Clin. Neurophysiol. 2016. 127 (1): 254–269.
Upshaw M.B., Bernier R.A., Sommerville J.A. Infants’ grip strength predicts mu rhythm attenuation during observation of lifting actions with weighted blocks. Developmental Science. 2016. 19 (2): 195–207.
Warreyn P., Ruysschaert L., Wiersema R., Handl A., Pattyn G., Roeyers H. Infants’ mu suppression during the observation of real and mimicked goal-directed actions. Developmental Science. 2013. 16 (2): 173–185.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


