Журнал высшей нервной деятельности им. И.П. Павлова, 2020, T. 70, № 3, стр. 314-325
ФУНКЦИИ ГИППОКАМПАЛЬНОГО ТЕТА-РИТМА
И. Е. Мысин *
Институт теоретической и экспериментальной биофизики РАН
Пущино, Россия
* E-mail: imysin@mail.ru
Поступила в редакцию 02.09.2019
После доработки 17.11.2019
Принята к публикации 16.12.2019
Аннотация
Тета-ритм (4–12 Гц) – главный ритм гиппокампа, в отличие от других ритмов он имеет свой пейсмекер (медиальную септальную область) и физиологические механизмы регуляции. Состояние генерации тета-ритма критически необходимо для обработки новой информации, поступающей в гиппокамп. В этом обзоре мы постарались описать современные представления о том, как именно синхронизация нейронной сети гиппокампа на тета-частоте участвует в когнитивных процессах.
Гиппокамп вовлечен во множество когнитивных функций, таких как детекция новизны, внимание, декларативная (в том числе эпизодическая) и пространственная память [Buzsáki, Moser, 2013; Vinogradova, 1995; Vinogradova, 2001]. Тета-ритм является неизменным спутником процессов внимания и памяти, связанных с гиппокампом [Buzsáki, 2002; Buzsáki, Moser, 2013; Vinogradova, 1995; Vinogradova, 2001].
Тета-ритм как колебания локального полевого потенциала в гиппокампе был впервые описан в экспериментах на кроликах еще в 1938 г. [Jung, Kornmüller, 1938]. Однако систематические исследования тета-ритма начались лишь в 50-е годы, и уже первые работы показали корреляцию возникновения тета-ритма и исследовательской активности животного [Grastyan et al., 1959; Green, Arduini, 1954]. На сегодняшний момент корреляция возникновения тета-ритма и процессов обучения показана не только у грызунов, мышей и крыс, но и у множества других млекопитающих, в частности летучих мышей [Ulanovsky, Moss, 2007], кошек [Gołebiewski et al., 2006], собак [Preobrazhenskaya, 1991] и человека [Burgess, Gruzelier, 1997; Doppelmayr et al., 1998; Grunwald et al., 2001; Klimesch et al., 2001; Sarnthein et al., 1998; Tesche, Karhu, 2000]. При этом параметры тета-ритма у человека и у грызунов в значительной степени совпадают, например взаимосвязь тета-ритма с другими ритмами гиппокампа [Chaieb et al., 2015] или соотношение тета-ритма в разных частях гиппокампа [Zhang, Jacobs, 2015]. Это позволяет говорить о схожести механизмов генерации тета-ритма у животных и человека.
В 60-е годы стало понятно, что тета-ритм в гиппокампе не обнаруживается при нарушении связи от медиальной септальной области (МСО) – небольшого ядра переднебазального мозга. Хирургическое удаление или фармакологическая инактивация активности в МСО нарушает гиппокампальный тета-ритм [Green, Arduini, 1954; Mitchell et al., 1982; Mizumori et al., 1990; Petsche, Stumpf, 1962; Wang et al., 2015], в то время как электрическая, фармакологическая или оптогенетическая стимуляция МСО вызывают и усиливают его [Lee et al., 2017; Robinson et al., 2016; Sweet et al., 2014; Zutshi et al., 2018]. Дальнейшие многочисленные исследования обнаружили, что тета-ритмическая активность возникает в МСО, а затем передается в гиппокамп [Brazhnik, 2004; Vinogradova, 1995]. Однако тета-ритм как колебания полевого потенциала возникает именно в гиппокампе, поскольку он имеет упорядоченную структуру апикальных дендритов пирамидных клеток [Buzsáki et. al., 2012; Chizhov et al., 2015]. Исходя из вышеизложенного в литературе часто встречается разделение определений, МСО называют пейсмекером тета-ритма, а гиппокамп – генератором. Далее в этой статье мы сосредоточимся на процессах, происходящих в гиппокампе и функциях тета-ритма.
Подавляющее большинство теоретических концепций об участии тета-ритма в обработке информации основываются на двух экспериментальных фактах. Во-первых, все области гиппокампальной формации (включая сам гиппокамп, субикулярный комплекс и энторинальную кору) генерируют тета-ритм, при этом наблюдается высокая когерентность между всеми точками регистрации [Kocsis et al., 1999; Mizuseki et al., 2009]. Во-вторых, все нейронные популяции гиппокампальной формации в большей или меньшей степени проявляют привязку своей активности к фазе тета-ритма, иными словами, они генерируют потенциалы действия преимущественно в определенной фазе тета-цикла, например, пирамидные и OLM нейроны имеют пик разрядов на минимуме тета-цикла, а парвальбумин-содержащие интернейроны преимущественно дают разряды на нисходящей фазе тета-ритма [Klausberger et al., 2003; Mizuseki et al., 2009; Somogyi et al., 2014].
Теоретические концепции, основанные на этих фактах, можно условно разделить на две большие группы. Первые предполагают, что тета-ритм каким-то образом организует работу гиппокампальной нейронной сети, когерентность между отделами гиппокампальной формации рассматривается как подтверждение того факта, что между ними происходит передача информации [Fries, 2005]. Другая группа теоретических идей рассматривает привязку активности нейронов к фазе тета-ритма как отражение синхронизации нейронов, необходимую для процессов синаптической пластичности, лежащих в основе процессов памяти [Bi, Poo, 1999; Feldman, 2012]. Далее мы более подробно рассмотрим эти теоретические идеи.
ТЕТА-РИТМ И ФОРМИРОВАНИЕ НЕЙРОННЫХ АНСАМБЛЕЙ
Современные теории о механизмах памяти, формирующейся с участием гиппокампа, берут свое начало в 70-х годах ХХ века, когда были открыты так называемые “клетки места” – нейроны, генерирующие потенциалы действия, когда животное находилось в определенном месте пространства [O’Keefe, 1976]. Эффект клеток места быстро привлек внимание многих ученых. Было показано, что от 30% до 50% пирамидных клеток в поле CA1 являются клетками места со специфическими полями места [Mizuseki et al., 2012]. В поле СА3 (и даже в энторинальной коре) клетки места также присутствуют, хотя и в меньшем количестве, чем в СА1. При помещении животного в новую обстановку клетки места быстро (в течение нескольких минут) перестраиваются на новые поля места, которые затем остаются устойчивыми в заданной обстановке [Jeffery, 2011]. При незначительном изменении окружающей обстановки клетки места сохраняют свои поля места, хотя могут до некоторой степени изменять свою активность [Moser et al., 2015].
Топографические свойства пространства не отражаются в формируемых полях места, т.е. клетки места с близкими полями места могут располагаться в далеких друг от друга участках гиппокампа. Каждое место кодируется популяцией клеток, которые активируются одновременно при попадании крысы в данное место [O’Keefe, 1976].
Другой важнейшей вехой в исследовании памяти стало открытие синаптической пластичности в форме долговременной потенциации и долговременной депрессии в гиппокампе, когда при высокочастотной тетанизации коллатералей Шаффера происходит усиление ответов на последующие одиночные стимулы, а при низкочастотной стимуляции (от 1 до 15 импульсов в с.), до наоборот, происходит угашение полевых ответов на последующие стимуляции [Alger, Teyler, 1976]. На сегодняшний день синаптическую пластичность рассматривают как молекулярный механизм памяти. Дальнейшие исследования показали, что для возникновения пластичности необходимо относительное совпадение во времени возникновения потенциала действия на пре- и постсинатическом нейронах, описанное в литературе как функция STDP (spike-timing dependent plasticity, пластичность, зависимая от времени между импульсами) [Bi, Poo, 1998; Feldman, 2012; Markram et al., 1997]. Для гиппокампа и неокортекса оказалось, что условием потенциации являются последовательные разряды на пресинаптическом, а затем, с задержкой до 30 мс, на постсинаптическом нейроне.
После открытия клеток места, синаптической пластичности и тета-ритма стало понятно, что все эти явления тесно взаимосвязаны. Один из неожиданных и интересных феноменов был обнаружен при исследовании активности клеток места в 90-е годы ХХ века. Этот феномен называется фазовой прецессией [O’Keefe, Recce, 1993; Skaggs et al., 1996]. Рецептивные поля различных клеток места в СА1 и СА3 могут в большей или меньшей степени пересекаться. Оказалось, что в момент генерации клеткой места импульса он привязан по времени к фазе тета-ритма и зависит от положения животного относительно центра поля места. При перемещении животного от одного края поля места к другому краю клетка этого места разряжается на разных фазах тета-ритма в последовательности тета-циклов, немного опережая тета-ритм. Предполагается, что такая временнáя организация активности клеток места необходима для создания или усиления нужных связей между клетками места в процессе обучения ориентации в пространстве. Благодаря синаптической пластичности, связи между клетками места в СА3 и СА1, которые разряжаются последовательно с короткой временной задержкой, усиливаются. Это дает возможность животному запоминать и вспоминать последовательность перемещений. Кроме того, синхронное срабатывание клеток места в СА3 и СА1, имеющих одинаковые рецептивные поля и связанных коллатералями Шаффера, должно приводить к усилению связи между этими нейронами и координации их активности. Все это создает условия для кодирования траекторий движения и формирования пространственной памяти [Foster, Wilson, 2007].
В начале ХХ века в гиппокампе были открыты клетки времени [Eichenbaum, 2014], нейроны, которые разряжаются в определенные фазы действия животного, например, отмечают начало, середину и конец какого-либо поведенческого акта. При этом было показано, что одни и те же нейроны могут быть как клетками места, так и клетками времени [Eichenbaum, 2014; Wang et al., 2015]. С учетом характера синаптической пластичности в гиппокампе и фактов о клетках места и времени в литературе сложилось мнение, что главная функция гиппокампа – это запоминание последовательностей [Mehta, 2015].
Идея о запоминании последовательностей получила развитие в аттракторной теории, которая на сегодняшний день является доминирующей для описания когнитивных процессов, происходящих в гиппокампе. Существует большое разнообразие аттракторных моделей, предложенных различными авторами [Jeffery, 2011]. Основой аттракторных моделей служит предположение о существовании непрерывных аттракторов. Под аттракторами понимаются устойчивые состояния нейронной сети, другими словами, состояния, в которых при отсутствии внешних стимулов в течение длительного времени активными остаются одни и те же нейроны. Непрерывность аттракторов подразумевает, что между близкими аттракторами возможны переходы, которые могут происходить либо с течением времени, либо под действием внешних стимулов. В свою очередь близость аттракторных состояний подразумевает то, что они кодируют близкие объекты, например, соседние места в лабиринте. Иными словами, активность аттрактора, кодирующего клетки места, может переходить на аттракторы, кодирующие соседние места, но не далекие локации в лабиринте. Как правило, предполагается, что пирамидные нейроны внутри одного аттрактора связаны сильными связями, при этом сила связей с нейронами из других аттракторов падает в зависимости от степени удаленности аттракторов (рис. 1). Также часто предполагается, что интернейроны принимают участие в формировании аттракторных состояний, а именно интернейроны имеют противоположную схему связей, т.е. сильно тормозят пирамидные нейроны далеких аттракторов и слабо близких. Это приводит к выделению активности только одного аттрактора и подавлению активности других пирамидных нейронов, не кодирующих данное место. В математических моделях показано, что “аттракторная” схема связей возникает в ходе обучения сети по правилу STDP в результате нескольких повторений одной и той же последовательности входов [D’Albis et al., 2015; Yoshida, Hayashi, 2007].
Рис. 1.
Типичная схема связей нейронов в аттракторных моделях гиппокампа и энторинальной коры. Близкие в функциональном смысле пирамидные нейроны связаны сильными связями между собой и с тормозными нейронами. Интернейроны, наоборот, сильно тормозят далекие пирамиды. На сегодняшний день предложено огромное количество аттракторных моделей. Некоторые авторы использую приведенную схему связей, например [Fuhs, Touretzky, 2006]. В моделях аттакторных состояний в гиппокампе авторы часто используют только возбуждение близких нейронов, схема тормозных связей при этом не упорядочена по состояниям [Ponulak, Hopfield, 2013; Solovyeva et al., 2015; Wang et al., 2015]. Иногда, наоборот, предполагается только упорядоченная схема тормозных связей, однако это делается в основном в моделях энторинальной коры [Burak, Fiete, 2009; Couey et al., 2013].
Fig. 1. A typical pattern of neuronal connections in attractor models of the hippocampus and entorhinal cortex. Close functional pyramidal neurons are connected by strong synapses among themselves and with inhibitory neurons. Interneurons strongly inhibit neurons, on the contrary, the distant pyramids. To date, a huge number of attractor models have been proposed. Some authors use the given scheme of relations, for example [Fuchs, Touretzky, 2006]. In models of attractor states in the hippocampus, the authors often use only the excitation of close neurons, the scheme of inhibitory connections is not ordered by states [Ponulak, Hopfield, 2013; Solovyeva et al., 2015; Wang et al., 2015]. Sometimes, on the contrary, only an ordered scheme of inhibitory connections is assumed, but this is done mainly in models of the entorhinal cortex [Burak, Fiete, 2009; Couey et al., 2013].
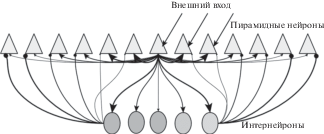
Аттракторная теория объясняет эффект клеток места следующим образом. В каждый момент времени в аттракторной сети есть активные нейроны, которые кодируют текущее положение. Перемещение активности в другой аттрактор кодирует перемещение животного в пространстве. Поскольку животное перемещается между близкими местами, то нейронная активность перемещается между соседними аттракторами.
Многие исследования демонстрируют важную роль тета-ритма в формировании аттракторных состояний и запоминании последовательностей. Например, фармакологическая блокада тета-ритма путем введения ГАМКергического агониста мусцимола в МСО нарушает формирование клеток места, делая неустойчивыми их поля места [Wang et al., 2015]. Кроме этого, в многочисленных экспериментах in vivo и in vitro было показано, что стимуляция различных структур гиппокампа на тета-частоте может вызывать долговременную потенциацию (обзор [Wójtowicz, Mozrzymas, 2015]).
Главным механизмом участия тета-ритма в усилении синаптической пластичности рассматривается синхронизация нейронов [Wójtowicz, Mozrzymas, 2015]. Исходя из теории о роли пластичности, зависящей от времени между импульсами (STDP), для обеспечения пластичности необходимо одновременное срабатывание пресинаптического и постсинаптического нейрона в интервале около 30 мс. При отсутствии внешней синхронизации вероятность случайного совпадения этих событий чрезвычайно мала.
В энторинальной коре также обнаружены пространственно зависимые нейроны – это клетки решетки, клетки границ и клетки поворота головы [Hartley et al., 2014]. Значительная часть исследований сосредоточена на клетках решетки. Клетки решетки были впервые обнаружены во II и III слоях медиальной энторинальной коры крыс [Hafting et al., 2005]. Активность этих нейронов обусловлена пространственным положением животного, а именно, эти нейроны генерируют импульсы, когда животное находится в узлах гексагональной решетки. Клетки решетки, как и клетки места, проявляют свойство фазовой прецессии относительно тета-ритма [Jeewajee et al., 2014]. Одним из теоретических направлений, объясняющих эффект клеток решетки, также являются аттракторные модели. Идеи, заложенные в эти модели, очень похожи на те, что мы описывали раньше для клеток места, с той разницей, что для клеток места функцией близости между аттракторными состояниями было расстояние между местами, а для клеток решетки функцией близости является расположение животного относительно центра ячейки [Burak, 2014; Hasselmo, Brandon, 2012; Si et al., 2014]. Предполагается, что роль тета-ритма также заключается в стабилизации аттракторных состояний. Другая гипотеза состоит в том, что при перемещении животного в пространстве тета-ритм необходим для того, чтобы “погасить” предыдущий аттрактор. Поскольку пирамидные нейроны гиппокампа модулируются тета-ритмом, а их активность меняется с периодом тета-ритма, то периодическое затухание их активности может быть необходимо для возможности активации соседнего аттракторного состояния [Stella, Treves, 2011]. При этом зависимость частоты тета-ритма от скорости движения животного рассматривается как доказательство этой гипотезы, так как чем быстрее движется животное, тем быстрее необходимо “гасить” предыдущий аттрактор.
В заключение данного раздела стоит заметить, что прямая регистрация эффекта STDP проводилась только при внутриклеточной регистрации двух нейронов на срезах или культурах нейронов. Исходя из этого многие авторы высказывают критику самого эффекта STDP. Есть множество данных, указывающих влияние дофамина и ацетилхолина. В частности показано, что выброс дофамина в гиппокампе необходим для фиксации пластичности, без активации дофаминергических рецепторов пластические изменения со временем угасают [Lisman et al., 2011]). Более того, при активации дофаминергических рецепторов становится неважна последовательность, в какой активировались нейроны, в любом случае наблюдается потенциация [Lisman et al., 2011]. Дальнейшие исследования показали, что при активации мускариновых рецепторов и отсутствии активации дофаминергических рецепторов происходит обратный эффект, всегда наблюдается синаптическая депрессия [Brzosko et al., 2017]. В последнее время появились данные по регистрации внутриклеточной активности, полученные in vivo. Эти данные показывают, что синхронизированность нейронной активности в СА3 и СА1 может составлять до 3 сек, чтобы наблюдалась пластичность [Bittner et al., 2017]. Тем не менее, несмотря на разнообразие вариантов пластичности, большинство данных указывают на необходимость совпадения моментов возникновения потенциалов действия на пресинаптическом и постсинаптическом нейроне, что может обеспечиваться тета-ритмом.
ТЕТА-РИТМ И УПОРЯДОЧЕННАЯ АКТИВНОСТЬ НЕЙРОННЫХ АНСАМБЛЕЙ
В этом разделе мы рассмотрим теоретические идеи, рассматривающие тета-ритм как процесс, упорядочивающий нейронную активность, которая в свою очередь необходима для обработки информации. Эта группа идей очень разнородна, далее мы опишем несколько наиболее цитируемых.
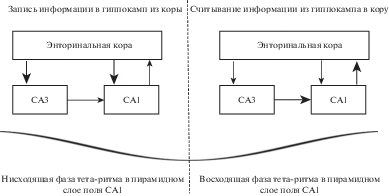
Интересно предположение, что на разных фазах тета-ритма выполняются разные функции в поле СА1 [Cutsuridis et al., 2010; Cutsuridis, Poirazi, 2015; Hasselmo et al., 2002; Manns et al., 2007]. Эта гипотеза основывается на том, что поле СА1 получает два информационных потока: от СА3 по коллатералям Шаффера и из энторинальной коры по перфорирующему пути. Сигнал по этим двум входам приходит в разные фазы тета-ритма [Mizuseki et al., 2009; Montgomery et al., 2009]. Авторы предполагают, что на минимуме тета-волны наибольший вход приходит от энторинальной коры, и нейронная сеть СА1 работает в режиме “записи” (рис. 2). На пике тета-волны наибольший вход приходит от поля СА3, при этом поле СА1 воспроизводит запомненную информацию. Следует заметить, что принципиальные нейроны третьего слоя энторинальной коры разряжаются на пике тета-ритма в пирамидном слое поля СА1, однако сигнал передается с большой задержкой в 70–80 мс и приходит около минимума тета-ритма в СА1 [Mizuseki et al., 2009].
Рис. 2.
Гипотетическая схема потоков информации на нисходящей и восходящей фазе тета-ритма [Cutsuridis et al., 2010; Cutsuridis, Poirazi, 2015; Hasselmo et al., 2002; Manns et al., 2007].
Fig. 2. Hypothetical scheme of information flows in the descending and ascending phases of theta rhythm [Cutsuridis et al., 2010; Cutsuridis, Poirazi, 2015; Hasselmo et al., 2002; Manns et al., 2007].
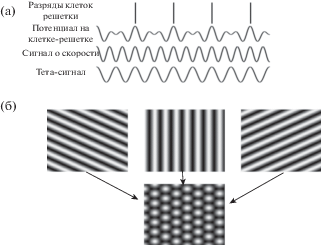
Кроме аттракторных теорий, существует другое популярное направление, объясняющее возникновение клеток решетки, которое называется осцилляторно-интерференционные модели [Burgess, Burgess, 2014; Burgess, 2008; Burgess et al., 2007; Bush, Burgess, 2014; Jeewajee et al., 2008; Jeewajee et al., 2014]. Эти модели основаны на предположении о существовании контролируемых скоростью осцилляторов (КСО) (velocity-controlled oscillators, VCO в терминологии авторов). КСО – это клеточные популяции, которые продуцируют ритмический сигнал, частота которого пропорциональна проекции скорости движения животного на предпочтительное направление осциллятора (рис. 3). В модели эти направления имеют дискретные значения с шагом 60°. Клетки решетки получают возбуждающий вход от КСО, а также возбуждающий ритмический вход со стабильной частотой в диапазоне тета-ритма. Сигналы о скорости животного в различных направлениях интерферируют на клетках решетки. К достоинствам данной модели можно отнести тот факт, что фазовая прецессия возникает в модели без каких-либо дополнительных условий. Таким образом, в данных моделях авторы рассматривают тета-ритм как своеобразный стандартный сигнал, относительно которого вычисляется положение животного внутри границ ячейки сетки с помощью информации о скорости и направлении движения животного.
Рис. 3.
Осцилляторно-интерференционная модель клеток решеток. (а) Схема формирования клеток решеток в линейном лабиринте. Клетки решетки суммируют тета-сигнал из МСО и сигнал, частота которого пропорциональна скорости. (б) Схема формирования клеток решеток в открытом поле. На верхних графиках показана активность контролируемых скоростью осцилляторов, частота каждого осциллятора пропорциональна проекции скорости животного на ось данного осциллятора [Burgess, Burgess, 2014; Burgess, 2008; Burgess, Barry, O’Keefe, 2007; Bush, Burgess, 2014; Jeewajee et al., 2008; Jeewajee et al., 2014].
Fig. 3. Oscillatory-interference model of grid cells. (а) Scheme of formation of grid cells in a linear maze. The grid cells summarize the theta signal from the medial septum and the signal whose frequency is proportional to the velocity. (б) Scheme of formation of grid cells in an open field. The upper plots show the activity of velocity-controlled oscillators, the frequency of each oscillator is proportional to the projection of the animal’s speed on the axis of the oscillator [Burgess, Burgess, 2014; Burgess, 2008; Burgess et al., 2007; Bush, Burgess, 2014; Jeewajee et al., 2008; Jeewajee et al., 2014].
Однако следует заметить, что предположение о тета-ритме как сигнале с постоянной частотой не является истинным. Показано, что частота и мощность тета-ритма коррелируют со скоростью движения животного [Chen et al., 2011; Ledberg, Robbe, 2011; Long et al., 2014]. Основываясь на этих результатах, некоторые авторы выдвигали мнение, что тета-ритм контролирует двигательное поведение [Kelemen et al., 2005; Robinson, Whishaw, 1974; Sinnamon, 2005a; Sinnamon, 2005b; Vanderwolf, 1975]. Подчеркивалось, что тета-осцилляции возникают лишь при целенаправленных, “произвольных” движениях, в противоположность стереотипной, “непроизвольной” активности [Vanderwolf, 1969; Wyble et al., 2004]. Несмотря на то что данное мнение не поддерживается в современной литературе, последние исследования позволяют рассуждать о механизмах этого явления. Было показано, что глутаматергические нейроны МСО за счет входа от глубоких слоев энторинальной коры модулируются скоростью движения животного [Justus et al., 2017]. В другом исследовании in vivo было показано, что частота гиппокампального тета-ритма сильно зависит от частоты оптогенетической стимуляции септальных глутаматергических нейронов [Robinson et al., 2016]. Также продемонстрировано, что инъекция глутаматергических агонистов в МСО увеличивает мощность гиппокампального ритма [Astasheva et al., 2015]. Таким образом, механизм корреляции тета-ритма и скорости движения животного можно объяснить активацией септальных глутаматергических нейронов. В самой работе, где обнаружили зависимость разрядов септальных глутаматергических нейронов от скорости движения, авторы показали, что проекции септальных глутаматергических нейронов в медиальную энторинальную кору играют важную роль в интеграции пути животным [Justus et al., 2017].
Еще одна популярная гипотеза о роли тета-ритма в когнитивных процессах заключается в том, что тета-осцилляции используются для сравнения поступающей сенсорной информации с таковой, уже хранящейся в памяти [Hasselmo, 1999; Lisman, Otmakhova, 2001; Lörincz, Buzsáki, 2000; Pickenhain, Klingberg, 1967; Sokolov, 1963; Vertes et al., 2004]. Наибольшую разработку эта идея получила в работах О.С. Виноградовой [Vinogradova, 1995; Vinogradova, 2001; Виноградова, 1975; Виноградова, Дудаева, 1972]. На основании собственных многолетних исследований Виноградовой была выдвинута теория о гиппокампе как компараторе (детекторе новизны). По мнению Виноградовой, функция сравнения информации, приходящей по сенсорным входам с имеющейся в памяти, выполняется в поле СА3 гиппокампа. Это поле получает информацию из зубчатой фасции и медиальной септальной области. Зубчатая фасция получает сигнал от энторинальной коры по перфорирующему пути, энторинальная кора в свою очередь имеет связи с другими отделами неокортекса. Виноградова считала, что в зубчатую фасцию приходит информация, уже хранящаяся в памяти. В зубчатой фасции она упрощается и уже в предобработаном виде передается в поле СА3. Информация о текущем сенсорном входе идет через стволовые структуры мозга, прежде всего через ядра ретикулярной формации в МСО и далее в поле СА3. В МСО информация также упрощается и подготавливается к сравнению. Далее в поле СА3 происходит проверка на согласованность информации, приходящей от коры и от ствола мозга. В случае расхождения по коллатералям Шаффера в поле СА1 и далее обратно в кору передается сигнал о новизне и о необходимости фиксации новой информации в памяти. В теории Виноградовой МСО рассматривается как синхронизатор при компараторном устройстве, а тета-ритм – как временной фильтр (“окно”), обеспечивающий пропуск на выход гиппокампальных нейронов только тех сигналов, которые приходят в определенном фазовом отношении к тета-волне. Виноградова предполагала, что такое квантование сигналов в виде тета-циклов должно увеличивать надежность работы компараторного устройства, поскольку это позволяет сравнивать сигналы, приходящие по разным входам, которые относятся к одному событию [Vinogradova, 2001]. О.С. Виноградова также уделяла большое внимание явлению сброса (reset) нейронной активности. Это явление заключается в периоде торможения гиппокампальных нейронов (от 50 до 150 мс) после прихода нового стимула, при этом при приходе аналогичных повторных стимулов торможение не наблюдается. После сброса начинается синхронная ритмическая активность. Виноградова полагала, что сброс нейронной активности служит точкой отсчета от момента появления нового стимула и синхронизации нейронов для его обработки [Vinogradova, 2001].
Во многих исследованиях показано, что при поступлении новой информации усиливается когерентность между гиппокампом и отделами коры, ответственными за эпизодическую память и планирование действий, прежде всего дорзолатеральной и медиальной префронтальной корой [Numan, 2015].
ТЕТА-РИТМ И СОН
Существует большое количество работ, показывающих изменения электрофизиологических параметров гиппокампа в различных фазах сна (обзоры [Diekelmann, Born, 2010; Freund, Buzsáki, 1996]). Достаточно давно было установлено, что тета-ритм наиболее сильно выражен в фазе быстрого сна [Jouvet, 1969], и наоборот, в фазе медленного сна тета-ритм в гиппокампе выражен крайне слабо. В фазе медленного сна наблюдается асинхронная активность, которая прерывается периодически возникающими риппл осцилляциями [Buzsáki, 1989; Buzsáki et al., 1992; Carr et al., 2011; Csicsvari et al., 1999; Sullivan et al., 2011]. Существует большое количество данных, указывающих на антагонистический характер этих видов электрической активности [Buzsáki, 2002; Buzsáki, 2015]. Такой физиологический антагонизм проявляется и во сне.
Тета-ритм во время быстрого сна по всем параметрам очень похож на тета-ритм, наблюдаемый в состоянии активного бодрствования. В частности, наблюдаются примерно те же параметры привязки активности нейрональных популяций к фазам тета-ритма [Buzsáki, 2002], сильная связанность тета- и гамма-ритмов [Belluscio et al., 2012], а также распространение тета-ритма по септо-темпоральной оси в виде “бегущей” волны [Patel et al., 2012]. Все это указывает на схожесть механизмов генерации тета-ритма в состоянии активного исследовательского поведения и быстрого сна. Кроме того, в нескольких работах было показано, что клетки места в быстром сне активируются в том же порядке, что и при нахождении бодрствующего животного в лабиринте [Louie, Wilson, 2001; Nádasdy et al., 1999; Skaggs, McNaughton, 1996].
Все эти данные наводят на мысль, что и информационные процессы в состоянии активного бодрствования и быстрого сна очень похожи, и что в состоянии быстрого сна происходит обработка информации. Впервые идея об обработке информации в быстром сне была выдвинута Марром [Marr, 1970]. В теории Марра гиппокамп выполняет роль временного хранилища новой информации, которая не успела обработаться в течение периода бодрствования в неокортексе. В течение сна эта информация повторно воспроизводится и снова передается в неокортекс, где уже осуществляются ее полная обработка и запоминание. Дальнейшие исследования показали важную роль не только быстрого, но и медленного сна в консолидации памяти. Однако на сегодняшний день идеи Марра широко поддерживаются в литературе [Diekelmann, Born, 2010].
ЗАКЛЮЧЕНИЕ
Несмотря на большое количество исследований вопрос о том, как тета-ритм участвует в когнитивных функциях гиппокампа, остается открытым. Ответ на этот вопрос требует ответа на другой связанный вопрос. Какую функцию выполняет сам гиппокамп? Несмотря на огромное количество работ гиппокамп остается одной из самых загадочных структур мозга. С одной стороны, гиппокамп составляет всего около 10% сырой массы мозга у крыс, а количество нейронов в гиппокампе не превышает 0.5% от количества нейронов в новой коре [Herculano-Houzel, 2009; West, Gundersen, 1990]; кроме этого, он имеет относительно простое анатомическое и гистологическое строение по сравнению с новой корой, всего один слой принципиальных нейронов в гиппокампе против шести в неокортексе. С другой стороны, гиппокамп играет критическую роль почти во всех когнитивных процессах, таких как детекция новизны, внимание, пространственная и эпизодическая память и т.д. В гиппокампе можно обнаружить нейроны, реагирующие практически на все виды сенсорных стимулов, такие как зрительные, слуховые, обонятельные и тактильные. У человека в гиппокампе обнаружены нейроны, реагирующие на специфические абстрактные стимулы, например, связанные с образом любимой актрисы или известного политика, так называемые “нейроны бабушки” [Kreiman et al., 2000; Quiroga et al., 2005]. Такое “противоречие” между простой структурой и очевидной сложной функцией требует объяснения. Многие авторы в разных формах высказывают гипотезу, которая могла бы снять это “противоречие”. Гипотеза заключается в следующем. Гиппокамп выполняет одну “простую” функцию в обработке информации, но эта функция очень важна и она используется при анализе сигналов всех модальностей. Например, Д. Марр рассматривал гиппокамп как временное хранилище информации. О.С. Виноградова рассматривала гиппокамп как детектор новой информации в процессе внимания.
Большое разнообразие теоретических идей о том, как тета-ритм участвует в операциях обработки информации на нейронном уровне, связано в значительной степени с многообразием представлений о функциях самого гиппокампа. С одной стороны, большинство идей, изложенных в данной статье, не противоречат друг другу. Например, участие тета-ритма в создании условий для обучения нейронной сети по правилу STDP не противоречит идее о том, что тета-ритм упорядочивает приход информации от разных структур мозга. С другой стороны, при рассмотрении всего многообразия экспериментальных данных и теоретических представлений о функциях тета-ритма сложно отделаться от мысли, что существует “простой” способ описать обработку информации в нейронной сети при выполнении “простой” функции гиппокампа таким образом, чтобы вышеупомянутые идеи были либо частным случаем этого описания, либо опровергались. Мы полагаем, что прорыв в области функций тета-ритма будет сделан, когда будет хорошо установлена такая “простая”, но очень нужная функция всего гиппокампа. Однако это очень сложная задача. Практически все описанные теоретические концепции очень сложно верифицируемы. Несмотря на всю мощь методов современной нейронауки, очень трудно предложить эксперимент, однозначно доказывающий, например, выполнение разных операций на разных фазах тета-ритма, хотя возможность этого хорошо показана в вычислительных моделях. На сегодняшний день в одном эксперименте возможно регистрировать в лучшем случае только несколько десятков нейронов, в то время как в гиппокампе их сотни миллионов [Herculano-Houzel, 2009; West, Gundersen, 1990]. Это делает крайне затруднительным изучение тонких информационных процессов в эксперименте, что в свою очередь затрудняет построение единой теории и приводит к множеству разнообразных гипотез. Таким образом, несмотря на более чем полувековую историю исследования, функциональная роль гиппокампа и тета-ритма остается дискуссионной областью, в которой стоит ждать революционных открытий.
Работа поддержана грантом Российского научного фонда № 17-75-20245.
Список литературы
Виноградова О.С., Дудаева К.И. О компораторной функции гиппокампа. Доклады АН СССР. 1972. 202: 241.
Виноградова О.С. Гиппокамп и память. М.: Наука, 1975.
Alger B.E., Teyler T.J. Long-term and short-term plasticity in the CA1, CA3, and dentate regions of the rat hippocampal slice. Brain Res. 1976. 110: 463–480.
Astasheva E., Astashev M., Kitchigina V. Changes in the behavior and oscillatory activity in cortical and subcortical brain structures induced by repeated l-glutamate injections to the medial septal area in guinea pigs. Epilepsy Res. 2015. 109: 134–145.
Belluscio M.A., Mizuseki K., Schmidt R., Kempter R., Buzsáki G. Cross-frequency phase-phase coupling between θ and γ oscillations in the hippocampus. J. Neurosci. 2012. 32: 423–435.
Bi G., Poo M. Distributed synaptic modification in neural networks induced by patterned stimulation. Nature. 1999. 401: 792–796.
Bi G.Q., Poo M.M. Synaptic modifications in cultured hippocampal neurons: dependence on spike timing, synaptic strength, and postsynaptic cell type. J. Neurosci. 1998. 18: 10464–10472.
Bittner K.C., Milstein A.D., Grienberger C., Romani S., Magee J.C. Behavioral time scale synaptic plasticity underlies CA1 place fields. Science. 2017. 357: 1033–1036.
Brazhnik E.S. Theta rhythmicity in the medial septum: entraining by the GABA-ergic neurons. Zh. Vyssh. Nerv. Deiat. 2004. 54 (2): 192–201.
Brzosko Z., Zannone S., Schultz W., Clopath C., Paulsen O. Sequential neuromodulation of Hebbian plasticity offers mechanism for effective reward-based navigation. elife. 2017. 6: 0-0.
Burak Y., Fiete I.R. Accurate path integration in continuous attractor network models of grid cells. PLoS Comput. Biol. 2009. 5: e1000291.
Burak Y. Spatial coding and attractor dynamics of grid cells in the entorhinal cortex. Curr. Opin. Neurobiol. 2014. 25: 169–175.
Burgess A.P., Gruzelier J.H. Short duration synchronization of human theta rhythm during recognition memory. Neuroreport. 1997. 8: 1039–1042.
Burgess C.P., Burgess N. Controlling phase noise in oscillatory interference models of grid cell firing. J. Neurosci. 2014. 34: 6224–6232.
Burgess N., Barry C., O’Keefe J. An oscillatory interference model of grid cell firing. Hippocampus. 2007. 17: 801–812.
Burgess N. Grid cells and theta as oscillatory interference: theory and predictions. Hippocampus. 2008. 18: 1157–1174.
Bush D., Burgess N. A hybrid oscillatory interference/continuous attractor network model of grid cell firing. J. Neurosci. 2014. 34: 5065–5079.
Buzsáki G., Anastassiou C.A., Koch C. The origin of extracellular fields and currents–EEG, ECoG, LFP and spikes. Nat. Rev. Neurosci. 2012. 13: 407–420.
Buzsáki G., Horváth Z., Urioste R., Hetke J., Wise K. High-frequency network oscillation in the hippocampus. Science. 1992. 256: 1025–1027.
Buzsáki G., Moser E.I. Memory, navigation and theta rhythm in the hippocampal-entorhinal system. Nat. Neurosci. 2013. 16: 130–138.
Buzsáki G. Hippocampal sharp wave-ripple: A cognitive biomarker for episodic memory and planning. Hippocampus. 2015. 25: 1073–1188.
Buzsáki G. Theta oscillations in the hippocampus. Neuron. 2002. 33: 325–340.
Buzsáki G. Two-stage model of memory trace formation: a role for “noisy” brain states. Neuroscience. 1989. 31: 551–570.
Carr M.F., Jadhav S.P., Frank L.M. Hippocampal replay in the awake state: a potential substrate for memory consolidation and retrieval. Nat. Neurosci. 2011. 14: 147–153.
Chaieb L., Leszczynski M., Axmacher N., Höhne M., Elger C.E., Fell J. Theta-gamma phase-phase coupling during working memory maintenance in the human hippocampus. Cogn. Neurosci. 2015. 6: 149–157.
Chen Z., Resnik E., McFarland J.M., Sakmann B., Mehta M.R. Speed controls the amplitude and timing of the hippocampal gamma rhythm. PLoS ONE. 2011. 6: e21408.
Chizhov A.V., Sanchez-Aguilera A., Rodrigues S., de la Prida L.M. Simplest relationship between local field potential and intracellular signals in layered neural tissue. Phys. Rev. E Stat. Nonlin. Soft Matter. Phys. 2015. 92: 062704.
Couey J.J., Witoelar A., Zhang S.J., Zheng K., Ye J., Dunn B., Czajkowski R., Moser M.B., Moser E.I., Roudi Y., Witter M.P. Recurrent inhibitory circuitry as a mechanism for grid formation. Nat. Neurosci. 2013. 16: 318–324.
Csicsvari J., Hirase H., Czurkó A., Mamiya A., Buzsáki G. Oscillatory coupling of hippocampal pyramidal cells and interneurons in the behaving. Rat. J. Neurosci. 1999. 19: 274–287.
Cutsuridis V., Cobb S., Graham B.P. Encoding and retrieval in a model of the hippocampal CA1 microcircuit. Hippocampus. 2010. 20: 423–446.
Cutsuridis V., Poirazi P. A computational study on how theta modulated inhibition can account for the long temporal windows in the entorhinal-hippocampal loop. Neurobiol. Learn. Mem. 2015. 120: 69–83.
Diekelmann S., Born J. The memory function of sleep. Nat. Rev. Neurosci. 2010. 11: 114–126.
Doppelmayr M., Klimesch W., Schwaiger J., Auinger P., Winkler T. Theta synchronization in the human EEG and episodic retrieval. Neurosci. Lett. 1998. 257: 41–44.
D’Albis T., Jaramillo J., Sprekeler H., Kempter R. Inheritance of hippocampal place fields through hebbian learning: effects of theta modulation and phase precession on structure formation. Neural Comput. 2015. 27: 1624–1672.
Eichenbaum H. Time cells in the hippocampus: a new dimension for mapping memories. Nat. Rev. Neurosci. 2014. 15: 732–744.
Feldman D.E. The spike-timing dependence of plasticity. Neuron. 2012. 75: 556–571.
Foster D.J., Wilson M.A. Hippocampal theta sequences. Hippocampus. 2007. 17: 1093–1099.
Freund T.F., Buzsáki G. Interneurons of the hippocampus. Hippocampus. 1996. 6: 347–470.
Fries P. A mechanism for cognitive dynamics: neuronal communication through neuronal coherence. Trends Cogn. Sci. (Regul. Ed.). 2005. 9: 474–480.
Fuhs M.C., Touretzky D.S. A spin glass model of path integration in rat medial entorhinal cortex. J. Neurosci. 2006. 26: 4266–4276.
Gołebiewski H., Eckersdorf B., Konopacki J. Electrical coupling underlies theta rhythm in freely moving cats. Eur. J. Neurosci. 2006. 24: 1759–1770.
Grastyan E., Lissak K., Madarasz I., Donhoffer H. Hippocampal electrical activity during the development of conditioned reflexes. Electroencephalogr. Clin. Neurophysiol. 1959. 11: 409–430.
Green J.D., Arduini A.A. Hippocampal electrical activity in arousal. J. Neurophysiol. 1954. 17: 533–557.
Grunwald M., Weiss T., Krause W., Beyer L., Rost R., Gutberlet I., Gertz H.J. Theta power in the EEG of humans during ongoing processing in a haptic object recognition task. Brain Res. Cogn. Brain Res. 2001. 11: 33–37.
Hafting T., Fyhn M., Molden S., Moser M.B, Moser E.I. Microstructure of a spatial map in the entorhinal cortex. Nature. 2005. 436: 801–806.
Hartley T., Lever C., Burgess N., O’Keefe J. Space in the brain: how the hippocampal formation supports spatial cognition. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 2014. 369: 20120510.
Hasselmo M.E., Bodelón C., Wyble B.P. A proposed function for hippocampal theta rhythm: separate phases of encoding and retrieval enhance reversal of prior learning. Neural Comput. 2002. 14: 793–817.
Hasselmo M.E., Brandon M.P. A model combining oscillations and attractor dynamics for generation of grid cell firing. Front. Neural Circuits. 2012. 6: 30.
Hasselmo M.E. Neuromodulation and the hippocampus: memory function and dysfunction in a network simulation. Prog. Brain Res. 1999. 121: 3–18.
Herculano-Houzel S. The human brain in numbers: a linearly scaled-up primate brain. Front. Hum. Neurosci. 2009. 3: 31.
Jeewajee A., Barry C., Douchamps V., Manson D., Lever C., Burgess N. Theta phase precession of grid and place cell firing in open environments. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 2014. 369: 20120532.
Jeewajee A., Barry C., O’Keefe J., Burgess N. Grid cells and theta as oscillatory interference: electrophysiological data from freely moving rats. Hippocampus. 2008. 18: 1175–1185.
Jeffery K.J. Place cells, grid cells, attractors, and remapping. Neural Plast. 2011. 2011: 182602.
Jouvet M. Biogenic amines and the states of sleep. Science. 1969. 163: 32–41.
Jung R., Kornmüller A.E. Eine Methodik der Ableitung Iokalisierter Potentialschwankungen aus subcorticalen Hirngebieten. Archiv f. Psychiatrie. 1938. 109: 1–30.
Justus D., Dalügge D., Bothe S., Fuhrmann F., Hannes C., Kaneko H., Friedrichs D., Sosulina L., Schwarz I., Elliott D.A., Schoch S., Bradke F., Schwarz M.K., Remy S. Glutamatergic synaptic integration of locomotion speed via septoentorhinal projections. Nat. Neurosci. 2017. 20: 16–19.
Kelemen E., Morón I., Fenton A.A. Is the hippocampal theta rhythm related to cognition in a non-locomotor place recognition task? Hippocampus. 15 (4). 2005: 472–479.
Klausberger T., Magill P.J., Márton L.F., Roberts J.D.B., Cobden P.M., Buzsáki G., Somogyi P. Brain-state- and cell-type-specific firing of hippocampal interneurons in vivo. Nature. 2003. 421: 844–848.
Klimesch W., Doppelmayr M., Yonelinas A., Kroll N.E., Lazzara M., Röhm D., Gruber W. Theta synchronization during episodic retrieval: neural correlates of conscious awareness. Brain Res. Cogn. Brain Res. 2001. 12: 33–38.
Kocsis B., Bragin A., Buzsáki G. Interdependence of multiple theta generators in the hippocampus: a partial coherence analysis. J. Neurosci. 1999. 19: 6200–6212.
Kreiman G., Koch C., Fried I. Category-specific visual responses of single neurons in the human medial temporal lobe. Nat. Neurosci. 2000. 3: 946–953.
Ledberg A., Robbe D. Locomotion-related oscillatory body movements at 6–12 Hz modulate the hippocampal theta rhythm. PLoS ONE. 2011. 6: e27575.
Lee D.J., Izadi A., Melnik M., Seidl S., Echeverri A., Shahlaie K., Gurkoff G.G. Stimulation of the medial septum improves performance in spatial learning following pilocarpine-induced status epilepticus. Epilepsy Res. 2017. 130: 53–63.
Lisman J., Grace A.A., Duzel E. A neoHebbian framework for episodic memory; role of dopamine-dependent late LTP. Trends Neurosci. 2011. 34: 536–547.
Lisman J.E., Otmakhova N.A. Storage, recall, and novelty detection of sequences by the hippocampus: elaborating on the SOCRATIC model to account for normal and aberrant effects of dopamine. Hippocampus. 2001. 11: 551–568.
Long L.L., Hinman J.R., Chen C.M.A., Stevenson I.H., Read H.L., Escabi M.A., Chrobak J.J. Novel acoustic stimuli can alter locomotor speed to hippocampal theta relationship. Hippocampus. 2014. 24: 1053–1058.
Lörincz A., Buzsáki G. Two-phase computational model training long-term memories in the entorhinal-hippocampal region. Ann. N. Y. Acad. Sci. 2000. 911: 83–111.
Louie K., Wilson M.A. Temporally structured replay of awake hippocampal ensemble activity during rapid eye movement sleep. Neuron. 2001. 29: 145–156.
Manns J.R., Zilli E.A., Ong K.C., Hasselmo M.E., Eichenbaum H. Hippocampal CA1 spiking during encoding and retrieval: relation to theta phase. Neurobiol. Learn. Mem. 2007. 87: 9–20.
Markram H., Lübke J., Frotscher M., Sakmann B. Regu-lation of synaptic efficacy by coincidence of postsynaptic APs and EPSPs. Science. 1997. 275: 213–215.
Marr D. A theory for cerebral neocortex. Proc. R. Soc. Lond. B. Biol. Sci. 1970. 176: 161–234.
Mehta M.R. From synaptic plasticity to spatial maps and sequence learning. Hippocampus. 2015. 25: 756–762.
Mitchell S.J., Rawlins J.N., Steward O., Olton D.S. Medial septal area lesions disrupt theta rhythm and cholinergic staining in medial entorhinal cortex and produce impaired radial arm maze behavior in rats. J. Neurosci. 1982. 2: 292–302.
Mizumori S.J., Perez G.M., Alvarado M.C., Barnes C.A., McNaughton B.L. Reversible inactivation of the medial septum differentially affects two forms of learning in rats. Brain Res. 1990. 528: 12–20.
Mizuseki K., Royer S., Diba K., Buzsáki G. Activity dynamics and behavioral correlates of CA3 and CA1 hippocampal pyramidal neurons. Hippocampus. 2012. 22: 1659–1680.
Mizuseki K., Sirota A., Pastalkova E., Buzsáki G. Theta oscillations provide temporal windows for local circuit computation in the entorhinal-hippocampal loop. Neuron. 2009. 64: 267–280.
Montgomery S.M., Betancur M.I., Buzsáki G. Behavior-dependent coordination of multiple theta dipoles in the hippocampus. J. Neurosci. 2009. 29: 1381–1394.
Moser M.B., Rowland D.C., Moser E.I. Place cells, grid cells, and memory. Cold Spring Harb. Perspect. Biol. 2015. 7: a021808.
Nádasdy Z., Hirase H., Czurkó A., Csicsvari J., Buzsáki G. Replay and time compression of recurring spike sequences in the hippocampus. J. Neurosci. 1999. 19: 9497–9507.
O’Keefe J., Recce M.L. Phase relationship between hippocampal place units and the EEG theta rhythm. Hippocampus. 1993. 3: 317–330.
O’Keefe J. Place units in the hippocampus of the freely moving rat. Exp. Neurol. 1976. 51: 78–109.
Patel J., Fujisawa S., Berényi A., Royer S., Buzsáki G. Traveling theta waves along the entire septotemporal axis of the hippocampus. Neuron. 2012. 75: 410–417.
Petsche H., Stumpf C. The origin of theta-rhythm in the rabbit hippocampus. Wien. Klin. Wochenschr. 1962. 74: 696–700.
Pickenhain L., Klingberg F. Changes of electrophysiological and behavioural indicators during the delay period of conditioned reflexes in rats. Act. Nerv. Super. (Praha). 1967. 9: 330.
Ponulak F., Hopfield J.J. Rapid, parallel path planning by propagating wavefronts of spiking neural activity. Front. Comput. Neurosci. 2013. 7: 98.
Preobrazhenskaya L.A. Dependence of the electrical activity of the hippocampus on the probability of reinforcement of an alimentary conditional stimulus. Neurosci. Behav. Physiol. 1991. 21: 296–302.
Quiroga R.Q., Reddy L., Kreiman G., Koch C., Fried I. Invariant visual representation by single neurons in the human brain. Nature. 2005. 435: 1102–1107.
Robinson J., Manseau F., Ducharme G., Amilhon B., Vigneault E., El Mestikawy S., Williams S. Optogenetic activation of septal glutamatergic neurons drive hippocampal theta rhythms. J. Neurosci. 2016. 36: 3016–3023.
Robinson T.E., Whishaw I.Q. Effects of posterior hypothalamic lesions on voluntary behavior and hippocampal electroencephalograms in the rat. J. Comp. Physiol. Psychol. 1974. 86: 768–786.
Sarnthein J., Petsche H., Rappelsberger P., Shaw G.L., von Stein A. Synchronization between prefrontal and posterior association cortex during human working memory. Proc. Natl. Acad. Sci. U.S.A. 1998. 95: 7092–7096.
Si B., Romani S., Tsodyks M. Continuous attractor network model for conjunctive position-by-velocity tuning of grid cells. PLoS Comput. Biol. 2014. 10: e1003558.
Sinnamon H.M. Hippocampal theta activity and behavioral sequences in a reward-directed approach locomotor task. Hippocampus. 2005. 15: 518–534.
Sinnamon H.M. Hippocampal theta activity related to elicitation and inhibition of approach locomotion. Behav. Brain Res. 2005. 160: 236–249.
Skaggs W.E., McNaughton B.L., Wilson M.A., Barnes C.A. Theta phase precession in hippocampal neuronal populations and the compression of temporal sequences. Hippocampus. 1996. 6: 149–172.
Skaggs W.E., McNaughton B.L. Replay of neuronal firing sequences in rat hippocampus during sleep following spatial experience. Science. 1996. 271: 1870–1873.
Sokolov E.N. Higher nervous functions; the orienting reflex. Annu. Rev. Physiol. 1963. 25: 545–580.
Solovyeva K.P., Karandashev I.M., Zhavoronkov A., Dunin-Barkowski W.L. Models of Innate Neural Attractors and Their Applications for Neural Information Processing. Front. Syst. Neurosci. 2015. 9: 178.
Somogyi P., Katona L., Klausberger T., Lasztóczi B., Viney T.J. Temporal redistribution of inhibition over neuronal subcellular domains underlies state-dependent rhythmic change of excitability in the hippocampus. Philos. Trans. R. Soc. Lond. B. Biol. Sci 2014. 369: 2012.0518.
Stella F., Treves A. Associative memory storage and retrieval: involvement of theta oscillations in hippocampal information processing. Neural Plast. 2011. 2011: 683961.
Sullivan D., Csicsvari J., Mizuseki K., Montgomery S., Diba K., Buzsáki G. Relationships between hippocampal sharp waves, ripples, and fast gamma oscillation: influence of dentate and entorhinal cortical activity. J. Neurosci. 2011. 31: 8605–8616.
Sweet J.A., Eakin K.C., Munyon C.N., Miller J.P. Improved learning and memory with theta-burst stimulation of the fornix in rat model of traumatic brain injury. Hippocampus. 2014. 24: 1592–1600.
Tesche C.D., Karhu J. Theta oscillations index human hippocampal activation during a working memory task. Proc. Natl. Acad. Sci. U. S. A. 2000. 97: 919–924.
Ulanovsky N., Moss C.F. Hippocampal cellular and network activity in freely moving echolocating bats. Nat. Neurosci. 2007. 10: 224–233.
Vanderwolf C.H. Hippocampal electrical activity and voluntary movement in the rat. Electroencephalogr. Clin. Neurophysiol. 1969. 26: 407–418.
Vanderwolf C.H. Neocortical and hippocampal activation relation to behavior: effects of atropine, eserine, phenothiazines, and amphetamine. J. Comp. Physiol. Psychol. 1975. 88: 300–323.
Vertes R.P., Hoover W.B., Viana Di Prisco G. Theta rhythm of the hippocampus: subcortical control and functional significance. Behav. Cogn. Neurosci. Rev. 2004. 3: 173–200.
Vinogradova O.S. Expression, control, and probable functional significance of the neuronal theta-rhythm. Prog. Neurobiol. 1995. 45: 523–583.
Vinogradova O.S. Hippocampus as comparator: role of the two input and two output systems of the hippocampus in selection and registration of information. Hippocampus. 2001. 11: 578–598.
Wang Y., Romani S., Lustig B., Leonardo A., Pastalkova E. Theta sequences are essential for internally generated hippocampal firing fields. Nat. Neurosci. 2015. 18: 282–288.
West M.J., Gundersen H.J. Unbiased stereological estimation of the number of neurons in the human hippocampus. J. Comp. Neurol. 1990. 296: 1–22.
Wójtowicz T., Mozrzymas J.W. Diverse impact of neuronal activity at θ frequency on hippocampal long-term plasticity. J. Neurosci. Res. 2015. 93: 1330–1344.
Wyble B.P., Hyman J.M., Rossi C.A., Hasselmo M.E. Analysis of theta power in hippocampal EEG during bar pressing and running behavior in rats during distinct behavioral contexts. Hippocampus. 2004. 14: 662–674.
Yoshida M., Hayashi H. Emergence of sequence sensitivity in a hippocampal CA3–CA1 model. Neural Netw. 2007. 20: 653–667.
Zhang H., Jacobs J. Traveling theta waves in the human hippocampus. J. Neurosci. 2015. 35: 12477–12487.
Zutshi I., Brandon M.P., F.u. M.L., Donegan M.L., Leutgeb J.K., Leutgeb S. Hippocampal neural circuits respond to optogenetic pacing of theta frequencies by generating accelerated oscillation frequencies. Curr. Biol. 2018. 28: 1179–1188.e3.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


