Журнал высшей нервной деятельности им. И.П. Павлова, 2020, T. 70, № 3, стр. 360-374
УЧАСТИЕ ПАННЕКСИНОВ-1 В МЕХАНИЗМЕ ДЕПРИВАЦИОННОЙ ПОТЕНЦИАЦИИ ПОПУЛЯЦИОННЫХ СПАЙКОВ НЕЙРОНОВ ПОЛЯ СА1 ГИППОКАМПА КРЫС
В. А. Попов *
Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
* E-mail: v-lad-i-mir@yandex.ru
Поступила в редакцию 31.07.2019
После доработки 08.11.2019
Принята к публикации 16.12.2019
Аннотация
На переживающих срезах гиппокампа крыс при тестировании связи коллатерали Шаффера – нейроны поля СА1 исследовали механизм депривационной потенциации (ДеП) популяционных спайков, развивающейся вследствие 60-минутного прерывания стимуляции (депривации). Ранее было показано, что ДеП обладает свойством входоспецифичности, способностью к длительному сохранению и состоит из двух компонентов с независимыми механизмами индукции: начального кратковременного “пика” пресинаптического происхождения и длительного “плато” с Ca2+-зависимым постсинаптическим механизмом, опосредованным P2 пуринорецепторами. Исследование свойства входоспецифичности ДеП проводили при стимуляции двух разных популяций коллатералей Шаффера и регистрации поп-спайков общей популяции нейронов поля СА1. Эксперименты показали, что изменение синаптической эффективности в депривируемом входе обеспечивается только пресинаптическим механизмом, ответственным за развитие кратковременного компонента ДеП. Изучение постсинаптического механизма индукции долговременного компонента ДеП продемонстрировало, что функцию источника аденозинтрифосфата (АТФ), необходимого для активации P2 пуринорецепторов, выполняют паннексины-1, образующие на постсинапсе АТФ-проводящие каналы. Представлена рабочая модель циклического механизма индукции долговременного компонента ДеП.
Наряду с длительной посттетанической потенциацией (LTP) [Bliss, Lømo, 1973] и длительной депрессией (LTD) [Lynch et al., 1977] ДеП представляет собой вариант синаптической пластичности, связанной с изменением характера афферентации [Попов, 2016]. Ранее в экспериментах на переживающих срезах гиппокампа крыс при тестировании связи коллатерали Шаффера – нейроны поля СА1 было показано, что длительное (от 10 мин до 4 ч) прерывание редкой (0.05 Гц) тестовой стимуляции приводит к индукции ДеП – возрастанию амплитуды популяционных возбудительных постсинаптических потенциалов и в большей мере популяционных спайков (ПС), пропорциональному длительности паузы (депривации). Исследования продемонстрировали, что ДеП обладает свойством входоспецифичности и способностью к длительному сохранению, и что механизм развития ДеП может вступать в конкурентные взаимоотношения с механизмом развития поздней протеинкиназа C (ПКC)-зависимой фазы LTP. На стадии сохранения ДеП были выделены два компонента: кратковременный (кДеП) продолжительностью 10–12 мин с пресинаптическим механизмом развития и долговременный (дДеП) продолжительностью более часа с Ca2+- и ПКC-зависимым постсинаптическим механизмом, что можно представить как алгебраическую сумму ДеП = кДеП + дДеП с их амплитудным соотношением на пике кДеП:дДеП = 1:2. Было показано, что Ca2+-зависимый механизм развития дДеП опосредуется не потенциал-зависимыми N-метил-D-аспартат (NMDA) рецепторами, а пуриновыми P2 рецепторами, естественным лигандом для которых является АТФ [Попов, 1994; 2016; Попов, Маркевич, 2001; 2014]. Из-за действия эктонуклеотидаз во внеклеточной среде и быстрого падения концентрации АТФ у источника его выделения АТФ является молекулой “короткой дистанции”/”короткого времени жизни” (short range/short timing) [Burnstock, Verkhratsky, 2012]. Было высказано предположение, что роль близкого источника АТФ в механизме индукции дДеП могут играть расположенные на постсинаптической мембране пирамидных клеток гиппокампа паннексины-1 (Panx1), при активации которых образуются АТФ-проводящие каналы, паннексоны [Dahl, 2015; Thompson et al., 2008; Weickert et al., 2005; Zoidl et al., 2007]. Обнаруженное ранее свойство входоспецифичности ДеП подразумевает возможность развития потенциации ответов депривированного входа независимо от активности других синаптических входов той же клетки-мишени [Попов, 1994]. С другой стороны, было показано, что активация постсинаптической клетки посредством антидромной стимуляции приводит к нарушению нормального развития ДеП – подавлению ее длительного компонента [Попов, 2016]. Сопоставление двух серий экспериментов сделало первоначальный вывод о входоспецифичности ДеП по меньшей мере неоднозначным. Это противоречие можно объяснить, если из двух независимых механизмов развития ДеП свойство входоспецифичности обеспечивается только пресинаптическим механизмом, ответственным за развитие кДеП.
Задачей данной работы было исследование механизма, лежащего в основе входоспецифичности ДеП, а также проверка предположения, что в Ca2+-зависимом, опосредуемом P2 пуринорецепторами постсинаптическом механизме индукции дДеП участвуют Panx1.
МЕТОДИКА
Эксперименты проводили на переживающих срезах гиппокампа самцов крыс линии Вистар массой 150–200 г, перед декапитацией животного использовали эфирный наркоз. Срезы толщиной 400 мкм помещали в регистрационную камеру с двусторонним протоком искусственной цереброспинальной жидкостью (ИЦСЖ). Состав раствора (мМ): NaCl – 124, KCl – 3.0, NaHCO3 – 26, КH2PO4 – 1.25, CaCl2 – 2.2, MgCl2 – 1.8, D-глюкоза – 10; раствор насыщали газовой смесью (95% O2–5% CO2) при температуре, соответствующей таковой в регистрационной камере (32°С); pH 7.4; скорость протока 0.9 мл/мин. Регистрацию ПС в пирамидном слое поля СА1 гиппокампа в ответ на стимуляцию КШ осуществляли через 2 ч после приготовления срезов. Для регистрации использовали стеклянные микроэлектроды, заполненные 2 М раствором NaCl, сопротивление электродов составляло 3–5 MОм, амплитуду ПС измеряли от первого положительного до отрицательного пиков ответа. Монополярные стимулирующие электроды (заточенная и покрытая винифлексовым лаком вольфрамовая проволока толщиной 100 мкм) устанавливали в средней части stratum radiatum поля СА1 гиппокампа. Параметры стимуляции: длительность импульса – 100 мкс, частота – 0.05 Гц, силу тока подбирали таким образом, чтобы амплитуда ПС составляла примерно 30% от максимального значения. В экспериментах с попеременной стимуляцией двух пучков коллатералей Шаффера и регистрацией ПС одним электродом (модель “два входа – одна клетка-мишень”) второй стимулирующий электрод помещали в том же слое (по глубине) со смещением относительно первого – ближе к молекулярному слою и к области регистрации; стимуляцию обоих входов производили поочередно с интервалом 10 с, соответственно частота стимуляции каждого входа составляла 0.05 Гц.
В опыте для индукции ДеП использовали стандартную 60-минутную депривацию (прерывание тестовой стимуляции), после чего тестирование возобновляли; в контроле осуществляли непрерывную стимуляцию с частотой 0.05 Гц.
Для индукции LTP использовали эффективную высокочастотную стимуляцию двадцатью импульсами (5 пачек импульсов с частотой 100 Гц по 4 импульса в пачке, интервал между пачками 200 мс).
В работе использовали ингибиторы Panx1 пробенецид [p-(Dipropylsulfamoyl) benzoic acid (probenecid), TCI, Германия (произведено в Бельгии)] в концентрации 1 мМ и карбеноксолон [3beta-hydroxy-11-oxoolean-12-en-30-oic acid 3-hemisuccinate disodium salt (сarbenoxolone disodium salt), SIGMA-ALDRICH, США (произведено в Японии)] в концентрации 50 мкМ.
Амплитуду ПС измеряли от первого позитивного пика до негативного, ответы усредняли по десяти предъявлениям стимулов. За базовый уровень ответов (100%) принимали усредненные ответы на десять последних стимулов перед депривацией или, в отдельных экспериментах – перед тетанизацией. Построение графиков и математический анализ результатов осуществляли с использованием программы Sigma Plot 12.0 и Statistica 8.
Эксперименты осуществляли с соблюдением принципов гуманности, изложенных в директивах Европейского Сообщества (2010/63/ЕU) и одобренных Комитетом по медицинской этике в соответствии с положением Института ВНД и НФ РАН о работе с экспериментальными животными.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Для исследования входоспецифичности ДеП и природы этого свойства в работе использовали экспериментальную модель стимуляции двух входов одной мишени. На гиппокампальных срезах в пирамидном слое поля СА1 регистрировали ответы (ПС) на попеременную стимуляцию двух разных пучков КШ. В одном из них (опыт) осуществляли 60-минутную депривацию, после чего тестовую стимуляцию возобновляли, в другом (контроль) стимуляцию не прерывали в течение всего эксперимента.
Обычно эксперименты с тестированием независимых входов схематично изображают в виде клетки-мишени с двумя синаптическими входами, расположенными с двух сторон клетки-мишени на разном уровне дендритного дерева (рис. 1 (а)). Если эту схему расширить до двух клеток, то можно допустить, что внеклеточный регистрирующий электрод, расположенный между ними, будет регистрировать схожие ответы от двух разных клеток (рис. 1 (б)), удовлетворяя критерию регистрации ответов одной мишени от двух независимых входов. В гиппокампальных срезах направление коллатералей Шаффера не обязательно параллельное поверхности среза, и регистрируемые одним электродом популяционные ответы могут отражать активацию разных популяций нейронов, перекрывающихся в большей или меньшей степени. Для достижения минимального пересечения двух активируемых пучков коллатералей Шаффера (условие стимуляции разных входов) и максимального перекрывания возбуждаемых ими популяций нейронов (критерий одной мишени) оба стимулирующих электрода размещали по одну сторону от регистрирующего электрода, один из них устанавливали в середине радиального слоя, другой немного смещали относительно первого – ближе к молекулярному слою и к области регистрации (схематично показано на рис. 1 (в)). Наклонное расположение объектива микроскопа позволяло осуществлять вертикальное погружение изогнутых под углом ∼30° двух стимулирующих и одного регистрирующего электродов в заданных областях среза; кончики стимулирующих электродов устанавливали на примерно равной глубине от поверхности среза, погружение регистрирующего электрода корректировали по ответам. Примеры усредненных ПС на 10 последовательных стимулов приведены на рис. 2 (а). Обычно ответы на стимуляцию “дальним” электродом (С1,1) имели чуть меньший латентный период (ЛП), чем ответы на стимуляцию “ближним” электродом (С2,1) (соответственно 4.9 ± 0.1 мс и 5.1 ± 0.1 мс), что являлось дополнительным свидетельством активации разных пучков коллатералей Шаффера.
Рис. 1.
Схема экспериментов с тестированием независимых входов: (а) – обычное схематичное изображение клетки-мишени с двумя синаптическими входами, расположенными с двух сторон клетки-мишени на разном уровне дендритного дерева; (б) – пример ошибочного соответствия модели “два входа – одна клетка-мишень” (регистрация одним электродом ответов двух клеток при стимуляции двух входов); (в) – вертикальное погружение двух близко расположенных стимулирующих электродов на равную глубину с небольшим смещением к молекулярному слою и к клетке-мишени позволяет осуществлять регистрацию ответов одной клетки-мишени на стимуляцию двух разных синаптических входов. С1 и С2 – стимулирующие электроды, Р – регистрирующий электрод.
Fig. 1. Scheme of experiments with testing two independent inputs: (а) – standard schematic representation of a target cell with two synaptic inputs located on both sides of the target cell at different levels of the dendritic tree; (б) – an example of the erroneous correspondence of the “two inputs – one target cell” model; (в) – vertical implantation of two closely spaced stimulating electrodes to equal depth with a slight shift to the molecular layer and to the target cell allows to record responses of one target cell to the stimulation of two different synaptic inputs. С1 and С2 – stimulating electrodes, Р – recording electrode.
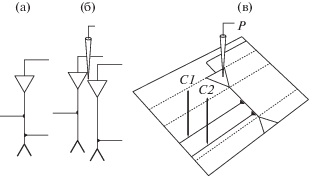
Рис. 2.
Активация одного из двух независимых входов подавляет развитие долговременного постсинаптического компонента депривационной потенциации (дДеП) поп-спайков (ПС) другого, депривируемого входа. (а) – примеры усредненных ПС (n = 10): 1 – перед 60-минутной депривацией, 2 –сразу после возобновления стимуляции и 3 – спустя примерно 12 мин (для сравнения пунктиром показаны ПС перед депривацией); С1 – опыт (депривируемый вход), С2 – контроль (постоянно стимулируемый вход). (б) – суммарные данные (n = 11): черные кружки – опыт, белые кружки – контроль, для сравнения белыми треугольниками показана стандартная ДеП при тестировании одного входа (n = 14) [из: Попов, 2016]. По оси абсцисс – время, мин, по оси ординат – амплитуда ПС, %. Показаны средние значения ± ошибка среднего; статистические различия между значениями в опыте и контроле по t-критерию Стьюдента: **, * – значимые (p < 0.01, p < 0.05 соответственно), x – не значимые (p > 0.05). Пунктирная линия – базовый уровень ответов, принятый за 100% (усредненная амплитуда ПС перед 60-минутной депривацией).
Fig. 2. The activation of one of the two independent inputs suppresses the development of the long-term component of deprivation potentiation (ltDeP) of the pop-spikes (PSs) of the other, deprivated input. (а) – examples of averaged PSs (n = 10): 1 – before 60-min deprivation, 2 – after stimulation was restarted and 3 – about 12 min later (for comparison dots show the PSs before deprivation). C1 shows the experiment (deprivated input), C2 shows the controls (continuously stimulated input). (б) – overall data (n = 11): black circles show the experiment, white circles show the controls, white triangles show the standard DeP (one input test) for comparison (n = 14) [from: Попов, 2016]. The abscissa shows time, min, and the ordinate shows PS amplitude, %. Values are shown as mean ± error of mean; statistically significant differences between values in experiments and controls, Student’s t-test: **, * significant (p < < 0.01, p < 0.05, respectively), x – not significant (p > 0.05). The dotted line shows the baseline response level taken as 100% (mean PS amplitude before 60-min deprivation).
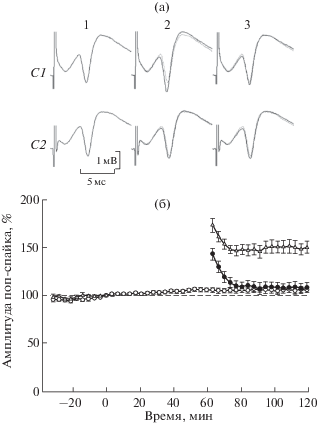
В экспериментах редкая (0.05 Гц) непрерывная стимуляция одного из двух входов оказывала негативное влияние на развитие ДеП депривируемого входа, подавляя ее долговременный компонент. На рис. 2 (а) приведен пример подавления развития дДеП депривируемого входа (показаны усредненные ПС на 10 последовательных стимулов): 60-минутное прерывание стимуляции одного из входов (опыт) привело к возрастанию амплитуды ПС (С1,2), спустя 12 мин после возобновления стимуляции амплитуда ПС возвратилась к исходному уровню (С1,3), тогда как ответы постоянно стимулируемого входа (контроль) оставались стабильными (С2,1-3); для сравнения исходные усредненные ответы обозначены пунктиром. На рис. 2 (б) представлены суммарные данные 11 экспериментов: по оси абсцисс – время (мин), по оси ординат – амплитуда ПС (%); за базовый уровень ответов (100%) принимали усредненную амплитуду ПС на последние перед депривацией 10 стимулов (соответствует точке “0” на оси абсцисс). 60-минутная депривация одного входа на фоне постоянной стимуляции другого вызывала кратковременное возрастание амплитуды ПС депривируемого входа: величины усредненных амплитуд ПС в опыте (черные кружки) и контроле (белые кружки) сразу после возобновления стимуляции были соответственно 143.1 ± 6.2 и 105.5 ± 2.5% (различия статистически значимы, p < 0.01); примерно через 12 мин после возобновления стимуляции депривируемого входа (четвертый интервал усреднения соответствует 10.5–14 мин после возобновления стимуляции) эти значения составляли соответственно 113.8 ± 5.4 и 105.4 ± 2.5% (различия статистически не значимы, p > 0.05 и далее p > 0.1). Для сравнения белыми треугольниками показана стандартная ДеП после 60-минутной депривации при тестировании одного входа (n = 14) [Попов, 2016]. Динамика изменения ПС (%) в первые 14 мин постдепривационного периода в данных экспериментах при тестировании двух входов одной мишени и в экспериментах с антидромной стимуляцией, демонстрирующих пресинаптическую природу кратковременного компонента ДеП [там же] практически совпадает, и ее можно представить в виде экспоненциальной кривой: ПС(t) = a – b exp(–ct), где a – максимальное значение амплитуды ПС после возобновления стимуляции, b – диапазон снижения амплитуды ПC, c – скорость снижения амплитуды ПС, t – время.
Таким образом, с одной стороны, данные эксперименты подтвердили возможность развития ДеП депривируемого входа при активации другого входа той же клетки-мишени (свойство входоспецифичности ДеП), с другой – сходство динамик падения “входоспецифичной” ДеП и пресинаптической кДеП позволяют заключить, что из двух независимых механизмов индукции ДеП свойство входоспецифичности обеспечивается только пресинаптическим механизмом. Соответственно активация (любого) другого афферентного входа той же клетки-мишени блокирует индукцию постсинаптической дДеП депривируемого входа.
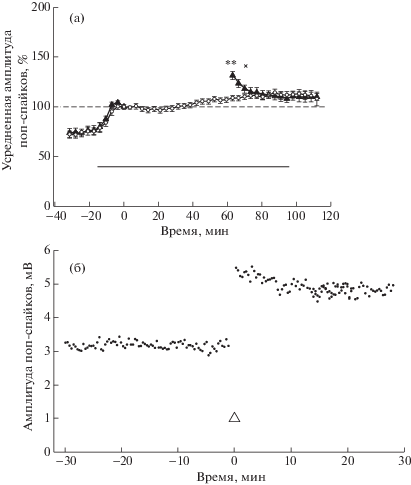
Для проверки предположения об участии Panx1 в развитии дДеП стандартную процедуру индукции ДеП (тестирование одного входа, 60-минутная депривация) проводили на фоне ингибиторов Panx1 – пробенецида и карбеноксолона (Cbx). Пробенецид в концентрации 1 мМ в течение около 15 мин вызывал заметное (около 20%) увеличение амплитуды ПС, после чего ответ относительно стабилизировался. С учетом этого в опытах депривацию начинали через 17.5 мин после переключения перфузионной системы на пробенецид-содержащий раствор, отмывание раствора производили через 35 мин после возобновления стимуляции (рис. 3 (а)). За 100% принимали усредненную амплитуду ответов на 10 тестовых раздражений перед депривацией (соответствует точке “0” по оси асбцисс). Эксперименты показали, что пробенецид подавляет длительную составляющую ДеП, в то время как начальный пик в несколько сглаженном виде по сравнению с нормальной кДеП сохраняется: попарное сравнение усредненных амплитуд ПС в опыте (n = 10) и контроле (n = 10) согласно t-критерию Стьюдента показало статистически значимые различия сразу после депривации (в первом интервале 60–63.5 мин соответственно 131.4 ± 4.1% и 108.7 ± 2.4%, p < 0.01), а спустя примерно 9 мин после возобновления тестовой стимуляции (третий интервал усреднения 67–70.5 мин) различия были в пределах статистической погрешности (соответственно 118.1 ± 4.2% и 110.0 ± 2.4%, p > 0.1).
Рис. 3.
(а) – участие паннексинов-1 (Panx1) в механизме ДеП: ингибитор Panx1, пробенецид (1 мМ) подавляет развитие дДеП, но не кДеП. Суммарные данные: черные треугольники – опыт (n = 10), светлые кружки – контроль (n = 10). Показаны средние значения ± ошибка среднего; статистические различия между значениями в опыте и контроле по t-критерию Стьюдента: **, * – значимые (p < 0.01, p < 0.05 соответственно); х – не значимые (p > 0.05). Пунктирной линией показан базовый уровень ответов, принятый за 100% (усредненная амплитуда ПС перед 60-минутной депривацией), горизонтальная линия – введение пробенецида. (б) – пробенецид (1 мМ) не подавляет индукцию NMDA-зависимой LTP (показаны ответы на фоне пробенецида). Тетанизация обозначена белым треугольником. По оси абсцисс – время, мин, по оси ординат – амплитуда ПС, % (а) или мВ (б).
Fig. 3. (а) – pannexins-1 (Panx1) participate in the mechanisms of DeP: Panx1 inhibitor, probenecid (1 mM) suppresses the development of the ltDeP but not stDeP. Overall data: black triangles show the experiments (n = 10); white circles show controls (n = 10). Values are shown as mean ± error of mean; statistically significant differences between values in experiments and controls, Student’s t-test: **,* – significant (p < 0.01, p < 0.05, respectively), x – not signifcant (p > 0.05). The dotted line shows the baseline response level taken as 100% (mean PS amplitude before 60-min deprivation); the horizontal bar shows addition of probenecid. (б) – addition of the probenecid to the solution (1 mM) does not suppress the NMDA-dependent induction of LTP (the responses in presence of probenecid of are shown). Tetanization is shown by the white triangle. The abscissa shows time, min; the ordinate shows PS amplitude, % (а) or mV (б).
Иная динамика ПС была при использовании другого ингибитора Panx1-токов, Cbx (концентрация в растворе 50 мкМ): после примерно 10-минутного незначительного увеличения амплитуды ПС на фоне Cbx (в среднем это изменение не превышало 10% от базового уровня ответов) препарат начинал оказывать подавляющий эффект на амплитуду ответов, который продолжался некоторое время и при отмывании Cbx. Для полного восстановления ответов требовалось до 1.5–2 ч отмывания препарата. В этой связи схему экспериментов изменили, сократив время присутствия в растворе Cbx до минимального – 60 мин во время депривации. На рис. 4 (а) показаны суммарные данные экспериментов с Cbx. Подавляя длительную составляющую ДеП, препарат не блокировал индукцию кДеП, которая имела острый характер. Попарное сравнение усредненных амплитуд ПС в опыте (n = 10) и контроле (n = 10) показало статистически значимые различия сразу после возобновления тестовой стимуляции (соответственно 135.4 ± 5.9% и 85.9 ± 5.1%, p < 0.001 в первом интервале усреднения 60–63.5 мин), а спустя примерно 16 мин различия были в пределах случайных отклонений (соответственно 90.8 ± 4.7% и 78.2 ± 6.0%, p > 0.1 в пятом интервале усреднения 74–77.5 мин).
Рис. 4.
(а) – ингибитор Panx1, карбеноксолон (Cbx) подавляет развитие дДеП, но не кДеП. Суммарные данные: черные треугольники – опыт (n = 10), светлые кружки – контроль (n = 10). По оси абсцисс – время, мин, по оси ординат – амплитуда ПС, %. Показаны средние значения ± ошибка среднего; статистические различия между значениями в опыте и контроле по t-критерию Стьюдента: **, * – значимые (p < 0.01, p < 0.05 соответственно); х – не значимые (p > 0.05). Пунктирная линия – базовый уровень ответов, принятый за 100% (усредненная амплитуда ПС перед 60-минутной депривацией), горизонтальная линия – введение Cbx (50 мкМ). (б) – индукция LTP на фоне Cbx (синхронная регистрация ПС от двух срезов): черные кружки – опыт, белые кружки – контроль. Тетанизация обозначена белым треугольником. Показаны усредненные амплитуды десяти ПС. Пунктирная линия – базовый уровень ответов, принятый за 100% (усредненная амплитуда десяти ПС перед тетанизацией), горизонтальная линия – введение Cbx (50 мкМ).
Fig. 4. (а) – Panx1 inhibitor, сarbenoxolone (Cbx) suppresses the development of the ltDeP but not stDeP. Overall data: black triangles show the experiments (n = 10); white circles show controls (n = 10). The abscissa shows time, min; the ordinate shows PS amplitude, %. Values are shown as mean ± error of mean; statistically significant differences between values in experiments and controls, Student’s t-test: **,* – significant (p < 0.01, p < 0.05, respectively), x – not signifcant (p > 0.05). The dotted line shows the baseline response level taken as 100% (mean PS amplitude before 60-min deprivation); the horizontal bar shows addition of Cbx (50 μM). (б) – аddition of the Cbx to the solution does not suppress the LTP induction (synchronous recording of PSs of two slices): black triangles show the experiment, white circles show controls. Tetanization is shown by the white triangle. Values are shown as mean of ten PSs amplitudes. The dotted line shows the baseline response level taken as 100% (mean of ten PSs amplitude before tetanization), the horizontal bar shows addition of Cbx (50 μM).
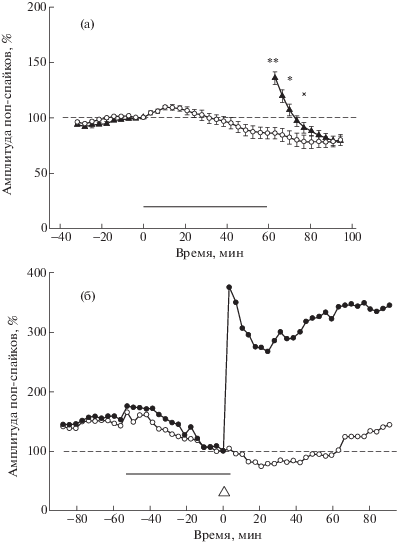
В отдельных экспериментах проверяли возможность индукции LTP на фоне блокаторов Panx1. Как пробенецид, так и Cbx не подавляли развитие NMDA-зависимой потенциации. На рис. 3 (б) показана индукция LTP на фоне 1 мМ пробенецида: через 30 мин после переключения перфузионной системы на подачу пробенецид-содержащего раствора была произведена тетанизация, отмывание раствора производили через 30 мин после тетанизации. На рис. 4 (б) показана индукция LTP на фоне 50 мкМ Cbx в эксперименте с синхронной регистрацией ПС от двух срезов, расположенных в одной инкубационной камере (обозначены значения усредненных амплитуд ПС на 10 последовательных стимулов, за 100% принята усредненная амплитуда ПС на 10 последних стимулов перед переключением ИЦСЖ на Cbx-содержащий раствор). В одном из двух срезов (опыт) через 56.5 мин после переключения на Cbx-содержащий раствор тетанизация вызвала сильную потенциацию ответов, спустя 3.5 мин перфузионную систему переключили на отмывание (таким образом индукция LTP и регистрация первых 10 ответов после тетанизации были на фоне Cbx); в другом срезе (контроль) тестовую стимуляцию не прерывали (параллельность в динамике ПС в опыте и контроле свидетельствует в пользу того, что вторичный медленный подъем амплитуды ПС после тетанизации является следствием отмывания Cbx). Эксперименты с индукцией LTP на фоне блокаторов Panx1, подавляющих развитие Ca2+-зависимой дДеП, являются дополнительным подтверждением неучастия NMDA рецепторов в развитии дДеП, а сходство “пологости” и “остроты” начальных периодов кДеП и LTP на фоне пробенецид и Cbx свидетельствует о системном побочном действии этих препаратов. В конце экспериментов для проверки сохранения жизнеспособности срезов производили стандартную процедуру тетанизации. Любопытно отметить, что во всех экспериментах с Cbx тетанизация во время отмывания препарата (даже спустя 2 ч при полном восстановлении исходного уровня ответов) приводила к повышенному уровню LTP по сравнению с потенциацией в срезах, инкубируемых в нормальной среде.
Таким образом, эксперименты свидетельствуют о вовлеченности Panx1 в Ca2+-зависимый P2 пуринорецептор-опосредованный постсинаптический механизм индукции дДеП, подтверждая предположение о том, что расположенные на постсинапсе Panx1 играют роль близкого источника АТФ.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Описание устоявшегося нейрофизиологического термина “клетка в состоянии покоя” включает в себя ряд параметров, таких как состав и концентрация основных клеточных электролитов, их электрохимические градиенты, потенциал покоя мембраны (ПП) и т.д., например, концентрация цитозольного свободного кальция ([Ca2+]i) в покоящихся клетках (∼100 нМ) на четыре порядка меньше концентрации внеклеточного кальция ([Ca2+]o), что обеспечивает кальцию функцию вторичного посредника при резком повышении [Ca2+]i [Albers, Siegel, 2006]. Однако в понятие состояния покоя не входит время, и исследования позволили скорректировать эту картину: при длительном состоянии покоя (депривации) в клетке начинают происходить сложные Ca2+-зависимые процессы, приводящие к увеличению эффективности синаптической передачи, сопоставимому с LTP. Так, в экспериментах на переживающих срезах гиппокампа крыс при тестировании связи коллатерали Шаффера – нейроны поля СА1 нами было показано, что прерывание редкой (0.05 Гц) тестовой стимуляции в течение от 10 мин до 4 ч приводит к возрастанию амплитуды популяционных ответов, названному ДеП, пропорциональному длительности депривации. Среди важных свойств ДеП были отмечены входоспецифичность и способность к длительному сохранению (более часа) [Попов, 1994; Попов, Маркевич, 2001]. Также было показано, что за развитие ДеП отвечают два независимых механизма: пресинаптический, ответственный за развитие кДеП, и Ca2+-зависимый постсинаптический, ответственный за развитие дДеП [Попов, 2016]. При этом источником цитозольного кальция, необходимого для развития дДеП, служит как внеклеточная среда, так и внутриклеточное хранилище эндоплазматического ретикулума (ЭР) [Попов, Маркевич, 2014]. ПКС-зависимость механизма дДеП и способность вступать в конкурентные взаимоотношения с механизмом развития поздней ПКС-зависимой стадии LTP [Попов, 2016; Попов, Маркевич, 2001], связанной с фосфорилированием белка [Frey et al., 1995; Reymann, 1993; Reymann et al., 1988], свидетельствуют в пользу того, что при индукции дДеП активируется Ca2+-зависимая цепь реакций, конечным звеном которой является фосфорилирование белка и, как следствие, – увеличение синаптической эффективности.
В данной работе на переживающих срезах гиппокампа с использованием модифицированной методики регистрации ПС одной популяции нейронов поля СА1 на попеременную стимуляцию двух пучков коллатералей Шаффера (модель активации двух входов одной клетки-мишени) исследовали природу механизма, лежащего в основе входоспецифичности ДеП. Достоверное увеличение амплитуды ПС одного из входов после 60-минутной депривации (опыт) и в это же время отсутствие значимых изменений ответов другого входа при его непрерывной стимуляции (контроль) подтвердили факт входоспецифичности ДеП. В то же время величина потенциации, ее длительность и сходная динамика падения ответов при “входоспецифичной” ДеП и “чистой” кДеП свидетельствовали о том, что из двух механизмов индукции ДеП входоспецифичность обеспечивается только пресинаптическим механизмом. Полученные результаты позволили внести важные коррективы в общую картину депривационной пластичности: а) входоспецифичная кДеП определяется длительностью депривации данного синапса и не зависит от “депривационного статуса” других синапсов той же клетки; б) пресинаптическая кДеП может развиваться без индукции дДеП, но при развитии последней ей сопутствует; в) для индукции дДеП требуется тотальный (или значительный) пресинаптический покой; г) в естественных условиях может складываться разнообразная и изменчивая мозаика индивидуальных пресинаптических модификаций на подпороговом для индукции дДеП уровне.
Как было показано на пирамидных клетках поля СА1 гиппокампа крыс, восстановление ПП после активации клетки происходит в четыре этапа, три из которых длятся 50–100 мс, а окончательное восстановление примерно 2% от значения ПП занимает до 1–2 с [Storm,1987]. Можно сравнить два состояния клетки: при 60-минутной депривации, вследствие которой происходит индукция ДеП, и при редкой стимуляции раз в 20 с за такой же период времени с неизменной эффективностью синаптической передачи (что соответствует опыту и контролю в наших экспериментах). Оказывается, что эти состояния в значительной степени идентичны, поскольку редко стимулируемая клетка в течение 90–95% времени находится в состоянии покоя. Известно, что потребление мозгом примерно 2/3 энергии связано с сигнализацией, при этом значительная часть расходуемой энергии связана с работой Na+/K+ насоса [McKenna et al., 2012]. Зная, что потребление энергии каждым ПД в 1.6 раза больше потребления энергии в секунду при ПП [Attwell, Laughlin, 2001], можно рассчитать отличие потребления энергии в клетке в течение 20 с при одном ПД и при “чистом” ПП за 20 с. Пусть E – потребление энергии в клетке при ПП за 1 с, тогда на один ПД клетка затратит 1.6 E. Потребление энергии в клетке за 20 с при одном ПД составит 1.6 E +20 E = 21.6 Е (длительность ПД $ \ll $ 1 с, здесь можно пренебречь), а на поддержание ПП в течение этого же периода потребуется 20 E. Отношение энергопотребления за 20 с в двух случаях будет 21.6 Е/20 E ≈ ≈ 1.08. То есть энергопотребление клетки в течение одного 20-секундного периода при ее активации с частотой 0.05 Гц будет на 8% больше, чем при депривации, и за период чуть более 4 мин это отличие достигнет двукратной величины (расчет для ЛП до запуска Ca2+-зависимого механизма). Существенное отличие энергопотребления клетки при депривации и последующей индукции дДеП от энергопотребления при редкой активации клетки и стабильной эффективности синаптической передачи, несмотря на значительное сходство этих состояний, дало основание для предположения, что механизм индукции дДеП связан с АТФ.
Известно, что АТФ является главным внутриклеточным источником энергии, а также способен выполнять функцию экстраклеточного посредника, влияющего на различные долговременные процессы [Burnstock, 2013; Burnstock,Verkhratsky, 2012]. Действие АТФ опосредуется через P2 пуринорецепторы, состоящие из двух семейств: ионотропных P2X рецепторов и метаботропных G-протеин-опосредуемых P2Y рецепторов. В противоположность NMDA рецепторам (потенциал-зависимым кальциевым каналам), P2X рецепторы выполняют функцию кальциевых каналов при мембранном ПП, а стимуляция P2Y рецепторов через активацию сигнальных каскадов приводит к высвобождению Ca2+ из ЭР [Pankratov et al., 2009]. Это соответствует условию индукции дДеП, зависимой как от внеклеточного, так и депонированного внутриклеточного Ca2+ [Попов, 2016].
Было установлено, что в индукции дДеП участвуют не NMDA рецепторы, а P2 пуринорецепторы, и анализ показал, что из семи субъединиц семейства P2X млекопитающих (P2X1–7) и восьми субъединиц семейства P2Y (P2Y1,2,4,6,11,12–14) [Burnstock, Verkhratsky, 2012] в механизме дДеП принимают участие активируемые АТФ ионотропные P2X1 и/или P2X2 рецепторы и активируемые метаболитом АТФ, аденозиндифосфатом (АДФ), метаботропные P2Y1 рецепторы [Попов, 2016].
Известно, что мембраны клеток непроницаемы для АТФ. Основными физиологическими способами высвобождения АТФ являются везикулярное пресинаптическое (в постсинаптическом механизме индукции дДеП не участвует) и невезикулярное – диффузия через поры мембраны (диффузия через потенциал-зависимые анионные каналы также не соответствует условию индукции дДеП при ПП мембраны). Различие между цитозольной концентрацией АТФ ([АТФ]i), которая в нейронах крысы составляет 2.6 мМ, и внеклеточной ([АТФ]o), исчисляемой в нМ, создает высокий трансмембранный концентрационный градиент (6 порядков). В клетке в состоянии покоя у отрицательно заряженной молекулы АТФ концентрационный и электрический градиенты имеют наружное направление, что благоприятствует ее диффузионному выходу. В связи с наличием во внеклеточной среде эктонуклеотидаз и быстрого падения концентрации АТФ вблизи источника его выделения АТФ является молекулой “короткой дистанции”/”короткого времени жизни” (short range/short timing) [Burnstock,Verkhratsky, 2012; Dahl, 2015; Veech et al., 1979].
Открытые в 2000 г. паннексины (Panx) [Panchin et al., 2000] составляют семейство протеинов позвоночных, имеющих структурную гомологию с коннексинами, но в отличие от последних Panx не формируют щелевых контактов, а способны образовывать АТФ-проводящие каналы. Существуют три изоформы Panx(1-3). Panx1 широко представлены в клетках многих тканей, в том числе центральной нервной системы. В пирамидных клетках поля СА1 гиппокампа крыс Panx1 имеет постсинаптическую локализацию и, предположительно, участвует в образовании постсинаптического комплекса каналов. Шесть субъединиц Panx1 формируют трансмембранный канал, называемый паннексоном (pannexon), который обладает большой проводимостью и неизбирательной проницаемостью, является каналом для АТФ и способен активироваться в физиологических условиях при ПП мембраны. Кроме того, показано, что Panx1 способен вовлекаться во множество функций центральной нервной системы и участвовать в синаптической пластичности [Dahl, 2015; Lohman et al., 2019; Prochnow et al., 2012; Sosinsky et al., 2011; Thompson et al., 2008; Zoidl et al., 2007]. Panx2 обнаружены почти исключительно в нервной системе, но на субклеточном уровне локализованы внутри цитоплазмы и не могут участвовать в диффузии АТФ во внеклеточную среду, а Panx3 в основном имеют внутриклеточную локализацию, играют функциональную роль в высвобождении Ca2+ из ЭР, однако экспрессия Panx3 показана в клетках кожи, кости, хряща и улитки (cochlea) [Boassa et al., 2015; Dahl, 2015; Li et al., 2018; Lohman, Isakson, 2014; Zhao, 2016]. Все это дало основание для предположения, что роль “близкого источника” АТФ в механизме индукции дДеП могут играть Panx1.
Для проверки этой гипотезы в наших экспериментах были использованы два известных ингибитора Panx1: Cbx, обладающий наибольшей способностью подавлять Panx1-индуцированные токи (IC50 ∼ 5 мкМ), и наименее активный в ряду ингибиторов Panx1 пробенецид (IC50 ∼ 350 мкМ). При концентрациях Cbx 50 мкМ и пробенецида 1 мМ оба препарата оказывают значительное подавление Panx1 токов (≥70%) [Ma et al., 2009].
В опыте по сравнению с контролем как Cbx (50 мкМ), так и пробенецид (1 мМ) подавляли развитие длительного компонента ДеП, тогда как начальный кратковременный пресинаптический компонент сохранялся, что подтвердило предположение об участии Panx1 в механизме индукции постсинаптического компонента ДеП.
Существует разными путями активируемые несколько аллостерических подсостояний Panx1 каналов. По одним данным их два: подсостояние с низкой проводимостью (50 пСм) и АТФ-непроницаемостью и подсостояние с высокой проводимостью (500 пСм) и АТФ-проницаемостью [Dahl, 2015]. Согласно другим исследованиям открытых подсостояний насчитывается до пяти: с проводимостью 5, 25, 30 и 90% от полностью открытого состояния [Bond, Naus, 2014]. Первые три подсостояния не обеспечивают АТФ-проводимость, и при используемых в настоящей работе концентрациях Cbx и пробенецида, подавляющих >70% Panx1-токов, АТФ-проницаемость практически невозможна, поскольку для этого необходимо, чтобы паннексон был полностью открытым или находился в подсостоянии с проводимостью 90% от полностью открытого состояния.
Большое количество работ, посвященных исследованию Panx1, были проведены на разных клетках разных животных с использованием широкого спектра методов. Можно полагать, что основные свойства Panx1 являются универсальными для разных клеток, тогда как функциональная роль Panx1 в клетке может определяться ее типом. Иммунологическими методами было показано функциональное и физическое взаимодействие между АТФ-активируемыми каналами и Panx1, и что в АТФ-опосредованную активацию Panx1 через разные механизмы вовлечены оба класса P2 пуринорецепторов – субъединицы P2X2/3/4/7 и P2Y1/2/6 [Bond, Naus, 2014; Lohman, Isakson, 2014], из которых P2X2 и P2Y1 были определены как вероятные участники механизма индукции дДеП [Попов, 2016]. Также показано, что в физиологических условиях Panx1 каналы могут открываться при повышении [Ca2+]i [Locovei et al., 2006].
АТФ-индуцированный Panx1-опосредованный выход АТФ можно описать “зеркально” как Ca2+-индуцированное P2 пуринорецептор-опосредованное повышение [Ca2+]i. Данный процесс как две стороны одной медали представляет собой единый АТФ-/Ca2+-зависимый механизм положительной обратной связи, создающий условия для резкого подъема [Ca2+]i. Одним из эффектов увеличения [Ca2+]i до 10–6 M является активация PKC [Nelson, Cox, 2013], участвующей в механизме индукции дДеП [Попов, Маркевич, 2001]. Без ограничительных механизмов положительная обратная связь потенциально опасна возможностью потери необходимой для жизнедеятельности клетки АТФ [Locovei et al., 2006] и возможностью накопления в клетке Ca2+ и гибели клетки через апоптоз [Parekh, 2011]. При достижении [АТФ]o вблизи Panx1 в 50–100 раз более высокой, чем она необходима для активации P2 пуринорецепторов, происходит связывание АТФ с Panx1 белком и перекрывание прохода паннексона (отрицательная обратная связь) [Dahl, 2015; Qiu et al., 2012]. После прекращения выхода АТФ и активации P2 пуринорецепторов работа Ca2+ насосов восстанавливает низкую [Ca2+]i с затратой энергии АТФ: АТФаза цитоплазматической мембраны (PMCA) обеспечивает выведение Ca2+ из клетки, а Ca2+ АТФаза ЭР (SERCA) – реабсорбцию Ca2+ в депо ЭР [Nelson, Cox, 2013]. Резкий подъем и последующее падение [Ca2+]i приводят к формированию Ca2+ спайка. При сохранении инициирующего фактора процесс обретает циклический характер с образованием внутриклеточных Ca2+ осцилляций. Такие колебания [Ca2+]i наблюдаются во всех типах клеток и представляют универсальный принцип сигнализации [Parekh, 2011]. По сравнению с постоянным увеличением [Ca2+]i переменный Ca2+ сигнал имеет ряд преимуществ: избегается токсический эффект длительного Ca2+ сигнала; отсутствует эффект десенсибилизации Ca2+-зависимых ответов, что дает возможность поддерживать долговременные клеточные ответы; увеличивается соотношение сигнал/шум, таким образом повышается чувствительность на сигнал низкого уровня; в кодировке кальциевого сигнала играет роль не только амплитуда и частота, но и расположение Ca2+ каналов. Частота Ca2+ осцилляций может отличаться у разных клеток и находится в диапазоне примерно 0.01–0.03 Гц [Parekh, 2011; Rooney et al., 1990]. (Любопытно отметить, что эти значения пересекаются с диапазоном частот пресинаптической активации при стабильных ответах.)
АТФ-/Ca2+-/ПКС-зависимость постсинаптического механизма индукции дДеП, уникальные свойства участвующих в этом механизме постсинаптического комплекса Panx1 и P2 пуринорецепторов, взаимовлияние АТФ и Ca2+ сигнальных систем, развитие потенциации во время депривации, пропорциональность величины дДеП длительности депривации и, как следствие, – “кальциевый парадокс” дДеП (длительный Ca2+-зависимый физиологический процесс и опасность гибели клетки при накоплении Ca2+ в цитоплазме) в совокупности свидетельствуют в пользу того, что механизм индукции дДеП является циклическим. Это позволяет периодически возникающими спайками Ca2+ без опасных для клетки последствий активировать Ca2+-зависимую ПКС с последующей модификацией AMPA (и NMDA?) рецепторов посредством фосфорилирования белка, в результате чего происходит возрастание эффективности синаптической передачи.
В любом сопряженном клеточном процессе важными являются как концентрация участвующих в этом процессе структурных элементов (молекул, атомов, ионов), так и их количественное соотношение, например, соотношение молекул АТФ и ионов Ca2, участвующих в одном АТФ-/Ca2+-зависимом цикле индукции дДеП. Известно, что в 1 л раствора 1 М концентрации вещества содержится одинаковое количество структурных элементов, равное постоянной Авогадро (NA). Тогда в некой клетке с объемом цитоплазмы V (л) количество элементов при концентрации 1 М будет (VNА), а при концентрации C (М) количество элементов будет C(VNА), где (VNА) = = const для данной клетки. Известно, что в цитоплазме клетки в состоянии покоя [Ca2+]i < < 10–7 М [Nelson, Cox, 2013]. Тогда количество ионов Ca2+ в клетке можно оценить числом <10–7(VNА). Активация ПКС, участвующей в механизме индукции дДеП, происходит при возрастании [Ca2+]i до ≥10–6 М [Nelson, Cox, 2013]. При такой концентрации количество ионов Ca2+ будет ≥10–6(VNА), соответственно численный прирост ионов Ca2+ будет >≈10–6(VNА). Если значение стационарной [АТФ]i составляет ∼10–3 М [Veech et al., 1979], и для активации максимального количества любых (P2 пуриновых) рецепторов достаточно из внутриклеточного пула высвободить ≤1% АТФ [Qiu, 2010], то число молекул АТФ, выходящих из клетки при одном цикле дДеП, можно оценить числом <≈10–5(VNА). Сопоставление значений >≈10–6(VNА) для Ca2+ и <≈10–5(VNА) для АТФ показывает, что в одном АТФ-/Ca2+-зависимом цикле индукции дДеП участвует сопоставимое в пределах одного порядка количество молекул АТФ и ионов Ca2+.
Каков бы ни был механизм инициации циклического АТФ-/Ca2+-зависимого процесса, можно утверждать, что 1) он протекает в постсинаптической клетке, 2) существует ЛП, во время которого состояние клетки претерпевает существенные изменения (“взведение пружины”), 3) пусковой фактор должен быть связан либо с высвобождением АТФ, либо с повышением [Ca2+]i. Во время ЛП при ПП мембраны NMDA рецепторы и P2 пуринорецепторы неактивны, основные Ca2+ каналы закрыты и [Ca2+]i стабильна, тогда как для АТФ расчеты показали (выше), что в этот период происходит значительное уменьшение энергопотребления клетки, что может вызвать повышение [АТФ]i (в этом случае ЛП можно трактовать в терминах концентрационных изменений до порогового значения). Предполагаемое повышение [АТФ]i не противоречит существованию в клетке регуляторного механизма поддержания [АТФ]i, компенсирующего потери энергии (стабилизация “снизу”). Известно, что мозг млекопитающих практически не имеет хранилища источника энергии [Nelson, Cox, 2013], роль же пресинаптических АТФ-содержащих везикул отличается от ЭР как хранилища Ca2+. Можно предположить, что Panx1-опосредованное высвобождение АТФ является одним из способов регулирования [АТФ]i (стабилизация “сверху”). После высвобождения АТФ меняет свою функцию с энергетической на информационную. Теоретически влияние повышения [АТФ]i на активацию Panx1 может быть опосредованным, например, через АМФ. Известно, что концентрация аденозинмонофосата ([АМФ]i) является более чувствительным индикатором энергетического состояния клетки, чем [АТФ]i: изменение [АТФ]i на 1% влечет за собой изменение [АМФ]i на 60% [Nelson, Cox, 2013] (при депривации это соотношение может быть бóльшим). Другая теоретическая возможность инициации может быть связана с активацией P2X рецепторов эндогенной АТФ [Pankratov et al., 2009], тогда повышение [АТФ]i могло бы привести к возникновению локального P2X-опосредованного Ca2+ импульса, запускающего циклический механизм индукции дДеП.
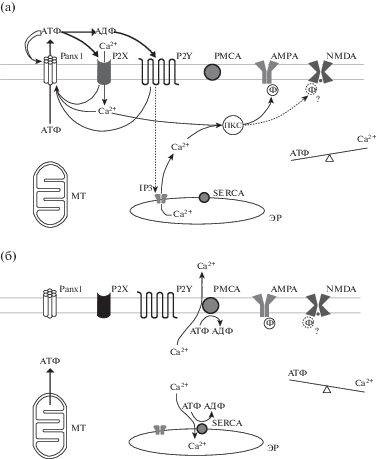
На рис. 5 показана рабочая модель АТФ-/Ca2+-зависимого Panx1-/P2 пуринорецептор-опосредованного цикла индукции дДеП. В острой фазе (а) сопоставимое количество АТФ и Ca2+ движутся по направлению их градиентов, вследствие резкого повышения [Ca2+]i и образования Ca2+ импульса происходит активация ПКС и фосфорилирование белка AMPA (и NMDA?) рецепторов. В фазе восстановления (б) происходит снижение [Ca2+]i, а поступление в цитоплазму АТФ из митохондрий (МХ) компенсирует потери АТФ при высвобождении АТФ через Panx1 каналы и при работе Ca2+ насосов (АТФ/Ca2+ “качели” восстанавливаются). Сохранение инициирующего фактора – депривации – способствует возобновлению процесса, который приобретает циклический характер. Для упрощения в представленном виде отсутствует пресинаптический компонент – усиление ответа предположительно за счет увеличения выброса медиатора.
Рис. 5.
Модель циклического постсинаптического механизма индукции длительного компонента ДеП. (а) – фаза активации: активация Panx1 каналов приводит к высвобождению АТФ, эктонуклеотидазы расщепляют АТФ до АДФ, АТФ активирует ионотропные P2X(1/2) пуринорецепторы, вследствие чего Ca2+ входит в клетку, АДФ активация метаботропных G-протеин-опосредуемых P2Y1 рецепторов приводит к высвобождению Ca2+ из эндоплазматического ретикулума (ЭР) через инозитол трифосфат (IP3) рецепторы. Резкое возрастание [Ca2+]i активирует протеинкиназу С (ПКС), вследствие чего происходит фосфорилирование AMPA (и NMDA?) рецепторов и увеличение эффективности синаптической передачи. (б) – фаза восстановления: значительное повышение [АТФ]o вблизи Panx1 каналов приводит к их блокированию, прекращению высвобождения АТФ и инактивации P2 пуринорецепторов. Работа Ca2+ насосов приводит к восстановлению низкой [Ca2+]i (PMCA выводит Ca2+ из цитоплазмы во внеклеточную среду, SERCA захватывает Ca2+ в ЭР хранилище), потери АТФ компенсируются поступлением АТФ из митохондрий (МТ).
Fig. 5. A model of the cyclic postsynaptic mechanism of induction of the long-term DeP component. (а) – activation phase: activation of Panx1 channels leads to the release of ATP, extracellular ATP is broken down by ectonucleotidases to ADP, ATP activates the ionotropic P2X(1/2) receptors, as a result of which Ca2+ enters the cell, ADP activation of the metabotropic G-protein-mediated P2Y1 receptors leads to the release of Ca2+ from the endoplasmic reticulum (ER) via inositol triphosphate (IP3) receptors. A sharp increase in [Ca2+]i activates protein kinase C (PKC), resulting in phosphorylation of the AMPA (and NMDA?) receptors and increase the efficiency of synaptic transmission. (б) – restoring phase: a significant increase in [ATP]o near Panx1 channels leads to blocking them, cessation of ATP release and inactivation of P2 purinoreceptors. The Ca2+ pumps function to restore a low [Ca2+]i (PMCA removes Ca2+ from the cytoplasm into the extracellular medium, SERCA transfers Ca2+ to the ER storage), ATP losses are compensated by the entry of ATP from mitochondria (МТ).
ВЫВОДЫ
1) ДеП обладает свойством входоспецифичности или способностью к увеличению эффективности синаптической передачи в депривируемом входе независимо от пресинаптической активности других входов.
2) Входоспецифичность ДеП обеспечивается только пресинаптическим механизмом, ответственным за развитие кратковременного компонента ДеП.
3) Для развития долговременного постсинаптического компонента требуется полный (или значительный) пресинаптический покой.
4) Роль источника АТФ, необходимого для активации P2 пуринорецепторов в (циклическом) АТФ-/Ca2+-зависимом постсинаптическом механизме индукции долговременного компонента ДеП, выполняют паннексины-1.
Работа выполнена при поддержке Российской академии наук и Российского фонда фундаментальных исследований (грант № 19-515-52001).
Список литературы
Попов В.А. Спонтанная потенциация фокальных потенциалов поля СА1 в длительно переживающих гиппокампальных срезах крысы при отсутствии электрической стимуляции. Журн. высш. нерв. деят. им. И.П. Павлова. 1994. 44 (1): 149–158.
Попов В.А., Маркевич В.А. Развитие медленной потенциации популяционного спайка длительно не стимулируемого входа у крыс в состоянии наркотического сна. Журн. высш. нерв. деят. им. И.П. Павлова. 1999. 49 (4): 689–693.
Попов В.А., Маркевич В.А. Исследование механизма развития “депривационной” потенциации популяционных ответов нейронов поля СА1 на переживающих срезах гиппокампа. Журн. высш. нерв. деят. им. И.П. Павлова. 2001. 51 (5): 598–603.
Попов В.А., Маркевич В.А. Ключевая роль кальция в механизме депривационной потенциации популяционных ответов нейронов поля СА1 гиппокампа. Журн. высш. нерв. деят. им. И.П. Павлова. 2014. 64 (1): 54–63.
Попов В.А. Пре- и постсинаптический механизмы депривационной потенциации популяционных ответов нейронов поля СА1 гиппокампа крыс. Журн. высш. нерв. деят. им. И.П. Павлова. 2016. 66 (2): 209–219.
Albers R.W., Siegel G.J. Membrane transport. In: G.J. Siegel (Editor-in-chief), Basic Neurochemistry (molecular, cellular and medical aspects), N.Y.: Elsevier Academic Press. 2006. P. 73–94.
Attwell D., Laughlin S.B. An energy budget for signaling in the grey matter of the brain. Journal of Cerebral Blood Flow and Metabolism. 2001. 21: 1133–1145.
Bliss T.V.P., Lømo T. Long-Lasting potentiation of synaptic transmission in the dentate area of the anesthetized rabbit following stimulation of the perforant path. J. Physiol. 1973. 232: 331–356.
Boassa D., Nguyen Ph., Hu J., Ellisman M.H., So-sinsky G.E. Pannexin2 oligomers localize in the membranes of endosomal vesicles in mammalian cells while Pannexin1 channels traffic to the plasma membrane. Front. Cell. Neurosci. 2015. 8 (468): 1–15.
Bond S.R., Naus C.C. The pannexins: past and present. Front. Physiol. 2014. 5 (58): 1–24.
Burnstock G. Purinergic signalling: pathophysiology and therapeutic potential. Keio J. Med. 2013. 62 (3): 63–73.
Burnstock G., Verkhratsky A. Purinergic Signalling and the Nervous System. Berlin. Springer-Verlag. 2012. XVIII. 715 p.
Dahl G. ATP release through pannexon channels. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 2015. 370 (1672): 20140191.
Frey U., Schollmeier K., Reymann K.G., Seidenbecher T. Asymptotic hippocampal long-term potentiation in rats does not preclude additional potentiation at later phases. Neuroscience. 1995. 67 (4): 799–807.
Li S., Bjelobaba I., Stojilkovic S.S. Interactions of Pannexin1 channels with purinergic and NMDA receptor channels. Biochim. Biophys. Acta Biomembr. 2018. 1860 (1): 166–173.
Locovei S., Wang J., Dahl G. Activation of pannexin 1 channels by ATP through P2Y receptors and by cytoplasmic calcium. FEBS Lett. 2006. 580 (1): 239–244.
Lohman A.W., Isakson B.E. Differentiating connexin hemichannels and pannexin channels in cellular ATP release. FEBS Lett. 2014. 588: 1379–1388.
Lohman A.W., Weilingerc N.L., Santos S.M.F., Bialecki J., Werner A.C., Anderson C.L., Thompson R.J. Regulation of pannexin channels in the central nervous system by Src family kinases. Neurosci. Lett. 2019. 695: 65–70.
Lynch G.S., Dunwiddie T., Gribkoff V. Heterosynaptic depression: a postsynaptic correlate of long-term potentiation. Nature. 1977. 266: 737–739.
Ma W., Hui H., Pelegrin P., Surprenant A. Pharmacological characterization of Pannexin-1 currents expressed in mammalian cells. J. Pharmacol. Exp. Ther. 2009. 328 (2): 409–418.
McKenna M.C., Dienel G.A., Sonnewald U., Waagepetersen H.S., Schousboe A. Energy metabolism of the brain. In: Brady S.T., Siegel G.J., Albers R.W., Price D.L. (eds), Basic neurochemistry: principles of molecular, cellular and medical neurobiology, 8th edition, Amsterdam, Boston, Heidelberg, London, New York, Oxford, Paris, San Diego, San Francisco, Singapore, Sydney, Tokyo: Elsevier-Academic Press. 2012. P. 200–231.
Nelson D.L., Cox M.M. Lehninger principles of biochemistry, 6th ed. W.H. Freeman and Company. New York. 2013.
Panchin Y., Kelmanson I., Matz M., Lukyanov K., Usman N., Lukyanov S. Aubiquitous family of putative gap junction molecules. Curr. Biol. 2000. 10: R473–R474.
Pankratov Y., Lalo U., Krishtal O.A., Verkhratsky A. P2X receptors and synaptic plasticity. Neurosci. 2009. 158 (1): 137–148.
Parekh A.B. Decoding cytosolic Ca2+ oscillations. Trends Biochem. Sci. 2011. 36 (2): 78–87.
Prochnow N., Abdulazim A., Kurtenbach S., Wildförster V., Dvoriantchikova G., Hanske J., Petrasch-Parwez E., Shestopalov V.I., Dermietzel R., Manahan-Vaughan D., Zoidl G. Pannexin1 Stabilizes Synaptic Plasticity and Is Needed for Learning. PLoS ONE, 2012. 7 (12): e51767.
Qiu F. Regulation of Pannexin 1 channels by ATP. 2010. Open Access Dissertations. 394.
Qiu F., Wang J., Dahl G. Alanine substitution scanning of pannexin1 reveals amino acid residues mediating ATP sensitivity. Purinergic Signal. 2012. 8: 81–90.
Reymann K.G. Mechanisms underlying synaptic long-term potentiation in the hippocampus: focus on postsynaptic glutamate receptors and protein kinases. Funct. Neurol. Suppl. 1993. 8 (5): 7–32.
Reymann K.G., Frey U., Jork R., Matthies H. Polymyxin B, an inhibitor of protein kinase C, prevents the maintenance of synaptic long-term potentiation in hippocampal CA1 neurons. Brain Res. 1988. 440 (2): 305–314.
Rooney T.A., Sass E.J., Thomas A.P. Agonist-induced cytosolic calcium oscillations originate from a specific locus in single hepatocytes. J. Biol. Chem. 1990. 265 (18): 10792–10796.
Storm J.F. Action potential repolarization and a fast after-hyperpolarization in rat hippocampal pyramidal cells. J. Physiol. 1987. 385: 733–759.
Sosinsky G.E., Boassa D., Dermietzel R., Duffy H.S., Laird D.W., MacVicar B.A., Naus C.C., Penuela S., Scemes E., Spray D.C., Thompson R.J., Zhao H.-B., Dahl G. Pannexin channels are not gap junction hemichannels. Channels (Austin, Tex.). 2011. 5 (3): 193–197.
Thompson R.J., Jackson M.F., Olah M.E., Rungta R.L., Hines D.J., Beazely M.A., MacDonald J.F., MacVicar B.A. Activation of pannexin-1 hemichannels augments aberrant bursting in the hippocampus. Science. 2008. 322: 1555–1559.
Veech R.L., Lawson J.W.R., Cornell N.W., Krebs H.A. Cytosolic phosphorylation potential. J. Biol. Chem. 1979. 254 (14): 6538–6547.
Weickert S., Ray A., Zoidl G., Dermietzel R. Expression of neural connexins and pannexin1 in the hippocampus and inferior olive: a quantitative approach. Mol. Brain Res. 2005. 133: 102–109.
Zhao H.-B. Expression and function of pannexins in the inner ear and hearing. BMC Cell Biology. 2016. 17 (Suppl. 1): 16.
Zoidl G., Petrasch-Parwez E., Ray A., Meier C., Bunse S., Habbes H.-W., Dahl G., Dermietzel R. Localization of the pannexin1 protein at postsynaptic sites in the cerebral cortex and hippocampus. Neurosci. 2007. 146 (1): 9–16.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


