Журнал высшей нервной деятельности им. И.П. Павлова, 2020, T. 70, № 3, стр. 351-359
ВОЗРАСТНЫЕ ИЗМЕНЕНИЯ РАННИХ ОСТРЫХ ВОЛН В ГИППОКАМПЕ НОВОРОЖДЕННЫХ КРЫС
В. В. Шумкова 1, В. Р. Ситдикова 1, Д. С. Сучков 1, М. Г. Минлебаев 1, 2, *
1 НИЛ нейробиологии, Казанский федеральный университет
Казань, Россия
2 Средиземноморский институт нейробиологии
Марсель, Франция
* E-mail: minlebaevm@mail.ru
Поступила в редакцию 18.07.2019
После доработки 02.12.2019
Принята к публикации 16.12.2019
Аннотация
Отличительной чертой нейронных сетей является наличие синхронизированной активности. К одному из типов такой активности относят ранние острые волны (рОВ) – синхронные сетевые разряды нейронных ансамблей, наблюдаемые в развивающемся гиппокампе. Несмотря на то что рОВ могут играть центральную роль в координации нейронной активности и формировании гиппокампальных функций, мало что известно об изменениях рОВ во время раннего постнатального периода. В экспериментах на новорожденных крысятах с помощью многоканальных внеклеточных электродов мы показали, что в течение первых двух постнатальных недель наряду с уменьшением длительности рОВ наблюдаются их учащение и рост амплитуды. Мы также наблюдали усиление внеклеточно зарегистрированной активности нейронов пирамидного слоя гиппокампа. На основании полученных данных мы предполагаем, что динамика изменений рОВ и общей сетевой гиппокампальной активности связана с развитием гиппокампальной нейронной сети и восходящих нейромодуляторных проекций.
Островолновые события, или острые волны (ОВ, sharp-wave, SPW) являются наиболее синхронным ритмом сетевой активности взрослого гиппокампа [Buhl, Buzsáki, 2005]. ОВ наблюдаются во время медленноволнового сна, состояния неподвижности и в периоды, когда животное умывается или принимает пищу [Lebovitz et al., 1971; MacVicar, Dudek, 1980]. Несмотря на то что на ранних этапах постнатального развития ранние ОВ (рОВ) регистрируются в состоянии покоя животного, в экспериментах с одновременной регистрацией электрической гиппокампальной и двигательной активности животного была показана высокая корреляция между спонтанными миоклоническими подергиваниями и рОВ [Valeeva et al., 2019]. рОВ, также как и ОВ, представляют собой высокоамплитудные колебания локального полевого потенциала, длящиеся от 30 до 300 мс. Но в отличие от ОВ, имеющих наибольшую мощность входящего тока на глубине радиального слоя, рОВ характеризуются наличием двух “стоков” тока: в радиальном и лакунозно-молекулярном слоях гиппокампа [Leinekugel et al., 2002; Sullivan et al., 2011; Laurent et al., 2015; Valeeva et al., 2019]. В то время как у взрослого животного ОВ сопровождаются высокочастотными колебаниями полевого потенциала в пирамидном слое гиппокампа (риппл) [Buzsáki et al., 1992; Traub, Bibbig, 2000], в незрелом мозге рОВ часто сопровождаются множественным спайкованием клеток пирамидного слоя, формирующими так называемый “хвост”, следующий за рОВ в течение нескольких секунд [Leinekugel et al., 2002]. Первые рОВ наблюдаются начиная со второго постнатального дня [Karlsson et al., 2006; Mohns et al., 2007; Mohns, Blumberg, 2008]. Начиная со второй недели появляются взрослые ритмы активности (тета- и гамма-осцилляции, риппл) [Buzsáki et al., 2003; Buhl, Buzsáki, 2005]. Несмотря на то что ранний постнатальный период характеризуется процессами активного формирования гиппокампальных нейронных сетей и установлением его функций, мало что известно о возрастных изменениях гиппокампальных паттернов активности в этот период. В настоящей работе нами была предпринята попытка описать возрастной профиль рОВ в первые две недели после рождения грызуна. Полученные данные показали, что в ходе взросления животного наблюдалось постепенное увеличение амплитуды рОВ, наблюдаемое как в краевом (oriens), так и в радиальном (radiatum) слоях СА1 отдела гиппокампа. Увеличение амплитуды рОВ сопровождалось уменьшением его длительности. Наряду с изменением амплитудно-временных параметров мы также наблюдали учащение рОВ и увеличение количества внеклеточно регистрируемых потенциалов действия. Похожие результаты показал анализ длительности сетевой активности, где было обнаружено постепенное увеличение уровня сетевой активности. Мы предполагаем, что прогрессивные изменения рОВ обусловлены развитием гиппокампальных нейронных сетей, в то время как увеличение общей гиппокампальной активности и частоты рОВ может быть связано как с развивающейся двигательной активностью животного, так и с модуляторным действием восходящих проекций ретикулярной формации.
МЕТОДИКА
Все экспериментальные протоколы с использованием животных создавались в соответствии с требованиями Национального института здоровья и медицинских исследований Франции (Инсерм, протокол N007.08.01) и Казанского федерального университета по использованию лабораторных животных (разрешение этического комитета по заботе и помощи животным Казанского федерального университета, N9-2013). Эксперименты проводились в соответствии с Директивой Совета Евросоюза от 24 ноября 1986 г. (86/609/EEC).
Хирургия. Для проведения экспериментов использовались крысы линии Wistar обоих полов возраста Р4–Р11, где Р0 соответствует дню рождения крысенка. Хирургические вмешательства проводились под изофлурановой анестезией (индукционная концентрация изофлюрана 5% и поддерживающая концентрация 2%). Дорсальная часть черепа животного очищалась от кожи и надкостницы, после чего покрывалась зубным цементом быстрого затвердевания за исключением области 5 × 5 мм2 над гиппокампом. Для фиксации и обездвиживания головы животного к цементу прикреплялся металлический держатель, второй конец которого фиксировался к стереотаксическому аппарату. С целью обеспечения анестезии во время последующей электрофизиологической регистрации, во время проведения хирургического вмешательства животному инъецировался анестетик – уретан в концентрации 1 г/кг. Во время эксперимента животное дополнительно подогревалось до физиологической температуры 35–37°C с помощью нагревательного коврика.
Регистрация электрической гиппокампальной активности, а именно локального полевого потенциала (ЛПП) и множественной нейронной активности (МНА) проводилась в СА1 отделе гиппокампа с использованием 16-канального электрода на кремниевой основе (50–100 мкм расстояние между электродами в зависимости от типа используемого электрода, Neuronexus Technologies, USA). Электрод вводился в гиппокамп, используя стереотаксические координаты – –1.6 – –2.6 мм в передне-заднем направлении и 2–4.5 мм в медиолатеральном направлении от брегмы. Координаты рассчитывались с использованием атласа мозга новорожденного крысенка [Khazipov et al., 2015] и корректировались в зависимости от возраста животного. Глубина погружения электрода в среднем составляла 2600–3300 мкм, однако основным критерием было наличие МНА пирамидного слоя СА1 отдела гиппокампа на 5-м или 6-м каналах электрода. Для последующей гистологической реконструкции следа электрода перед погружением в мозг животного поверхность электрода покрывалась растворенным в этаноле флуоресцентным маркером (DiI, Sigma, USA). Серебряная проволока, погруженная в мозжечок, служила земляным электродом. Сигналы, зарегистрированные электродами, усиливались и фильтровались (×10 000; в диапазоне от 0.15 Гц до 10 кГц) с помощью усилителя Digital Lynx SX (Neuralynx, USA) с последующей записью на жесткий диск компьютера с частотой аквизиции 16 000 Гц. Спонтанная гиппокампальная активность регистрировалась в течение 1–2 ч для последующего анализа.
Морфология. После регистрации электрофизиологической активности животные умерщвлялись инъекцией летальной дозы уретана (3 г/кг, интраперитонеально). Мозг животного извлекался и фиксировался путем помещения в раствор 4% параформальдегида. По прошествии нескольких дней мозги промывались полифосфатным буфером (Sigma, USA) и резались на срезы толщиной 200 мкм в корональной проекции с использованием вибратома (Thermo Scientific, USA). Корональные срезы использовались для идентификации многоканального электрода в гиппокампе. Глубина регистрирующих электродов определялась по флуоресцентному следу маркера DiI (которым были покрыты электроды), наложенному на микрофотографию среза, окрашенного метиленовым синим.
Анализ. Электрофизиологическая регистрация, сделанная в широкополосном диапазоне, проходила предобработку с помощью написанных функций в среде Матлаб (MathWorks, USA). Исходный сигнал фильтровался полосным фильтром с полосой пропускания 200–2000 Гц. Все события, чья амплитуда превышала 3 стандартных девиации, считались внеклеточно зарегистрированными потенциалами действия. После детекции МНА частота аквизиции исходного сигнала снижалась до 1000 Гц для последующей детекции рОВ, которая проводилась в 2 этапа. Первый этап состоял из автоматической детекции. Для этого ЛПП пропускался через полосный фильтр Чебышева (1–100 Гц). Все события, чья амплитуда превышала 3 стандартных девиации колебаний ЛПП, считались как потенциальные рОВ. На втором этапе все задетектированные события проверялись оператором вручную. Событие засчитывалось как рОВ при соблюдении ряда критериев: а) наличие реверсии в пирамидном слое СА1 региона и б) отсутствие боковых “плеч”, говорящих о том, что событие является частью осцилляции.
Чтобы избежать ошибки в определении глубины генерации рОВ, связанной с пассивным распространением полевого потенциала, мы использовали методику анализа плотности источников тока, разработанную и описанную группой Фримана [Nicholson et al., 1975].
Для описания возрастных изменений рОВ в каждом эксперименте рассчитывались следующие параметры: частота рОВ в минуту, их амплитуда в радиальном и краевом слоях, частота МНА, также проводилась оценка ассоциированной с рОВ МНА в 1 с окне после рОВ события.
В процессе статистической обработки использовалась Джекнайф девиация, отражающая доверительный интервал (Chronux toolbox, Pesaran, 2008). На рисунках границы доверительного интервала представлены в виде серой области, окружающей усредненные значения. Динамика возрастных изменений амплитудно-временных параметров рОВ и МНА представлены в виде диаграмм размаха, где средняя линия отражает медиану, верхние и нижние контуры “коробки” соответствуют нижнему и верхнему квартилю, а усы характеризуют минимальное и максимальное значение выборки. Результаты индивидуальных экспериментов представлены окружностями. В тексте приведены медианы разбросов зарегистрированных параметров. Для оценки взаимосвязи анализируемых параметров рассчитывался коэффициент ранговой корреляции Спирмена (rs), относящийся к непараметрическим методам статистического изучения связи между явлениями. Статистическая значимость коэффициента корреляции Спирмена определялась с помощью теста перестановки, встроенного в пакет Matlab.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Возрастные изменения частоты и амплитудно-временных параметров рОВ. С целью ответить на вопрос о возрастных изменениях амплитудно-временных и частотных параметров рОВ были проведены серии экспериментов in vivo на новорожденных крысятах возраста Р4–P11. Активность регистрировалась в СА1 регионе гиппокампа с помощью многоканального электрода на кремниевой основе, что позволяло отслеживать активность одновременно от разных слоев гиппокампа (рис. 1). Анализ нейронной активности в СА1 регионе показал, что начиная с записей на самых маленьких животных (Р4, n = = 2 животных) наиболее высокоамплитудные рОВ наблюдались в лакунозно-молекулярном слое (–130.3 мкВ, табл. 1). При этом ЛПП рОВ реверсировал на границе радиального и пирамидного слоев, в краевом слое рОВ характеризовались положительно направленным колебанием ЛПП (72.48 мкВ, табл. 1, рис. 1 (б, в)). Мы также обнаружили, что в течение первых двух постнатальных недель происходит достоверное увеличение амплитуды рОВ в радиальном слое СА1 региона гиппокампа (коэффициент пропорциональности k = –29, rs = 0.73, p < 0.05), в то время как в краевом слое увеличение амплитуды рОВ было незначительное и недостоверное (k = 3.2, rs = 0.5, p > 0.1, рис. 2 (а, б)). Также отмечалось достоверное уменьшение полуширины рОВ в ходе развития крысы. В то время как у Р4 крыс полуширина рОВ составляла около 50 мс (53.4 мс, табл. 1), ближе к концу второй постнатальной недели полуширина рОВ достигала 30 мс (30.9 мс, n = 34 животных, k = –3.5 и rs = –0,95, p < 0.001, табл. 1, рис. 2 (а, в)). Наряду с возрастными изменениями амплитудно-временных параметров было обнаружено значительное учащение рОВ в несколько раз. В течение первых двух постнатальных недель частота рОВ увеличилась более чем в 5 раз (с 1.8 рОВ/мин на Р4 до 13.6 рОВ/мин на Р11, k = 1.4 и rs = 0.97, p < < 0.001, табл.1, рис. 2 (г)).
Рис. 1.
Регистрация сетевой нейронной активности в СА1 участке развивающегося гиппокампа новорожденного крысы. (а) Схема эксперимента по регистрации гиппокампальной активности у новорожденного крысы (сверху) и микрофотография фронтального среза неокортекса и гиппокампа, прокрашенная метиленовой синью с наложенным многоканальным электродом на место регистрации. (б) Эпизоды (20 с) зарегистрированной гиппокампальной активности у животных Р4 (сверху) и Р11 (снизу). Черные линии, соответствующие зарегистрированным колебаниям ЛПП на разных электродах, наложены на результаты анализа плотности источников тока, чьи результаты отражены цветовым кодом. Гиппокампальные слои, полученные по результатам морфологических исследований, показаны справа. (в) Результаты усреднения рОВ (по негативному пику), наложенные на результаты анализа плотности источников тока для экспериментов, показанных на рис. 1 (б).
Fig. 1. Registration of neuronal network activity in the CA1 region of the developing hippocampus of a newborn rat. (а) The scheme of the experiment to record hippocampal activity in the newborn rat (upper subplot) and a micrograph of the frontal section of the neocortex and hippocampus stained with a methylene blue and superimposed with the multichannel electrode on the place of recording (below). (б) Episodes (20 s) of recorded hippocampal activity in animals of P4 (upper) and P11 (below). Black lines corresponding to the recorded fluctuations of the LFP on different electrodes are superimposed on the results of the current source density analysis, (coded by color). Localization of the hippocampal layers obtained from morphological studies are shown on the right. (в) Averaged eSPW triggered by negative peak are superimposed on the results of the current source density analysis for the experiments shown in fig. 1 (б).
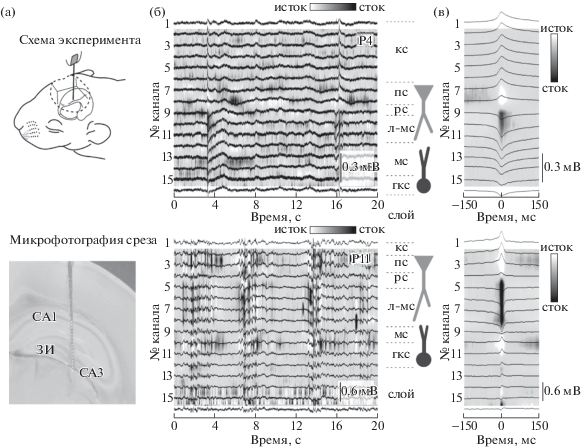
Таблица 1.
Результаты статистической обработки ЛПП и МНА Table 1. The results of statistical analysis of LFP and MUA
| Параметр | Медиана | Нижний квартиль | Верхний квартиль | Нижняя граница | Верхняя граница | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| Возраст | Р4 | Р11 | Р4 | Р11 | Р4 | Р11 | Р4 | Р11 | Р4 | Р11 |
| Амплитуда рОВ в краевом слое, мкВ | 72.5 | 105.7 | 61 | 67.5 | 84 | 108.4 | 61 | 67 | 84 | 113.1 |
| Амплитуда рОВ в радиальном слое, мкВ | –130.3 | –371 | –148.5 | –454.2 | –112.2 | –195.5 | –148.5 | –526.4 | –148.5 | –175.9 |
| Полуширина рОВ, мс | 53.4 | 30.8 | 50.6 | 28.2 | 56.3 | 34.3 | 50.6 | 28.2 | 56.3 | 34.3 |
| Частота рОВ, Гц | 1.8 | 12.6 | 1 | 11.7 | 2.6 | 16.7 | 1 | 9.2 | 2.6 | 16.7 |
| МНА общая, спайков/с | 0.8 | 10.4 | 0.7 | 3.2 | 0.9 | 59.3 | 0.7 | 1.2 | 0.9 | 62.6 |
| МНА “хвоста”, спайков/с | 1.3 | 15.6 | 1.3 | 5.7 | 1.4 | 84.4 | 1.3 | 3.6 | 1.4 | 103.6 |
Рис. 2.
Возрастные изменения амплитудно-временных параметров и частоты рОВ. (а) Результаты усреднения рОВ (по негативному пику) для краевого и радиального слоев для Р4 (слева) и Р11 (справа) крыс. Черная линия отражает усреднение, в то время как серая область соответствует доверительному интервалу. (б) Возрастные изменения амплитуды рОВ зарегистрированных в краевом (сверху) и радиальном (снизу) слоях. (в) Возрастные изменения полуширины рОВ, зарегистрированных в радиальном слое. (г) Возрастной профиль частоты рОВ. (б)–(г) Черные прямые линии отражают линейные аппроксимации (параметры указаны в тексте). Средняя линия отражает медиану, верхние и нижние контуры “коробки” соответствуют нижнему и верхнему квартилю, а усы характеризуют минимальное и максимальное значение выборки. Серые круги соответствуют результатам отдельных экспериментов.
Fig. 2. Developmental changes of amplitude-temporal parameters and frequency of eSPW. (а) Averaged eSPW triggered by negative peak for oriens and radial layers for P4 (left) and P11 (right) rats are shown. The black line reflects the averaging, while the gray area corresponds to the confidence interval. (б) Developmental changes of the amplitude of eSPWs in the str. oriens (upper) and radiatum (below). (в) Developmental changes in the half-width of eSPWs recorded in the radial layer. (г) Developmental profile of the frequency of eSPWs. (б)–(г) Black lines reflect linear approximations (parameters are specified in the text). The middle line reflects the median, the upper and lower contours of the boxplot correspond to the lower and upper quartile whereas the whiskers characterize the minimum and maximum value of the sample. Gray circles correspond to the results of individual experiments.
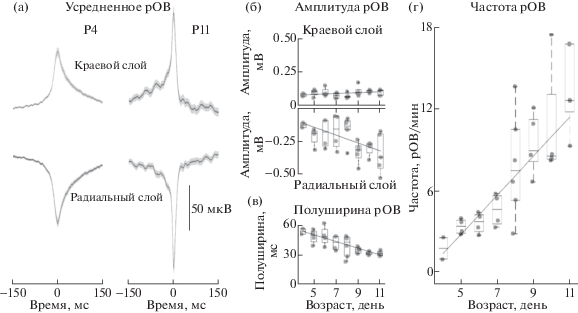
Таким образом, в течение первых двух постнатальных недель развития гиппокампа наряду со значительным учащением рОВ нами наблюдались прогрессивное увеличение их амплитуды и укорочение длительности.
Множественная нейронная активность. Для того чтобы охарактеризовать возрастные изменения частоты спайкования гиппокампальных нейронов, мы провели серию экспериментов, где оценивали общую частоту МНА в пирамидном слое СА1 региона развивающегося гиппокампа. Анализ полученных данных показал, что в течение первых двух постнатальных недель происходило прогрессивное увеличение МНА от 1 до 27 Гц (0.8 Гц у Р4 и 27.2 Гц на P11, k = 1.3, rs = 0.64, p < 0.05, n = 20 животных, табл. 1, рис. 3 (а, б)). В развивающемся гиппокампе рОВ часто сопровождаются следующей за ним множественной нейронной активностью пирамидного слоя так называемым “хвостом” (“tail”, [Karlsson, Blumberg, 2003; Leinekugel et al., 2002]). Чтобы охарактеризовать возрастные изменения МНА, ассоциированные с рОВ, мы рассчитывали МНА в окне 1 с начиная от негативного пика рОВ. Однако, несмотря на увеличение количества внеклеточно зарегистрированных потенциалов действия, следующих за рОВ с 9 спайков/с (у Р4 крыс) до 22.3 спайков/с у Р11 животных (k = 1.6, rs = = 0.45), изменения частоты МНА “хвоста” рОВ были недостоверными (p > 0.05, n = = 34 животных, табл. 1, рис. 3 (а, в)).
Рис. 3.
Возрастные изменения МНА. (а) Эпизоды (30 с) зарегистрированных ЛПП радиального слоя (ЛПП РС) и соответствующей МНА пирамидного слоя гиппокампа у животного Р4 (сверху) и Р11 (снизу). Стрелками указаны рОВ. (б) Возрастные изменения частоты МНА пирамидного слоя СА1 региона гиппокампа. (в) Возрастные изменения частоты МНА пирамидного слоя СА1 региона в окне 1 с после пика рОВ. Средняя линия отражает медиану, верхние и нижние контуры “коробки” соответствуют нижнему и верхнему квартилю, а усы характеризуют минимальное и максимальное значение выборки. Серые круги соответствуют результатам отдельных экспериментов.
Fig. 3. Developmental changes of MUA. (а) Episodes (30 s) of recorded LFP in radial layer (LFP RL) and MUA recorded hippocampal pyramidal layer MUA in animal P4 (overhand) and P11 (below). The arrows indicate the eSPW. (б) Age changes in the MUA frequency of the CA1 pyramidal layer of the hippocampus region. (в) Age changes in the MUA frequency of the CA1 pyramidal layer of the region in window 1 s after the peak of eSPW. The middle line reflects the median, the upper and lower contours of the “box” correspond to the lower and upper quartile, and the whiskers characterize the minimum and maximum value of the sample. Gray circles correspond to the results of individual experiments.
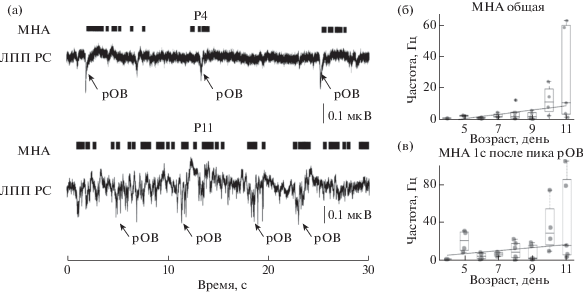
Наши результаты демонстрируют возрастное увеличение уровня спайкования нейронов пирамидного слоя СА1 региона гиппокампа. Однако учащение МНА не связано с увеличением частоты рОВ.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Основным результатом нашего исследования является впервые описанный возрастной профиль раннего сетевого гиппокампального ритма активности – рОВ. Мы показали, что наряду с увеличением общего уровня гиппокампальной активности первые две постнатальные недели характеризуются увеличением частоты и амплитуды рОВ и укорочением их длительности.
Во время развития центральной нервной системы формирование нейронных сетей в основном обусловлено генетической программой, запускаемой еще на стадии формирования эмбриона. Показано, что несмотря на внутриутробный этап развития, развивающиеся нейронные сети активно перестраиваются в зависимости от внешних факторов и возникающей в них активности [Ben-Ari, 2001; Spitzer et al., 2006]. Формирование синаптических контактов между нейронами и образование функциональных сетей сопровождаются спонтанными и вызванными сетевыми событиями, вовлекающими большие нейронные популяции. В развивающемся гиппокампе самым ранним ритмом синхронизированной нейронной активности in vivo являются ранние острые волны. рОВ – высокоамплитудные колебания локального полевого потенциала, за которыми часто следует множественное спайкование нейронов пирамидного слоя гиппокампа (“хвост”). Основным местом генерации ОВ в зрелом гиппокампе считается радиальный слой [Buzsáki, 2015], однако результаты наших экспериментов показали, что во время рОВ наибольшая плотность входящего тока наблюдается как на глубине радиального, так и лакунарно-молекулярного слоев гиппокампа. Можно предположить, что в отличие от ОВ, рОВ в СА1 регионе развивающегося гиппокампа запускаются нейронными входами как из СА3 региона, так и напрямую из III слоя энторинальной коры, что также описывалось другими авторами [Leinekugel et al., 2002; Valeeva et al., 2019]. В пользу этой гипотезы говорят результаты экспериментов с одновременной регистрацией электрической активности в энторинальной коре и гиппокампе и двигательной активности [Valeeva et al., 2019], где было показано, что активность энторинальной коры, связанная со спонтанными миоклоническими подергиваниями новорожденного крысенка, сопровождалась рОВ. Таким образом, одним из механизмов учащения рОВ может являться увеличение уровня двигательной активности взрослеющей крысы. В экспериментах на соматосенсорной коре было продемонстрировано, что начиная со второй постнатальной недели усиление спонтанной кортикальной активности находится под контролем восходящих проекций ретикулярной формации [Colonnese et al., 2010]. В экспериментах в зрительной системе было продемонстрировано, что изолирование переднего мозга от нейромодуляторного влияния восходящих входов ретикулярной формации приводит к уменьшению уровня спонтанной кортикальной активности. Таким образом, в увеличение гиппокампальной активности (как рОВ, так и МНА) могут вносить вклад как прямое ее растормаживание со стороны нейромодуляторных восходящих проекций, так и соматосенсорные входы, опосредованные активностью энторинального неокортекса. Высокая амплитуда ОВ во взрослом мозге обусловлена результатом работы 50 000–100 000 нейронов, которые синхронно активируются в “СА3-СА1-субикулум-энторинальная кора” комплексе [Chrobak, Buzsáki, 1996; Csicsvari et al., 1999]. Сенсорная депривация на ранних этапах постнатального развития приводит к нарушению формирования развивающихся сенсорных систем [Woolsey, Van der Loos, 1970; Van der Loos, Woolsey, 1973; Rakic, Riley, 1983], что говорит о ключевой роли сетевой активности в организации нейронных сетей. При этом одним из свойств раннего постнатального периода развития центральной нервной системы грызунов являются слабо развитые межнейрональные связи. Мы предполагаем, что рОВ являются инструментом, необходимым для формирования нейронной сети в развивающемся гиппокампе. В этом случае рост амплитуды рОВ является отражением процесса формирования межнейрональных связей в период интенсивного синаптогенеза, наблюдаемого у грызунов на первом месяце постнатального развития [Pokorný, Yamamoto, 1981] (также см. рис. 10 [обзор Ben-Ari et al., 2007]). Результаты экспериментов на срезах гиппокампа крысы, выполненные с помощью метода фиксации потенциала клетки, показали, что в течение первых двух недель происходит уменьшение входного сопротивления гиппокампальных нейронов [Spigelman et al., 1992], а значит, длительность реакции нейрона на возбуждение также будет укорачиваться. Таким образом, синхронизация нейронной активности за счет уменьшения времени ответа нейрона вносит вклад не только в увеличение амплитуды рОВ, но и в уменьшение длительности рОВ.
ЗАКЛЮЧЕНИЕ
Таким образом, наряду с тем, что рОВ являются одним из инструментов, необходимых для формирования гиппокампальных сетей, результаты наших экспериментов демонстрируют, что рОВ также подвергаются изменениям в ходе взросления крысы. Можно предположить, что оценка амплитудно-временных параметров рОВ может служить маркером степени зрелости нейронных сетей в развивающемся гиппокампе.
Статистическая часть представленной работы выполнена с использованием аналитических подходов, разработанных в рамках проекта, поддержанного РНФ, № 16-15-10174.
Авторы благодарят д.м.н. проф. Р.Н. Хазипова за помощь в подготовке текста статьи.
Список литературы
Ben-Ari Y. Developing networks play a similar melody. Trends Neurosci. 2001. 24 (6): 353–360.
Ben-Ari Y., Gaiarsa J.-L.J.-L., Tyzio R., Khazipov R. GABA: A Pioneer Transmitter That Excites Immature Neurons and Generates Primitive Oscillations. Physiol. Rev. 2007. 87 (4): 1215–1284.
Buhl D.L., Buzsáki G. Developmental emergence of hippocampal fast-field “ripple” oscillations in the behaving rat pups. Neuroscience. 2005. 134 (4): 1423–1430.
Buzsáki G. Hippocampal sharp wave-ripple: A cognitive biomarker for episodic memory and planning. Hippocampus. 2015. 25 (10): 1073–1188.
Buzsáki G., Buhl D.L., Harris K.D., Csicsvari J., Czéh B., Morozov A. Hippocampal network patterns of activity in the mouse. Neuroscience. 2003. 116 (1): 201–211.
Buzsáki G., Horváth Z., Urioste R., Hetke J., Wise K. High-frequency network oscillation in the hippocampus. Science. 1992. 256 (5059): 1025–1027.
Chrobak J.J., Buzsáki G. High-frequency oscillations in the output networks of the hippocampal-entorhinal axis of the freely behaving rat. J. Neurosci. 1996. 16 (9): 3056–3066.
Colonnese M.T., Kaminska A., Minlebaev M., Milh M., Bloem B., Lescure S., Moriette G., Chiron C., Ben-Ari Y., Khazipov R. A Conserved Switch in Sensory Processing Prepares Developing Neocortex for Vision. Neuron. 2010. 67 (3): 480–498.
Csicsvari J., Hirase H., Czurkó A., Mamiya A., Buzsáki G. Fast network oscillations in the hippocampal CA1 region of the behaving rat. J. Neurosci. 1999. 19 (16): RC20.
Karlsson K., Mohns E.J., Viana di Prisco G., Blumberg M.S. On the co-occurrence of startles and hippocampal sharp waves in newborn rats. Hippocampus. 2006. 16 (11): 959–965.
Karlsson K.Æ., Blumberg M.S. Hippocampal Theta in the Newborn Rat Is Revealed under Conditions That Promote REM Sleep. J. Neurosci. 2018. 23 (4): 1114–1118.
Khazipov R., Zaynutdinova D., Ogievetsky E., Valeeva G., Mitrukhina O., Manent J.B., Represa A. Atlas of the postnatal rat brain in stereotaxic coordinates. Front. Neuroanat. 2015. 9 (DEC).
Laurent F.F., Brotons-Mas J.R., Cid E., Lopez-Pigozzi D., Valero M., Gal B., de la Prida L.M. Proximodistal structure of theta coordination in the dorsal hippocampus of epileptic rats. J. Neurosci. 2015. 35 (11): 4760–4775.
Lebovitz R.M., Dichter M., Spencer W.A. Recurrent excitation in the CA3 region of cat hippocampus. Int. J. Neurosci. 1971. 2 (2): 99–107.
Leinekugel X., Khazipov R., Cannon R., Hirase H., Ben-Ari Y., Buzsáki G. Correlated Bursts of Activity in the Neonatal Hippocampus in Vivo. Science. 2002. 296 (5575): 2049–2052.
MacVicar B.A., Dudek F.E. Local synaptic circuits in rat hippocampus: interactions between pyramidal cells. Brain Res. 1980. 184 (1): 220–223.
Mohns E.J., Blumberg M.S. Synchronous Bursts of Neuronal Activity in the Developing Hippocampus: Modulation by Active Sleep and Association with Emerging Gamma and Theta Rhythms. J. Neurosci. 2008. 28 (40): 10134–10144.
Mohns E.J., Karlsson K., Blumberg M.S. Developmental emergence of transient and persistent hippocampal events and oscillations and their association with infant seizure susceptibility. Eur. J. Neurosci. 2007. 26 (10): 2719–2730.
Nicholson C., Freeman J.A., Freeman A. Theory of Current Analysis Tensor for and Determination Anuran of Conductivity Cerebellum. J. Neurophysiol. 1975. 38 (2): 356.
Pesaran B. Spectral Analysis for Neural Signals. Short Course III. 2008. : 1.
Pokorný J., Yamamoto T. Postnatal ontogenesis of hippocampal CA1 area in rats. I. Development of dendritic arborisation in pyramidal neurons. Brain Res. Bull. 1981. 7 (2): 113–120.
Rakic P., Riley K.P. Regulation of axon number in primate optic nerve by prenatal binocular competition. Nature. 1983. 305 (5930): 135–137.
Spigelman I., Zhang L., Carlen P.L. Patch-clamp study of postnatal development of CA1 neurons in rat hippocampal slices: Membrane excitability and K + currents. J. Neurophysiol. 1992. 68 (1): 55–69.
Spitzer M.W., Calford M.B., Clarey J.C., Pettigrew J.D., Roe A.W. Spontaneous and Stimulus-Evoked Intrinsic Optical Signals in Primary Auditory Cortex of the Cat Spontaneous and Stimulus-Evoked Intrinsic Optical Signals in Primary Auditory Cortex of the Cat. Changes. 2006. 85: 1283–1298.
Sullivan D., Csicsvari J., Mizuseki K., Montgomery S., Diba K., Buzsaki G. Relationships between Hippocampal Sharp Waves, Ripples, and Fast Gamma Oscillation: Influence of Dentate and Entorhinal Cortical Activity. J. Neurosci. 2011. 31 (23): 8605–8616.
Traub R.D., Bibbig A. A model of high-frequency ripples in the hippocampus based on synaptic coupling plus axon-axon gap junctions between pyramidal neurons. J. Neurosci. 2000. 20 (6): 2086–2093.
Valeeva G., Janackova S., Nasretdinov A., Rychkova V., Makarov R., Holmes G.L., Khazipov R., Lenck-Santini P.-P. Emergence of Coordinated Activity in the Developing Entorhinal-Hippocampal Network. Cereb. Cortex. 2019. 29 (2): 1–15.
Van der Loos H., Woolsey T. Somatosensory cortex: structural alterations following early injury to sense organs. Science. 1973. 173 (4071): 395–398.
Woolsey T., Van der Loos H. The structural organization of layer IV in the somatosensory region (S I) of mouse cerebral cortex. The description of a cortical field composed of discrete cytoarchitectonic units. Brain Res. 1970. 17 (2): 205–242.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


