Журнал высшей нервной деятельности им. И.П. Павлова, 2022, T. 72, № 5, стр. 717-727
Сравнение эффективности протоколов транскраниальной магнитной стимуляции в качестве дополнения к медикаментозной терапии резистентной депрессии с коморбидной хронической болью
Д. С. Петелин 1, *, В. Е. Безруков 1, Р. М. Шишорин 1, Б. А. Волель 1
1 Институт клинической медицины им. Н.В. Склифосовского, Первый МГМУ им. И.М. Сеченова
Москва, Россия
* E-mail: petelinhome1@yandex.ru
Поступила в редакцию 15.03.2022
После доработки 09.05.2022
Принята к публикации 27.06.2022
- EDN: LFHPEA
- DOI: 10.31857/S0044467722050112
Аннотация
Коморбидность резистентной депрессии и хронической боли активно обсуждается в научной литературе. В данной статье рассматривается сравнение эффективности двух протоколов ТМС в дополнение к медикаментозной терапии резистентной депрессии с коморбидной хронической болью. Было показано, что стимуляция левой и правой дорсолатеральной префронтальной коры оказывает различное воздействие на болевую и депрессивную симптоматику. Высокочастотная стимуляция левой дорсолатеральной префронтальной коры оказывает постепенно развивающийся антидепрессивный и противоболевой эффект, в то время как низкочастотная стимуляция правой дорсолатеральной префронтальной коры оказывает быстрое противоболевое действие, которое уменьшается после завершения курса. Полученные результаты позволяют уточнить нейрофизиологические основы восприятия боли и формирования настроения при психических расстройствах.
ВВЕДЕНИЕ
Депрессивные расстройства и хроническая боль относятся к числу расстройств, наиболее распространенных и негативно влияющих на качество жизни и уровень функционирования. По современным данным, 12-месячная распространенность депрессии во всем мире составляет около 6%, по данным ВОЗ на 2008 год депрессия находится на третьем месте по тяжести бремени болезни, а к 2030 году выйдет на первое место, что делает данное расстройство важнейшей формой нейропсихиатрической патологии. В свою очередь, усредненная распространенность хронической боли за 12-месячный промежуток составляет около 20%, причем у 8% населения земного шара боль определяется как активно влияющая на качество жизни (high-impact pain), то есть существенно затрудняющая функционирование (Dalhamer et al., 2018).
При этом между депрессивными расстройствами и хронической болью отмечается достаточно заметная коморбидность. Так, наличие хронической боли повышает риск развития депрессии – ОШ (отношение шансов) – 1.86 (95% доверительный интервал – ДИ – 1.37–2.54), а различная болевая симптоматика отмечается у до 50% пациентов с депрессией (Roughan et al., 2021). При этом наличие коморбидности боли и депрессии является не только их сосуществованием – такие пациенты имеют большую тяжесть аффективной и болевой симптоматики, хуже функционируют и чаще становятся инвалидами, более склонны к злоупотреблению алкоголем и психоактивными веществами (в первую очередь, анальгетиками), имеют большее число психосоциальных проблем, чаще совершают суициды и являются более резистентными к проводимой терапии (Li et al., 2015).
В результате, несмотря на наличие ряда препаратов, обладающих высокой эффективностью в отношении как депрессии, так и боли (в первую очередь, ингибиторы обратного захвата серотонина и норадреналина, а также трициклические антидепрессанты), среди пациентов с коморбидными депрессиями и болями отмечается накопление случаев высокой резистентности, слабо отвечающих на лекарственную терапию (Shah et al., 2021).
В настоящее время разработка стратегий преодоления резистентности при депрессивных расстройствах (в том числе при наличии болей) является одной из приоритетных биомедицинских задач. Помимо разработки инновационных лекарственных препаратов, исследование идет также в области неинвазивной стимуляции головного мозга, в первую очередь при помощи транскраниальной магнитной стимуляции (ТМС) (Somani et al., 2019).
Эффективность метода транскраниальной магнитной стимуляции была показана как в отношении депрессии, так и в отношении целого ряда хронических болевых синдромов, в числе которых нейропатическая боль, фибромиалгия, мигрень и некоторые другие болевые состояния. В результате ТМС получила одобрение ряда авторитетных регулирующих органов: применение ТМС при депрессии было одобрено агентством по контролю за продуктами питания и лекарствами (FDA), а применение ТМС при нейропатической боли было одобрено Европейским медицинским агентством (см. детальный обзор в (Рагимова и др., 2019)).
Дополнительно ситуация усложняется в связи с тем, что при лечении боли и депрессии ТМС чаще всего имеет различные точки приложения – так, основной мишенью коррекции аффективных симптомов является дорсолатеральная префронтальная кора (ДЛПК), а противоболевой эффект ТМС развивается преимущественно при стимуляции первичной моторной коры (М1), функции которой не связаны с регуляцией эмоционального фона. В связи с этим курация пациентов с хронической болью и депрессией может потребовать параллельного применения двух протоколов, что требует больше времени и стоит существенно дороже (Hamid et al., 2019).
Однако накапливаются данные о том, что существует ряд структур головного мозга, который может быть мишенью как антидепрессивной, так и анальгетической терапии. В первую очередь речь идет о низкочастотной стимуляции правой ДЛПК, которая оказалась эффективна как в отношении боли, так и в отношении психоэмоциональных симптомов при фибромиалгии (Tanwar et al., 2020).
Данная область головного мозга представляется перспективной в отношение лечения как психоэмоциональных, так и болевых симптомов в связи с многообразием ее нейрофизиологических функций. Согласно современным представлениям, ДЛПК выступает в качестве “узла”, который может собирать информацию, касающуюся как некоторых ключевых эмоций, так и эмоционального восприятия боли (Seminowicz et al., 2017).
Однако число исследований, в которых бы прицельно оценивалась эффективность магнитной стимуляции ДЛПК при сочетании депрессии и хронической боли, в настоящее время ограничено. При анализе недавних публикаций удалось идентифицировать лишь одну качественную работу, в которой была показана эффективность высокочастотной стимуляции левой дорсолатеральной префронтальной коры (ДЛПК) при депрессии с коморбидной болью, причем большая выраженность боли описывалась в качестве фактора меньшей эффективности ТМС (Corlier et al., 2021).
В связи с этим возникает вопрос о том, какой метод стимуляции дорсолатеральной префронтальной коры обеспечивает более полное воздействие на депрессивную и болевую симптоматику у пациентов с коморбидной патологией. Настоящее исследование направлено на попытку решения этого вопроса.
Помимо решения прикладных задач по оптимизации терапии пациентов с хронической болью и депрессией настоящее исследование позволяет существенно дополнить представления о механизмах реализации болевых ощущений в центральной нервной системе.
ЦЕЛЬ ИССЛЕДОВАНИЙ
Сравнение эффективности двух протоколов транскраниальной магнитной стимуляции (низкочастотная стимуляция правой ДЛПК и высокочастотная – левой ДЛПК) при резистентных депрессиях, коморбидных хронической боли.
Сравнение немедленных и отсроченных эффектов двух протоколов транскраниальной магнитной стимуляции на выраженность депрессиивной у болевой симптоматики у пациентов с резистентной депрессией, коморбидной хронической боли.
Задачи
• Установить сравнительное влияние двух протоколов транскраниальной магнитной стимуляции на выраженность болевой и депрессивной симптоматики;
• Оценить устойчивость эффекта проведенной ТМС-терапии спустя месяц;
• Сравнить доли ремиттеров по боли и депрессивной симптоматике соответственно для обоих протоколов проведения ТМС.
МЕТОДИКА
Настоящее исследование проводилось в период с 2020 по 2021 год на базе психотерапевтического отделения УКБ № 3 Первого МГМУ им. И.М. Сеченова Минздрава РФ (Сеченовский Университет) в сотрудничестве с Институтом когнитивных нейронаук НИУ ВШЭ.
В исследование включались пациенты из числа проходивших лечение на базе отделения. Отбирались пациенты, страдающие одновременно резистентной депрессией (согласно общепринятому консенсусу определяется как депрессия, при которой не было отмечено терапевтического ответа на как минимум два адекватных по длительности и дозировке курса антидепрессивной терапии (Voineskos et al., 2020)), а также хроническим болевым расстройством, определяемым как стойкое наличие боли в течение по меньшей мере шести месяцев (Mills et al., 2019).
Дизайн исследования предполагал наличие “заслепления” – курс ТМС проводил врач, не задействованный напрямую в лечении и оценке состояния пациента. Динамику выраженности депрессивной и болевой симптоматики оценивал лечащий врач, неосведомленный о типе протокола, применяемого у данного пациента.
Распределение пациентов по группам осуществлялось путем простой рандомизации с использованием таблицы случайных чисел. Процессом рандомизации занимался врач, не задействованный ни в ведении пациента, ни в проведении курса ТМС.
Критериями невключения в настоящее исследование были:
1. Наличие в структуре депрессии активных суицидальных мыслей, психотических симптомов, выраженной когнитивной дисфункции;
2. Депрессии в рамках биполярного аффективного расстройства либо расстройств шизофренического спектра;
3. Наличие в тканях головы металлических имплантатов;
4. Установленный диагноз эпилепсии либо наличие признаков эпиактивности на ЭЭГ;
5. Декомпенсированная соматическая или неврологическая патология, препятствующая регулярному посещению сеансов ТМС;
6. Однозначно установленная причина наличия хронической болевой симптоматики – мигрень, фибромиалгия, остеоартроз, боль, связанная со злокачественным новообразованием, и т.д.;
7. Сопутствующий прием препаратов, заметно снижающих порог судорожной готовности (трициклические антидепрессанты, клозапин и т.д.);
8. Предшествующее прохождение курса ТМС и/или ЭСТ (электросудорожной терапии).
Критериями исключения в настоящем исследовании были:
1. Отзыв информированного согласия;
2. Признаки значимого ухудшения психического состояния в процессе проведения курса ТМС, определяемые либо лечащим врачом, либо самим пациентом.
Для объективизированной оценки выраженности депрессии и хронической боли использовались валидизированные и международно признанные психометрические методики: шкала Монтгомери-Асберг (MADRS)11 (Zimmerman et al., 2004) для оценки депрессии и визуальная аналоговая шкала (VAS) для оценки выраженности боли (Delgado et al., 2018).
Дизайн исследования предполагал трехкратную оценку выраженности депрессии и боли – перед началом курса ТМС-терапии, непосредственно после окончания (сразу после 10-го сеанса) и катамнестически спустя месяц. Оценивалось два параметра: динамика баллов MADRS и VAS в процессе лечения и катамнестически, а также категориально оценивалось число респондеров спустя 1 месяц после проведенной процедуры. Дефиниция терапевтического ответа (респонс) в соответствии с общепринятыми стандартами как в отношении депрессии, так и в отношении боли определялась как уменьшение баллов по шкале на 50% и более (de Zwart et al., 2019; Delgado et al., 2018).
Курс транскраниальной магнитной стимуляции производился при помощи аппарата Magstim Rapid22 с 70-мм катушкой (Magstim, Whitland, Южный Уэльс, Великобритания) в специально оборудованном помещении в клинике нервных болезней. Перед проведением первого сеанса осуществлялась оценка моторного порога (МП) стандартным способом. Дорсолатеральная префронтальная кора определялась в соответствии с “правилом 5 см” на 5 см фронтальнее от точки, где был выявлен максимальный моторный ответ (Рагимова и др., 2019). Протокол правосторонней низкочастотной стимуляции был аналогичным таковому в недавно опубликованном РКИ (рандомизированном контролируемом исследовании), оценивающем эффективность ТМС при фибромиалгии: частота 1 Гц, 1200 импульсов, разделенных на 8 пакетов, мощность 90% от моторного порога (Tanwar et al., 2020). Протокол левосторонней высокочастотной стимуляции был аналогичен одобренному FDA для терапии большой депрессии: 10 Гц, 3000 импульсов за сессию, разделенные на пакеты длительностью 4 секунды с 26-секундным интервалом между ними, мощность – 100–120%2 от моторного порога (McClintock et al., 2019).
Общая длительность курса для каждого пациента составила 10 сеансов в связи с двумя соображениями. Во-первых, речь шла о пациентах, получающих на фоне курса ТМС психофармакотерапию, поэтому длительность курса была сокращена по сравнению с общепринято используемыми 20 сеансами при монотерапии депрессии при помощи ТМС. Во-вторых, протокол из 10 сеансов относится к наиболее часто используемым в РКИ, оценивающих эффективность ТМС при хронической боли (Lefaucheur et al., 2020).
Все участники исследования перед включением подписали добровольное информированное согласие на проведение курса ТМС и были проинформированы о возможности отозвать согласие в любой момент.
Выборку настоящего исследования составили 25 пациентов, которые были рандомизированы в две группы по 12 и 13 пациентов (группы низкочастотной правосторонней и высокочастотной левосторонней соответственно). Полностью курс ТМС прошли 24 пациента, один пациент из группы высокочастотной левосторонней стимуляции отказался от прохождения курса после двух сеансов, сообщая о труднопереносимой болезненности в области стимуляции и психологическом дискомфорте. Еще два пациента (по одному из каждой группы) были потеряны на катамнестическом этапе и исключены из итогового анализа. Таким образом, для итогового анализа была доступна когорта из 22 пациентов, по 11 пациентов в каждой из групп соответственно.
Статистическая обработка результатов исследования производилась в программе SPSS Statistics v22. Оценка нормальности распределения осуществлялась при помощи теста Колмогорова–Смирнова. Статистический материал представлен средними значениями, стандартным отклонением (М ± δ). Достоверность клинической динамики в процессе терапии оценивалась при помощи Т-теста для связанных выборок. Отличия между результатами двух протоколов оценивались при помощи Т-теста для несвязанных выборок. Уровень достоверности в исследовании составлял p < 0.05.
Социодемографические и клинические параметры обсуждаемых пациентов представлены в таблице 1.
Таблица 1.
Социодемографические и клинические параметры групп Table 1. Sociodemographic and clinical parameters of groups
| Высокочастотная стимуляция левой ДЛПК | Низкочастотная стимуляция правой ДЛПК | p | |
|---|---|---|---|
| Пол (% лиц мужского пола) | 6 (54.5%) | 4 (36.4%) | 0.387 |
| Возраст | 48.09 ± 15.9 | 46.27 ± 15.1 | 0.767 |
| Образование: Среднее Среднее специальное Высшее |
2 (18%) 3(27%) 6 (55%) |
3 (27%) 1 (9%) 7 (64%) |
0.635 |
| Семейный статус: Женат/замужем Не состоит в браке Развод/овдовел(а) |
5 (45.5%) 2 (18%) 4 (36%) |
6 (55%) 1 (9%) 4 (36%) |
0.572 |
| Рабочий статус: Работает Инвалид На пенсии Не работает без оформления инвалидности |
3 (27%) 2 (18%) 1 (9%) 5 (45.5%) |
4 (36%) 2 (18%) 2 (18%) 3 (27%) |
0.241 |
| Диагноз: Депрессивный эпизод Рекуррентное депрессивное расстройство Дистимия |
3 (27%) 4 (36%) 4 (36%) |
2 (18%) 3 (27%) 6 (55%) |
0.183 |
| Длительность существования симптоматики | 2.7 ± 0.84 года | 2.5 ± 1.1 года | 0.218 |
| Тяжесть депрессии по MADRS | 28.64 ± 8.7 | 28.55 ± 9.2 | 0.949 |
| Тяжесть боли по VAS | 7.27 ± 1.18 | 6.64 ± 1.1 | 0.217 |
При анализе социодемографических факторов обращает на себя внимание накопление пациентов старшей возрастной группы – после 40 лет, а также лиц с достаточно высоким уровнем образования (у 6 и 7 пациентов из обсуждаемых групп образование было высшим), вместе с тем среди этой в целом работоспособной группы населения отмечается крайне невысокий уровень трудовой адаптации, лишь 3 и 4 пациента соответственно работают на момент включения в исследование, накапливаются при этом лица, не работающие без оформления инвалидности, а также инвалиды.
В настоящее исследование включались пациенты с достаточно выраженной депрессивной симптоматикой по шкале MADRS – около 28 баллов, что соответствует категории депрессии средней степени тяжести (Herman et al., 1998). Выраженность болевой симптоматики была даже более высокой – около 6–7 баллов, что соответствует достаточно интенсивной боли.
Нозологически пациенты в настоящем исследовании распределялись на депрессивный эпизод, рекуррентное депрессивное расстройство, а также дистимию, при этом отмечалось статистически недостоверное накопление в обеих группах дистимий. Вне зависимости от нозологического распределения, депрессии в обсуждаемой выборке можно квалифицировать как затяжные или хронические, на что указывает средняя длительность существования симптоматики, превышающая два года – общепринятый временной порог для квалификации хронической депрессии (Kohler et al., 2019).
Все включенные в настоящее исследование пациенты прошли как минимум два адекватных по длительности курса психофармакотерапии, не давших терапевтического ответа ни по депрессии, ни по хронической боли. Спектр получаемых препаратов до включения в исследование был представлен большинством ингибиторов обратного захвата серотонина либо обратного захвата серотонина и норадреналина, трициклическими антидепрессантами (кломипрамин, имипрамин, амитриптилин), миртазапин. Также указывалось на наличие в анамнезе аугментирующих стратегий, таких как добавление нормотимиков (карбамазепин, вальпроаты, габапентин), атипичных антипсихотиков (сульпирид, тиаприд, перфеназин) и миорелаксантов (тизанидин, баклосан).
На момент включения в исследование пациенты продолжали получать психофармакотерапию, направленную на преодоление резистентности, основу терапевтической схемы большинства пациентов составляли ингибиторы обратного захвата серотонина и норадреналина (венлафаксин, дулоксетин, милнаципран) в средневысоких и высоких дозах, в комбинации с аугментирующими препаратами, такими как миртазапин, габапентиноиды (габапентин, прегабалин), атипичные антипсихотики (кветиапин, оланзапин, арипипразол). В связи с выраженным проэпилептогенным действием, пациенты на терапии трициклическими антидепрессантами в настоящее исследование не включались. В исследование включались только те пациенты, у которых терапевтическая схема была стабильной в течение двух и более месяцев, для того, чтобы осуществить достоверное разграничение между эффектом психофармакотерапии и эффектом ТМС.
На момент включения в исследование все пациенты отмечали наличие интенсивных ежедневных болей. По локализации болевого синдрома пациенты подразделялись на головную боль и боль орофациальной локализации (по 5 пациентов, 22.8% соответственно), распространенную скелетно-мышечную боль (7 пациентов, 32%), хроническую дисфункциональную абдоминальную боль (3 пациента, 14%) и хронические торакалгии (2 пациента, 9%). У всех пациентов дебют болевой симптоматики в целом совпадал с началом депрессивной симптоматики. Обязательным условием включения пациентов в исследование было исключение явных соматоневрологических причин для появления боли, осуществляемое на консилиуме с участием невролога и, при необходимости, гастроэнтеролога или ревматолога.
При сравнении групп между собой также отмечается отсутствие каких-либо статистически достоверных отличий, как по социодемографическим, так и по клиническим параметрам, что позволяет напрямую сравнивать группы в ходе ТМС-терапии.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
В ходе настоящего исследования было показано, что оба изучаемые протокола оказывали клинический эффект на выраженность как депрессивной, так и болевой симптоматики. Однако степень и временная динамика этого эффекта в существенной мере отличались между протоколами.
Динамика выраженности болевой симптоматики по шкале VAS представлена на рис. 1.
Рис. 1.
Динамика болевой симптоматики по шкале VAS. Fig. 1. Dynamics of pain symptoms according to the VAS scale.

Анализируя представленные результаты, можно отметить заметное и выраженное воздействие на интенсивность боли при использовании протокола с низкочастотной стимуляцией правой ДЛПК – к концу курса усредненная интенсивность боли снизилась фактически вдвое, достоверно отличаясь от первоначальных результатов (p < 0.001). В свою очередь, высокочастотная стимуляция левой ДЛПК также оказала некоторое воздействие на выраженность болевой симптоматики, которое было статистически достоверным (p = 0.024), однако клинически малозначимым (усредненная редукция боли на один балл по VAS оказывает крайне малое влияние на уровень функционирования и качество жизни пациентов). Закономерным образом на момент окончания курса ТМС низкочастотная стимуляция правой ДЛПК оказывала статистически более достоверное действие на боль, по сравнению с высокочастотной стимуляцией левой ДЛПК (p = 0.001).
Однако при катамнестическом обследовании пациентов спустя один месяц результаты оказались совершенно иными. Так, фактически выраженность боли по VAS оказалась статистически неотличимой между различными протоколами (p = 0.606). При этом выраженность боли при левосторонней высокочастотной стимуляции продолжала уменьшаться, а при правосторонней низкочастотной отмечалось определенное ослабление противоболевого эффекта (отличия от баллов непосредственно после завершения курса стимуляции статистически достоверно для обоих протоколов – p = 0.011 и p = 0.014 соответственно). При этом выраженность боли оставалась статистически достоверно ниже по сравнению с началом исследования в обеих группах (p = = 0.004 для высокочастотной стимуляции левой ДЛПК и p = 0.003 для низкочастотной стимуляции).
Динамика баллов шкалы депрессии MADRS, представленных на рис. 2, в существенной степени отличалась.
Рис. 2.
Динамика депрессивной симптоматики по шкале MADRS. Fig. 2. Dynamics of depressive symptoms according to the MADRS scale.
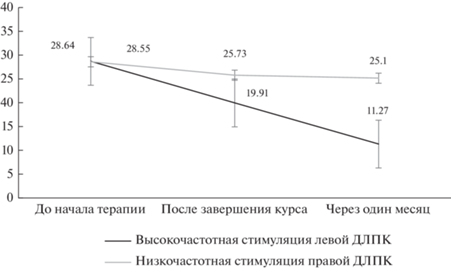
Как можно убедиться в процессе анализа представленного графика, высокочастотная стимуляция левой ДЛПК оказывала более заметное воздействие на выраженность депрессивной симптоматики к моменту завершения курса (статистически достоверное отличие по сравнению с началом исследования при р = = 0.004). В свою очередь, к концу курса низкочастотная стимуляция правой ДЛПК оказывала лишь крайне слабое воздействие на выраженность депрессивной симптоматики, не являющееся статистически достоверным (р = 0.062). Различие между протоколами к моменту окончания курса терапии также было на уровне тенденций (р = 0.065).
Спустя месяц после окончания терапии антидепрессивный эффект левосторонней высокочастотной стимуляции только усиливался (р = 0.003 по сравнению с моментом окончания курса), в то время как статистически достоверной динамики баллов депрессии при правосторонней стимуляции зарегистрировано не было (р = 0.42). Отличия между протоколами были очевидными с существенно более высоким эффектом левосторонней стимуляции (р = 0.001). Однако оба протокола при оценке эффективности через месяц после завершения терапии продемонстрировали статистически достоверное отличие от начальных значений MADRS (p = 0.039 и р = = 0.003 для правосторонней и левосторонней стимуляции соответственно).
Учитывая большее значение для пациента факта ответа на терапию, а не усреднeнной динамики баллов, был предпринят анализ встречаемости терапевтического ответа по обеим шкалам сравнительно для двух протоколов (см. таблицы 2 и 3).
Таблица 2.
Встречаемость терапевтического ответа по VAS Table 2. Therapeutic response rate according to VAS
| Доля респондеров по VAS | Завершение терапии | Через один месяц |
|---|---|---|
| Высокочастотная стимуляция левой ДЛПК | 2 (18%) | 4 (36%) |
| Низкочастотная стимуляция правой ДЛПК | 7 (64%) | 4 (36%) |
Таблица 3.
Доля респондеров по MADRS после завершения курса и через месяц Table 3. Percentage of MADRS responders after course completion and one month later
| Доля респондеров по MADRS | Завершение терапии | Через один месяц |
|---|---|---|
| Высокочастотная стимуляция левой ДЛПК | 1 (9%) | 9 (82%) |
| Низкочастотная стимуляция правой ДЛПК | 0 (0%) | 2 (18%) |
При анализе данной таблицы можно убедиться в хорошей способности низкочастотной стимуляции правой ДЛПК вызывать терапевтический ответ немедленно после завершения цикла, в противовес высокочастотной, – зарегистрирован более чем в половине случаев. Однако спустя месяц число респондеров сравнялось и стало относительно небольшим – 36% в обоих случаях, что в полной мере согласуется с динамикой средних значений баллов.
Краткосрочная эффективность ТМС в отношении баллов MADRS в нашем исследовании оказалась крайне низкой – лишь у одного пациента из группы высокочастотной стимуляции был зарегистрирован терапевтический ответ. Однако спустя месяц результативность обсуждаемого протокола оказалась достаточно высокой – у более чем 80% пациентов был отмечен терапевтический ответ, что следует признать очень хорошим результатом при лечении резистентных пациентов. Аналогично средним значениям баллов, долгосрочная эффективность низкочастотной правосторонней стимуляции в нашем исследовании оказалась крайне невысокой.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В настоящем исследовании были показаны различие профили действия двух изучаемых протоколов ТМС на эмоциональную и болевую симптоматику.
Антидепрессивная эффективность высокочастотной левосторонней стимуляции ДЛПК оказалась ожидаемо высокой, что хорошо согласуется с ранее полученными данными, в том числе и в отношении резистентных пациентов (Somani et al., 2019). При этом наиболее интересной находкой является дополнительное улучшение состояния пациентов спустя месяц наблюдения. Улучшение состояния пациентов спустя определенное время после окончания курса было продемонстрировано в ряде случаев, причем в некоторых немедленного эффекта после завершения курса не отмечалось вовсе (Koerselman et al., 2004) Во-первых, помимо непосредственного влияния на уровень нейромедиаторов и возбудимость нейронов, ТМС также отсроченно способствует улучшению трофики нервной ткани за счет повышения уровня нейротрофического мозгового фактора (BDNF), а также подавляет микровоспаления, что было убедительно показано в том числе на выборке пациентов с резистентной депрессией (Zhao et al., 2019). Во-вторых, следует учитывать, что все пациенты в исследовании получали эффективную психофармакотерапию. Поэтому можно предположить, что по тем или иным механизмам стимуляция левой ДЛПК привела к постепенному, но выраженному усилению ответа на антидепрессивную терапию, что уже было показано ранее (Ullrich et al., 2020).
Низкая эффективность левосторонней высокочастотной стимуляции в отношении болевого синдрома также находит убедительное объяснение. Традиционно, левая ДЛПК не рассматривалась как зона интереса для курации болевых синдромов (Рагимова и др., 2019), однако на выборке пациентов с депрессией и болью было показано наличие некоторого анальгетического эффекта, который, однако, был заметно слабее при наличии выраженной боли (Corlier et al., 2021). По-видимому, противоболевое действие подобного протокола у депрессивных пациентов связано с редукцией депрессивной симптоматики и тех механизмов, которые ответственны за гиперальгезию при депрессии, в первую очередь когнитивных, таких как катастрофизация и пессимистическое восприятие собственных перспектив (Khera et al., 2021).
Выраженный эффект правосторонней низкочастотной стимуляции в целом согласуется с уже имеющимися данными об эффективности такого протокола при болях, преимущественно без анатомического субстрата (например, при фибромиалгии). Однако заметное ослабление противоболевого эффекта противоречит метаанализу исследований, выполненных на выборке пациентов с фибромиалгией, где сохранение эффекта от терапии отмечалось вплоть до 6 месяцев (Tanwar et al., 2020). Однако боль при депрессии может иметь существенные нейробиологические и нейропсихологические отличия, делающие в последнем случае лечение менее эффективным.
Более труднообъяснимым является слабость собственно антидепрессивного эффекта при протоколе с низкочастотной стимуляцией. Так, в одной работе было показано развитие терапевтического ответа у почти половины пациентов с резистентной депрессией (Pallanti et al., 2012). Отличия могут быть объяснены несколькими способами. Во-первых, для оценки аффективного статуса пациентов авторы использовали шкалу депрессии Гамильтона, в которой значительная часть вопросов посвящена соматизации, в том числе представленной болевым расстройством, в то время как использованная в нашей работе MADRS измеряет исключительно ядерные симптомы депрессии. В связи с этим часть пациентов в работе S. Pallanti и соавторов могли отметить появление терапевтического ответа в том числе за счет снижения боли. С другой стороны, наши результаты могут подтверждать большую тяжесть пациентов с коморбидной болью, многократно описанную в цитированных во введении источниках.
Наконец, следует обратить внимание также и на особенности самого протокола. В нашем исследовании использовался протокол с 90% МП (показавший эффективность при фибромиалгии), в то время как S. Pallanti и соавт. использовали 110% МП, которые могут быть существенно более эффективными при купировании депрессивной симптоматики. Также, в отличие от нашего исследования, было проведено 15 сеансов, а не 10. Завершая обсуждение полученных результатов, следует предположить, что комбинированная стимуляция с последовательным использованием обоих изученных протоколов может быть более полезна для пациентов с хронической депрессией и болью. Однако, до тестирования таких протоколов в последующих исследованиях, можно предположить, что разные типы протоколов могут подходить для разных пациентов. Так, правосторонняя низкочастотная стимуляция будет полезна для пациентов, в первую очередь озабоченных болью и рассматривающих уменьшение ее интенсивности в качестве ключевого показателя эффективности лечения. В свою очередь, левосторонняя высокочастотная стимуляция в большей степени полезна для пациентов, ориентированных на более медленный, однако устойчивый результат.
Ограничения исследования: исследование выполнено на специфической когорте пациентов, страдающих хроническими резистентными депрессиями с сопутствующей болевой симптоматикой, в результате чего генерализировать имеющиеся результаты на всю популяцию пациентов с коморбидной аффективной и болевой симптоматикой следует с осторожностью. Также интерпретировать результаты следует, учитывая факт приема комбинированной психофармакотерапии всеми пациентами в обсуждаемой выборке. Еще одним ограничением исследования является отсутствие группы плацебо-ТМС, в связи с чем не удается полностью исключить вклад эффекта плацебо в полученные результаты. Наконец, результаты следует интерпретировать с учетом относительно короткого курса ТМС (10 сеансов в противовес общепринятым при терапии депрессии 20 сеансам).
ЗАКЛЮЧЕНИЕ
Низкочастотная стимуляция правой ДЛПК и высокочастотная стимуляция левой ДЛПК способны снижать выраженность депрессивной и болевой симптоматики, однако направленность и временная динамика клинического эффекта отличаются. Низкочастотная стимуляция правой ДЛПК оказывает более отчетливое влияние на болевой компонент, которое со временем постепенно уменьшается, и медленное антидепрессивное действие, становящееся очевидным лишь спустя месяц после завершения терапии. Высокочастотная стимуляция левой ДЛПК оказывает отчётливое антидепрессивное и умеренное противоболевое действие, усиливающееся после завершения курса.
Конфликт интересов: авторы не сообщают о конфликте интересов.
Список литературы
Рагимова А.В., Петелин Д.С., Захарова Н.В., Самушия М.А., Косминский А.Г., Абрамов С.В. Применение транскраниальной магнитной стимуляции в психиатрической и психоневрологической практике. М: Центральная государственная медицинская академия Управления делами Президента Российской Федерации, 2019. 97 с.
Corlier J., Tadayonnejad R., Wilson A.C., Lee J.C., Marder K.G., Ginder N.D., Wilke S.A., Levitt J., Krantz D., Leuchter A.F. Repetitive transcranial magnetic stimulation treatment of major depressive disorder and comorbid chronic pain: response rates and neurophysiologic biomarkers. Psychological medicine, 1–10. Advance online publication. 2021. 10.1017.
Dahlhamer J., Lucas J., Zelaya, C., Nahin R., Mackey S., DeBar L., Kerns R., Von Korff M., Porter L., Helmick C. Prevalence of Chronic Pain and High-Impact Chronic Pain Among Adults – United States, 2016. MMWR. Morbidity and mortality weekly report. 2018. 67(36): 1001–1006.
Delgado D.A., Lambert B.S., Boutris N., McCulloch P.C., Robbins A.B., Moreno M.R., Harris J.D. Validation of Digital Visual Analog Scale Pain Scoring With a Traditional Paper-based Visual Analog Scale in Adults. Journal of the American Academy of Orthopaedic Surgeons. Global research & reviews. 2018. 2(3): e088
de Zwart P.L., Jeronimus B.F., de Jonge P. Empirical evidence for definitions of episode, remission, recovery, relapse and recurrence in depression: a systematic review. Epidemiology and psychiatric sciences. 2019. 28(5): 544–562.
Hamid P., Malik B.H., Hussain M.L. Noninvasive Transcranial Magnetic Stimulation (TMS) in Chronic Refractory Pain: A Systematic Review. Cureus. 2019. 11(10): e6019.
Herrmann N., Black S.E., Lawrence J., Szekely C., Szalai J.P. “The Sunnybrook Stroke Study: A Prospective Study of Depressive Symptoms and Functional Outcome”. Stroke. 1998. 29(3): 618-624.
Khera T., Rangasamy V. Cognition and Pain: A Review. Frontiers in psychology. 2021. 12: 673962.
Koerselman F., Laman D.M., van Duijn H., van Duijn M.A., Willems M.A. A 3-month, follow-up, randomized, placebo-controlled study of repetitive transcranial magnetic stimulation in depression. The Journal of clinical psychiatry. 2004. 65(10):1323–1328.
Köhler S., Chrysanthou S., Guhn A., Sterzer P. Differences between chronic and nonchronic depression: Systematic review and implications for treatment. Depression and anxiety. 2019. 36(1): 18–30.
Lefaucheur J.P., Aleman A., Baeken C., Benninger D.H., Brunelin J., Di Lazzaro V., Filipović S.R., Grefkes C., Hasan A., Hummel F.C., Jääskeläinen S.K., Langguth B., Leocani L., Londero A., Nardone R., Nguyen J.P., Nyffeler T., Oliveira-Maia A.J., Oliviero A., Padberg F., Ziemann U. Evidence-based guidelines on the therapeutic use of repetitive transcranial magnetic stimulation (rTMS): An update (2014–2018). Clinical neurophysiology: official journal of the International Federation of Clinical Neurophysiology. 2020. 131(2): 474–528.
Li J.X. Pain and depression comorbidity: a preclinical perspective. Behavioural brain research. 2015. 276: 92–98.
Mc Clintock S.M., Reti I.M., Carpenter L.L., McDonald W.M., Dubin M., Taylor S.F. et al. Consensus recommendations for the clinical application of repetitive transcranial magnetic stimulation (rTMS) in the treatment of depression. Journal of Clinical Psychiatry. Physicians Postgraduate Press Inc. 2018. 78: 35–48.
Mills S., Nicolson K. P., Smith B. H. Chronic pain: a review of its epidemiology and associated factors in population-based studies. British journal of anaesthesia. 2019. 123(2): e273–e283.
Pallanti S., Di Rollo A., Antonini S., Cauli G., Hollander E., Quercioli L. Low-frequency rTMS over right dorsolateral prefrontal cortex in the treatment of resistant depression: cognitive improvement is independent from clinical response, resting motor threshold is related to clinical response. Neuropsychobiology. 2012. 65(4): 227–235.
Roughan W.H., Campos A.I., García-Marín L.M., Cuéllar-Partida G., Lupton M.K., Hickie I.B., Medland S.E., Wray N.R., Byrne E.M., Ngo T.T., Martin N.G., Rentería M.E. Comorbid Chronic Pain and Depression: Shared Risk Factors and Differential Antidepressant Effectiveness. Frontiers in psychiatry. 2021. 12: 643609.
Seminowicz D., Moayedi M. The Dorsolateral Prefrontal Cortex in Acute and Chronic Pain. J Pain. 2017. 18(9): 1027–1035.
Shah D., Allen L., Zheng W., Madhavan S.S., Wei W., LeMasters T.J., Sambamoorthi U. Economic Burden of Treatment-Resistant Depression among Adults with Chronic Non-Cancer Pain Conditions and Major Depressive Disorder in the US. PharmacoEconomics. 2021. 39(6): 639–651.
Somani A., Kar S.K. Efficacy of repetitive transcranial magnetic stimulation in treatment-resistant depression: the evidence thus far. General psychiatry. 2019. 32(4): e100074.
Tanwar S., Mattoo B., Kumar U., Bhatia R. Repetitive transcranial magnetic stimulation of the prefrontal cortex for fibromyalgia syndrome: A randomised controlled trial with 6-months follow up. Advances in Rheumatology. 2020. 60(1).
Ullrich H., Kranaster L., Sigges E., Andrich J., Sartorius A. Ultra-High-Frequency Left Prefrontal Transcranial Magnetic Stimulation as Augmentation in Severely Ill Patients with Depression: A Naturalistic Sham-Controlled, Double-Blind, Randomized Trial. Neuropsychobiology. 2012. 66: 141–148.
Voineskos D., Daskalakis Z.J., Blumberger D.M. Management of Treatment-Resistant Depression: Challenges and Strategies. Neuropsychiatric disease and treatment. 2020. 16: 221–234.
Zhao X., Li Y., Tian Q., Zhu B., Zhao Z. Repetitive transcranial magnetic stimulation increases serum brain-derived neurotrophic factor and decreases interleukin-1β and tumor necrosis factor-α in elderly patients with refractory depression. The Journal of international medical research. 2019. 47(5): 1848–1855.
Zimmerman M., Chelminski I., Posternak M. A review of studies of the Montgomery-Asberg Depression Rating Scale in controls: implications for the definition of remission in treatment studies of depression. International clinical psychopharmacology. 2004. 19(1): 1–7.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


