Журнал высшей нервной деятельности им. И.П. Павлова, 2023, T. 73, № 4, стр. 490-509
Динамика сенсомоторного ритма ЭЭГ при мысленном повторении за наблюдаемым движением
А. Н. Васильев 1, 2, *, А. Е. Маковская 1, А. Я. Каплан 1, 3
1 Московский Государственный Университет им. М.В. Ломоносова
Москва, Россия
2 МЭГ-центр, Московский психолого-педагогический университет
Москва, Россия
3 Балтийский Федеральный Университет им. И. Канта
Калининград, Россия
* E-mail: a.vasilyev@anvmail.com
Поступила в редакцию 24.11.2022
После доработки 19.04.2023
Принята к публикации 05.05.2023
- EDN: WHOMMY
- DOI: 10.31857/S004446772304010X
Аннотация
Мысленная симуляция собственного движения, или представление движения, а также наблюдение за движениями других людей применяются в нейрореабилитации в качестве методов стимуляции сенсомоторных отделов мозга. В настоящей работе тестируется новый способ представления – мысленная имитация движения, синхронная с движением, наблюдаемым от первого лица на видеоэкране. Задачами исследования являлись сравнение реактивности сенсомоторных ритмов ЭЭГ при произвольном представлении движения и представлении вслед за видеостимулом, а также выявление связи между фазами движения на видео и динамикой паттернов ЭЭГ. В исследовании приняли участие 30 здоровых добровольцев, у которых регистрировалась 69-канальная энцефалограмма во время выполнения и представления ими движений большим пальцем правой руки в двух режимах: произвольно (без внешнего ориентира) и синхронно имитируя движение на видеоролике. При анализе ЭЭГ у испытуемых выделялись индивидуальные пространственно-частотные компоненты с наибольшей реактивностью мю-ритма ЭЭГ (8–14 Гц), после чего проводилась количественная оценка десинхронизации в изучаемых условиях на основе анализа распределений плотности вероятности мощности мю-ритма. Для оценки связи динамики десинхронизации мю-ритма с событиями на видео применялась обобщенная аддитивная модель, описывающая функцию ответов на одиночные события в наблюдаемых движениях и их суммацию при серийном выполнении или представления движений. Было показано, что мысленная кинестетическая симуляция наблюдаемого движения не приводит к увеличению десинхронизации сенсомоторных ритмов по сравнению с произвольным представлением такого же движения. Впервые установлено, что во временном ходе десинхронизации мю-ритма возникают пертурбации, зависящие от фазы и скорости наблюдаемого движения как при его синхронном мышечном повторении, так и при мысленной синхронной имитации. Полученные результаты могут быть использованы для оптимизации параметров движений в индивидуальных системах идеомоторных тренировок с ЭЭГ-контролем для достижения наибольшей сенсомоторной активации.
ВВЕДЕНИЕ
Двигательные нарушения являются самыми распространенными последствиями инсульта, с которыми сталкиваются около 80% выживших пациентов, а у большинства из них двигательная дисфункция приобретает хроническую форму (Hendricks et al., 2002). Наряду с богатым репертуаром мер классической восстановительной медицины, современная нейрореабилитация признает и активно задействует когнитивные упражнения, направленные на дополнительную активацию сенсомоторной системы мозга у больного, такие как представление движений, наблюдение за движениями, зеркальная терапия, биологическая обратная связь (De Vries, Mulder, 2007; Langhorne et al., 2009). Нейрофизиологическое обоснование эффективности подобных методик опирается на то, что мысленное представление и восприятие своих или чужих движений задействует те же нейрональные сети, что задействованы в генерации произвольных мышечных движений (Fadiga et al., 1995; Gerardin et al., 2000; Grafton et al., 1996; Hardwick et al., 2018).
В настоящей статье основное внимание будет уделено представлению движений и активному наблюдению за движениями. Представление движения (ПД) определяют как акт мысленной перцептивной симуляции (репетиции) собственного движения, подразумевающий генерацию мультисенсорных образов, основными значимыми модальностями которых являются зрительная, соответствующая визуализации движущихся частей тела, и кинестетическая, охватывающая все телесные ощущения, включая тактильные. Поскольку зрительное и кинестетическое представления опираются на разные мозговые системы, а также могут быть сознательно диссоциированы человеком, их рассматривают отдельно друг от друга, в том числе в их практических применениях (Féry, 2003). В контексте нейрореабилитации предпочтение отдается кинестетическому представлению, т. к. только оно значимо вовлекает сенсомоторные контуры мозга (Guillot et al., 2009; Stinear et al., 2006; Мокиенко et al., 2013). По сравнению с представлением, наблюдение за движением (НД) объединяет большое количество протоколов реализации, включающих активный просмотр видеоряда движений другого человека или частей его тела с целью толкования, оценки, предсказания, выучивания или имитации наблюдаемого движения в дальнейшем (Hodges, 2017; Sarasso et al., 2015).
Несмотря на довольно обширную литературу, посвященную отдельным методикам наблюдения за движениями (Buccino, 2014; Ertelt et al., 2007) и представлению движений (Braun et al., 2013; Machado et al., 2015), идеи об их совместном применении и изучении начали появляться сравнительно недавно (Emerson et al., 2018). Согласно современным представлениям, между наблюдаемым и воображаемым движением возможны различные смысловые и функциональные отношения за счeт вариаций точки зрения наблюдателя и конгруэнтности двух актов (Vogt et al., 2013). Привлекательность идеи их объединения заключается, с одной стороны, в том, что оба акта являются формами мысленной симуляции движения (Vogt et al., 2013), а с другой стороны, задействуют два разных механизма инициации движения: внешний, реактивный – для наблюдения – и эндогенный и произвольный – для представления (Eaves et al., 2016b). Наиболее эффективным способом их объединения с целью максимизации активации внутренних двигательных контуров является представление движения, полностью конгруэнтного наблюдаемому движению. В таком режиме представления (“представляемой имитации” (Friesen et al., 2017)) зрительный перцептивный компонент наблюдаемого движения запускает механизмы репетиции движения за счет активации зеркальной системы мозга, а испытуемый произвольно добавляет кинестетический компонент, формируя более полный мультисенсорный двигательный образ. Предъявление наблюдаемого движения в перспективе от первого лица также способствует, при одновременном представлении, развитию чувства собственности (аналогично иллюзии “резиновой руки”, англ. – rubber hand illusion, (Tsakiris, Haggard, 2005) и зеркальной иллюзии (Altschuler et al., 1999)) и чувства авторства действия (англ. – agency) (Vogt et al., 2013). Однако добавление к и без того сложной задаче представления движения необходимости постоянного отслеживания и реагирования на внешний стимул может оказывать отрицательное влияние на качество кинестетического воображения и общую эффективность задействования сенсомоторного контура в когнитивной задаче.
На данный момент в литературе отсутствуют однозначные свидетельства о преимуществах комбинированного с наблюдением представления по сравнению с полностью произвольным представлением. Так, ряд исследований демонстрирует более сильную активацию сенсомоторной коры в условии “представление + наблюдение” по сравнению с “только наблюдением” (Nedelko et al., 2012; Villiger et al., 2013), преимущество комбинированного условия по сравнению с “только представлением” отсутствует в одних исследованиях (Friesen et al., 2017; Meers et al., 2020) и присутствует в других (Eaves et al., 2016a; Nagai, Tanaka, 2019).
Тем не менее представление движений вслед за видеостимулом имеет существенное методическое преимущество – становится явной структура фаз (направлений и скоростей) отдельных представляемых движений, которые невозможно предугадать при произвольном воображении. Этот прием позволил показать, что возбудимость корковых моторных зон увеличивается синхронно с движением на видео с минимальной временной задержкой (Borroni et al., 2005; Cengiz et al., 2018). Закономерности фазы и скорости наблюдаемого/представляемого движения еще не были исследованы для электрической активности мозга, в частности для классического маркера сенсомоторной активации – десинхронизации сенсомоторных ритмов ЭЭГ (Neuper et al., 2009).
Таким образом, целями настоящего исследования было выяснить, вызывает ли мысленное повторение движений за видеостимулом большую десинхронизацию по сравнению с произвольным представлением того же движения, а также проверить наличие связи между фазами и скоростями воображаемого движения и временной динамикой десинхронизации сенсомоторных ритмов.
МЕТОДИКА
Испытуемые. В исследовании приняли участие 30 здоровых добровольцев (16 женщин) в возрасте от 20 до 29 лет (медиана – 21) с доминантной правой рукой (согласно результатам самоотчета). Испытуемые не были знакомы с методикой представления движений до начала исследования и не были осведомлены о гипотезах исследования на всeм его протяжении. Все испытуемые дали письменное информированное согласие на участие в исследовании. Протокол исследования был одобрен Комиссией по биоэтике биологического факультета МГУ имени М.В. Ломоносова.
Регистрация ЭЭГ. Регистрация ЭЭГ осуществлялась при помощи двух электроэнцефалографов NVX-52 (МКС, Зеленоград, Россия) и 69 чашечных Ag+/AgCl электродов (MCSCAP-NTH), установленных согласно системе “10-10”. Для синхронизации двух энцефалографов использовались входящие и исходящие TTL-импульсы, генерируемые каждым устройством. В качестве референта использовался электрод в позиции Тр10, регистрируемый обоими энцефалографами с помощью электрода с Y-раздвоенным контактом. Контактное сопротивление для всех электродов не превышало 15 кОм. Частота дискретизации составляла 1000 Гц, при полосе пропускания от 0 до 200 Гц (по уровню –3 dB). Для контроля за наличием/отсутствием двигательной активности во время выполнения заданий с помощью дополнительных каналов одного из энцефалографов регистрировалась электромиограмма (ЭМГ) с короткой мышцы, отводящей большой палец кисти (abductor pollicis brevis).
Экспериментальные условия. Во время эксперимента испытуемый сидел в комфортном кресле, располагая руки так, чтобы локти находились на подлокотниках, предплечья сводились под 30–45 градусов в аксиальной плоскости, а кисти клались на плоский планшет, располагаемый на коленях. Правая кисть испытуемого помещалась в специальную подставку (рис. 1, верх), поддерживающую кисть в нейтральной позиции. Между большим и остальными пальцами кисти в подставке располагался гладкий упор, позволяющий большому пальцу скользить вверх и вниз, что соответствовало отведению и приведению большого пальца и имитировало работу со смартфоном с сенсорным экраном. Непосредственно перед располагаемой в подставке кистью устанавливался портативный 10-дюймовый ЖК-монитор, полностью закрывающий дистальную часть предплечья от взгляда испытуемого. В зависимости от экспериментального условия на монитор выводились стимулы: абстрактная картинка, пиктограмма руки или видео руки, совершающей движения пальцем вверх и вниз. В случае с видеостимулом перспектива, положение и размеры руки были максимально приближены к таковым для руки испытуемого с его точки зрения. Всего в эксперименте было 5 условий со следующими инструкциями:
Рис. 1.
Сверху – положение руки в подставке в нейтральном положении – кадр из видеостимула. По центру – пример оцифрованного сигнала фотодатчика, кодирующего фазу движения на видео (снизу). Траектории движения большого пальца в условиях с видеостимулами. Для периодических движений приведена частота выполнения движений в Гц. Fig. 1. The position of the hand in the stand in the neutral position – a frame from the video stimulus (top). Сenter – an example of a digitized signal from photosensor encoding the phase of motion in the video (bottom). Thumb movement trajectories under video-stimulated conditions. For periodic movements, the frequency of movements is given in Hz.
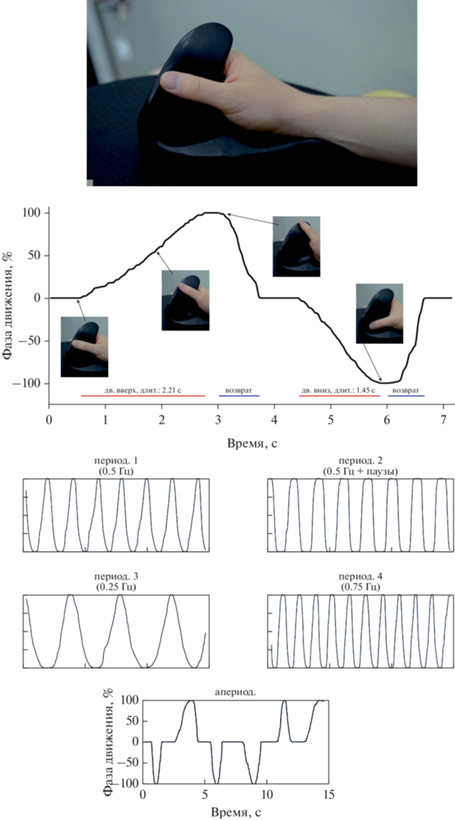
• Произвольные движения большим пальцем вверх и вниз по гладкому упору (“Д”) – испытуемые должны были совершать движения в случайном порядке из обозначенного выемкой центра упора вверх и вниз, варьируя только скорость фазы эксцентрического движения и возвращая палец в центр с примерно одинаковой скоростью. Движения совершались из центра гребня, их скорость и направление спонтанно выбирались непосредственно перед началом каждого движения. Испытуемым рекомендовалось не думать о скорости возвратных движений и совершать их в комфортном темпе без промедления. Испытуемый должен был начинать серию произвольных движений при появлении пиктограммы руки на мониторе и прекращать выполнение при ее исчезновении.
• Имитирующие движения большим пальцем вверх и вниз по гладкому упору (“ДИ”), синхронизованные с видеостимулом, – испытуемых просили с минимально возможной задержкой повторять движения, предъявляемые в видео на экране. Перспектива наблюдения монитора настраивалась так, чтобы создавалось ощущение продолжения собственной руки.
• Представления движений большим пальцем вверх и вниз по гладкому упору в произвольном темпе (П) – испытуемые должны были мысленно воспроизводить план движения, симулируя кинестетические и тактильные ощущения, возникающие, как если бы эти движения выполнялись в действительности. Между блоками с попытками представления испытуемые проходили устное интервью, включающее вербальное описание субъективных ощущений, возникающих при выполняемых и представляемых движениях. В ходе обсуждения с экспериментатором испытуемым объяснялась разница между “визуальными” и “кинестетическими” мысленными образами и рекомендовалось опираться на субъективно наиболее яркие кинестетические ощущения. При представлении движений рекомендовалось по возможность соблюдать манеру движения аналогично условию “Д”. Испытуемый должен был начинать представлять произвольные движения при появлении пиктограммы руки на мониторе и прекращать представление при ее исчезновении.
• Представление синхронно имитируемых движений на видео-стимуле (ПИ) – испытуемых просили внимательно отслеживать движения в видеоролике и мысленно представлять кинестетические ощущения, как если бы это были их собственные движения.
• Зрительный счет (ЗС) – на экране появлялась абстрактная картинка, содержащая большое количество геометрических элементов (Васильев et al., 2016). Испытуемым требовалось мысленно планомерно подсчитывать элементы рисунка того или иного типа (по усмотрению испытуемого). Это условие выполняло роль контроля для всех предыдущих условий и псевдослучайно чередовалось в блоках с каким-либо из двигательных условий (например, ЗС, П, ЗС, П, П, ЗС…).
Эксперимент был поделен на “записи” – неразрывные периоды выполнения попыток с одним из двигательных условий (Д, ДИ, П, ПИ) и зрительного счeта. В рамках одной записи выполнялось по 8–10 попыток каждого из двух условий, длящихся 7 с для условий П, Д и ЗС и 15 с для условий ДИ и ПИ. Синхронно имитируемые движения имели два варианта исполнения: апериодическое и периодическое (рис. 1).
У первых десяти испытуемых был представлен только апериодический вариант исполнения, а у оставшихся двадцати был как периодический, так и апериодический. Решение о включении в регламент периодических движений последовало в ответ на жалобы ряда испытуемых о том, что отдельные фазы апериодических движений было сложно имитировать из-за их внезапности и слабой предсказуемости. Напротив, в периодическом режиме движения испытуемые следовали постоянному ритму, что позволяло его быстро выучить и при выполнении/представлении следовать внутреннему предсказуемому плану движений, лишь сверяясь с видео-стимулом. В свою очередь, периодический режим выполнения подразделялся на четыре варианта, различающихся по скорости и частоте выполняемых движений. Это было сделано для того, чтобы избежать некорректных выводов из-за влияния неудачно (для конкретных испытуемых) подобранного темпа движения. Дополнительно, периодические режимы в своей совокупности соответствовали апериодическому, содержащему разные скорости и паузы, что позволило оценить влияние скорости и пауз в движении на уровень мозговой активации.
Предъявляемые видеостимулы в углу каждого кадра содержали сигнальную метку, кодирующую положение пальца уровнем серого по шкале от черного к белому. На место сигнальной метки на дисплее помещали подключаемый к энцефалографу аналоговый фотодатчик, регистрирующий световой поток, что при анализе позволяло достоверно установить фазу движения, наблюдаемую испытуемым в тот или иной момент времени (рис. 1, снизу).
Анализ ЭЭГ. Анализ ЭЭГ включал в себя четыре этапа: определение индивидуальных частотно-пространственных проекций мю-ритма (т.е. пространственный и частотный фильтры, отделяющие его от посторонних сигналов), вычисление мощности мю-ритма для всех неотбракованных эпох, статистическое сравнение значений десинхронизации в изучаемых состояниях, анализ связи временного хода десинхронизации с фазами и скоростями отдельных движений в условиях с видеостимулом (ДИ, ПИ).
Первым шагом анализа ЭЭГ в настоящей работе было выделение индивидуальных пространственно-частотных компонент реактивных сенсомоторных ритмов. Это подразумевало алгоритмический поиск оптимальных пространственных проекций (пространственных фильтров) и частотных фильтров, обеспечивающих наибольшую чувствительность к десинхронизации за счeт отклонения иррелевантных для анализа частей сигнала. Для вычисления оптимальных пространственных фильтров в работе был использован метод обобщенного разложения ковариационных матриц на основе собственных векторов (generalized eigendecomposition, GED), позволяющий находить оптимальные линейные комбинации каналов ЭЭГ, максимизирующие/минимизирующие отношение дисперсий между фрагментами многоканальных данных (Cohen, 2022). В настоящем исследовании проекции (собственные векторы), максимизирующие отношения дисперсии альфа-диапазона сигнала в задаче ЗС к дисперсии сигнала того же диапазона в моторных задачах, соответствовали статистическим (не анатомическим) источникам реактивных компонентов сенсомоторного ритма. При должной подготовке репрезентативных ковариационных матриц обоих состояний данный подход даeт статистически надeжные и нейрофизиологически интерпретируемые пространственные координаты изучаемых реакций (Haufe et al., 2014; Nikulin et al., 2011; Parra et al., 2005), а также используется для классификации состояний по ЭЭГ в интерфейсах “мозг–компьютер” (Blankertz et al., 2007). Для повышения чувствительности пространственных фильтров к сенсомоторному ритму вычисление ковариационных матриц проводилось после фильтрации в альфа-диапазоне: сначала в относительно широком (7–14 Гц), а затем в итеративно уточненном индивидуальном диапазоне частот, – такая процедура часто применяется при подготовке признаков для статистической классификации (Nikulin et al., 2008).
На следующем этапе анализа вычисленные оптимальные пространственные фильтры применялись к исходным ЭЭГ-данным, после чего проводилось вычисление мощности мю-ритма в индивидуальном частотном диапазоне. Для этого над сигналами интересующих пространственных компонент проводилось вейвлет-преобразование с суперсемплированием, предложенное в работе (Moca et al., 2021) и обеспечивающее повышенную временную и частотную разрешающую способность по сравнению со стандартной вейвлет-свeрткой. Далее анализировался временной ход мощности мю-ритма при выполнении отдельных фаз движений, оценивались плотности распределения вероятностей мощности мю-ритма в изучаемых условиях, а также вычислялся интегральный числовой индекс десинхронизации ERDd, разработанный нами ранее (Vasilyev et al., 2017) и представляющий собой интегральную величину различий синхронизации мю-ритма в двух состояниях. Статистический анализ интегральных величин (ERDd) проводился с использованием ANOVA для повторных измерений. Для выявления связи отдельных возмущений мю-ритма с фазами движения и их количественными показателями проводилось регрессионное моделирование с последующим статистическим тестированием (F-тест) коэффициентов модели (см. ниже).
Ниже представлен подробный алгоритм анализа.
Определение индивидуальных частотно-пространственных компонентов.
1) Выполнялась обработка фильтром с конечной импульсной характеристикой, не дающим фазового сдвига (zero-phase FIR) широкого альфа-диапазона 7–14 Гц (расчет оптимального порядка и коэффициентов фильтра определялся по процедуре Паркса-Макклеллана (функцией firpm из пакета Signal Processing Toolbox для MATLAB) со следующими целевыми показателями: ширина переходных полос – 0.8 Гц, амплитуда пульсаций в полосе пропускания – 0.002 дБ и амплитуда пульсаций в полосе подавления – 0.02 дБ).
2) Вычислялись две ковариационные матрицы: средняя для всех попыток c моторными условиями (Д, ДИ, П, ПИ) – ${{C}_{{{\text{active}}}}}$ и средняя для условия “зрительный счeт” – ${{C}_{{{\text{passive}}}}}$; для вычисления брался интервал от 2 с после начала попытки до окончания попытки.
3) Рассчитывались обобщенные собственные векторы для ковариационных матриц, так что
(1)
$\Lambda = {\text{argma}}{{{\text{x}}}_{w}}\left\{ {\frac{{{{W}^{T}}{{C}_{{{\text{active}}}}}W}}{{{{W}^{T}}{{C}_{{{\text{passive}}}}}W}}} \right\},$4) Матрица $W$ является набором пространственных фильтров, переводящих исходное пространство каналов ЭЭГ в набор компонентов с максимальными/минимальными отношениями дисперсий сигналов в двух условиях, а матрица А ≈ (W–1)T ≈ WT${{C}_{{{\text{active}}}}}$ является аппроксимацией прямой модели источников и используется для идентификации топографической локализации источника (Haufe et al., 2014).
5) Из всех источников отбирались два, обладающие наименьшим соотношением $\frac{{{{C}_{{{\text{active}}}}}}}{{{{C}_{{{\text{passive}}}}}}}$, имеющие не более двух выраженных локальных максимумов и латерализованную локализацию, захватывающую ряды электродов FC, C, CP, P – у одного источника в левом, а у второго – в правом полушарии. Первое условие гарантировало уменьшение дисперсии сигнала в моторном условии (т.е. десинхронизацию), а второе – принадлежность к физиологически правдоподобной локализации сенсомоторных ритмов. У большинства испытуемых эти источники имели индексы 1 и 2 (т.е. являлись источниками с минимальным отношением дисперсий).
6) Соответствующие отобранным источникам фильтры применялись к нефильтрованным данным, после чего проводилось частотно-временное преобразование отдельных эпох изучаемых состояний.
7) Усредненные по эпохам частотно-временные карты в двигательных условиях нормализовались на средние значения вейвлет-коэффициентов референтного состояния (ЗС) и использовались для уточнения индивидуальных диапазонов мю-ритма. Индивидуальный частотный диапазон определялся таким образом, чтобы в него было включено значение частоты, для которой наблюдался максимум десинхронизации, а также все смежные частоты, для которых десинхронизация составляла не менее чем 20% от максимума.
8) После уточнения индивидуальных частотных диапазонов повторялись шаги 1–7, при этом в шаге 1 фильтрация проходила уже в индивидуальном частотном диапазоне.
9) Далее для обоих источников определялся диапазон шириной 2 Гц, с наибольшим разделением плотностей вероятностей значений средней мощности для моторных состояний и зрительного счeта.
Вычисление мощности мю-ритма
10) Проводилось вейвлет-преобразование эпох для выделенных ипсилатерального и контралатерального источников. Для этого применялся набор комплексных вейвлетов Морле с вариабельным числом циклов для разных частот, после свертки которых с сигналом вычислялось геометрическое среднее по схеме, предложенной в (Moca et al., 2021).
11) Значения вейвлет-коэффициентов усреднялись для частотных диапазонов, выделенных на шаге 9 в соответствующих источниках, нормализовались на свое медианное значение для условия ЗС для всех эпох и переводились в децибелы (дБ) логарифмированием по основанию 10 и умножением полученного значения на 10.
Статистическое сравнение значений десинхронизации
12) В качестве значений десинхронизации использовался разработанный нами ранее индикатор ERDd (Vasilyev et al., 2017). Значение этой статистики представляет интеграл разности между функциями вероятностей значений мощности в каждом из изучаемых моторных состояний и объединенном условии ЗС. Мотивация для использования такой статистики будет пояснена далее (см. Результаты исследований).
13) Значения ERDd во время П и всех режимов ПИ анализировались с использованием ANOVA для повторных измерений.
Анализ связи временного хода десинхронизации с фазами движения на видеостимуле
14) Для анализа связи десинхронизации с происходящими на видео событиями (сменой отдельных фаз движений) применялась деконволюционная модель. Согласно этой модели, каждое отдельное событие на видео провоцирует локальное во времени возмущение мощности мю-ритма (P(mu)) постоянной формы (аналогично конечной импульсной характеристике) и модулируется по амплитуде некоторым свойством события. Реакции отдельных близко расположенных событий суммируются. В качестве событий были выбраны “начало направленного движения” и “начало возвратного движения”, величина ответа на событие “начало направленного движения” предполагалась в зависимости от его длительности. Для обоих событий моделировался ответ в интервале от –750 до 2000 мс относительно начала события. Связь между длительностью движения и реакцией моделировалась нелинейно методом обобщенной аддитивной модели (generalized additive model, GAM) с помощью пяти коэффициентов, соответствующих каждой из пяти ортогональных сплайн-функций (spl5) (Ehinger, Dimigen, 2019). Таким образом, модель мощности мю-ритма $P\left( {mu} \right)$ представлялась системой из двух уравнений:
где уравнение 3.1 соответствовало событиям “начало направленного движения”, а уравнение 3.2 – событиям “начало возвратного движения”; 1 – обозначает свободный коэффициент (intercept), а spl() – группа из пяти коэффициентов, описывающая нелинейную взаимосвязь мощности и длительности движения.15) Описанная в п. 14 модель обучалась для каждого испытуемого отдельно на данных в условии ДИ и ПИ с помощью пакета UNFOLD 1.2 (Ehinger, Dimigen, 2019). Получаемые в ходе регрессионного моделирования бета-коэффициенты анализировались на отличие от нуля и отличие среди уровней фактора $MovDuration$ = = $\left[ {0.6;1.0;1.4;1.8} \right]$. Неравенство нулю (F-тест) коэффициентов свидетельствовало о достоверности связанной с событиями реакции, а неравенство коэффициентов для разных уровней фактора указывало на зависимость между реакцией и длительностью движения на видео.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
На рис. 2 представлены прямые (генеративные) модели пространственных фильтров, захватывающие наиболее значимые источники десинхронизации сенсомоторного ритма в контралатеральном и ипсилатеральном полушариях. Для вычисления этих пространственных проекций для каждого испытуемого использовались все объединенные данные всех попыток моторных состояний (Д, ДИ, П, ПИ) и всех попыток зрительного счeта. Объединение состояний позволяет избежать переобучения фильтров из-за избыточной оптимизации к одному из условий. Как можно видеть, у всех испытуемых обнаружены источники с дипольной структурой и центром масс в районе центральных отведений рядов C-CP. Исключение составили испытуемые S06 и S18, у которых ни источников, ни самой реакции десинхронизации не наблюдалось. Отсутствие достаточной для детекции на ЭЭГ амплитуды мю-ритма, по всей видимости, связано с индивидуальными особенностями испытуемого, а не с повышенным моторным возбуждением, поскольку отсутствие выраженных сенсомоторных осцилляций фиксировалось уже в начале эксперимента при закрытых глазах.
Рис. 2.
Топографические представление пространственных источников, отобранных для анализа десинхронизации мю-ритма. Для каждого испытуемого модели представлены в парах: контралатеральный – слева, ипсилатеральный – справа. Fig. 2. Topographical representation of spatial sources selected for mu-rhythm desynchronization analysis. For each subject, the models are presented in pairs: contralateral – on the left, ipsilateral – on the right.
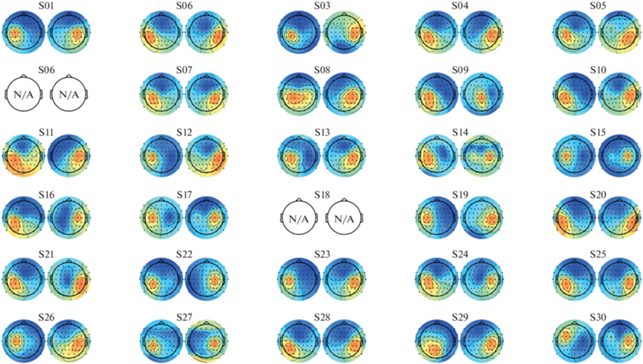
Выделение реактивных частотных диапазонов проводилось по описанному выше алгоритму (см. Методы) и также преследовало уменьшение размерности анализируемых данных. Реактивные частотные интервалы для всех испытуемых были унифицированы по ширине, составлявшей 3.5 Гц (7 бинов по 0.5 Гц). Средний по группе испытуемых частотный диапазон для контралатеральных источников определялся границами от 10 до 13 Гц.
Следующим этапом анализа была оценка мощности мю-ритма во время выполнения испытуемыми экспериментальных заданий. Для этого к данным применялся пространственный фильтр, выполнялось спектральное вейвлет-разложение (см. Методы) и усреднялись значения избранных частотных бинов. Для статистического анализа рассматривались значения мощности мю-ритма из интервала от 2 с от начала попыток до их окончания. Поскольку в эксперименте отдельные попытки имели существенную продолжительность и включали многократные повторы отдельных движений (представлений, подсчетов), при анализе они рассматривались как периоды стационарных изменений ритмической активности – т.е. без разбиения в пределах попытки.
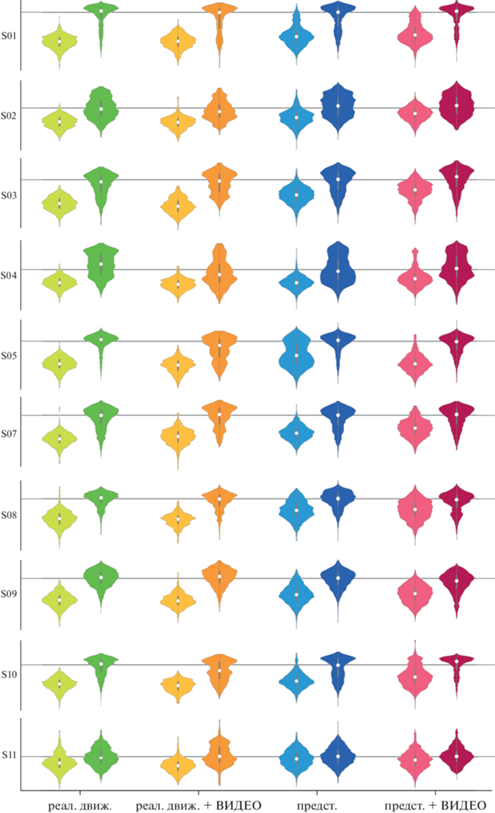
В интересах получения наиболее полной картины динамики ритмической активности были изучены эмпирические распределения значений мощности мю-ритма в каждом из изучаемых условий и сопутствующих им контролей (смежных с ними попыток ЗС). На рис. 3 представлены примеры, демонстрирующие характерные формы распределений мощности мю-ритма, а на рис. 4 изображены оценки плотности распределения вероятностей мощности мю-ритма для десяти первых испытуемых для состояний ДИ и ПИ в контралатеральных источниках.
Рис. 3.
Примеры функций плотности вероятности для мощности мю-ритма в моторном состоянии (светлые оттенки) и выполняемых в смежных попытках задания на зрительный счет (темные оттенки). Fig. 3. Examples of kernel density estimates for mu-rhythm power in the motor states (light shades) and those performed in adjacent attempts of the visual count task (dark shades).
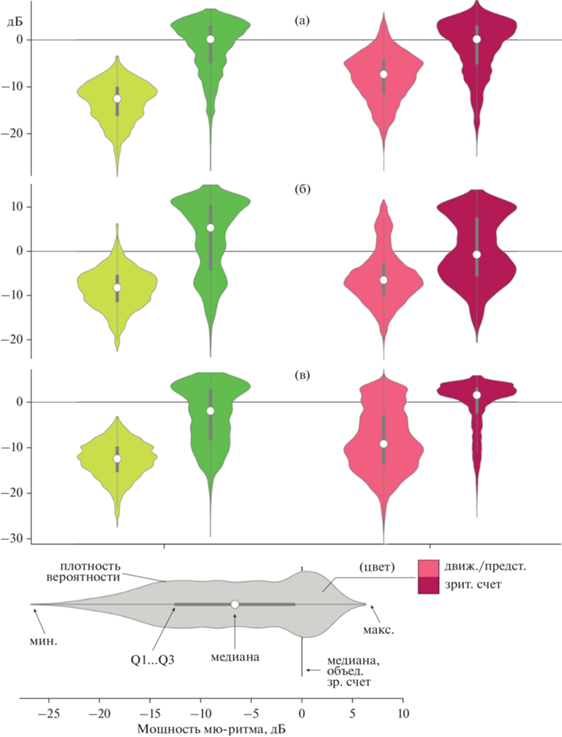
Рис. 4.
Оценки функций плотности вероятности для мощности мю-ритма в контралатеральных источниках для всех условий и первых десяти испытуемых. Масштаб осей сохранен для всех условий каждого испытуемого. Fig. 4. Kernel density estimates for mu-rhythm power in contralateral sources for all conditions and the first ten subjects. The scale of the axes is preserved for all conditions of each subject.
Визуальный анализ распределений показывает, что у одних испытуемых функция вероятности при зрительном счeте (на рисунках – темные тона) сохраняет свою форму и позицию (рис. 3 (а)), тогда как у других форма распределения меняется (рис. 3 (б, в)) за счeт изменения баланса между низкими и высокими значениями мощности, что говорит о частичном возврате в двигательно-расслабленное (синхронизованный мю-ритм) состояние. Так, у одних испытуемых (рис. 3 (в)) между попытками выполнения серий мышечных движений наблюдалась большая синхронизация, чем между попытками представления движений, тогда как у других (рис. 3 (б)) ситуация была обратной.
Второй особенностью являются расхождения в симметричности и модальности распределений. В ряде случаев значения мощности группируются вокруг своего среднего, образуя высокосимметричные мономодальные распределения, для которых меры центральной тенденции (среднее, медиана) достаточны для описания распределений мощности мю-ритма и оправданны для статистического анализа. Однако в большинстве случаев распределения приобретают мультимодальные или асимметричные формы, анализ которых при использовании традиционных статистик некорректен как со статистической, так и с нейрофизиологической точки зрения.
Можно видеть, что статистическая природа изменения средних значений величины десинхронизации отличается для испытуемых и состояний. Например, для испытуемого S10 мощность мю-ритма при выполнении движений в среднем меньше, чем для представления движений (рис. 3 (в): салатовая и розовая диаграммы), тем не менее различия связаны с увеличением фракции высоких значений, но не снижением типичной величины (моды у обоих распределений равны). Таким образом, можно говорить, что десинхронизация при представлении была не менее сильная, но менее стабильная, что указывает на наличие прерываний, а выраженное бимодальное распределение может быть связано с переключением между двумя состояниями – условных “покоя” и “работы” системы. У других испытуемых природа различий обусловлена именно снижением силы десинхронизации (рис. 3 (а): салатовая и розовая диаграммы), но не переключением между фиксированными десинхронизованным и синхронизованным состояниями. На основе этой характеристики в грубом приближении можно выделить два типа модуляции средней величины десинхронизации: амплитудную и импульсную модуляцию. Примером амплитудной модуляции могут служить испытуемые S03, S07, S08, у которых средняя мощность мю-ритма изменяется плавно в широком диапазоне значений, образуя мономодальные распределения одной формы со смещением центрального момента, а испытуемые S01, S05, S10 демонстрируют временную модуляцию за счeт изменения баланса фракций больших и малых значений мощностей из бимодального распределения (рис. 4).
Попыткой корректного учeта свойств распределений является разработанный нами индикатор десинхронизации ERDd (Vasilyev et al., 2017), вычисляемый как единица минус интеграл разности между распределениями мощности мю-ритма при референтном (ЗС) и моторном состояниях (Д, ДИ, П, ПИ). В отличие от классической разности средних, ERDd учитывает динамический диапазон значений мощности, форму их распределений и дополнительно отвязывает величину десинхронизации от единиц измерения сигнала (мкВ, дБ). Значение ERDd нормализовано на интервал [–100 100]: его модуль может пониматься как “доля значений, не входящих в распределение значений в контрольном состоянии”, а знак – расположение этих уникальных значений слева (десинхронизация) или справа (синхронизация) от контрольного распределения.
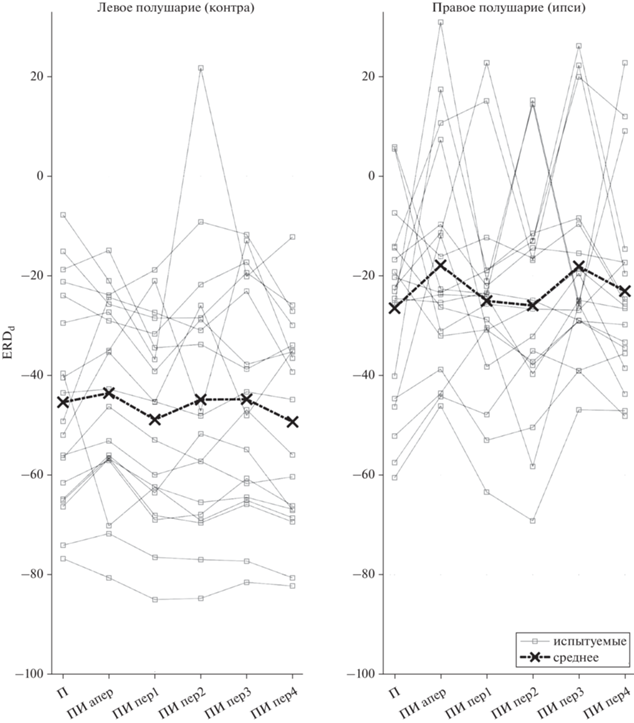
Для оценки значимых различий среди всех моторных состояний использовался ANOVA с повторными измерениями, который не показал достоверных различий показателя десинхронизации ERDd (табл. 1, рис. 5) для различных режимов представления (П, ПИ [апер, пер1–4]) как для контралатеральных источников (F5.90 = 1.6751, p = 0.14868, с поправкой на несферичность по методу “нижняя граница” p = 0.21193), так и для ипсилатеральных (F5.90 = 1.5829, p = 0.17295, с поправкой на несферичность p = 0.22443). Таким образом, на групповом уровне не удалось выявить статистически достоверного преимущества какого-либо режима представления движений. Однако для отдельных испытуемых, сила десинхронизации у которых была мала (относительно таковой при выполнении движения – Д, ДИ), выявлялось преимущество в пользу одного или нескольких режимов с мысленной имитацией периодических движений. У ряда испытуемых (S05, S14, S19, S29 – cм. табл. 1) наблюдались различия с превышением более, чем в полтора раза. Даже на групповом уровне значения ERDd для режимов с быстрым ритмическим представлением без остановок (пер1 и пер4) значительно выделялись на фоне остальных режимов с видеостимулами (ПИ) и произвольного представления (П). Учитывая большой межиндивидуальный разброс показателя ERDd, наиболее показательным окажется сравнение нормированных на максимальный ERDd при движении. Для режимов ПИ с пер1 и пер4 он составил 78–79% от максимума, тогда как для остальных режимов был в пределах 70–72%.
Таблица 1.
Оценки величины десинхронизации мю-ритма в контралатеральном движению источнике по показателю ERDd (меньше – сильнее десинхронизация) для всех испытуемых (n = 28) и всех типов задач на представление (Д – движение, П – кинестетическое представление движения, ПИ – представление движения с видео в режимах: “АПЕР” – апериодический, ПЕР# – периодический, см. рис. 1). Для движения (Д) представлено минимальное значение среди всех режимов, рассматриваемое как наибольшая зарегистрированная сила десинхронизации. Средние значения ERDd и они же, нормализованные к значениям для Д, представлены для групп испытуемых со всеми режимами (n = 19) и только без ПИ, пер* (n = 28). Подчеркнуты номера испытуемых, для которых в режимах ПИ ERDd превышает П более чем в полтора раза Table 1. Estimated desynchronization of the mu-rhythm in the contralateral movement of the source in terms of ERDd (less – stronger desynchronization) for all subjects (n = 28), and all types of tasks (Д – movement, П – kinesthetic imagery of movement, ПИ – imagery with video in the modes: “АПЕР” – aperiodic, ПЕР# – periodic, see fig. 1). For movement (Д), the minimum value among all modes is presented, considered as the largest recorded desynchronization score. The mean values of ERDd, and the same values normalized to the values for Д, are presented for groups of subjects with all regimens (n = 19) and only without ПИ, пер* (n = 28). Underlined are the numbers of subjects for whom in the ПИ modes ERDd exceeds П by more than one and a half times
| ИСПЫТ. № |
П | ПИ АПЕР |
ПИ ПЕР1 |
ПИ ПЕР2 |
ПИ ПЕР3 |
ПИ ПЕР4 |
Д, ВСЕ (МИН.) |
|---|---|---|---|---|---|---|---|
| 1 | –61.7 | –56.4 | – | – | – | – | –79.8 |
| 2 | –42.1 | –32.9 | – | – | – | – | –64.6 |
| 3 | –53.5 | –41.0 | – | – | – | – | –75.0 |
| 7 | –63.0 | –48.5 | – | – | – | – | –76.8 |
| 8 | –46.3 | –42.1 | – | – | – | – | –78.5 |
| 9 | –58.6 | –57.0 | – | – | – | – | –79.2 |
| 10 | –56.2 | –39.5 | – | – | – | – | –75.3 |
| 11 | –10.8 | –16.5 | – | – | – | – | –47.4 |
| 12 | –32.6 | –38.9 | – | – | – | – | –74.7 |
| 4 | –52.0 | –35.3 | –45.4 | –25.9 | –48.0 | –35.0 | –62.2 |
| 5 | –39.6 | –70.2 | –62.4 | –69.1 | –65.0 | –68.6 | –81.1 |
| 13 | –40.4 | –35.0 | –21.0 | –47.2 | –12.9 | –36.5 | –39.4 |
| 14 | –7.7 | –21.0 | –36.8 | 21.8 | –20.1 | –12.2 | –43.9 |
| 15 | –66.3 | –56.7 | –62.3 | –65.5 | –64.4 | –66.8 | –79.8 |
| 16 | –23.9 | –29.0 | –31.7 | –21.7 | –17.2 | –29.9 | –50.7 |
| 17 | –21.2 | –23.8 | –18.8 | –9.2 | –11.7 | –27.1 | –35.7 |
| 19 | –15.1 | –25.7 | –28.5 | –28.4 | –19.4 | –25.8 | –34.0 |
| 20 | –56.0 | –53.1 | –60.0 | –57.2 | –61.7 | –60.3 | –64.5 |
| 21 | –64.8 | –56.0 | –63.6 | –51.7 | –54.9 | –67.1 | –76.5 |
| 22 | –49.2 | –24.3 | –27.4 | –30.9 | –23.1 | –39.3 | –60.5 |
| 23 | –43.5 | –42.7 | –45.2 | –48.1 | –43.3 | –44.8 | –47.3 |
| 24 | –76.7 | –80.6 | –85.0 | –84.7 | –81.5 | –82.2 | –86.1 |
| 25 | –74.1 | –71.7 | –76.5 | –77.0 | –77.2 | –80.6 | –87.9 |
| 26 | –65.1 | –56.5 | –68.1 | –69.6 | –65.9 | –69.4 | –75.0 |
| 27 | –29.5 | –27.3 | –39.2 | –28.8 | –37.8 | –35.2 | –43.6 |
| 28 | –61.5 | –57.0 | –69.0 | –67.9 | –60.7 | –66.1 | –72.5 |
| 29 | –18.7 | –14.9 | –34.4 | –33.8 | –38.7 | –33.9 | –45.2 |
| 30 | –56.5 | –46.2 | –53.0 | –57.2 | –46.9 | –55.9 | –75.8 |
| ср. (n = 19) | –45.36 | –43.53 | –48.84 | –44.85 | –44.76 | –49.31 | –61.15 |
| ср. норм. (n = 19) | 0.72 | 0.70 | 0.78 | 0.70 | 0.70 | 0.79 | 1 |
| ср. (n = 28) | –45.95 | –42.86 | – | – | – | – | –64.76 |
| ср. норм. (n = 28) | 0.69 | 0.65 | – | – | – | – | 1 |
Рис. 5.
Оценки величин десинхронизации мю-ритма по показателю ERDd (меньше – сильнее десинхронизация) (n = 19), во всех задачах на представление движений (П – кинестетическое представление движений, ПИ – представление движений с видео в режимах: “апер” – апериодический, “пер#” – периодический, см. рис. 2) и двух источников десинхронизации (левое полушарие – слева, правое – справа). Fig. 5. Estimates of mu-rhythm desynchronization in terms of ERDd (less – stronger desynchronization) for subjects with all modes (n = 19), for all tasks for the imagined movements (П – kinesthetic imagery, ПИ – imagery with video in the modes: “апер” – aperiodic, “пер#” – periodic, see fig. 2) and two sources of desynchronization (left hemisphere – on the left, right – on the right).
Заключительный этап анализа был направлен на временную динамику мю-ритма во время повторения движений с видеоролика. Целью данного анализа было выяснить, является ли десинхронизация мю-ритма суммой ответов на одиночные движения (или их представление), или она развивается независимо при переходе в “режим” движения/представления. Для исследования этого вопроса временной ход десинхронизации в апериодическом режиме был смоделирован как ответ на события “начало направленного движения” и “возвратное движение”, причем величина ответа на начало направленного движения нелинейно масштабировалась в зависимости от длительности движения.
Результатом анализа являлись бета-коэффициенты модели, представленные для контралатеральных источников на рис. 6. Можно видеть, что как реальные движения, так и представления характеризуются отчетливым временным профилем десинхронизации, причем для движения ответ больше по амплитуде и происходит более резко, т.е. достигает максимума быстрее. Также для движений большей длительности ответ десинхронизации имеет большую амплитуду и длительность. Для проверки достоверности коэффициентов модели были протестированы контрасты для коэффициента, связанного с направленными движениями и возвратными движениями, а также влияние фактора “длительность движения” на коэффициенты перед функциями сплайнов spl(movDur, 5). Статистическое сравнение (F-тест) коэффициентов с нулем показало, что эффект от отдельных движений значим для реальных и представляемых движений для контралатеральных и ипсилатеральных источников (p < 0.0049), а длительность движения оказывает значимый эффект на амплитуду вызываемого ответа (p < 0.0014).
Рис. 6.
Бета-коэффициенты для значений мощности мю-ритма контралатеральных источников в интервалах [–0.5 2] c: (слева) относительно событий “начало направленного движения” фактора “длительность движения”; (справа) относительно событий “начало возвратного движения”. Сверху – для реального движения, снизу – для представляемого. Fig. 6. Beta-coefficients for mu-rhythm power values of contralateral sources in the intervals [–0.5 2] s: (left) relative to the events “the beginning of directed movement” of the “duration of movement” factor; (right) regarding the events of “start of the return movement”. Top row – for real movement, bottom row – for motor imagery.
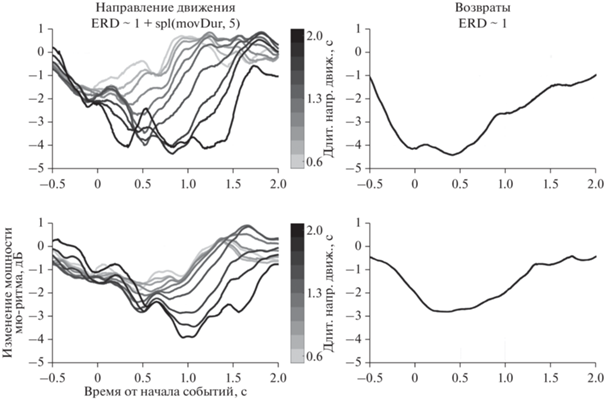
Таким образом, установлено, что отдельные движения, выполняемые в серии друг за другом, вызывают отдельные импульсы десинхронизации, при этом более медленные (продолжительные) движения вызывают более сильную десинхронизацию.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Изменение уровня синхронизации сенсомоторной коры
Анализ различий в формах плотностей распределения вероятностей мощности мю-ритма показывает несколько ключевых закономерностей, потенциально влияющих на получаемый результат. Во-первых, форма распределений для мощности в референтном состоянии может существенно меняться при смене моторной задачи. Так, у одних испытуемых выполнение движений приводит к увеличению фракции низких значений в смежных попытках зрительного счeта, что можно было бы объяснить повышением общего уровня сенсомоторного возбуждения и недостаточным временем между попытками, тогда как у других испытуемых, напротив, уже представление движений приводит к такому эффекту. Таким образом, у одних испытуемых увеличение базового уровня сенсомоторного возбуждения происходит больше при выполнении попыток намеренных движений, а у других – больше при представлении движений. В литературе указывается на вероятность связи эффектов уменьшения и увеличения десинхронизации с неудачным выбором референтного периода (Pfurtscheller, Da Silva, 1999). Тем не менее стандартным рекомендуемым методом вычисления индекса десинхронизации остается вычитание значений в периоде, предваряющем изучаемые события, которым в большинстве случаев является задача “фиксационный крест”. Наши данные показывают, что даже в случае состояний со слабой поведенческой вариабельностью (ЗС) у ряда испытуемых повышается вероятность спонтанной десинхронизации в состоянии моторного покоя. Это вызывает вопрос: насколько важно устанавливать “истинное” распределение значений мощности для моторного покоя и при каком состоянии это необходимо делать? С практической точки зрения, необходимость регистрации изолированного от остального эксперимента условия несет существенные временные издержки и не является необходимым примерно для половины испытуемых. В то же время очевидно, что излишняя возбудимость, фиксируемая в референтном состоянии, “наследуется” от смежного условия с той или иной моторной задачей и может ухудшать выделение пространственных компонент и искажать абсолютные значения метрик десинхронизации, что является важным при сравнении между испытуемыми. В данном исследовании данный вопрос был решeн в пользу объединения референтных состояний во всех условиях, что заведомо занизило показатели у некоторых испытуемых (например, S04).
Аналогичный вопрос встаeт для распределений в изучаемых (сравниваемых) состояниях, для которых мы наблюдали статистически разные механизмы модуляции средних значений изучаемыми состояниями: амплитудный и импульсный. При амплитудной (см. S03, S07, S08 на рис. 4) модуляции происходит плавное смещение моды распределения, а при импульсной – изменяется отношение фракций значений с фиксированными модами (S01, S05, S10). С точки зрения нейрональных механизмов, амплитудная модуляция десинхронизации означает изменение количества (Elul, 1972) синхронно работающих нейронов, тогда как широтно-импульсная модуляция соответствует уменьшению времени синхронной/асинхронной работы. В нашем исследовании амплитудная модуляция чаще наблюдалась при сравнении представления и движения, что может объясняться активацией большего количества нейронов при выполнении движения. Увеличение фракции высоких значений означает кратковременные переходы в синхронизированное состояние, что у нас было выражено для условия представления с видео в апериодическом режиме (ПИ апер). Это может быть связано с наличием в видео пауз, когда испытуемый ждет движения от руки на видео, тогда как при самостоятельном представлении пауз нет за счет постоянной генерации плана следующего движения. В контексте исследования паузы в видео были необходимы для корректного решения задачи связи событий и реакций десинхронизации, но в дальнейших исследованиях паузы можно убрать, сделав движения более частыми, – это может положительно сказаться на величине десинхронизации при имитации движений.
Влияние видеостимулов на силу десинхронизации
Как было предположено выше исходя из формы распределений, вероятным объяснением некоторого уменьшения десинхронизации в условиях с видео было наличие пауз и более редкие движения, что наиболее характерно для режима “ПИ апер” и, вероятно, вызвало заметное снижение десинхронизации (ERDd: с –45.95 до –42.86). Однако это не объясняет отсутствие увеличения десинхронизации по механизму амплитудной модуляции, ожидаемого из теоретических соображений. Так, в исследовании с наиболее близкими к рассматриваемым нами задачами (Eaves et al., 2016a) исследователи наблюдали увеличение десинхронизации в условии “наблюдение + представление” по сравнению с “представлением”. Стоит почеркнуть, что важным отличием приводимого исследования является то обстоятельство, что перспектива наблюдения за движением была от третьего лица. В эксперименте Eaves и коллег испытуемые наблюдали за движениями актера, обращенного на них лицом, а сами движения были сложными (вытирание лица, работа малярной кистью). Таким образом, их исследование было направлено на изучение имитации сложного двигательного поведения, в то время как в нашем исследовании было простое поведение с наблюдением от первого лица – конфигурация, рассчитанная на развитие иллюзии собственных движений. Другой важной особенностью было то, что в их исследовании движение было строго ритмичное, что более соответствовало режиму “ПИ пер1” из нашего исследования, для которого у нас также наблюдалась наибольшая десинхронизация. Наконец, в работе Eaves перед попытками самостоятельного представления давалась графическая инструкция в виде кадра из видео с ритмическим движением – это могло существенно склонять испытуемых к зрительному представлению, занижая тем самым десинхронизацию при условии “только представление”. Описанная работа приводит убедительные доказательства большей десинхронизации мю-ритма при объединении наблюдения и представления, однако различия в методике предъявления видео и типе движения не дают провести закономерные сравнения с нашим исследованием. Стоит также отметить, что в более новой работе с ТМС от той же группы и аналогичным дизайном исследователи приходят к обратному выводу – синергичного эффекта от наблюдения нет, а все эффекты на кортикоспинальную возбудимость связаны с представлением (Meers et al., 2020).
Другим заслуживающим внимания исследованием, рапортующим об увеличении десинхронизации при объединении наблюдения и представления является работа (Kondo et al., 2015). В их эксперименте видеостимул подавался в той же перспективе, что и в нашем, а движение было сопоставимо по сложности – сжатие кисти. Исследователями было показано, что тренировка в группе испытуемых c инструктирующим видеостимулом в многодневном эксперименте обучения работе с интерфейсом “мозг–компьютер” вызывала увеличение спонтанной десинхронизации с номером сессии, тогда как в группе испытуемых, тренирующихся со статическим стимулом, не было направленной динамики. Это наблюдение согласуется с полученными нами данными: для ряда испытуемых с низкой силой десинхронизации режимы с имитацией ритмического движения вызывали наибольший эффект.
Связь динамики мю-ритма с фазами наблюдаемого движения
В нашем исследовании показано, что представление вслед за видео вызывает ограниченный во времени и зависимый от свойств наблюдаемого движения ответ в виде снижения мощности мю-ритма (десинхронизацию). На данный момент существует целый ряд работ, изучавших изменения кортикоспинальной возбудимости с помощью транскраниальной магнитной стимуляции, применяющейся в разные фазы наблюдаемого цикличного предсказуемого движения. В своем большинстве эти работы изучают либо только наблюдение, либо добавляют условия “наблюдение + представление”, и показывают достоверную модуляцию возбудимости моторных зон мышц-агонистов с минимальной временной задержкой (Borroni et al., 2005; Cengiz et al., 2018). Это указывает на способность сенсомоторной системы мозга в реальном времени обрабатывать и симулировать наблюдаемое движение. К аналогичным выводам пришли в (Yokoyama et al., 2021), где исследователи смогли декодировать фазы представляемой ходьбы, наблюдаемой от третьего лица, хотя используемые ими признаки находились в затылочной коре, что свидетельствует в пользу преимущественно зрительного представления движений. В нашей работе уровень связи с отдельными событиями не позволяет детектировать одиночные движения, однако повышение ритмичности и предсказуемости движения в нашем дизайне может увеличить надежность связи амплитудных характеристик ответов, тем самым стать достаточным для считывания их средних на сравнительно коротких периодах времени (менее минуты). Это может быть использовано для оптимизации параметров движений в индивидуальных системах идеомоторных тренировок с ЭЭГ-контролем для вызова наибольшей сенсомоторной активации.
ВЫВОДЫ
• Выполнение и представление движений оказывает тоническое воздействие на амплитуду сенсомоторных ритмов, смещая уровень синхронизации при моторном покое. Наличие и направление воздействия индивидуальны.
• Количественные изменения величины десинхронизации происходят по двум механизмам: за счeт переключения между двумя уровнями синхронизации и изменения количества асинхронно работающих нейронов.
• Мысленное повторение наблюдаемого от первого лица движения приводит к десинхронизации сенсомоторного мю-ритма, эффект сильнее для ритмических быстрых движений без пауз.
• Во временном ходе десинхронизации мю-ритма возникают пертурбации, зависящие от фазы и скорости наблюдаемого движения как при его синхронном мышечном повторении, так и при мысленной синхронной имитации (представлении).
• Более продолжительные и медленные движения вызывают значимо более сильную десинхронизацию при попытке их мышечного или мысленного повторения.
Список литературы
Васильев А.Н., Либуркина С.П., Каплан А.Я. Латерализация паттернов ЭЭГ у человека при представлении движений руками в интерфейсе мозг–компьютер. Журн. высшей нервной деятельности им И.П. Павлова. 2016. 66 (3): 302–312.
Мокиенко О., Черникова Л., Фролов А., Бобров П. Воображение движения и его практическое применение. Журн. высшей нервной деятельности им И.П. Павлова. 2013. 63 (2): 195–195.
Altschuler E.L., Wisdom S.B., Stone L., Foster C., Galasko D., Llewellyn D.M.E., Ramachandran V.S. Rehabilitation of hemiparesis after stroke with a mirror. The Lancet. 1999. 353 (9169): 2035–2036.
Blankertz B., Tomioka R., Lemm S., Kawanabe M., Muller K.-R. Optimizing spatial filters for robust EEG single-trial analysis. IEEE Signal processing magazine. 2007. 25 (1): 41–56.
Borroni P., Montagna M., Cerri G., Baldissera F. Cyclic time course of motor excitability modulation during the observation of a cyclic hand movement. Brain research. 2005. 1065 (1–2): 115–124.
Braun S., Kleynen M., van Heel T., Kruithof N., Wade D., Beurskens A. The effects of mental practice in neurological rehabilitation; a systematic review and meta-analysis. Frontiers in human neuroscience. 2013. 7: 390.
Buccino G. Action observation treatment: a novel tool in neurorehabilitation. Philosophical Transactions of the Royal Society B: Biological Sciences. 2014. 369 (1644): 20130185.
Cengiz B., Vurallı D., Zinnuroğlu M., Bayer G., Golmohammadzadeh H., Günendi Z., Turgut A.E., İrfanoğlu B., Arıkan K.B. Analysis of mirror neuron system activation during action observation alone and action observation with motor imagery tasks. Experimental brain research. 2018. 236 (2): 497–503.
Cohen M.X. A tutorial on generalized eigendecomposition for denoising, contrast enhancement, and dimension reduction in multichannel electrophysiology. Neuroimage. 2022. 247: 118809.
De Vries S., Mulder T. Motor imagery and stroke rehabilitation: a critical discussion. Journal of rehabilitation medicine. 2007. 39 (1): 5–13.
Eaves D.L., Behmer Jr L., Vogt S. EEG and behavioural correlates of different forms of motor imagery during action observation in rhythmical actions. Brain and cognition. 2016a. 106: 90–103.
Eaves D.L., Riach M., Holmes P.S., Wright D.J. Motor imagery during action observation: a brief review of evidence, theory and future research opportunities. Frontiers in neuroscience. 2016b. 10: 514.
Ehinger B.V., Dimigen O. Unfold: an integrated toolbox for overlap correction, non-linear modeling, and regression-based EEG analysis. PeerJ. 2019. 7: e7838.
Elul R. The genesis of the EEG. International review of neurobiology. 1972. 15: 227–272.
Emerson J.R., Binks J.A., Scott M.W., Kenny R.P., Eaves D.L. Combined action observation and motor imagery therapy: a novel method for post-stroke motor rehabilitation. AIMS neuroscience. 2018. 5 (4): 236.
Ertelt D., Small S., Solodkin A., Dettmers C., McNamara A., Binkofski F., Buccino G. Action observation has a positive impact on rehabilitation of motor deficits after stroke. Neuroimage. 2007. 36: T164–T173.
Fadiga L., Fogassi L., Pavesi G., Rizzolatti G. Motor facilitation during action observation: a magnetic stimulation study. J. neurophysiology. 1995. 73 (6): 2608–2611.
Féry Y.-A. Differentiating visual and kinesthetic imagery in mental practice. Canadian Journal of Experimental Psychology/Revue canadienne de psychologie expérimentale. 2003. 57 (1): 1.
Friesen C.L., Bardouille T., Neyedli H.F., Boe S.G. Combined action observation and motor imagery neurofeedback for modulation of brain activity. Frontiers in human neuroscience. 2017. 10: 692.
Gerardin E., Sirigu A., Lehéricy S., Poline J.-B., Gaymard B., Marsault C., Agid Y., Le Bihan D. Partially overlapping neural networks for real and imagined hand movements. Cerebral cortex. 2000. 10 (11): 1093–1104.
Grafton S.T., Arbib M.A., Fadiga L., Rizzolatti G. Localization of grasp representations in humans by positron emission tomography. Experimental brain research. 1996. 112 (1): 103–111.
Guillot A., Collet C., Nguyen V.A., Malouin F., Richards C., Doyon J. Brain activity during visual versus kinesthetic imagery: an fMRI study. Human brain mapping. 2009. 30 (7): 2157–2172.
Hardwick R.M., Caspers S., Eickhoff S.B., Swinnen S.P. Neural correlates of action: Comparing meta-analyses of imagery, observation, and execution. Neuroscience & Biobehavioral Reviews. 2018. 94: 31–44.
Haufe S., Meinecke F., Görgen K., Dähne S., Haynes J.-D., Blankertz B., Bießmann F. On the interpretation of weight vectors of linear models in multivariate neuroimaging. Neuroimage. 2014. 87: 96–110.
Hendricks H.T., Van Limbeek J., Geurts A.C., Zwarts M.J. Motor recovery after stroke: a systematic review of the literature. Archives of physical medicine and rehabilitation. 2002. 83 (11): 1629–1637.
Hodges N.J. Observations on action-observation research: an autobiographical retrospective across the past two decades. Kinesiology Review. 2017. 6 (3): 240–260.
Kondo T., Saeki M., Hayashi Y., Nakayashiki K., Takata Y. Effect of instructive visual stimuli on neurofeedback training for motor imagery-based brain–computer interface. Human movement science. 2015. 43: 239–249.
Langhorne P., Coupar F., Pollock A. Motor recovery after stroke: a systematic review. The Lancet Neurology. 2009. 8 (8): 741–754.
Machado S., Lattari E., Souza de Sa A., BF Rocha N., Yuan T.-F., Paes F., Wegner M., Budde H., E Nardi A., Arias-Carrión O. Is mental practice an effective adjunct therapeutic strategy for upper limb motor restoration after stroke? A systematic review and meta-analysis. CNS & Neurological Disorders-Drug Targets (Formerly Current Drug Targets-CNS & Neurological Disorders). 2015. 14 (5): 567–575.
Meers R., Nuttall H.E., Vogt S. Motor imagery alone drives corticospinal excitability during concurrent action observation and motor imagery. Cortex. 2020. 126: 322–333.
Moca V.V., Bârzan H., Nagy-Dăbâcan A., Mureșan R.C. Time-frequency super-resolution with superlets. Nature communications. 2021. 12 (1): 1–18.
Nagai H., Tanaka T. Action observation of own hand movement enhances event-related desynchronization. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 2019. 27 (7): 1407–1415.
Nedelko V., Hassa T., Hamzei F., Schoenfeld M.A., Dettmers C. Action imagery combined with action observation activates more corticomotor regions than action observation alone. J. Neurologic Physical Therapy. 2012. 36 (4): 182–188.
Neuper C., Scherer R., Wriessnegger S., Pfurtscheller G. Motor imagery and action observation: modulation of sensorimotor brain rhythms during mental control of a brain–computer interface. Clinical neurophysiology. 2009. 120 (2): 239–247.
Nikulin V.V., Hohlefeld F.U., Jacobs A.M., Curio G. Quasi-movements: A novel motor–cognitive phenomenon. Neuropsychologia. 2008. 46 (2): 727–742.
Nikulin V.V., Nolte G., Curio G. A novel method for reliable and fast extraction of neuronal EEG/MEG oscillations on the basis of spatio-spectral decomposition. NeuroImage. 2011. 55 (4): 1528–1535.
Parra L.C., Spence C.D., Gerson A.D., Sajda P. Recipes for the linear analysis of EEG. Neuroimage. 2005. 28 (2): 326–341.
Pfurtscheller G., Da Silva F.L. Event-related EEG/MEG synchronization and desynchronization: basic principles. Clinical neurophysiology. 1999. 110 (11): 1842–1857.
Sarasso E., Gemma M., Agosta F., Filippi M., Gatti R. Action observation training to improve motor function recovery: a systematic review. Archives of physiotherapy. 2015. 5 (1): 1–12.
Stinear C.M., Byblow W.D., Steyvers M., Levin O., Swinnen S.P. Kinesthetic, but not visual, motor imagery modulates corticomotor excitability. Experimental brain research. 2006. 168 (1–2): 157–164.
Tsakiris M., Haggard P. The rubber hand illusion revisited: visuotactile integration and self-attribution. Journal of experimental psychology: Human perception and performance. 2005. 31 (1): 80.
Vasilyev A., Liburkina S., Yakovlev L., Perepelkina O., Kaplan A. Assessing motor imagery in brain-computer interface training: psychological and neurophysiological correlates. Neuropsychologia. 2017. 97: 56–65.
Villiger M., Estévez N., Hepp-Reymond M.-C., Kiper D., Kollias S.S., Eng K., Hotz-Boendermaker S. Enhanced activation of motor execution networks using action observation combined with imagination of lower limb movements. PloS one. 2013. 8 (8): e72403.
Vogt S., Di Rienzo F., Collet C., Collins A., Guillot A. Multiple roles of motor imagery during action observation. Frontiers in human neuroscience. 2013. 7: 807.
Yokoyama H., Kaneko N., Watanabe K., Nakazawa K. Neural decoding of gait phases during motor imagery and improvement of the decoding accuracy by concurrent action observation. Journal of Neural Engineering. 2021. 18 (4): 046099.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


