Химическая физика, 2019, T. 38, № 1, стр. 67-74
Способы формирования пористых кальций-фосфатных полимерных композитовВ. Н. Горшенёв
В. Н. Горшенёв *
Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
* E-mail: gor@sky.chph.ras.ru
Поступила в редакцию 14.05.2018
После доработки 20.06.2018
Принята к публикации 14.05.2018
Аннотация
Рассмотрены способы формирования пористой структуры в пластичных и термопластичных кальций-фосфатных композитах. Пластичные композиции синтезировались на основе природных полимеров (коллаген, желатин, альгинат натрия). В качестве термопластичных полимеров применялись биодеградируемые полимеры: полилактид и поли-3-гидроксибутират. Развиваемые в работе подходы формирования пористой структуры в полимерных композитах за счет лиофильного, микроволнового высушивания, использования специальных приспособлений, газовыделяющих добавок, применения методов 3D-печати и электроформования волокон свидетельствуют о необходимости совмещать различные способы для достижения разветвленной пористой структуры и требуемых размеров пор в композитах.
ВВЕДЕНИЕ
В настоящее время наблюдается значительный рост работ по созданию синтетических костнозамещающих биоматериалов, получаемых совмещением кальций-фосфатных соединений с природными и синтетическими полимерами [1–3]. Это связано, как с увеличением уровня травматизма, так и с обширными заболеваниями костной ткани. При выборе исходных материалов для создания биокомпозитов наиболее естественными являются биодеградируемые полимеры и кальций-фосфатное соединение гидроксиапатит, которые в многочисленных экспериментах на животных показали не только биосовместимость, но и продемонстрировали свою способность в зависимости от состава, способа изготовления стимулировать костеобразование и служить матрицей для формирующейся новой костной ткани [4–6]. Создание пористых кальций-фосфатных композитов для замещения дефектов костной ткани является актуальной и социально значимой задачей. Пористые биоматериалы необходимы для эффективного взаимодействия с тканями в живых системах. Важно, чтобы поверхность биоматериалов способствовала адгезии, закреплению клеток и их миграции в пористой структуре [7]. Преимущества применений пористых материалов для медико-биологических целей на основе природных и синтетических полимеров связаны также с возможностью регулирования функциональных свойств синтезируемых материалов за счет иммобилизации ферментов, белков, аминокислот и других природных веществ на поверхности биоматериалов [8, 9].
Цель работы – изготовление кальций-фосфатных композитов и оценка возможности применения рассматриваемых способов для формирования пористых структур в полимерных композитах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Кальций-фосфатные биокомпозиты на основе природных и синтетических биодеградируемых полимеров изготавливались смешением суспензий полимеров с синтезированными частицами гидроксиапатита Са10(РО4)6(ОН)2. Частицы гидроксиапатита синтезировались по реакциям (1) и (2) в условиях механо-акустического смешения реагентов. Детальные условия смешения реагентов представлены в работах [10, 11].
(1)
$\begin{gathered} 6{\text{CaHP}}{{{\text{О }}}_{4}} \cdot {{{\text{H}}}_{{\text{2}}}}{\text{O}} + 4{\text{Ca(OH}}{{)}_{2}} \to \\ \to {\text{С }}{{{\text{а }}}_{{10}}}{{({\text{Р }}{{{\text{О }}}_{4}})}_{6}}{{({\text{О Н }})}_{2}} + 12{{{\text{Н }}}_{{\text{2}}}}{\text{О }}, \\ \end{gathered} $(2)
$\begin{gathered} 6{{\left( {{\text{N}}{{{\text{H}}}_{4}}} \right)}_{2}}{\text{HP}}{{{\text{O}}}_{4}} + 10{\text{Ca}}{{\left( {{\text{N}}{{{\text{O}}}_{3}}} \right)}_{2}} \cdot 4{{{\text{H}}}_{{\text{2}}}}{\text{O}} + \\ + \,\,8{\text{N}}{{{\text{H}}}_{{\text{4}}}}{\text{OH}} \to {\text{C}}{{{\text{a}}}_{{{\text{10}}}}}{{\left( {{\text{P}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{{\text{6}}}}{{\left( {{\text{OH}}} \right)}_{{\text{2}}}} + \\ + \,\,20{\text{N}}{{{\text{H}}}_{{\text{4}}}}{\text{N}}{{{\text{O}}}_{{\text{3}}}} + 46{{{\text{H}}}_{{\text{2}}}}{\text{O}}{\text{.}} \\ \end{gathered} $В результате синтеза по реакции (1) были получены частицы гидроксиапатита ГАП-1 размером 2–3 мкм. По реакции (2) синтезированы кальций-фосфатные суспензии с наноразмерными частицами гидроксиапатита ГАП-2. При центрифугировании кальций-фосфатных суспензий ГАП-1 и ГАП-2 на центрифуге Allegra 64R, Beckman в режиме 6000 мин–1 в течение 15–20 мин образуются осадки пастообразной консистенции, Такие синтезированные кальций-фосфатные концентраты смешивались с суспензиями коллагена, альгината натрия (INCI:Sodium Alginate, США) с применением ультразвукового диспергатора (УЗДН-А). Новый подход получения коллагеновых кальций-фосфатных композитов состоял в синтезе частиц гидроксиапатита непосредственно в коллагеновой матрице.
В качестве исходного коллагенсодержащего сырья использовалась свиная шкура, обезжиренная гексаном, подвергнутая криодроблению до размера частиц ≤5 мм и диспергированная в условиях механоакустической активации в ротарно-пульсационном аппарате (РПА) ОАО КПП “Авиамотор” (Казань) до гидрозоля коллагена. Благодаря конструктивным особенностям РПА жидкотекучие среды в зоне обработки подвергаются комплексному механо-акустическому воздействию за счет больших градиентов скоростей, вихреобразования и высокочастотных пульсаций.
Дробленая свиная шкурка (массой 0.5 кг) при скорости вращения двигателя РПА 3000 мин–1 в течение 10–15 мин и температуре не выше 80 °С превращалась в гидрозоль коллагена. Полученный результат позволил провести реакции (1) и (2) путем механоакустической активации реакционных смесей, состоящих из: а) водных суспензий монофосфита кальция и гидроксида кальция – реакция (1), б) водных растворов диаммонийфосфата, тетрагидрата нитрата кальция и гидроксида аммония – реакция (2), непосредственно в суспензии коллагена.
Смешивание кальций-фосфатных концентратов с 6–7% растворами полилактида и поли-3-гидроксибутирата (ПГБ) в хлороформе также проводилось в условиях ультразвукового диспергирования (УЗДН-А).
Для смешивания компонентов были приготовлены 7%-ные растворы полилактида (ПЛА, марка 4032D, фирма Nature Works LLC, США, (L-D,L): плотность – 1.27 г/см3, температура плавления – 165–170 °С) и поли-3-гидроксибутирата, полученного микробиологическим синтезом (фирма BIOMER, Германия: плотность – 1.25 г/см3, температура стеклования – 5–10 °С, температура плавления – 173–180 °С).
Смесевые кальций-фосфатные полимерные композиции пастообразной консистенции помещали в формы различных конструкций, в специальные приспособления для высушивания смесей и формирования пористой структуры в образцах материалов. Удаление жидких фаз из кальций-фосфатных композиций осуществлялось лиофильным высушиванием и под действием термо- и/или СВЧ-нагрева.
Лиофильное высушивание проводилось в лиофильной сушилке (Gamma 1-16 L 4SC, фирма Martin Christ, Германия). Удаление жидких фаз из композиций под действием микроволнового излучения проводили в СВЧ-печи (частота – 2.45 ГГц, мощность $ \approx $800 Вт, фирма SHARP, Япония). Методами электронной (сканирующий электронный микроскоп Neon40EsB-35-09, фирма Carl Zeiss, Германия) и оптической микроскопии (Leica DM CM, США) регистрировали поры в образцах.
Измерения пористости проводили для коллагеновых кальций-фосфатных композиций, высушенных лиофильно и под действием СВЧ-нагрева, методом эталонной контактной порометрии по изменению веса образцов, обработанных под вакуумом органической жидкостью октаном [12, 13].
Для оценки дополнительного действия на формирование пористой структуры в композитах порофоров, интеркалированных слоистых соединений проведены сравнительные эксперименты с рядом соединений. При введении в состав композиций порофора углекислого аммония, который разлагается с выделением газообразных продуктов по реакции (3), происходит вспенивание композиции и образование пор
(3)
${{\left( {{\text{N}}{{{\text{H}}}_{{\text{4}}}}} \right)}_{2}}{\text{C}}{{{\text{O}}}_{3}} \to 2{\text{N}}{{{\text{H}}}_{2}} + {\text{C}}{{{\text{O}}}_{2}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}.$Модифицированные слоистые соединения, вводимые в полимерные композиции под действием термо- и/или микроволнового нагрева, расширяются с газовыделением (СО, СО2, Н2О) [14] и формируют пористые образцы материалов пониженной плотности. Такой подход апробирован в работе на примере интеркалированных графитов, вводимых в образцы биодеградируемых полимеров ПЛА и ПГБ.
Для формирования регулярных распределений пор ячеистого строения в работе применялся метод 3D-печати. Трехмерная печать является новым подходом производства конструкций для тканевой инженерии. Потенциал техники 3D-печати позволяет изготавливать конструкции высокой структурной сложности. Для 3D-печати использовали модифицированный 3D-принтер Engineer V2 [15], работающий по принципу послойного наплавления полимера.
Процесс электроформования волокон (ЭФВ) осуществляли [16] на опытной лабораторной однокапиллярной установке ЭФВ-1 (Россия) с диаметром капилляра 0.1 мм. Напряжение на электроде составляло 12 кВ. Расстояние между электродами 18 см. Формовочные растворы из полилактида и поли-3-гидроксибутирата готовили на основе хлороформа с содержанием полимера 7%. В раствор полимера вводили частицы гидроксиапатита до 5 мас. % в условиях ультразвукового диспергирования. Волокна полимерных композиций осаждались на полипропиленовой подложке.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В настоящее время разрабатываются различные способы и применяется новая техника для формирования пористых биоматериалов, особенно для применений в медицине. Способы формирования пористых кальций-фосфатных биокомпозитов, которые рассматриваются в работе, приведены ниже:
| 1. Лиофильное высушивание. |
| 2. Микроволновое высушивание (СВЧ-печь). |
| 3. Применение приспособлений с волокнами (полезные модели). |
| 4. Применение газовыделяющих добавок в составе композиций (порофоры, сверхкритический СО2). |
| 5. Конструирование пористых биоматериалов методом 3D-печати. |
| 6. Конструирование пористых биоматериалов методом ЭФВ. |
В результате синтеза частиц гидроксиапатита по реакции (1) непосредственно в коллагеновой матрице были получены коллагеновые кальций-фосфатные суспензии. В работе использовалась способность синтезированных суспензий из частиц гидроксиапатита (ГАП-1) и коллагеновых кальций-фосфатных частиц (ГАП-К) образовывать пластичные пастообразные композиции в результате удаления избыточной воды центрифугированием. Гидроксиапатитовые концентраты после центрифугирования помещали в специальные формы для изготовления пористых биокомпозитов с применением способов, указанных выше.
Лиофильное высушивание
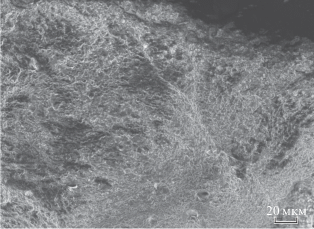
Лиофильным высушиванием коллагенового кальций-фосфатного концентрата получены пористые образцы плотностью 0.15–0.2 г/см3 (рис. 1). Методом эталонной контактной порометрии определено, что основная доля пор для коллагенового кальций-фосфатного композита (ГАП-1/К) приходится на размеры от 10 до 100 мкм. При этом поры размером 60 мкм являются доминирующими. При сравнении коллагеновых кальций-фосфатных биокомпозитов с образцом только из частиц гидроксиапатита (без органического связующего компонента) установлено, что величина поверхности пор зависит от соотношения минеральной и органической составляющих композита и заметно уменьшается при увеличении содержания органического компонента. Так, ксерогель из частиц гидроксиапатита ГАП-2, полученного по реакции (2), характеризуется площадью пор около 616 м2/г, а для композиции коллаген–кальций-фосфат (при соотношении неорганической и органической составляющих 60 : 40 мас. %) эта величина уменьшается до 27 м2/г, что обусловлено блокированием пор органическим компонентом.
Рис. 1.
Микрофотографии образца гидроксиапатит/ коллаген (ГАП-К), полученные в сканирующем электронном микроскопе Neon40EsB-35-09.
Известно, что лиофильное высушивание применяется также при изготовлении нановолокнистых композиций из синтетических полимеров в органических растворителях [17]. В этом случае синтетический полимер полилактид растворяют в органическом растворителе, затем проводят гелеобразование смеси и экстракцию растворителя из геля водой. После замораживания водной композиции проводят лиофильное высушивание в вакууме. В результате структура нанофибриллярной матрицы представляла трехмерный непрерывный волокнистый каркас с диаметром волокон от 50 до 500 нм. В работе [17] также установлено, что равномерные сетки нановолокон формируются из геля после замораживания в жидком азоте, а структурная равномерность распределений и размеров пор зависят от концентрации полимера, температуры гелеобразования, растворителя и температуры замерзания образца перед высушиванием.
В работе [18] отмечают сложный характер процесса замораживания, когда с образованием льда происходит выталкивание частиц твердой фазы на поверхность льда за счет перемещения фронта замерзания и за счет затекания жидкой фазы в область между частицами твердой фазы и льдом.
Поэтому, для уменьшения влияния объемных процессов замерзания, формы для лиофильного высушивания образцов (паст) изготавливали из диэлектрических материалов с углублением от 0.3 до 3 мм. В таких формах осуществлялось высушивание образцов кальций-фосфатных композиций с природными и синтетическими полимерами различных составов лиофильно и под действием микроволнового нагрева.
Микроволновое высушивание. Термостимулированный СВЧ-нагрев
Применение микроволнового излучения для удаления жидких фаз из биокомпозитных смесей – перспективно, особенно, в условиях формирования смешанных композиций из природных и синтетических полимеров. Биокомпозиты, содержащие воду, полярные растворители, электропроводящие частицы, при взаимодействии с микроволновым излучением (СВЧ-диапазона) интенсивно нагреваются. В результате происходит удаление из биокомпозитов жидких веществ, переходящих в газовую фазу, и формирование пористой структуры материала [19]. Взаимодействие электромагнитного излучения с образцами материалов характеризуется коэффициентами: отражения (R), поглощения (Q), прохождения (T). Величины R, Q, T определяются комплексными значениями диэлектрической, магнитной проницаемости образцов материалов, длиной волны ($\lambda $) излучения и толщиной облучаемого материала (d). Модельные эксперименты с материалами различной природы (интеркалированными графитами, саженаполненной бумагой, жидкостями) показали [20], что для эффективного взаимодействия с электромагнитным излучением необходимо определенное отношение удельного объемного сопротивления материалов (ρv), толщины материала (слоя d) и расположения материала на диэлектрической подложке (с величиной диэлектрической проницаемости подложки ε). Баланс всех частей энергии и определяет условия нагрева.
Образцы биокомпозитов помещались так, чтобы весь образец находился в поле излучения. Образцы изготавливали нанесением пастообразных композиций на диэлектрическую (тефлоновую) подложку с последующим высушиванием под действием излучения СВЧ-печи. Установлено, что процесс высушивания в режиме последовательного нагрева коллаген-гидроксиапатитовой композиции по 15–20 с не приводит к сильному нагреву образцов и развитию деструктивных процессов. Спектры комбинационного рассеяния образцов коллаген-гидроксиапатита лиофильно высушенные и высушенные под действием СВЧ-излучения практически не отличаются. Как отмечается в работе [21], температура до 60 °С не оказывает на коллаген повреждающего действия. Сравнение порометрических характеристик (для пор больше 10 мкм) образцов биокомпозитов, высушенных лиофильно и под действием СВЧ-излучения, также не выявили явных различий.
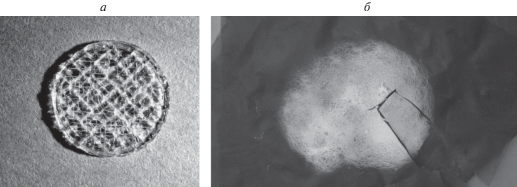
При изготовлении сложных композиций, состоящих из коллаген-гидроксиапатитового концентрата и биодеградируемых полимеров (ПЛА, ПГБ) также применялось СВЧ-излучение. При этом водный коллаген-гидроксиапатитовый концентрат смешивался с биодеградируемым полимером в органическом растворителе (хлороформе) под действием ультразвукового диспергирования с частотой 22 кГц в течение 3–5 мин. Формирование пористых биокомпозитов осуществлялось послойным нанесением полученной пастообразной композиции на диэлектрическую подложку и удалением жидких компонентов под действием микроволнового излучения. Оценку количества полимерного компонента М (г), необходимого для обеспечения оптимального пленкообразования на частицах гидроксиапатита, проводили с учетом массы сухого ГАП (m, г), удельной поверхности порошка ГАП (Sуд, см2/г), плотности полимера (ρ, г/см3) и толщины слоя полимера на поверхности частиц порошка (h, см) по соотношению: М = mSρh. Виды пористых образцов биокомпозитов из коллаген-гидроксиапатитового концентрата и полилактида в хлороформе, полученного под действием СВЧ-нагрева, представлен на рис. 2а.
Рис. 2.
а – поры в образце полилактида с частицами гидроксиапатита формировались после смещивания компонентов и высушивания в СВЧ-печи; б – образец из пастообразной композиции альгинат натрия с частицами гидроксиапатита в виде решетки, изготовленный в специальной форме с окном 0.3–0.3 мм.

В результате исследований установлено, что при введении в состав пастообразных композиций добавок, влияющих на электрическую проводимость композиций, можно регулировать скорость удаления газообразных компонентов и влиять на пористую структуру биоматериалов. Изготовление пористых образцов биокомпозитов с применением специальных приспособлений с закладными элементами для образования сквозных пор необходимых размеров проводили с применением форм (рис. 2). Оптимальный размер пор составляет величины от 50 до 500 мкм, что делает возможным прорастание в материал костных клеток, сосудов и обеспечивает проницаемость для межтканевых жидкостей организма.
Приспособления и полезные модели
Для изготовления биокомпозитов со сквозными порами были разработаны приспособления, из которых (рис. 3) после заполнения кальций-фосфатными пастами удаляли жидкую фазу. Приспособление для формирования пористого кальций-фосфатного композита, содержащее полую кювету 1 (рис. 3а), выполненную с возможностью заполнения биокомпозитной массой 4 и задающими пористость закладными волокнами 3, отличается тем, что в стенках кюветы была сделана сетка сквозных отверстий 2 для проведения и фиксации в них волокон. Кювета в форме трубки 3 (рис. 3б) для заполнения биокомпозитной массой была выполнена из эластичного полимера, преимущественно каучука, а введение закладных волокон нити (1, 2) осуществляли через сквозные отверстия в ее стенках, образованных прокалыванием иглой с нитью. Волокна выбирались из группы, включавшей текстильные, полимерные, металлические волокна, в том числе из биоразлагаемых материалов диаметром 100–500 мкм. После заполнения биокомпозитной массой, сушки и удаления волокон получается композит со сквозной пористостью, заданной первоначальным распределением волокон. Кальций-фосфатные композиции с природными, синтетическими полимерами и их смесями в таких приспособлениях также после заморозки высушивали лиофильно в вакуумно-сушильном шкафу и под действием микроволнового нагрева в СВЧ-печи.
Рис. 3.
Приспособления для формирования биокомпозитов со сквозной пористостью: а – полая кювета из оргстекла; б – кювета в форме трубки из эластичного полимера.
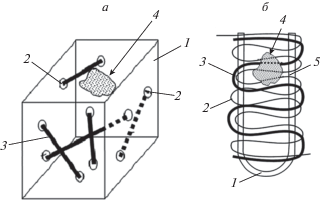
К способу формирования пористых полимерных композиций с применением специальных приспособлений можно отнести способ заполнения кювет (рис. 3) водорастворимыми гранулами, волокнами. При таком подходе гранулы и волокна в кюветах обрабатываются раствором биодеградируемого полимера. Затем гранулы, волокна растворяются и композиция высушивается. Пористые трехмерные носители для культивирования и трансплантации клеток на основе сополимера гидроксибутирата с гидроксивалератом в работе [22] изготавливались путем создания временного каркаса, растворимого в нетоксичном растворителе, отличном от растворителя полимера. Временный каркас был выполнен из частиц водорастворимого соединения (размер – 200–400 мкм). После формирования пор временный каркас пропитывали раствором полимера.
Применение газовыделяющих добавок
Введение в состав композиций порофоров для пенообразования проводили на примере углекислого аммония, который разлагается с выделением газообразных продуктов по реакции (3). Дополнительное введение в пастообразные коллаген кальций-фосфатные композиции углекислого аммония при нагревании приводит к вспениванию композиций с увеличением толщины образцов и возникновению пор. Аналогичный эффект наблюдается для биодеградируемых полимеров. Пластинка из прессованных гранул полилактида помещалась в водно-ацетоновый раствор углекислого аммония из расчета (1 г углекислого аммония в 10 мл ацетона с добавлением 3 мл воды) на 24 ч. Образец прессованной пластинки из ПЛА за 30 с нагрева под действием СВЧ-излучения уменьшился в весе в 2 раза, а толщина образца увеличилась от 1.2 до 7.4 мм. При таком подходе расширение образцов с образованием пор происходит в результате испарения органических растворителей и терморазложения порофоров.
Термическое расширение полимерных образцов из ПЛА и ПГБ под действием разлагающихся порофоров и терморасширяющихся интеркалированных графитов происходит, когда полимерные материалы переходят в вязкотекучее состояние. Расширение интеркалированных графитов начинается при температуре 180 °С, поэтому полимеры при нагревании переходят в расплав и терморасширяются при выделении СО, СО2, Н2О. Термомеханический анализ (ТМА) характеризует терморасширение [23] как расширение образца с изменением направления движения индентора, который погружается в начале процесса плавления полимера. Разложение порофоров в полимерных матрицах регистрировалось методом дифференциально-сканирующей калориметрии по эндо- или экзотермическим пикам поглощения тепла при газовыделениях.
Формирование пор с применением порофоров демонстрирует сложность регулирования размеров пор и их распределение в полимерной матрице. Методы формирования пористой структуры в полимерных материалах с газообразующими добавками следует совмещать с другими способами формирования пористых структур. Выделение методов 3D-печати и ЭФВ (нетканых материалов) из биодеградируемых полимеров связано с возможностями создания сложных костнозамещающих конструкций.
Метод 3D-печати
Методом 3D-печати в настоящее время изготавливаются пористые трехмерные полимерные биокомпозиты с регулярной архитектурой распределения пор заданных размеров [24]. Послойное построение конструкций (рис. 4а, 5а) методом экструзии, осуществлялось продавливанием через сопло расплава полимера ПЛА в виде отдельных линий, которые отверждаются при охлаждении на строительной плите. Ячейки конструкции из биодеградируемого термопластичного полимера полилактида заполнялись кальций-фосфатными пастами на основе коллагена, альгината натрия с испарением жидких фаз под действием микроволнового СВЧ-излучения. Образец пористой конструкции ячеистого типа, изготовленный послойным построением из полимерных волокон, формирующих за счет перекрестного расположения волокон в соседних слоях ячейки заданных размеров, изображен на рис. 4а. Конструкции каркасного строения, построенные из биодеградируемых полимеров с ячейками, которые заполнялись кальций-фосфатными пастами с органическими компонентами на основе коллагена и альгината натрия, представляют интерес как пористые имплантаты. Регулярное распределение ячеек размером 300–500 мкм позволяет улучшить условия для протекания процесса остеогенеза.
Метод электроформования волокон
В отличие от метода 3D-печати, который позволяет формировать конструкции с применением термопластичных полимеров, методом электроформования волокон [25] получают нетканные волокнистые биоматериалы из растворов полимеров (рис. 4б, 5б). В этом случае к растворам биодеградируемых полимеров предъявляются дополнительные специфические требования. Величины коэффициентов поверхностного натяжения, вязкости, электропроводности и диэлектрической проницаемости прядильного раствора влияют на устойчивость жидкой струи и ее отверждение на диэлектрической подложке. Электроформование нетканых волокнистых материалов (ЭФВ) из биодеградируемых полимеров проводили с целью изготовления: 1) подложек для дальнейшего наслоения кальций-фосфатных композиций и построения пористых конструкций имплантатов с применением 3D-принтера, 2) для электроформования нетканых волокнистых материалов с лекарствами [26]. Совмещение образцов материалов, полученных методом 3D-печати и ЭФВ, является перспективным направлением при изготовлении пористых трехмерных каркасных конструкций в тканевой инженерии.
На рис. 5б представлен образец конструкции, состоящей из подложки (нетканный материал, ПГБ), к которой раствором из ПГБ приклеен каркас из ПЛА, состоящий из ячеек необходимых размеров. Такие конструкции могут быть построены из различных биодеградируемых полимеров и их смесей и кальций-фосфатных паст с природными полимерами. Для каждого рассматриваемого в работе способа, указанного выше, необходимо выполнение определенных требований, условий к составам и свойствам композиций, их высушиванию, стерилизации и соблюдения необходимых медико-биологических параметров.
ЗАКЛЮЧЕНИЕ
В работе рассмотрены некоторые способы формирования пористых кальций-фосфатных биокомпозитов, которые часто применяются при изготовлении пористых образцов материалов. Развиваемые в работе подходы формирования пористой структуры в полимерных композитах свидетельствуют о необходимости совмещать различные способы для достижения разветвленной пористой структуры и требуемых размеров пор в биоматериалах. Преимущество метода 3D-печати связано с возможностью построения ячеистых конструкций с размерами пор 200–500 мкм с последующим заполнением кальций-фосфатными пастами, морфогенетическими белками, стволовыми клетками. При построении тканеинженерных конструкций необходимы пластичные композиции в виде паст, в виде термопластичных прутков, нетканных материалов, поэтому для формирования в них пористой структуры следует выбирать способ и разрабатывать условия изготовления биокомпозитов. Совмещение образцов материалов, полученных методом 3D-печати и ЭФВ, является перспективным направлением при изготовлении пористых трехмерных каркасных конструкций в тканевой инженерии.
Работа выполнена при поддержке Российским фондом фундаментальных исследований (проект № 15-29-04862).
Список литературы
Наноструктуры в биомедицине / Под ред. Гонсалвеса К.Е., Хальберштадта К.Р., Лоренсина К.Т. М.: БИНОМ. Лаборатория знаний, 2015.
Кузнецова Д.С., Тимашев П.С., Баграташвили В.Н., Загайнова Е.В. // СТМ. 2014. Т. 6. № 4. С. 201.
Терещенко В.П., Ларионов П.М., Кирилова И.А., Садовой М.А., Мамонова Е.В. // Хирургия позвоночника. 2016. Т. 13. № 1. С. 72.
Мураев А.А, Иванов С.Ю., Леонов С.В.,Старостин П.В., Чугунов Н.М. // Стоматология. 2016. Т. 95(1). С. 18.
Ершов Ю.А., Горшенев В.Н. // Матер. Всероссийской научной конф. с международным участием “Нанотехнологии в онкологии 2008”. М.: ИБХФ РАН, 2008. С. 127.
Ершов Ю.А., Горшенев В.Н., Косенко Н.В. Способ формирования костного имплантата // Патент РФ № 2206341. 2002.
Вахрушев И.В., Антонов Е.Н., Попова А.В. и др. // Клеточные технологии в биологии и медицине. 2012. № 1. С. 29.
Штильман М.И. Полимеры медико-биологического назначения. М.: ИКЦ “Академкнига”, 2006.
Hosseinkhani H., Hosseinkhani M., Tian F., Kobayashi H., Tabata Y. // Biomaterials. 2006. V. 27. P. 5089.
Горшенев В.Н., Телешев А.Т., Ершов Ю.А. и др. Способ получения пористого костного биокомпозита // Патент. РФ № 2482880. БИ. 2013. № 15.
Горшенев В.Н., Ершов Ю.А., Телешев А.Т. и др. // Мед. техника. 2014. № 1. С. 30.
Вольфкович Ю.М., Сосенкин В.Е. // ДАН СССР. 1977. Т. 234. С. 125.
Плаченов Т.Г., Колосенцев С.Д. Порометрия. Л.: Химия, 1988.
Горшенев В.Н., Мельников В.П. // Хим. физика. 2013. Т. 32. № 1. С. 1.
Мураев А.А., Иванов С.Ю., Ивашкевич С.Г., Горшенев В.Н. и др. // Стоматология. 2017. Т. 96. № 3. С. 36.
Ольхов А.А., Акатов В.С., Просвирин А.А. и др. // Хим. волокна. 2017. № 3. С. 90.
Ma P.X., Zhang R. // J. Biomed. Mater. Res. 1999. V. 46. P. 60.
Маэно Н. Наука о льде. М.: Мир, 1988.
Горшенев В.Н., Мураев А.А., Телешев А.Т., Иванов С.Ю. // Матер. IV Междисциплинарного конгресса по заболеваниям органов головы и шеи. М., 2016. С. 80.
Горшенев В.Н. // Хим. физика. 2012. Т. 31. № 1. С. 1.
Vangsness C.T., Jr., Mitchell W., Nimni M. et al. // Clin. Orthop. Relat. Res. 1997. V. 337. P. 267.
Марковиева М.Г., Немец Е.А., Севастьянов В.И. // Вестн. трансплантологии и искусственных органов. 2006. № 4. С. 83.
Горшенев В.Н., Щеголихин А.Н. // Хим. физика. 2008. Т. 27. № 1. С. 55.
Guvendiren M., Molde J., Soares R.M., Kohn J. // ACS Biomaterials Science & Engineering. 2016. V. 2. № 10. P. 1679.
Филатов Ю.Н. Электроформование волокнистых материалов (ЭФВ-Процесс). М., 2001.
Горшенев В.Н., Ольхов А.А., Яковлева М.А, Телешев А.Т., Акатов В.С. // Матер. XII междунар. научн.-техн. конф. БФФХ-2017. Севастополь, 2017.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика