Химическая физика, 2019, T. 38, № 1, стр. 86-92
Твердые продукты захвата NO3 на покрытии из метановой сажиВ. В. Зеленов, Е. В. Апарина, В. И. Козловский, И. В. Сулименков, Д. А. Кардонский, А. Е. Носырев
В. В. Зеленов 1, *, Е. В. Апарина 1, В. И. Козловский 1, И. В. Сулименков 1, Д. А. Кардонский 2, А. Е. Носырев 2
1 Филиал Института энергетических проблем химической физики им. В.Л. Тальрозе
Российской академии наук
Черноголовка, Россия
2 Первый московский государственный медицинский университет им. И.М. Сеченова
Москва, Россия
* E-mail: zelenov@binep.ac.ru
Поступила в редакцию 27.06.2018
После доработки 20.08.2018
Принята к публикации 27.06.2018
Аннотация
С использованием проточного реактора с подвижной вставкой, сопряженного с масс-спектрометром для кинетических исследований, проводилась обработка сажевого покрытия радикалами NO3 до момента полного прекращения захвата поверхностью этих радикалов. На основе хроматографического и масс-спектрометрического анализов состава исходной метановой сажи и твердых продуктов ее реакции с окисляющим газофазным реагентом NO3 установлено, что одними из основных продуктов этой гетерогенной реакции являются производные фталевой кислоты, соединения группы парафинов и производные ацетофенона. В составе необработанной сажи присутствуют арены вплоть до четырехзвенных ароматических молекул. Нитросоединения в исходной саже и в продуктах ее обработки радикалами NO3 не обнаружены.
ВВЕДЕНИЕ
Радикал NO3 является важным окислителем ночной тропосферы. По данным полевых измерений его относительная концентрация в загрязненных регионах составляет 20–400 ppt при скорости образования 1–2 ppb в час [1–3]. Основные каналы стока NO3 – это его реакции с летучими органическими компаундами природного и антропогенного происхождения, а также конверсия NO3 ↔ N2O5 и захват на аэрозолях [4].
Аэрозоли с частицами микронного и субмикронного размеров широко распространены в атмосфере. Большую часть твердого органического аэрозоля составляет сажа, а глобальная эмиссия сажевого аэрозоля достигает 12.6–24 Тг/год [5–7]. Сажевый аэрозоль влияет на глобальный излучательный баланс планеты и может служить центром нуклеации облаков [8, 9]. Сажа образуется при неполном сгорании топлив и биомасс, при лесных пожарах и состоит из нерастворимого в воде углеродного остова и растворимой органической фракции частично окисленных углеводородов, либо связанных с ядром, либо образующих адсорбированный слой на поверхности частицы. Подтверждено наличие функциональных групп на поверхности сажевых частиц, включая алканы, алкены, алкины, ароматические, карбонильные и эфирные группы, а также полициклические ароматические углеводороды (ПАУ), или арены [10, 11]. По определению, ПАУ состоят из нескольких бензольных колец, содержащих только С и Н в линейной, угловой или кластерной конфигурациях. Указанные органические компоненты могут играть значительную роль в химии сажи [10, 12].
Первой стадией образования сажи считается формирование частиц размером 5–10 нм вследствие реактивной коагуляции молекул ПАУ [13, 14]. В частности, все системы горения производят значительные количества ПАУ, которые оказывают канцерогенное, мутагенное и нейротоксическое воздействия на человека [15, 16]. Эволюция атмосферных ПАУ может происходить в физико-химических процессах их взаимодействия с активными газовыми компонентами. При этом возможно образование еще более токсичных продуктов – нитро-ПАУ [17, 18]. До настоящего времени достоверно не установлено, образуются ли нитроарены непосредственно в процессах горения или же при взаимодействии NOx в тропосфере с аэрозолем, содержащим арены на поверхности. В частности, реакции основного ночного окислителя NO3 с аренами могут служить существенным каналом стока NO3 в атмосфере, а также изменять свойства ПАУ в аспекте их токсичности.
Существует предположение, что сажа обладает восстанавливающими свойствами при взаимодействии с NOx, HNO3, O3, причем эти процессы не являются каталитическими, т.е. в этих реакциях расходуются активные центры сажевых частиц, что приводит к модификации поверхности и образованию окисленных функциональных групп [8]. К настоящему времени имеется много лабораторных исследований по захвату NO2 на различных типах сажевых субстратов, однако известно всего несколько работ, связанных с захватом NO3 на сажевых покрытиях различной природы. Измерялись коэффициенты захвата (γ) нитрат-радикала и газофазные продукты его реакции (NO, N2O5, HONO, HNO3) [19–22]. В работе [20] исследовали захват совокупности реагентов NO3/N2O5 на поверхности частиц электроискрового сажевого аэрозоля в большой аэрозольной камере при времени взаимодействия в несколько дней, температуре 294 К и относительной концентрации газофазных реагентов 0.2–6 ppb в сухом воздухе. Вычисленный коэффициент захвата для NO3 составляет ≤3 ⋅ 10–4.
Коэффициенты захвата NO3 на покрытии из метановой сажи измеряли в работе [21] с использованием струевого реактора с сажевым покрытием стенок и подвижным инжектором, через который подавали газофазный реагент при Т = 298 К, [NO3] = (0.7÷4) ⋅ 1011 см–3, давление в реакторе – 2–4 Торр, масса сажи – 1.6–6.4 мг, а поток реагента состоял из смеси NO3 + N2O5 в различных соотношениях. Захват на свежем сажевом покрытии протекает эффективно с величиной γ0 ∼ 0.1, а спустя 180 мин γss = 0.0054 ± 0.0027. С учетом удельной поверхности сажи квазистационарный коэффициент захвата при этих условиях оценен как γss = 8.3 ⋅ 10–4. Расчет показал, что в условиях ночной загрязненной тропосферы радикалы NO3 при их относительном содержании 50 ppt окисляют 90% поверхности сажи за 5 мин. В работе [19] изучали, в частности, гетерогенные реакции NO3 c сажей гексана, получаемой в лабораторном пламени в реакторе Кнудсена низкого давления с масс-спектральным детектированием газофазных продуктов при Т = 298 К и массе наносимой сажи 1.5–20 мг; образец откачивали в течение 10 мин перед началом измерений. Газофазными продуктами захвата NO3 на покрытии из гексановой сажи были NO, N2O5, HONO и HNO3. Коэффициенты захвата γ0 (начальный) и γss (стационарный), рассчитанные по геометрической поверхности подложки, растут с уменьшением концентрации NO3. При некоторой пороговой концентрации [NO3] = 2.7 ⋅ 1011 см–3 величина γss = 0.3, а при [NO3] = 2 ⋅ 1012 см–3 выше пороговой γss не зависит от концентрации и составляет 5 ⋅ 10–2. Зависимость 1/γ от концентрации ниже концентрационного предела выявляет сложный механизм для реакции NO3 + сажа. В нашей предыдущей работе [22] была исследована зависимость начального коэффициента захвата NO3 на покрытии из метановой сажи при Т = 256 и 297 К от концентрации NO3 (2.4 ⋅ 1012–3.6 ⋅ 1013 cм−3) с использованием проточного реактора с подвижной вставкой и масс-спектрометрической регистрации. Установлено, что в указанном диапазоне концентраций захват на покрытии из сажи NO3, в отличие от захвата NO2 и N2O5, происходит по механизму ударной рекомбинации. При этом на один активный поверхностный центр расходуется порядка 100 радикалов NO3 при 297 К и около 50 радикалов NO3 при 256 К. На базе лэнгмюровской концепции адсорбции были сделаны оценки элементарных параметров, определяющих процесс захвата NO3 на сажевом покрытии: константа скорости десорбции, теплота адсорбции, а также константа скорости бимолекулярной гетерогенной реакции переработки активных поверхностных центров и ее энергия активации.
Из экспериментальных данных по захвату NO3 на сажевых покрытиях различного типа следует, что значения полученных коэффициентов захвата велики, т.е. эти процессы в атмосфере протекают эффективно. Также строились предположительные схемы взаимодействия радикала NO3 с поверхностными углеродными центрами, однако в литературе отсутствуют экспериментальные данные по твердым продуктам захвата. Таким образом, для построения адекватной модели захвата NO3 на сажевом покрытии необходима информация о продуктах, образующихся на твердой поверхности субстрата.
Цель данной работы состояла в наработке твердых продуктов захвата NO3 на пленочном покрытии из метановой сажи, имитирующем атмосферный аэрозоль, и последующей идентификации твердых продуктов этого гетерогенного процесса. Анализ твердых образцов, а также необработанной сажи проводили методом масс-спектрометрии высокого разрешения, а также на тандемном приборе газовый хроматограф/масс-спектрометр (ГХ/МС).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактор с потоком и с подвижной вставкой
Наработку твердых продуктов захвата NO3 на пленочном покрытии из метановой сажи проводили в проточном реакторе с подвижной вставкой и нанесенным на нее исходным сажевым покрытием. Реактор сопряжен с секторным магнитным масс-спектометром высокого разрешения. Подробное описание установки приводилось ранее [23]. Отметим кратко основные особенности. Основной поток гелия протекает через термостатированную ампулу с намороженной N2O5, термоячейку, в которой происходит разложение N2O5 → → NO2 + NO3, цилиндрический реактор и регулируемый вентиль откачки. Все внутренние поверхности реактора и вентилей покрыты тефлоновой пленкой (Teflon FEP). Тонкий центральный стержень из нержавеющей стали с нанесенной на него сажей может перемещаться с помощью внешнего магнита вдоль оси трубки реактора в зону контакта с газом-реагентом. Отбор пробы в масс-спектрометр проводится в виде молекулярного пучка через отверстие диаметром 0.35 мм в вершине напускного конуса, расположенного соосно с внешней трубкой реактора и омываемого потоком газа-носителя с примесью газа-реагента и продуктов реакции. Геометрические параметры термоячейки, ее температура, равная 470 К, и время пребывания N2O5 в термоячейке подобраны так, чтобы исключить дальнейший распад NO3. Пятиокись диазота синтезируется заранее по реакции O3 + NO2 + M → N2O5 +M (M = O2) и намораживается в рабочую ампулу. Ампула помещена в криостат с регулировкой температуры в пределах 113–283 К с точностью ±0.01 К. Абсолютная концентрация радикалов NO3 в зоне реакции определяется по реакции титрования NO + + NO3 → 2NO2 при подаче через дополнительный ввод измеряемого потока NO в гелии. Окончание гетерогенного процесса взаимодействия NO3 с сажей в потоке гелия контролировали масс-спектрометрически по прекращению расхода этого газофазного реагента.
Основные параметры реактора
Внутренний диаметр трубки реактора – 1.3 см; внешний диаметр стержня из нержавеющей стали – 0.2 см; максимальная длина стержня 50 см; давление – 1–1.5 Торр; скорость потока газа-носителя – 400–590 см с–1.
Нанесение сажи и приготовление образца для анализа
В качестве источника сажи использовали лабораторную горелку, присоединенную к газовой магистрали, без дополнительной подачи сжатого воздуха. Центральный стержень из нержавеющей стали общей площадью 32.8 см2 располагали на расстоянии 15–17 см от основания пламени и вращали стержень вручную. Массу нанесенной на стержень сажи определяли взвешиванием на весах с точностью 0.1 мг. При нанесении сажи за время 20 мин масса сажи составила от 4 до 6 мг. Стержень с нанесенной сажей сразу вставляли в реактор и откачивали в течение нескольких часов под вакуумом при ∼10−4 Торр. Прореагировавшую сажу смывали ацетонитрилом марки “ЧДА” объемом ∼20 мл и центрифугировали, чтобы не забивались капилляры электроспрейного ионного источника.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
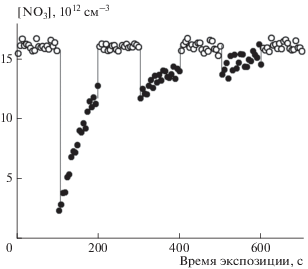
Пример контроля процедуры обработки сажи радикалами NO3 приведен на рис. 1. При первом введении стержня с сажевым покрытием в поток радикалов наблюдается их первоначальный большой расход. При повторных введениях происходит дальнейшая модификация поверхности. Процесс обработки продолжается до тех пор, пока регистрируемая концентрация газофазного реагента на линии m/z = 62 не перестает изменяться после очередного ввода стержня с сажевым покрытием в поток NO3. Следует отметить, что поток газофазных реагентов состоит из равного количества NO3 и NO2, выходящих из термоячейки после разложения N2O5. Ранее [24] было установлено, что захват NO2 на покрытии из метановой сажи в наших условиях протекает с коэффициентами захвата, на два порядка меньшими по сравнению с захватом на покрытии из NO3-сажи. По этой причине в данной работе захват спутного реагента NO2 мы не учитывали. После обработки сажевого покрытия радикалами NO3 стержень с нанесенным покрытием извлекали из реактора и покрытие смывали ацетонитрилом. Приготовленный таким образом раствор анализировали по составу продуктов.
Рис. 1.
Кинетическая кривая расхода радикалов NO3 при их захвате на свежем покрытии из метановой сажи при T = 297 K, p = 0.9 Торр, [NO3] = 1.6 ⋅ 1013 cм−3, скорость потока – 658 см с−1, время контакта – 3.04 мс; символы: ⚪ – концентрация NO3, измеряемая в отсутствие покрытия, ⚫ – при чередующемся введении стержня с покрытием в поток NO3.
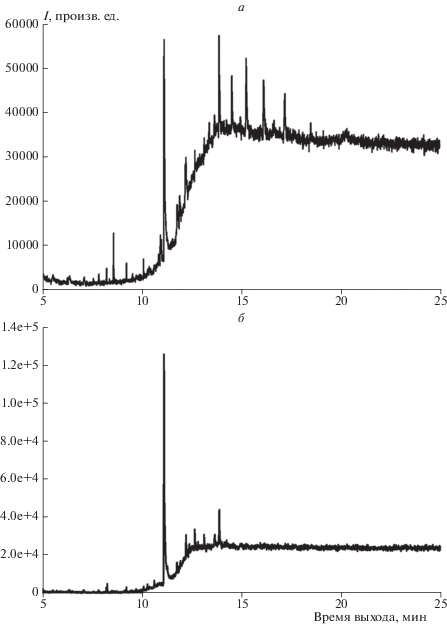
Анализ раствора твердых продуктов захвата NO3 на сажевом покрытии проводили с использованием тандемного прибора ГХ/МС Agilent 6890/5973 c ионизацией электронным ударом и масс-спектрометра высокого разрешения Exactive Orbitrap, ThermoFisher Scientific c электроспрейным ионным источником. Результаты анализа приведены на рис. 2, 3. Оказалось, что масс-спектры высокого разрешения, приведенные на рис. 2, затруднительно использовать с целью идентификации индивидуального органического вещества из-за сложного многокомпонентного состава исходного образца. Однако они оказываются полезны в качестве подтверждения содержания в образце некоего конкретного целевого соединения, после того как оно идентифицировано по хроматографическому пику и набору нескольких характерных масс-спектральных пиков этого целевого вещества, зарегистрированных на тандемном приборе. Так, в последних столбцах табл. 2 и 3 указаны зарегистрированные протонированные молекулярные ионы и наиболее интенсивные осколочные ионы искомых соединений. Максимальное отличие экспериментальных величин m/z зарегистрированных ионов от рассчитанных величин m/z составляет не более 0.003 Дa.
Рис. 2.
Масс-спектр высокого разрешения в положительных ионах: а – исходная сажа, б – сажа после экспозиции к радикалам NO3.
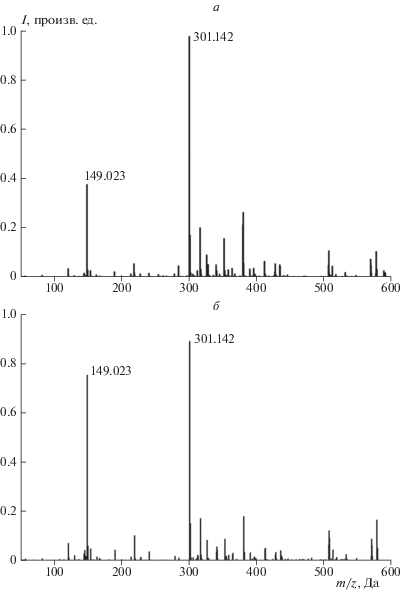
Таблица 1.
Хроматографические пики исходной сажи (рис. 3а), которые не изменяются после экспозиции сажи в потоке радикалов NO3
| Время выхода, мин |
Соединение | Формула | M | ID NIST |
|---|---|---|---|---|
| 11.148 | дибутил фталат | C16H22O4 | 278.152 | 66 999 |
| 11.790 | группа парафинов | CnH2n+ 2 | ||
| 11.953 | n ≥ 10 | |||
| 12.246 | ||||
| 12.685 | ||||
| 13.154 | ||||
| 13.680 | ||||
| 13.908 | диоктил фталат | C24H38O4 | 390.277 | 66 784 |
Таблица 2.
Хроматографические пики исходной сажи (рис. 3а), которые исчезают после экспозиции сажи в потоке радикалов NO3
| Время выхода, мин |
Cоединение | Формула | М | ID NIST | [M + H]+ |
|---|---|---|---|---|---|
| 8.59 | дибутилгидрокси толуол | C15H24O | 220.183 | 84 224 | – |
| 10.95 | метиловый эфир пальметиновой кислоты | C17H34O2 | 270.256 | 28 354 | – |
| 10.994 | метил(гидроксифенил) пропионат | C18H28O3 | 292.204 | 96 940 | + |
| 12.246 | пирен | C16H10 | 202.078 | 83 585 | – |
| 14.538 | гептилоктил фталат | C23H36O4 | 376.241 | 67 005 | + |
| 15.27 | производная фталевой кислоты |
C22H34O4 | 362.246 | 67 159 | + |
| 16.14 | |||||
| 17.21 |
Таблица 3.
Хроматографические пики продуктов (рис. 3б), которые появляются после экспозиции исходной сажи в потоке радикалов NO3
| Время выхода, мин | Соединение | Формула | M | ID NIST | [M* + H]+ |
|---|---|---|---|---|---|
| 8.299 | 3,4-диметокси-ацетофенон | C10H12O3 | 180.079 | 72 479 | M* = C9H9O3 |
| 10.31 | группа парафинов | C11H24 | 156.196 | 16 533 | M* = C4H9 |
| 10.65 | бутил карбобутокси-метил фталат | C18H24O6 | 336.157 | 67 152 | M* = C8H5O3 |
Гораздо большей информативностью обладает метод хромато-масс-спектрометрии. Результаты обработки хроматограмм, приведенных на рис. 3, просуммированы в табл. 1–3. В этих таблицах приведены идентификационные номера соответствующих веществ из масс-спектральной базы данных NIST [25]. Идентификацию веществ проводили по восьми наиболее интенсивным пикам, учитывая соотношение их интенсивностей согласно справочному значению. Это позволяет практически однозначно определять искомое соединение. Исключение составляет ряд классов веществ, таких как парафины и фталаты, масс-спектры которых практически одинаковы. Из анализа данных табл. 1 и 2 следует, что исходная сажа содержит ряд ароматических соединений, включая и полиароматические, которые полностью расходуются в реакции с радикалами NO3. Есть ряд соединений, инертных по отношению к NO3. К ним относятся группа парафинов и соединения типа фталатов. В частности, самый интенсивный хроматографический пик со временем выхода 11.148 мин соответствует дибутилфталату (ДБФ), который является пластификатором при изготовлении полиэтиленовых ампул для приготовления тестируемых образцов сажи и продуктов ее реакции с NO3. Масс-спектральные пики этого пластификатора наиболее интенсивны и в масс-спектрах высокого разрешения исходной и обработанной сажи, приведенных на рис. 2: m/z = = 149.024 (${{{\text{C}}}_{{\text{8}}}}{{{\text{O}}}_{{\text{3}}}}{\text{H}}_{{\text{5}}}^{ + }$ – основной осколочный ион из ДБФ) и m/z = 301.142 (Na–ДБФ+). В исходной саже и среди продуктов ее реакции с NO3 нитросоединений не обнаружено, в то время как при захвате NO2 на сажах различного типа с использованием ИК‑спектроскопии ранее были обнаружены поверхностные группы R–NO2, R–ONO2, R–ONO [8].
ЗАКЛЮЧЕНИЕ
Из анализа хромато-масс-спектрометрических данных по составу свежей метановой сажи и сажи, обработанной радикалами NO3, можно сделать следующие выводы. Исходная сажа содержит ряд ароматических соединений, включая и полиароматические, которые полностью расходуются в реакции с радикалами NO3. Есть ряд соединений, инертных по отношению к NO3. К ним относятся группа парафинов и соединения типа фталатов.
Среди продуктов захвата NO3 на саже обнаружены соединения класса фталатов и установлено, что после окончания реакции захвата NO3 эти продукты являются преобладающими. Таким образом, при захвате NO3 на покрытии из метановой сажи, по-видимому, происходит разрыв ароматического кольца ПАУ с образованием не нитросоединений, а именно фталатных групп.
Результаты работы позволят проводить количественные оценки изменения регионального химического состава тропосферы на базе модельного описания захвата азотсодержащих газов на поверхности частиц органического аэрозоля [26–28] в совокупности с данными по эмиссии NOx и данными полевых измерений концентрации аэрозольной компоненты.
Список литературы
Goliff W.S., Luria M., Blake D.R. et al. // Atmos. Environ. 2015. V. 114. P. 102.
Sobanski N., Tang M.J., Thieser J. et al. // Atmos. Chem. Phys. 2016. V. 16. P. 4867.
Brown S.S., Dubé W.P., Peischl J. et al. // J. Geophys. Res. 2011. V. 116D. P. 24305.
Martinez M., Perner D., Hackenthal E.-M. et al. // J. Geophys. Res. 2000. V. 105D. P. 22685.
Stadler D., Rossi M.J. // Phys. Chem. Chem. Phys. 2000. V. 2. P. 5420.
Cohen J.B., Wang C. // J. Geophys. Res. Atmos. 2014. V. 119. P. 307.
Mahmood R., von Salzen K., Flanner M. et al. // J. Geophys. Res. Atmospheres. 2016. V. 121. P. 7100.
Kirchner U., Scheer V., Vogt R. // J. Phys. Chem. A. 2000. V. 104. P. 8908.
Arens F., Gutzwiller L., Baltensperger U. et al. // Environ. Sci. Technol. 2001. V. 35. P. 2191.
Akhter M.S., Chughtai A.R., Smith D.M. // Appl. Spectrosc. 1985. V. 39. P. 143.
Ringuet J., Albinet A., Leoz-Garziandia E. et al. // Atmos. Environ. 2012. V. 61. P.15.
Salgado M.S., Rossi M.J. // Internat. J. Chem. Kin. 2002. V. 34. P. 620.
Onischuk A.A., di Stasio S., Karasev V.V. et al. // J. Aerosol Sci. 2003. V.34. P. 383.
Dobbings R.A. // Aerosol Sci. Technol. 2007. V. 41. P. 485.
Baek S.O., Field R.A., Goldstone M.E. et al. // Water, air, and soil pollution. 1991. V. 60. P. 279.
Hong W.-J., Jia H., Ma W.-L. et al. // Environ. Sci. Technol. 2016. V. 50. P. 7163.
Pitts J.N., Jr., Zielinska B., Sweetman J.A. et al. // Atmos. Environ. 1985. V. 19. P. 911.
Durant J.L., Lafleur A.L., Plummer E.F. et al. // Environ. Sci. Technol. 1998. V. 32. P. 1894.
Karagulian F., Rossi M.J. // J. Phys. Chem. A 2007. V. 111. P. 1914.
Saathoff H., Naumann K.-H., Riemer N. et al. // Geophys. Res. Lett. 2001. V. 28. P. 1957.
Mak J., Gross S., Bertram A.K. // Ibid. 2007. V. 34. P. L10804.
Зеленов В.В., Апарина Е.В., Каштанов С.А., Шардакова Э.В. // Хим. физика. 2017. Т. 36. № 1. С. 80.
Зеленов В.В., Апарина Е.В., Чудинов А.В., Каштанов С.А. // Хим. физика. 2010. Т. 29. № 5. С. 39.
Зеленов В.В., Апарина Е.В., Каштанов С.А., Шардакова Э.В. // Хим. физика. 2016. Т. 35. № 2. С. 86.
www.sisweb.com/software/ms/nist.htm
Poschl U., Rudich Y., Ammann M. // Atmos. Chem. Phys. 2007. V. 7. P. 5989.
Shiraiwa M., Garland R.M., Poschl U. // Ibid. 2009. V. 9. P. 9571.
Kaiser C., Riemer N., Knopf D.A. // Atmos. Chem. Phys. Discuss. 2011. V. 11. P. 5127.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика