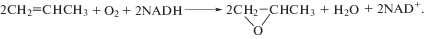Химическая физика, 2019, T. 38, № 11, стр. 52-57
Действие солей тяжелых металлов на процесс окисления пропилена бактериями-метанотрофами
Л. В. Авдеева 1, *, Р. И. Гвоздев 1
1 Институт проблем химической физики Российской академии наук
Черноголовка, Россия
* E-mail: tuman@cat.icp.ac.ru
Поступила в редакцию 29.11.2018
После доработки 10.03.2019
Принята к публикации 20.03.2019
Аннотация
Исследовано действие солей тяжелых металлов (ТМ): Cu(II), Fe(III), Ni(II), Zn(II), на реакцию окисления пропилена метанокисляющими бактериями Мethylococcus capsulatus (М) как процесс, моделирующий окисление метана бактериями-метанотрофами. Реакция начинается с активации молекулярного кислорода с последующим окислением пропилена. Кинетика накопления пропилен-оксида под действием ТМ коррелирует со снижением поглощения кислорода и не изменяется со временем. Обнаружено, что ТМ в разной степени подавляют поглощение пропилена мембранами М. capsulatus (М). ЭПР-cпектры мембран М. capsulatus (М) показывают наличие сигнала меди типа II со значением g-фактора, равным 2.05 как до, так и после воздействия ТМ. Токсичность исследуемых металлов для бактерий-метанотрофов изменяется в ряду Zn > Ni > Fe > Cu. Впервые показано, что цинк усиливает ингибиторный эффект других металлов. Установлено, что ТМ в концентрациях, превышающих ПДК не менее чем в 3 раза, замедляют окисление пропилена незначительно, что делает данный вид бактерий перспективным при разработке биофильтров для удаления углеводородов (метана, пропилена и др.) в условиях промышленной очистки и загрязнения тяжелыми металлами.
ВВЕДЕНИЕ
Проблема глобального потепления начала привлекать к себе внимание еще в середине прошлого века. Считается, что глобальное потепление климата вызвано парниковым эффектом, который возникает из-за водяного пара, диоксида углерода, озона, метана и других газов, которые поглощают и задерживают солнечную энергию, способствуя нагреву земной поверхности. Известно, что парниковая активность метана в 28 раз сильнее, чем у углекислого газа. Недавно проведена прямая экспериментальная оценка парникового эффекта метана и в результате полевых измерений установлен монотонный рост содержания метана [1]. Это означает, что необходимо контролирование промышленных выбросов парниковых газов, в частности метана.
Биологическим фильтром на пути эмиссии метана в атмосферу являются метанокисляющие микроорганизмы, которые утилизируют около 15% выделяемого с поверхности Земли метана [2]. Наиболее изученными среди этих микроорганизмов являются аэробные бактерии, которые имеют биоремедиационный потенциал, так как способны окислять не только метан, но и некоторые токсичные соединения, которые они используют в качестве источника углерода. Аэробные бактерии, использующие метан (метанотрофы) или его окисленные и замещенные производные (метилобактерии), повсеместно распространены в природе и часто ассоциированы с растениями [3]. Метанотрофы живут и в экстремальных физико-химических условиях с повышенными и пониженными значениями температуры, солености и рН [4].
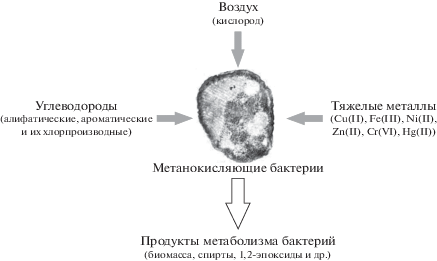
В последние десятилетия в результате человеческой деятельности в окружающей среде резко выросло содержание не только парниковых газов, но и различных токсичных веществ и соединений. В частности, к ним относятся тяжелые металлы (ТМ), которые являются техногенными ксенобиотиками и опасными загрязнителями окружающей среды, способными оказывать мутагенное действие на микроорганизмы, вызывая увеличение частоты мутаций, хромосомные аберрации или другие разрушения ДНК [5, 6]. Важное значение имеет влияние на живые организмы повышенных концентраций биологически значимых металлов (Сu, Zn, Fe) или металлов, проявляющих токсичность даже в малых количествах (Ni) [6]. В связи с важной функцией метанотрофов в глобальном круговороте углерода изучение влияния техногенных загрязнителей окружающей среды на метанотрофы является актуальной задачей. В связи с этим данное исследование направлено на изучение биофизического действия катионов тяжелых металлов Cu(II), Fe(III), Ni(II), Zn(II) на динамику обменных процессов метанокисляющих бактерий Мethylococcus capsulatus (М) с целью выявить их биоремедиационный потенциал.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Получение биомассы бактерий. Клетки M. сapsulatus (М) выращивали на минеральной среде в ферментере АНКУМ-2М, как описано ранее [7], с использованием метана в качестве источника углерода. Суспензию клеток концентрировали в сепараторе и разрушали на полуавтоматическом дезинтеграторе ДКМ-5 (конструкции Института проблем химической физики РАН) в присутствии 1 мМ ДНКазы, 1 мМ бензамидина, 0.5 М NaCl и центрифугировали при 10 000 g в течение 15 мин для удаления неразрушенных клеток. Для получения нативных мембран бесклеточный препарат центрифугировали 2 раза при 45 000 g в течение 1 ч, промывая буфером: 0.025 М 1,4-пиперазиндиэтан сульфоновой кислоты (Pipes), 1 мМ бензамидина, 0.5 М NaCl, рН 7.25.
Определение окисления пропилена. Окисление пропилена нативными мембранами М. capsulatus (М) определяли методом газожидкостной хроматографии (ГЖХ) по скорости окисления пропилена в пропиленоксид. Стандартная реакционная смесь содержала мембраны М. capsulatus (М), восстановитель (15 мМ NADH или 30 мМ дурохинол) и 0.02 М натрий-фосфатный буфер (рН 7.00). Реакционную смесь инкубировали с ТМ (3 мг/л) в термостатируемой ячейке (42 °С) при постоянном перемешивании в течение 1 и 5 ч. Реакцию инициировали путем введения пропилена. Пробы из газовой фазы анализировали методом ГЖХ с использованием газожидкостного хроматографа ЛХМ-8МД (модель 5, “Севкавэлектроприбор”, Россия) на колонке с Porapak Q. Температуры испарителя и детектора находились в интервале 120–150 °С. Содержание пропиленоксида в образце определяли по калибровочной кривой, построенной при разном содержании пропиленоксида.
Полярографический анализ. Измерение поглощения кислорода проводили на полярографической приставке (конструкции ООО “Биосенсоран”) с термостатируемой ячейкой (42 °С), оснащенной электродом Кларка. Стандартная реакционная смесь содержала 0.2 М натрий-фосфатный буфер (рН 7.20) и мембраны М. capsulatus (М), в параллельных экспериментах – мембраны М. capsulatus (М), инкубированные с ТМ. Реакцию инициировали путем введения 0.2 М натрий-фосфатного буфера (рН 7.20), насыщенного метаном или пропиленом.
ЭПР-спектроскопия. ЭПР-спектры регистрировали на спектрометре Bruker ESP300, оснащенном гелиевым криостатом ER900. В качестве стандарта использовали раствор CuSO4. Спектры регистрировали при температуре 10 К. Образцы замораживали в изопентане, охлажденном жидким азотом, и хранили в жидком азоте.
Определение содержания белка. Содержание белка оценивали по методу Бредфорда с использованием бычьего гамма-глобулина в качестве стандарта, как описано ранее [7].
В работе были использованы следующие реактивы: CuSO4 · 5H2O марки х. ч. (“Мосреактив”, Россия), Fe2(SО4)3 · 9H2O марки ч. д. а. (“Реахим”, Россия), NiSO4 · 7H2O марки ч. д. а. (“Реахим”, Россия), ZnSO4 · 7H2O марки х. ч. (“Реахим”, Россия), NaCl марки х. ч. (“Реахим”, Россия), NADH (Reanal, Венгрия), Pipes, дурохинон, бензамидин (“Sigma-Aldrich”, США).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Говоря об антропогенном воздействии ТМ на микроорганизмы, нужно отметить, что большинство металлов в микроконцентрациях необходимы для их жизнедеятельности (Fe, Zn, Сu, Мn, Со и др.). В частности, эти металлы входят в состав среды роста метанотрофов. Однако в больших концентрациях они становятся токсичными. Концентрации ТМ в данном исследовании были выбраны в значении 3 мг/л, что в 3 раза выше концентрации, находящейся на верхней границе предельно допустимых значений исследуемых ТМ в воде культурно-бытового назначения (Сu и Zn – 1.0 мг/л, Fe – 0.3 мг/л, Ni – 0.02 мг/л) [6]. Железо, медь и цинк относятся к наиболее важным биоактивным (эссенциальным) химическим элементам, для которых установлены основные биохимические процессы, в которых они участвуют. Динамику обменных процессов в мембранах М. capsulatus (М) в зависимости от присутствия ТМ изучали по прямому показателю – по реакции окисления пропилена с образованием пропиленоксида.
Суммарная реакция прямого биологического окисления пропилена кислородом воздуха в пропиленоксид является экзотермической и благодаря бактериальным ферментам протекает с высокими скоростями при нормальных условиях:
Константа Михаэлиса (KM) реакции окисления как метана, так и пропилена увеличивается с возрастанием температуры. Последнее обстоятельство указывает на то, что гидрофобные взаимодействия субстратов с ферментом, катализирующим этот процесс, не являются лимитирующими стадиями.
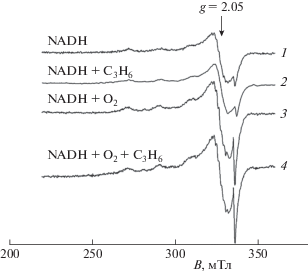
В ЭПР-спектрах мембран М. capsulatus (М) наблюдается сигнал меди типа II со значением g-фактора, равным 2.05, типичный для мембран метанотрофов. Инкубирование мембран M. capsulatus (М) с NADH приводит к восстановлению сигнала меди (рис. 1, спектр 1). Введение пропилена не приводит к изменению интенсивности и формы ЭПР-сигнала меди типа II (рис. 1, спектр 2). При добавлении кислорода интенсивность сигнала меди типа II увеличивается и наблюдается сигнал радикала (рис. 1, спектр 3). Этот спектр подобен спектру мембран М. capsulatus (М) с NADH, кислородом и пропиленом (рис. 1, спектр 4). Это подтверждает, что, как и в случае с метаном [8], сначала происходит активация молекулярного кислорода, а затем – окисление пропилена. Аналогичные результаты были получены методом скоростного замораживания. В анаэробных условиях в присутствии NADH происходит полное восстановление сигнала меди. Введение в реакционную смесь пропилена и кислорода уже через 20 мс приводит к появлению ЭПР-сигнала меди типа II с g = 2.05, который обладает исходной интенсивностью. Эти данные согласуются с данными полярографического анализа. После инкубирования мембран М. capsulatus (М) с ТМ не наблюдается изменение интенсивности и формы ЭПР-сигнала меди типа II, что указывает на целостность фермента, который осуществляет окисление пропилена.
Рис. 1.
ЭПР-спектры мембран М. capsulatus (М): 1 – NADH, 2 – NADH и пропилен, 3 – NADH и кислород, 4 – NADH, кислород и пропилен. Условия регистрации: частота микроволнового поля – 9.4 ГГц, частота модуляционного поля – 100 кГц, амплитуда модуляционного поля – 0.5 мТл, мощность микроволнового поля – 40 мкВт, температура 10 К.
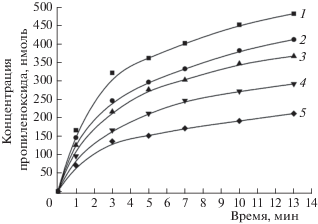
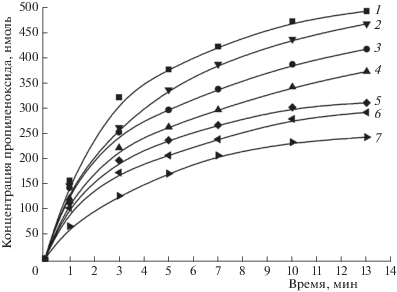
Кинетика накопления пропиленоксида мембранами М. capsulatus (М) представлена на рис. 2. Как выяснилось, все исследуемые ТМ: Cu(II), Fe(III), Ni(II), Zn(II), приводят к снижению скорости образования продукта реакции – пропиленоксида. Других продуктов реакции не обнаружено. Наибольшая остаточная активность наблюдалась для Cu(II) и Fe(III), см. рис. 2. Более того, низкие концентрации меди и железа (<1.0 мг/л) приводят к стимулированию поглощения пропилена мембранами М. capsulatus (М). Ряд токсичности ТМ для исследуемых бактерий имеет следующий вид: Zn > Ni > Fe > Cu. Ингибирующая способность ТМ возрастает с ростом их атомной массы (за исключением меди, которая демонстрирует наименьшее ингибирование). Это вызвано тем, что метанотрофам нужны больши́е количества меди для их жизнедеятельности [4]. При этом накопление пропиленоксида мембранами М. capsulatus (М), определяемое с использованием дурохинола в качестве восстановителя, было несколько ниже по сравнению с NADH. Такая же зависимость наблюдалась и в контрольном эксперименте – в отсутствие ТМ.
Рис. 2.
Кинетика накопления пропиленоксида, катализируемого мембранами М. capsulatus (М) в присутствии тяжелых металлов (концентрация – 3 мг/л): 1 – контроль (без ТМ), 2 – Cu(II), 3 – Fe(III), 4 – Ni(II), 5 – Zn(II).
Концентрации железа и никеля в 10 и 150 раз превышают концентрации, соответствующие их значениям ПДК в воде. А никель является токсичным даже в малых дозах [6]. Однако наибольший ингибиторный эффект проявляет цинк – известный ингибитор мембраносвязанной метанмоно-оксигеназы – фермента, который осуществляет активацию С–Н-связи углеводородов [9]. Известно, что мембраны M. capsulatus (Bath), обогащенные Cu и Zn, обладают удельной активностью в реакции окисления пропилена, составляющей всего 6% от активности нативного фермента [10].
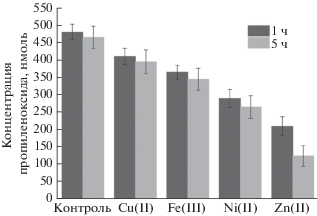
Увеличение времени воздействия ТМ на мембраны М. capsulatus (М) до 5 ч не приводит к статистически достоверно значимому снижению скорости накопления пропиленоксида. Наиболее заметное снижение, приблизительно в 2 раза, наблюдается только для Zn(II), см. рис. 3.
Рис. 3.
Накопление пропиленоксида, катализируемого мембранами М. capsulatus (М) после инкубирования с ТМ (3 мг/л) через 1 и 5 ч.
При сравнении сочетанного действия металлов обнаружено, что добавление цинка усиливает ингибиторный эффект других ТМ при окислении пропилена мембранами М. capsulatus (М), см. рис. 4. При этом сочетание никеля и цинка оказывает наибольший ингибиторный эффект и приводит к снижению окисления пропилена приблизительно в 2 раза. Эти два металла оказались и самыми токсичными при одиночном воздействии (рис. 2).
Рис. 4.
Кинетика накопления пропиленоксида, катализируемого мембранами М. capsulatus (М) в присутствии комбинаций ТМ (по 1.5 мг/л каждого ТМ в каждой паре): 1 – контроль (без ТМ), 2 – Cu(II) + Fe(III), 3 – Cu(II) + Ni(II), 4 – Ni(II) + Fe(III), 5 – Zn(II) + Cu(II), 6 – Zn(II) + Fe(III), 7 – Zn(II) + Ni(II).
Под действием исследуемых ТМ также наблюдается снижение поглощения кислорода, которое коррелирует с определением скорости окисления пропилена методом ГЖХ. Следует отметить, что по данным полярографического определения молекулярного кислорода нативные клетки М. capsulatus (М) очень слабо поглощают кислород из раствора. Это поглощение обусловлено окислением эндогенных субстратов. В то же время мембраны М. capsulatus (М) в присутствии NADH поглощают кислород со скоростью, значительно превосходящей скорость его эндогенного поглощения. Однако в присутствии метана или пропилена поглощение кислорода резко увеличивается, что хорошо коррелирует с определением скорости окисления пропилена. Под действием ТМ мембраны М. capsulatus (М) слабо поглощают кислород и в присутствии NADH. Таким образом, биофизическое воздействие ТМ на мембраны М. capsulatus (М), по-видимому, связано в основном с ингибированием переноса субстратов в клетку либо с прямым взаимодействием ТМ с компонентами дыхательной цепи [11] и ингибированием дыхания [12].
Основные исследования метанотрофов направлены на получение биокатализаторов. Однако метанотрофы имеют и биоремедиационный потенциал. Это обусловлено тем, что они способны приводить к деградации некоторых токсичных соединений, которые они используют в качестве источника углерода. Например, Methylosinus trichosporium OB3b может окислять не только метан, но и широкий круг алифатических, ароматических и алициклических углеводородов и их хлорпроизводных [13]. В частности, метанотрофы способны окислять ди- и трихлорэтилен, которые являются основными загрязнителями почв. Другой причиной использования метанотрофов для биоремедиации загрязненных экосистем может быть то, что метанотрофы влияют на видообразование и биодоступность металлов в окружающей среде [14, 15]. Биоремедиации ТМ будет способствовать пептид метанобактин, выделяемый метан-окисляющими бактериями. Метанобактин из M. trichosporium OB3b, является наиболее изученным и способен, кроме Cu(I, II), связывать и другие металлы, такие как Ag(I), Au(III), Co(II), Cd(II), Fe(III), Hg(II), Mn(II), Ni(II), Pb(II), U(VI) и Zn(II), но с константами связывания меньше, чем для Cu(II) [16]. Среди этих металлов Cd(II), Pb(II), Hg(II) и Ag(I) не выполняют никаких биологических функций [17]. Это свойство метанобактина связывать широкий спектр металлов определяет важную экологическую роль метанотрофов в солюбилизации/мобилизации и удалении металлов и радионуклидов, что может найти применение в биоремедиации воды, используемой для охлаждения реакторов АЭС или отвалов урановых рудников [18]. Также метанотроф M. trichosporium OB3b благодаря биосинтезу метанобактина может быстро разлагать метилртуть [19].
В работе [20] описан и охарактеризован новый белок – Csp1, полученный из метанотрофа M. trichosporium OB3b, который может связывать большие количества меди (каждый мономер тетрамера может связывать до 13 атомов Cu(I)). Авторы работы [21] предполагают, что на основе свойств метанобактина, поглощающего ТМ, можно создать уникальный механизм очищения окружающей среды – промышленные бактериальные биофильтры [22, 23], которые найдут применение не только на небольших производствах, но также на промышленных предприятиях. Биофильтры – это хорошо известная инженерная система биологической очистки, в которой используется метаболическая активность микроорганизмов, закрепленных на различных материалах, для удаления широкого спектра органических и неорганических загрязняющих веществ [22, 23].
В настоящее время доказано наличие генов, кодирующих метанобактин, только у нескольких штаммов метанотрофов, относящихся к филуму Alphaproteobacteria [24]. Штаммы, относящиеся к филуму Gammaproteobacteria, синтезируют другой класс медь-связывающих соединений [19, 25]. Однако эти метанотрофы тоже обладают биоремедиационным потенциалом. Так, известно о восстановительном превращении растворимого и токсичного Cr(VI) в менее токсичный нерастворимый Cr(III) метанотрофом M. capsulatus (Bath) [26]. Наши исследования показали, что воздействие высоких концентраций меди (более 5 мг/л) на бактерии M. capsulatus (M) приводит к ее биосорбции в цитоплазме и на поверхности клеток из окружающей среды [27]. Это защищает метанотрофы, а также другие микроорганизмы от избыточной токсичной меди в окружающей среде. Вероятно, метанотрофы способны к такому биоакумулированию и других металлов. Результаты, полученные в данном исследовании, показали, что метанотроф, не синтезирующий метанобактин, окисляет пропилен и при высоких концентрациях ТМ, что подчеркивает биоремедиоционный потенциал этих бактерий (рис. 5).
Таким образом, штаммы метанотрофов, не синтезирующие метанобактин, тоже являются перспективными объектами при разработке биофильтров для снижения содержания не только углеводородов и парниковых газов, но и ТМ.
ЗАКЛЮЧЕНИЕ
Загрязнение окружающей среды тяжелыми металлами – одна из основных причин экологической нестабильности из-за их широкого использования, распространения и токсичности. В отличие от углеводородных загрязнителей металлы не подвергаются процессам деградации, а лишь перераспределяются между отдельными компонентами природной среды. В природоохранной практике существуют различные методы очистки и детоксикации загрязненных почв и грунтов. К наиболее успешным технологиям биоремедиации загрязненных почв относятся те, в которых используются микроорганизмы, в естественных условиях присутствующие в загрязненной среде. Метан-окисляющие бактерии являются важными компонентами водных и почвенных систем, обеспечивающих процессы трансформации и рециркуляции углерода и азота биосферы. В данном исследовании показано, что метанокисляющие бактерии М. capsulatus (М) в присутствии солей ТМ Cu(II), Fe(III), Ni(II), Zn(II) в концентрациях выше их ПДК в воде окисляют пропилен. Предположительно, регуляция поступления ТМ в окружающую среду с помощью метанотрофов может лежать в основе стратегий преодоления экологических последствий загрязнения тяжелыми металлами.
Работа выполнена по теме государственного задания № 0089-2014-0006.
Список литературы
Feldman D.R., Collins W.D., Biraud S.C. et al. // Nature Geoscience. 2018. V. 11. P. 238; https://doi.org/10.1038/s41561-018-0085-9
Singh J.S., Pandey V.C., Singh D.P., Singh R.P. // Agric. Ecosyst. Environ. 2010. V. 139. P. 74; https://doi.org/10.1016/j.agee.2010.07.003
Капаруллина Е.Н., Доронина Н.В., Мустахимов И.И. и др. // Микробиология. 2017. Т. 86. № 1. С. 107; https://doi.org/10.7868/S0026365617010086
Троценко Ю.А., Хмеленина В.Н. Экстремофильные метанотрофы. Пущино: ОНТИ ПНЦ РАН, 2008.
Пищик В.Н., Воробьев Н.И., Проворов Н.А., Хомяков Ю.В. // Микробиология. 2016. Т. 85. № 3. С. 231; https://doi.org/10.7868/S0026365616030113
Ульяненко Л.Н., Рева Е.В., Сынзыныс Б.И. // Сельскохоз. биология. 2017. Т. 52. № 1. С. 183; https://doi.org/10.15389/agrobiology.2017.1.183rus
Гвоздев Р.И., Тухватуллин И.А., Туманова Л.B. // Изв. АН. Сер. биол. 2008. № 2. С. 186.
Choi D.W., Antholine W.A., Do Y.S. et al. // Microbiology. 2005. V. 151. P. 3417; https://doi.org/10.1099/mic.0.28169-0
Sirajuddin S., Barupala D., Helling S. et al. // J. Biol. Chem. 2014. V. 289. № 31. P. 21782; https://doi.org/10.1074/jbc.M114.581363
Chen C.-Li, Chen K.H.-C., Ke S.-C. et al. // J. Inorg. Biochem. 2004. V. 98. P. 2125; https://doi.org/10.1016/j.jinorgbio.2004.09.021
Саратовских Е.А., Коршунова Л.А., Рощупкина О.С., Скурлатов Ю.И. // Хим. физика. 2007. Т. 26. № 8. С. 46.
Каравайко Г.И., Дубинина Г.А., Кондратьева Т.Ф. // Микробиология. 2006. Т. 75. № 5. С. 593.
Higgins I.J., Best D.J., Hammond R.C. // Nature. 1980. 286. P. 561; https://doi.org/10.1038/286561a0
Pandey V.C., Singh J.S., Singh D.P., Singh R.P. // Intern. J. Environ. Sci. Technol. 2014. V. 11. P. 241; https://doi.org/10.1007/s13762-013-0387-9
Jenkins M.B., Chen J.H., Kadner D.J., Lion L.W. // Appl. Environ. Microbiol. 1994. V. 60. P. 3491.
Bruins M.R., Kapil S., Oehme F.W. // Ecotoxicol. Environ. Saf. 2000. V. 45. № 2. P. 198; https://doi.org/10.1006/eesa.1999.1860
Choi D.W., Do Y.S., Zea C.J. et al. // J. Inorg. Biochem. 2006. V. 100. P. 2150; https://doi.org/10.1016/j.jinorgbio.2006.08.017
Троценко Ю.А., Медведкова К.А., Хмеленина В.Н., Ешинимаев Б.Ц. // Микробиология. 2009. Т. 78. № 4. С. 435.
Lu X., Gu W., Zhao L. et al. // Sci. Adv. 2017. V. 3. e1700041; https://doi.org/10.1126/sciadv.1700041
Vita N., Platsaki S., Basle A. et al. // Nature. 2015. V. 525. P. 140; https://doi.org/10.1038/nature14854
Kenney G.E., Dassama L.M.K., Pandelia M.-E. et al. // Science. 2018. V. 359. Issue 6382. P. 1411; https://doi.org/10.1126/science.aap9437
Aimen H., Khan A.S., Kanwal N. // J. Bioremediat. Biodegrad. 2018. V. 9. № 2. P. 432; https://doi.org/10.4172/2155-6199.1000432
Yoon S. Ph.D. Dissertation Towards practical application of methanotrophic metabolism in chlorinated hydrocarbon degradation, greenhouse gas removal, and immobilization of heavy metals. USA: University of Michigan, 2010.
Semrau J.D., DiSpirito A.A., Gu W., Yoon S. // Appl. Environ. Microbiol. 2018. V. 84. № 6. UNSP e02289-17; https://doi.org/10.1128/AEM.02289-17
Choi D.W., Bandow N.L., McEllistrem M.T. et al. // J. Inorg. Biochem. 2010. V. 104. P. 1240; https://doi.org/10.1016/j.jinorgbio.2010.08.002
Hasin A.A.L., Gurman S.J., Murphy L.M. et al. // Environ. Sci. Technol. 2010. V. 44. P. 400; https://doi.org/10.1021/es901723c
Avdeeva L., Gvozdev R. // Chem. J. Mold. 2017. V. 12. № 1. P. 110; https://doi.org/10.19261/cjm.2017.404
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика