Химическая физика, 2019, T. 38, № 11, стр. 23-33
Регенерация фтора в форме фторида водорода из летучих фторсодержащих отходов в пламени водородсодержащего топлива и кислородсодержащего окислителя
1 Санкт-Петербургский политехнический университет Петра Великого
Санкт-Петербург, Россия
2 ООО “Новые химические продукты”
Санкт-Петербург, Россия
* E-mail: Pashkevich-DS@yandex.ru
Поступила в редакцию 29.11.2018
После доработки 01.03.2019
Принята к публикации 20.03.2019
Аннотация
Термодинамическими расчетами и экспериментальными исследованиями показано, что регенерацию фтора из фторсодержащих побочных продуктов и отходов современной промышленности целесообразно осуществлять в виде фторида водорода, обрабатывая фторсодержащие вещества в пламени водородсодержащего топлива и кислородсодержащего окислителя. В качестве источников сырья для синтеза фторида водорода рассмотрены плавиковая кислота, в том числе азеотропного состава, гексафторид урана, тетрафторид углерода и трифторид азота, бифторид аммония, тетрафторид кремния, гексафторкремниевая кислота и гексафторосиликаты.
ВВЕДЕНИЕ
Фторид водорода HF и получаемый из него фтор являются основными фторирующими агентами при производстве практически всех промышленных фторсоединений – фторидов урана в ядерном топливном цикле, фторполимеров, фреонов, электронных газов и др. [1, 2]. Современной промышленностью освоен единственный метод получения HF – сернокислотное разложение при T ~ 250 °С концентрата природного плавикового шпата [2]:
(1)
${\text{Ca}}{{{\text{F}}}_{{{\text{2}}\,{\text{тв}}}}} + {{{\text{H}}}_{{\text{2}}}}{\text{S}}{{{\text{O}}}_{{{\text{4}}\,{\text{жидк}}}}} \to {\text{CaS}}{{{\text{O}}}_{{{\text{4}}\,{\text{тв}}}}} + {\text{2H}}{{{\text{F}}}_{{{\text{газ}}}}}.$В России запасы плавикового шпата необходимого качества исчерпаны и его приходится импортировать из Монголии [3, 4]. В то же время в целом ряде отраслей российской и мировой промышленности образуются фторсодержащие отходы и побочные продукты: водный раствор фторида водорода (плавиковая кислота) [5, 6]; гексафторид урана, обедненного по изотопу 235U в ядерном топливном цикле [7]; водный раствор гексафторкремниевой кислоты при производстве фосфатных удобрений [8]; фториды углерода, азота, серы при производстве электронных газов, фторполимеров, фреонов [2]; отходы алюминиевой промышленности, содержащие гексафторалюминат натрия и другие соединения фтора [9]; фториды аммония при производстве тантала и ниобия [6].
Содержание фтора в вышеперечисленных побочных продуктах и отходах существенно превышает его потребление в современной промышленности, которое оценивается в 1.5 млн т/год [10]. Поэтому целесообразно рассмотреть эти фторсодержащие вещества в качестве промышленного сырья для получения из них фторида водорода.
РЕЗУЛЬТАТЫ РАСЧЕТОВ И ЭКСПЕРИМЕНТОВ
Термическая стабильность фторида водорода
Фторид водорода – одно из наиболее стабильных соединений фтора. В табл. 1 представлены результаты расчета термодинамически равновесной диссоциации летучих фторидов, полученные на основе данных [11].
Таблица 1.
Степень равновесной диссоциации различных фторидов (η) и фтора в зависимости от температуры
| Вещество | Реакция диссоциации | η, % | |||
|---|---|---|---|---|---|
| 1000 К | 1500 К | 2000 К | 2500 К | ||
| HF | HF ↔ H + F | 4.9 ∙ 10–13 | 5.9 ∙ 10–8 | 2.2 ∙ 10–5 | 8.0 ∙ 10–4 |
| CF4 | CF4 ↔ CF3 + F | 4.2 · 10–11 | 1.9 · 10–6 | 3.6 · 10–4 | 7.5 · 10–3 |
| SiF4 | SiF4↔ SiF3+ F | 1.1 · 10–13 | 2.4 · 10–8 | 8.3 · 10–6 | 2.0 · 10–4 |
| SF6 | SF6 ↔ SF5 + F | 3.2 · 10–4 | 2.0 · 10–1 | 8.9 · 10–1 | 9.8 · 10–1 |
| UF6 | UF6 ↔ UF5 + F | 1.7 · 10–10 | 2.4 · 10–8 | 3.0 · 10–7 | 1.5 · 10–6 |
| NF3 | NF3 ↔ NF2 + F | 7.9 · 10–4 | 9.3 · 10–2 | 9.0 · 10–1 | 3.2 |
| F2 | F2 ↔ 2F | 0.1 | 2.7 | 14.1 | 39.8 |
Высокая термостабильность молекулы фторида водорода позволила реализовать ряд процессов его получения из различных летучих соединений фтора и их смесей, являющихся отходами и побочными продуктами промышленного производства, в режиме горения. Рассмотрим эти продукты более подробно с точки зрения возможности регенерации из них фтора путем синтеза фторида водорода.
Плавиковая кислота
Плавиковая кислота является побочным продуктом двустадийного гидролиза обедненного гексафторида урана, процессов получения кварцевого концентрата и др. Обычно фторид водорода получают из плавиковой кислоты путем ректификации [12]. Однако смесь воды и фторида водорода при содержании последнего 35–40% является азеотропной, и ректификацией разделить ее на индивидуальные вещества не представляется возможным.
Известно несколько методов получения фторида водорода из азеотропного водного раствора – обработка серной кислотой [13], фторидом натрия [14], полиэтиленгликолем [15]. В сернокислотном методе образуется значительное количество отходов 75%-ной серной кислоты – до 10 кг на 1 кг фторида водорода. Два других метода не нашли промышленного применения в связи со сложностями технологического характера.
В работе [16] предложено получать фторид водорода из плавиковой кислоты, в том числе и азеотропной, путем восстановления воды углеродом по схеме
(2)
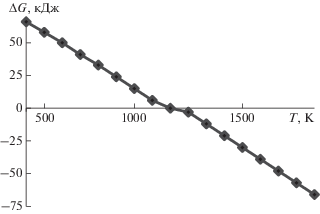
$\begin{gathered} {{{\text{С}}}_{{{\text{тв}}}}} + {\text{H}}{{{\text{F}}}_{{{\text{газ}}}}} + {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{{\text{газ}}}}} \to \\ \to {\text{C}}{{{\text{O}}}_{{{\text{газ}}}}} + {{{\text{H}}}_{{{\text{2}}\,{\text{газ}}}}} + {\text{H}}{{{\text{F}}}_{{{\text{газ}}}}} + 132\,\,{\text{кДж}}. \\ \end{gathered} $Термодинамическими расчетами было установлено, что в системе элементов C–H–F–O единственным фторсодержащим веществом является фторид водорода, а фториды и оксифториды углерода отсутствуют [17]. При температуре выше 1300 К вода отсутствует в термодинамически равновесной смеси, компонентами которой, кроме фторида водорода, являются монооксид углерода и водород. На рис. 1 представлены результаты расчета термодинамически равновесного состава веществ в указанной системе элементов при избытке углерода, который учитывали, задавая постоянным и равным равновесному давление паров углерода в системе уравнений давления веществ.
Рис. 1.
Зависимость термодинамически равновесного состава веществ в системе элементов C–O–H–F при избытке углерода и соотношении элементов 4.5O–4H–F (соответствует 40%-ному раствору плавиковой кислоты): 1 – H2, 2 – H2O, 3 – HF, 4 – CO, 5 – CO2, 6 – CH4.
Для экспериментального подтверждения результатов термодинамического расчета была создана лабораторная установка, в которой пары плавиковой кислоты подавали во фронт фильтрационного горения углерода в кислороде [18]. В результате экспериментов было подтверждено, что фторид водорода является единственным фторсодержащим веществом в процессе
(3)
$\begin{gathered} {{{\text{С}}}_{{{\text{тв}}}}} + {\text{H}}{{{\text{F}}}_{{{\text{газ}}}}} + {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{{\text{газ}}}}} + {{{\text{О}}}_{{{\text{2}}\,{\text{газ}}}}} \to \\ \to {\text{С}}{{{\text{О}}}_{{{\text{2}}\,{\text{газ}}}}} + {\text{C}}{{{\text{O}}}_{{{\text{газ}}}}} + {{{\text{H}}}_{{{\text{2}}\,{\text{газ}}}}} + {\text{H}}{{{\text{F}}}_{{{\text{газ}}}}} \\ \end{gathered} $при температуре порядка 1500 К.
Также было установлено, что присутствие фторида водорода не оказывало существенного влияния на скорость реакции взаимодействия воды с углеродом, характерное время которой в условиях эксперимента составило величину порядка 10 с. Конверсия воды в проведенных опытах превышала 90%. Таким образом, результаты расчета термодинамически равновесного состава хорошо совпали с результатами экспериментального исследования.
Известно, что получение фторида водорода из 90%-ной плавиковой кислоты путем ректификации хорошо освоено современной промышленностью [2]. Таким образом, на основе разработанного метода может быть создана промышленная технология получении безводного фторида водорода из плавиковой кислоты, в том числе и азеотропного состава.
Гексафторид урана
Гексафторид урана, обедненного по изотопу 235U (ОГФУ), появляется в качестве побочного продукта при изотопном обогащении урана. В настоящее время в мире накоплено до 2 млн т ОГФУ, в том числе в России – до 1 млн т [19, 20].
Единственная промышленная технология переработки ОГФУ основана на его двустадийном гидролизе при температуре 250–600 °С [21]. Процесс ведут при значительном избытке воды, поэтому его продуктом является не фторид водорода, а 70%-ная плавиковая кислота, что не позволяет замкнуть ядерный топливный цикл по фтору, так как для производства фторидов природного урана требуется безводный фторид водорода. Кроме того, в разработанной технологии тепло в зону реакции подводят от стенки, и с учетом высокой температуры на второй стадии, а также высокой коррозионной активности среды требуются эксклюзивные конструкционные материалы, состав и технология производства которых являются “ноу-хау” компании-разработчика. В связи с этим описанная технология не нашла широкого применения.
Уран образует целый ряд фторидов и оксифторидов – гексафторид урана, тетрафторид урана, диоксид-дифторид урана и др. [1]. Эти вещества гидролизуются при определенных условиях с образованием фторида водорода:
(4)
$\begin{gathered} 3{\text{U}}{{{\text{O}}}_{{\text{2}}}}{{{\text{F}}}_{{{\text{2}}\,{\text{тв}}}}} + 3{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{{\text{газ}}}}} \leftrightarrow \\ \leftrightarrow {{{\text{U}}}_{{\text{3}}}}{{{\text{O}}}_{{{\text{8}}\,{\text{тв}}}}} + 6{\text{H}}{{{\text{F}}}_{{{\text{газ}}}}} + 0.5{{{\text{O}}}_{{{\text{2}}\,{\text{газ}}}}} + 498\,\,{\text{кДж}}, \\ \end{gathered} $(5)
${\text{U}}{{{\text{F}}}_{{{\text{4}}\,{\text{тв}}}}} + 2{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{{\text{газ}}}}} \leftrightarrow {\text{U}}{{{\text{O}}}_{{{\text{2}}\,{\text{тв}}}}} + 4{\text{H}}{{{\text{F}}}_{{{\text{газ}}}}} + 207\,\,{\text{кДж}},$(6)
$\begin{gathered} 3{\text{U}}{{{\text{O}}}_{{\text{2}}}}{{{\text{F}}}_{{{\text{2}}\,{\text{тв}}}}} + {\text{3}}{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{{\text{газ}}}}} + {{{\text{H}}}_{{{\text{2}}\,{\text{газ}}}}} \to \\ \to {{{\text{U}}}_{{\text{3}}}}{{{\text{O}}}_{{{\text{8}}\,{\text{тв}}}}} + {\text{6H}}{{{\text{F}}}_{{{\text{газ}}}}} + {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{{\text{газ}}}}} + 256\,\,{\text{кДж}}, \\ \end{gathered} $(7)
$\begin{gathered} {\text{U}}{{{\text{F}}}_{{{\text{6}}\,{\text{газ}}}}} + 3{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{{\text{газ}}}}} \leftrightarrow \\ \leftrightarrow {\text{U}}{{{\text{O}}}_{{{\text{2}}\,{\text{тв}}}}} + {\text{6H}}{{{\text{F}}}_{{{\text{газ}}}}} + 0.5{{{\text{О}}}_{2}} + 146\,\,{\text{кДж}}, \\ \end{gathered} $(8)
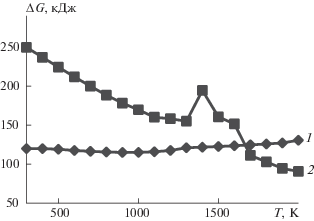
$\begin{gathered} {\text{U}}{{{\text{F}}}_{{{\text{6}}\,{\text{газ}}}}} + {\text{2}}{{{\text{Н}}}_{{\text{2}}}}{{{\text{О}}}_{{{\text{газ}}}}} \to \\ \to {\text{U}}{{{\text{O}}}_{{\text{2}}}}{{{\text{F}}}_{{{\text{2}}\,{\text{тв}}}}} + {\text{4H}}{{{\text{F}}}_{{{\text{газ}}}}} - 131\,\,{\text{кДж}}. \\ \end{gathered} $На рис. 2 представлены результаты расчета изменения энергии Гиббса для реакций (4)–(8), полученные на основе данных из работы [11]. Из этого рисунка следует, что только реакция (8) термодинамически не запрещена во всем диапазоне изменения температуры. Остальные процессы целесообразно проводить при температуре выше 550 К для реакции (7) и выше 1150 К для реакции (4).
Рис. 2.
Зависимость изменения энергии Гиббса ΔG от температуры Т для следующих реакций: 1 – (4), 2 – (5), 3 – (6), 4 – (7), 5 – (8).
Температура ∼1000 К и выше может быть достигнута при обработке гексафторида урана в пламени водородсодержащего топлива и кислородсодержащего окислителя:
(9)
$\begin{gathered} {\text{U}}{{{\text{F}}}_{{{\text{6}}\,{\text{газ}}}}} + {{x}_{1}}{{{\text{С}}}_{m}}{{{\text{H}}}_{n}}{{{\text{O}}}_{k}}{{{\text{N}}}_{{1\,{\text{газ}}}}} + {{x}_{2}}{{{\text{О}}}_{{{\text{2}}\,{\text{газ}}}}} \to \\ \to {\text{U}}{{{\text{O}}}_{{x\,{\text{тв}}}}} + 6{\text{H}}{{{\text{F}}}_{{{\text{газ}}}}} + {{y}_{1}}{\text{C}}{{{\text{O}}}_{{y\,{\text{газ}}}}} + {{y}_{2}}{{{\text{N}}}_{{{\text{2}}\,{\text{газ}}}}} - Q, \\ \end{gathered} $где СmHnOkNl – летучее водородсодержащее вещество, n > 0, m ≥ 0, k ≥ 0, l ≥ 0, nx1 ≥ 6, 2x2 > 2, y = 1 или 2,Q ~ 102–103 кДж, Тad > 103 К.
Использование водородсодержащего вещества должно обеспечить получение фторида водорода, а кислородсодержащего – оксидов урана, которые в отличие от UF6 являются твердыми негидролизуемыми и нерастворимыми в воде веществами, удобными для длительного хранения.
В качестве топлива могут быть рассмотрены такие доступные вещества, как CH4 (и другие углеводороды), H2, NH3, а также вещества с различными гетероатомами, в том числе спирты. Нагрев реагирующих веществ в процессе (9) осуществляется за счет химического тепловыделения, и стенки реакторного узла могут быть относительно холодными – порядка 100 °С для исключения конденсации плавиковой кислоты. Следовательно, для создания реакторного узла не потребуются эксклюзивные конструкционные материалы.
В табл. 2 приведены результаты расчета адиабатической температуры продуктов процесса (9) и температуры, рассчитанной при допущении, что гетерогенный факел может терять до 40% энергии вследствие излучения [22], которая названа радиационной. Из данных этой таблицы следует, что адиабатическая и радиационная температуры существенно выше 1000 К, что может обеспечить эффективность получения фторида водорода по реакции (9). Известно, что наиболее стабильными соединениями урана в системе элементов U–F–H–O являются гексафторид, тетрафторид, диоксид-дифторид и диоксид урана [1]. С учетом этого был рассчитан термодинамически равновесный состав веществ, которые могут образоваться при обработке гексафторида урана в пламени водорода и кислорода:
(10)
$\begin{gathered} {{x}_{1}}{\text{U}}{{{\text{F}}}_{{{\text{6}}\,{\text{газ}}}}} + {{x}_{2}}{{{\text{H}}}_{{{\text{2}}\,{\text{газ}}}}} + {{x}_{3}}{{{\text{O}}}_{{2\,{\text{газ}}}}} \to \\ \to {{y}_{1}}{\text{U}}{{{\text{O}}}_{{2\,{\text{тв}}}}} + {{y}_{2}}{\text{U}}{{{\text{F}}}_{{{{4\,{\text{тв}}} \mathord{\left/ {\vphantom {{4\,{\text{тв}}} {{\text{жидк}}}}} \right. \kern-0em} {{\text{жидк}}}}}}} + \\ + \,\,{{y}_{3}}{\text{U}}{{{\text{O}}}_{{\text{2}}}}{{{\text{F}}}_{{{{2\,{\text{тв}}} \mathord{\left/ {\vphantom {{2\,{\text{тв}}} {{\text{жидк}}}}} \right. \kern-0em} {{\text{жидк}}}}}}} + {{y}_{4}}{\text{H}}{{{\text{F}}}_{{{\text{газ}}}}} + {{y}_{5}}{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{{\text{газ}}}}}, \\ \end{gathered} $Таблица 2.
Тепловой эффект, адиабатическая температура (Tad) и температура с учетом теплового излучения гетерогенного факела (Trad) для процессов обработки UF6 в пламени водородсодержащего топлива и кислородсодержащего окислителя
| Реакция | –Q, кДж | Тad, К | Trad, К |
|---|---|---|---|
| UF6 газ + 3H2 газ + O2 газ → UO2 тв + 6HFгаз | 583 | 2542 | 1667 |
| UF6 газ + 2NH3 газ + O2 газ → UO2 тв + 6HFгаз + N2 газ | 490 | 2071 | 1384 |
| UF6 газ + 1.5CH4 газ + 2.5O2 газ → UO2 тв+ 6HFгаз + 1.5CO2 газ | 1061 | 3281 | 2082 |
где xi, yj – стехиометрические коэффициенты.
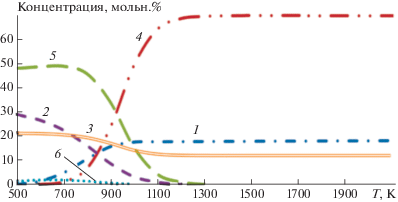
Расчеты проводили методом минимизации энергии Гиббса продуктов процесса, варьируя значения yj, при фиксированных значениях xi [23]. На рис. 3 приведены расчетные данные по термодинамическому равновесному составу веществ в системе элементов U–H–F–O в зависимости от температуры.
Рис. 3.
Зависимость термодинамически равновесного состава веществ в системе элементов U–F–H–O от температуры для x1 = 1, x2 = 3, x3 = 1: 1 – UO2, 2 – UF4, 3 – UO2F2, 4 – HF, 5 – H2O.
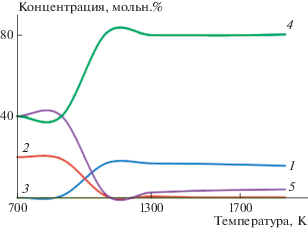
Из этого рисунка следует, что основным фторсодержащим веществом в указанной системе элементов при температуре выше 1300 К является фторид водорода, а содержание тетрафторида урана и диоксида-дифторида урана не превышает 0.3 и 0.1% соответственно. Содержание воды при температуре выше 1300 К составляет 2–4%.
Для экспериментального исследования процесса (10) в АО “Сибирский химический комбинат” была создана пилотная установка с реактором типа “туннельная горелка”, внутренний диаметр которого составил 150 мм, длина – 3 м, а температура стенки – 80–90 °С. Расход ОГФУ варьировали в диапазоне 1–2 г/с. Мольный расход водорода был в три и более раз выше мольного расхода ОГФУ, а мольный расход кислорода был больше или равным мольному расходу ОГФУ.
В результате проведенных опытов было показано, что при указанных соотношениях и расходах компонентов фронт горения стабилен. При подаче UF6 в горящий кислород-водородный факел температура, регистрируемая термопарами, установленными в полости реактора в защитных чехлах, увеличивалась примерно на 200 °С, несмотря на то, что адиабатическая температура продуктов горения водорода в кислороде существенно выше, чем адиабатическая температура продуктов трехкомпонентного факела:
(11)
$\begin{gathered} {\text{U}}{{{\text{F}}}_{{{\text{6}}\,{\text{газ}}}}} + 3{{{\text{H}}}_{{{\text{2}}\,{\text{газ}}}}} + {{{\text{O}}}_{{2\,{\text{газ}}}}} \to \\ \to {\text{U}}{{{\text{O}}}_{{{\text{2}}\,{\text{тв}}}}} + {\text{6H}}{{{\text{F}}}_{{{\text{газ}}}}} + 583\,\,{\text{кДж}}, \\ {{Т}_{{{\text{ад}}}}} = 2400\,\,{\text{К}}; \\ \end{gathered} $(12)
$\begin{gathered} 2{{{\text{H}}}_{{{\text{2}}\,{\text{газ}}}}} + {{{\text{O}}}_{{{\text{2}}\,{\text{газ}}}}} \to 2{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{{\text{газ}}}}} + 482\,\,{\text{кДж}}, \\ {{Т}_{{{\text{ад}}}}} = 3480\,\,{\text{К}}. \\ \end{gathered} $Это связано с тем, что в продуктах процесса (11), в отличие от процесса (12), присутствуют конденсированные соединения (например, диоксид урана с температурой плавления 2875 °С), тепловое излучение которых существенно интенсивней, чем газовых компонентов [24]. Таким образом, повышение измеряемой температуры при подаче UF6 свидетельствует о его химическом реагировании с образованием конденсированной фазы.
Основными твердыми продуктами процесса были диоксид урана и октаоксидтриурана в сравнимых количествах. Тетрафторид урана UF4 не был обнаружен. Содержание дифторида-диоксида урана UO2F2 и тетрафторида-оксида урана UOF4 составило около 1%, или порядка 0.2 мас.% фтора в твердой фазе. Основным фторсодержащим продуктом процесса была плавиковая кислота с концентрацией более 90%. Результаты экспериментов хорошо совпадают с результатами термодинамического расчета.
Предложенный метод получения фторида водорода из ОГФУ может стать основой промышленной технологии, которая позволит замкнуть ядерный топливный цикл по фтору.
Тетрафторид углерода и трифторид азота
Тетрафторид углерода (и другие перфторуглероды) является отходом или побочным продуктом многих промышленных производств – фторполимеров, фторида углерода, фтора и алюминия при электролизе и др. [2, 9]. Кроме того, газообразные смеси, содержащие CF4 и NF3, образуются при травлении кремния и его соединений в промышленности полупроводников [25]. Тетрафторид углерода и трифторид азота имеют четвертый класс опасности, однако значения их потенциала глобального потепления составляют 6500 и 7400, а время жизни в атмосфере оценивается в 50 000 и 740 лет соответственно. Поэтому эти летучие фториды целесообразно не рассеивать в атмосфере, как поступают в настоящее время, а перерабатывать, получая фторид водорода.
Термодинамические расчеты показывают, что во всем диапазоне изменения температуры в системах элементов C–F–O–H и N–F–H единственным стабильным фторсодержащим веществом является фторид водорода. Для экспериментального исследования процесса получения HF при взаимодействии тетрафторида углерода и других летучих фторидов с кислородом и водородсодержащим топливам в режиме горения во ФГУП РНЦ “Прикладная химия” была создана лабораторная установка. Ее основной элемент – термостатированный реактор типа “туннельная горелка” с внутренним диаметром 40 мм, который оборудован термопарами для фиксации фронта пламени и спиралью накаливания для инициирования горения.
Термодинамически реакция взаимодействия тетрафторида углерода с водородом
(13)
${\text{C}}{{{\text{F}}}_{{{\text{4}}\,{\text{газ}}}}} + 2{{{\text{H}}}_{{{\text{2}}\,{\text{газ}}}}} \to {{{\text{C}}}_{{{\text{тв}}}}} + 4{\text{H}}{{{\text{F}}}_{{{\text{газ}}}}} - 160\,\,{\text{кДж}}$не запрещена во всем диапазоне изменения температуры. Адиабатическая температура продуктов реакции составляет 1450 К при температуре исходных веществ 20 °С.
Однако сформировать фронт горения в смеси тетрафторида углерода и водорода при температуре исходных веществ 20 °С не удалось. Поэтому были проведены опыты с использованием кислорода и водородсодержащих веществ – водорода и метана:
(14)
$\begin{gathered} {\text{C}}{{{\text{F}}}_{{{\text{4}}\,{\text{газ}}}}} + 2{{{\text{H}}}_{{{\text{2}}\,{\text{газ}}}}} + {{{\text{O}}}_{{{\text{2}}\,{\text{газ}}}}} \to \\ \to {\text{C}}{{{\text{O}}}_{{{\text{2}}\,{\text{газ}}}}} + 4{\text{H}}{{{\text{F}}}_{{{\text{газ}}}}} - 553\,\,{\text{кДж}}, \\ {{Т}_{{{\text{ад}}}}} = 3200\,\,{\text{K}}, \\ \end{gathered} $(15)
$\begin{gathered} {\text{C}}{{{\text{F}}}_{{{\text{4}}\,{\text{газ}}}}} + {\text{С}}{{{\text{H}}}_{{{\text{4}}\,{\text{газ}}}}} + 2{{{\text{O}}}_{{{\text{2}}\,{\text{газ}}}}} \to \\ \to 2{\text{C}}{{{\text{O}}}_{{{\text{2}}\,{\text{газ}}}}} + 4{\text{H}}{{{\text{F}}}_{{{\text{газ}}}}} - 872\,\,{\text{кДж}}, \\ {{Т}_{{{\text{ад}}}}} = 3600\,\,{\text{K}}; \\ \end{gathered} $адиабатическая температура продуктов была рассчитана без учета их диссоциации и для Т0 = 300 К.
Результаты экспериментов, касающиеся состава продуктов обработки тетрафторида углерода в водород-кислородном и метан-кислородном пламени, приведены в табл. 3. Из данных этой таблицы следует, что конверсия тетрафторида углерода достигала в проведенных опытах 90% при концентрации фторида водорода в получаемой плавиковой кислоте порядка 60–80%.
Таблица 3.
Концентрация веществ (С) в продуктах обработки CF4 в пламени H2 и O2 и CH4 или O2 и степень конверсии CF4(К) в зависимости от расхода компонентов (W)
| W, см3 ∙ с–1 | С, мас.% | К, % | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CF4 | H2 | CH4 | O2 | CF4 | O2 | H2 | CH4 | CO2 | CO | HF | H2O | |
| 16 | 44 | – | 22 | 7.8 | 2.6 | – | – | 19.6 | 3.6 | 52.5 | 14.7 | 89 |
| 17 | 39 | – | 22 | 11.2 | 0.5 | – | – | 22.3 | – | 49.4 | 16.7 | 83 |
| 17 | 40 | – | 17 | 30.5 | 5.5 | 0.6 | – | 9.1 | – | 38.5 | 15.8 | 66 |
| 4 | – | 5 | 8 | 12.2 | 2.2 | 0.1 | 0.2 | 14.7 | – | 39.2 | 31.5 | 78 |
При производстве трифторида азота с содержанием основного вещества выше 99% одним из отходов производства является смесь трифторида азота и тетрафторида углерода [26]. На созданной лабораторной установке были проведены опыты по получению фторида водорода из этой смеси при взаимодействии ее с водородом и фтором в режиме горения. Было установлено, что конверсия трифторида азота и тетрафторида углерода в этом процессе достигает 100%, а одним из продуктов является тетрафторэтилен (табл. 4):
(16)
$\begin{gathered} {{x}_{1}}{\text{C}}{{{\text{F}}}_{{{\text{4}}\,{\text{газ}}}}} + {{x}_{2}}{\text{N}}{{{\text{F}}}_{{{\text{3}}\,{\text{газ}}}}} + {{x}_{3}}{{{\text{H}}}_{{{\text{2}}\,{\text{газ}}}}} + {{x}_{4}}{{{\text{F}}}_{{{\text{2}}\,{\text{газ}}}}} \to \\ \to {{y}_{1}}{\text{C}}{{{\text{F}}}_{{{\text{4}}\,{\text{газ}}}}} + {{y}_{2}}{\text{N}}{{{\text{F}}}_{{{\text{3}}\,{\text{газ}}}}} + {{y}_{3}}{{{\text{С}}}_{{{\text{тв}}}}} + {{y}_{4}}{{{\text{N}}}_{{{\text{2}}\,{\text{газ}}}}} + \\ + \,\,{{y}_{5}}{\text{H}}{{{\text{F}}}_{{{\text{газ}}}}} + {{y}_{6}}{{{\text{C}}}_{{\text{2}}}}{{{\text{F}}}_{{{\text{4}}\,{\text{газ}}}}}. \\ \end{gathered} $Таблица 4.
Степень конверсии CF4 и NF3(К), количество C2F4(χ) в % от возможного и адиабатическая температура продуктов реакции без учета диссоциации (Тad) в зависимости от расхода компонентов (W) при обработке смеси CF4 и NF3 водородом и водородом и фтором в режиме горения
| W, см3 ∙ с–1 | К, % | χ, % | Tad, K | ||||
|---|---|---|---|---|---|---|---|
| H2 | NF3 | CF4 | F2 | NF3 | CF4 | ||
| 7.7 | 3.1 | 0.3 | – | 100 | 100 | – | 4586 |
| 8.3 | 2.4 | 0.9 | – | 100 | 92.9 | 0.7 | 3828 |
| 8.7 | 1.9 | 1.4 | – | 100 | 89.1 | 20.9 | 3160 |
| 8.8 | 2.0 | 1.5 | – | 97.3 | 85.0 | 38.1 | 2980 |
| 8.9 | 1.6 | 1.7 | – | 99.4 | 51.5 | 48.4 | 2550 |
| 9.2 | 1.3 | 2.1 | – | 100 | 66.1 | 31.9 | 2260 |
| 9.3 | 1.2 | 2.2 | – | 100 | 69.2 | 19.2 | 2220 |
| 9.6 | 1.0 | 2.4 | – | 100 | 75.9 | 1.2 | 1930 |
| 9.8 | 0.7 | 2.8 | – | 100 | 64.6 | – | 1580 |
| 7.8 | 0.1 | 2.5 | 0.8 | 100 | 97.3 | – | 1820 |
Наличие в продуктах тетрафторэтилена позволяет предположить, что при средних значениях адиабатических температур продуктов образуется дифторкарбен, который способен вступать в реакцию рекомбинации [27]. Таким образом, показана возможность практически полной регенерации фтора из CF4 и NF3 и их смесей в виде фторида водорода в режиме горения.
Бифторидаммония
Бифторид аммония NH4F · HF – это побочный продукт производств трифторида азота, тантала, ниобия и др. Ряд авторов рассматривали бифторид аммония как сырье для производства фторида водорода посредством сернокислотного разложения [28]. Однако промышленного применения этот метод не нашел.
Бифторид аммония кипит с разложением на аммиак и фторид водорода при температуре 240 °С [29]. Регенерировать фтор из бифторида аммония можно, сжигая его (или продукты его термического разложения) в кислороде и получая фторид водорода:
(17)
$\begin{gathered} {\text{N}}{{{\text{H}}}_{{{\text{3}}\,{\text{газ}}}}} + 2{\text{H}}{{{\text{F}}}_{{{\text{газ}}}}} + {{x}_{1}}{{{\text{O}}}_{{{\text{2}}\,{\text{газ}}}}} \to \\ \to {{y}_{1}}{{{\text{N}}}_{{{\text{2}}\,{\text{газ}}}}} + {{y}_{2}}{\text{N}}{{{\text{H}}}_{{{\text{3}}\,{\text{газ}}}}} + 2{\text{H}}{{{\text{F}}}_{{{\text{газ}}}}} + \\ + \,\,{{y}_{3}}{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{{\text{газ}}}}} + {{y}_{4}}{{{\text{H}}}_{{{\text{2}}\,{\text{газ}}}}} + {{y}_{5}}{{{\text{О}}}_{{{\text{2}}\,{\text{газ}}}}}. \\ \end{gathered} $Результаты расчетов термодинамически равновесного состава веществ в системе элементов N–H–F–O с учетом фторидов азота (NF3, N2F4, NHF2) и дифторида кислорода позволили сделать вывод, что единственным термодинамически стабильным фторсодержащим веществом в этой системе является фторид водорода.
Тепловыделение в процессе (17) при значении х1 ∼ 1 достаточно высоко (табл. 5). Поэтому можно предположить, что взаимодействие будет протекать в режиме горения.
Таблица 5.
Тепловые эффекты (Q) и адиабатические температуры (Tad) продуктов в процессе (17) для различных значений х1 при начальной температуре исходных веществ 500 К
| Реакция | х1 | Q, кДж | Tad, K |
|---|---|---|---|
| NH3 + 2HF + 0.75O2 → 0.5N2 + 1.5H2O + 2HF | 0.75 | –317 | 2707 |
| NH3 + 2HF + 0.5O2 → 0.5N2 + 1.0H2O + 2HF + 0.5H2 | 0.50 | –196 | 2062 |
Для выяснения влияния фторида водорода на процесс горения аммиака вначале были проведены опыты, где вместо фторида водорода в зону реакции подавали эквимольное количество аргона:
(18)
$\begin{gathered} {\text{N}}{{{\text{H}}}_{{{\text{3}}\,{\text{газ}}}}} + 2{\text{A}}{{{\text{r}}}_{{{\text{газ}}}}} + {{x}_{1}}{{{\text{O}}}_{{{\text{2}}\,{\text{газ}}}}} \to \\ \to {{y}_{1}}{{{\text{N}}}_{{{\text{2}}\,{\text{газ}}}}} + {{y}_{2}}{\text{N}}{{{\text{H}}}_{{{\text{3}}\,{\text{газ}}}}} + 2{\text{A}}{{{\text{r}}}_{{{\text{газ}}}}} + \\ + \,\,{{y}_{3}}{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{{\text{газ}}}}} + {{y}_{4}}{{{\text{H}}}_{{{\text{2}}\,{\text{газ}}}}} + {{y}_{5}}{{{\text{О}}}_{{{\text{2}}\,{\text{газ}}}}}. \\ \end{gathered} $Было показано, что в созданной лабораторной установке при значении х1 от 0.5 до 1.2 при расходе смеси от 15 до 50 см3 · с–1 фронт горения аммиака стабилен, что хорошо коррелирует с данными по концентрационным пределам распространения пламени в смеси воздуха и аммиака (14–29 об.%) [30]. Конверсия аммиака увеличивалась от 60 до 98% с ростом значения x1 в указанном интервале.
При проведении опытов по схеме (17) было показано, что при значениях параметра x1 от 0.6 до 1 (концентрация аммиака в смеси – от 25 до 28 об.%) и расходе смеси порядка 20 см3 · с–1 (линейная скорость смеси в 7 раз ниже нормальной скорости распространения пламени в смеси аммиак–воздух, которая составляет 0.1 м · с–1 [31]) сформировать фронт горения не удается. Вероятно, что фторид водорода как полярное вещество (дипольный момент – 1.91 Д [32]) является ингибитором процесса горения аммиака в кислороде, обрывая реакционные цепи.
Для обеспечения стабильности горения аммиака было предложено подавать в зону реакции метан:
(19)
$\begin{gathered} {\text{N}}{{{\text{H}}}_{{{\text{3}}\,{\text{газ}}}}} + 2{\text{H}}{{{\text{F}}}_{{{\text{газ}}}}} + {{х}_{1}}{{{\text{O}}}_{{{\text{2}}\,{\text{газ}}}}} + {{х}_{2}}{\text{C}}{{{\text{H}}}_{{{\text{4}}\,{\text{газ}}}}} \to \\ \to {{y}_{1}}{{{\text{N}}}_{{{\text{2}}\,{\text{газ}}}}} + {{y}_{2}}{\text{N}}{{{\text{H}}}_{{{\text{3}}\,{\text{газ}}}}} + 2{\text{H}}{{{\text{F}}}_{{{\text{газ}}}}} + {{y}_{3}}{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{{\text{газ}}}}} + \,\, \\ + \,\,{{y}_{4}}{{{\text{H}}}_{{{\text{2}}\,{\text{газ}}}}} + {{y}_{5}}{{{\text{О}}}_{{{\text{2}}\,{\text{газ}}}}} + {{y}_{6}}{\text{C}}{{{\text{H}}}_{{{\text{4}}\,{\text{газ}}}}} + {{y}_{7}}{\text{C}}{{{\text{O}}}_{{{\text{2}}\,{\text{газ}}}}} + {{y}_{8}}{\text{C}}{{{\text{O}}}_{{{\text{газ}}}}}. \\ \end{gathered} $Значение х1 выбирали так, чтобы кислорода было достаточно для полного сжигания аммиака и метана с образованием воды и диоксида углерода.
В результате экспериментов было показано, что стабильный фронт горения формируется при значениях x2 > 0.2 (расход смеси – 35–40 см3 · с–1). В этом случае конверсия аммиака достигала 95% и увеличивалась до 98% при увеличении х2 до 0.42.
Применение метана позволяет стабилизировать фронт горения, однако при этом увеличивается количество воды в продуктах реакции. Так, при х1 = 1.2, х2 = 0.2 концентрация фторида водорода в получаемой плавиковой кислоте составляет примерно 50%.
Снизить концентрацию метана и обеспечить стабильность горения можно, добавляя в кислород фтор:
(20)
$\begin{gathered} {\text{N}}{{{\text{H}}}_{{{\text{3}}\,{\text{газ}}}}} + 2{\text{H}}{{{\text{F}}}_{{{\text{газ}}}}} + {{х}_{1}}{{{\text{O}}}_{{{\text{2}}\,{\text{газ}}}}} + {{х}_{2}}{\text{C}}{{{\text{H}}}_{{{\text{4}}\,{\text{газ}}}}} + {{х}_{{\text{3}}}}{{{\text{F}}}_{{{\text{2}}\,{\text{газ}}}}} \to \\ \to {{y}_{1}}{{{\text{N}}}_{{{\text{2}}\,{\text{газ}}}}} + {{y}_{2}}{\text{N}}{{{\text{H}}}_{{{\text{3}}\,{\text{газ}}}}} + 2\left( {1{\text{ }} + {{х}_{3}}} \right){\text{H}}{{{\text{F}}}_{{{\text{газ}}}}} + \\ + \,\,{{y}_{3}}{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{{\text{газ}}}}} + {{y}_{4}}{{{\text{H}}}_{{{\text{2}}\,{\text{газ}}}}} + {{y}_{5}}{{{\text{О}}}_{{{\text{2}}\,{\text{газ}}}}} + \\ + \,\,{{y}_{6}}{\text{C}}{{{\text{H}}}_{{{\text{4}}\,{\text{газ}}}}} + {{y}_{7}}{\text{C}}{{{\text{O}}}_{{{\text{2}}\,{\text{газ}}}}} + {{y}_{8}}{\text{C}}{{{\text{O}}}_{{{\text{газ}}}}}. \\ \end{gathered} $Энергия связи в молекуле фтора низкая: 159 кДж · моль–1 [2], поэтому степень равновесной диссоциации фтора гораздо выше степени диссоциации других фторидов (табл. 1). Это позволяет предположить, что атомы фтора могут стать инициаторами реакционных цепей.
Экспериментально было показано, что при значении х3 = 0.02 факел стабилен, если х2 = 0.1. Конверсия аммиака в этом случае составила 98%. Однако при х2 = 0 и х1 = 0.75–1.15 не удалось добиться стабильного горения, если х3 = 0.03–0.05. Таким образом, для получения фторида водорода из бифторида аммония в режиме горения в кислороде для стабилизации горения необходимо добавлять метан в количестве порядка 20% от количества аммиака.
Тетрафторид кремния и гексафторкремниевая кислота
Побочным фторсодержащим продуктом производства фосфатных удобрений является тетрафторид кремния SiF4, который гидролизуют и получают водный раствор гексафторкремниевой кислоты H2SiF6 [33]. На рис. 4 приведены результаты расчета изменения энергии Гиббса для реакции гидролиза SiF4 с получением фторида водорода [34]:
(21)
${\text{Si}}{{{\text{F}}}_{{{\text{4}}\,{\text{газ}}}}} + 2{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{{\text{газ}}}}} \to {\text{Si}}{{{\text{O}}}_{{{\text{2}}\,{\text{тв}}}}} + 4{\text{H}}{{{\text{F}}}_{{{\text{газ}}}}} - 97\,\,{\text{кДж}}.$Реакция гидролиза SiF4 является обратимой, скорость прямой реакции равна скорости обратной при температуре 1170 К, которую для удобства изложения назвали критической Ткр. Таким образом, чтобы получить фторид водорода из SiF4, нужно проводить гидролиз последнего при температуре выше Ткр и быстро охлаждать продукты при температуре ниже Ткр. Необходимое значение температуры может быть достигнуто при обработке SiF4 в пламени водородсодержащего топлива и кислородсодержащего окислителя с получением SiO2 и HF.
В табл. 6 приведены значения тепловых эффектов, адиабатичеcкой и радиационной температур продуктов взаимодействия SiF4 с водородсодержащими веществами и кислородом. При температуре выше 1000 К существуют три кристаллические модификации SiO2: β-кварц, β‑тридимит и β-кристобалит [35]. Значения термодинамических функций – стандартных энтальпии и энтропии образования и теплоемкости – для этих веществ различаются на единицы процентов. Расчеты проводили для β-кристобалита. Из данных табл. 6 следует, что температура продуктов приведенных реакций существенно выше 1170 К, поэтому вероятно, что продуктами обработки SiF4 в пламени водородсодержащего топлива и кислорода будут фторид водорода и диоксид кремния.
Таблица 6.
Тепловые эффекты (Q) и температуры продуктов реакций взаимодействия SiF4 с NH3, CH4, H2 и O2 – адиабатическая (Tad) и с учетом теплового излучения гетерогенного факела (Trad)
| № реакции | Реакция | Q, кДж | Tad, K | Trad, K |
|---|---|---|---|---|
| 1 | SiF4 газ + 2NH3 газ + 2HFгаз + 1.5O2 газ → N2 газ + SiO2 тв+ 6HFгаз + H2Oгаз | 539 | 2120 | 1510 |
| 2 | SiF4 газ + СН4 газ + 2O2 газ → SiO2 тв+ СO2 газ + 4HFгаз | 703 | 3400 | 2300 |
| 3 | SiF4 газ + 2H2 газ + O2 газ → SiO2 тв + 4HFгаз | 384 | 2540 | 1760 |
В системе элементов Si–F–H–O наиболее термостабильными являются SiO2, SiF4, H2O и HF. Расчет термодинамически равновесного состава веществ в этой системе элементов осуществляли методом минимизации энергии Гиббса смеси, варьируя концентрации компонентов при заданном соотношении количества атомов [23]:
(22)
$\begin{gathered} {{x}_{1}}{\text{Si}}{{{\text{F}}}_{{{\text{4}}\,{\text{газ}}}}} + {{x}_{2}}{{{\text{H}}}_{{{\text{2}}\,{\text{газ}}}}} + {{x}_{3}}{{{\text{O}}}_{{{\text{2}}\,{\text{газ}}}}} \to \\ \to {{y}_{1}}{\text{Si}}{{{\text{O}}}_{{{\text{2}}\,{\text{тв}}}}} + {{y}_{2}}{\text{Si}}{{{\text{F}}}_{{{\text{4}}\,{\text{газ}}}}} + {{y}_{3}}{\text{H}}{{{\text{F}}}_{{{\text{газ}}}}} + {{y}_{4}}{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{{\text{газ}}}}}, \\ \end{gathered} $где xi, yj – стехиометрические коэффициенты.
На рис. 5 приведены зависимости концентрации продуктов реакции (22) в термодинамически равновесной смеси, рассчитанные с использованием созданной модели [34], от температуры. При температуре выше 1300 К основным кремнесодержащим веществом в системе элементов Si–F–H–O является SiO2 и основным фторсодержащим – HF, концентрация SiF4 не превышает 3%, H2O – 8%.
Рис. 5.
Зависимости концентрации веществ С в системе элементов Si–F–H–O в термодинамически равновесной смеси от температуры при x1 = 1, x2 = 2, x3 = 1 (SiF4–2H2–O2): 1 – SiO2, 2 – SiF4, 3 – H2O, 4 – HF.
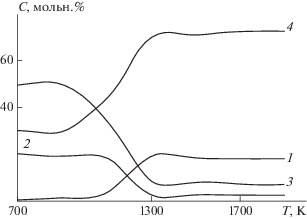
Таким образом, при восстановлении SiF4 в пламени водородсодержащего топлива и кислородсодержащего окислителя при температуре выше 1300 К основным фторсодержащим веществом может быть HF, а основным кремнесодержащим – SiO2.
В технологии производства фосфатных удобрений SiF4 гидролизуют с получением водного раствора гексафторкремниевой кислоты H2SiF6 [36, 37]:
(23)
$\begin{gathered} {\text{Si}}{{{\text{F}}}_{{{\text{4}}\,{\text{газ}}}}} + {{({\text{2HF}} + n{{{\text{H}}}_{{\text{2}}}}{\text{O}})}_{{{\text{раств}}}}} \to \\ \to {{{\text{(}}{{{\text{H}}}_{{\text{2}}}}{\text{Si}}{{{\text{F}}}_{{\text{6}}}} + n{{{\text{H}}}_{{\text{2}}}}{\text{O}})}_{{{\text{раств}}}}}, \\ \end{gathered} $концентрация H2SiF6 в растворе обычно составляет 10–25%.
Из водного раствора H2SiF6 могут быть получены гексафторосиликаты металлов и аммония [35, 37, 38]:
(24)
$\begin{gathered} {{{\text{H}}}_{{\text{2}}}}{\text{Si}}{{{\text{F}}}_{{{\text{6}}\,{\text{раств}}}}} + 2{\text{NaC}}{{{\text{l}}}_{{{\text{раств}}}}} \to \\ \to {\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{Si}}{{{\text{F}}}_{{{\text{6}}\,{\text{тв}}}}} + 2{\text{HC}}{{{\text{l}}}_{{{\text{раств}}}}}, \\ \end{gathered} $(25)
${{{\text{H}}}_{{\text{2}}}}{\text{Si}}{{{\text{F}}}_{{{\text{6}}\,{\text{раств}}}}} + 2{\text{N}}{{{\text{H}}}_{{\text{4}}}}{\text{O}}{{{\text{H}}}_{{{\text{раств}}}}} \to {{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{\text{2}}}}{\text{Si}}{{{\text{F}}}_{{{\text{6}}\,{\text{раств}}}}},$(26)
$2{\text{N}}{{{\text{H}}}_{{\text{4}}}}{{{\text{F}}}_{{{\text{раств}}}}} + {\text{Si}}{{{\text{F}}}_{{{\text{4}}\,{\text{газ}}}}} \to {{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{\text{2}}}}{\text{Si}}{{{\text{F}}}_{{{\text{6}}\,{\text{раств}}}}},$(27)
$\begin{gathered} {{{\text{H}}}_{{\text{2}}}}{\text{Si}}{{{\text{F}}}_{{{\text{6}}\,{\text{раств}}}}} + {\text{СaC}}{{{\text{O}}}_{{{\text{3}}\,{\text{тв}}}}} \to \\ \to {\text{СаSi}}{{{\text{F}}}_{{{\text{6}}\,{\text{тв}}}}} + {{{\text{H}}}_{{\text{2}}}}{\text{C}}{{{\text{O}}}_{{{\text{3}}\,{\text{раств}}}}}. \\ \end{gathered} $Поэтому целесообразно исследовать термодинамическую возможность получения фторида водорода из гексафторсиликатов в пламени водородсодержащего топлива и кислородсодержащего окислителя.
В литературных источниках не обнаружены данные по термодинамическим функциям гексафторсиликатов CaSiF6, (NH4)2SiF6, Na2SiF6, однако эти соли термически нестабильны при температуре выше 370, 250 и 600 °C, соответственно [39, 40]:
поэтому дальнейшие расчеты проводили для продуктов термического разложения.
Для реакций гидролиза фторидов натрия и кальция:
(28)
${\text{Na}}{{{\text{F}}}_{{{\text{тв}}}}} + {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{{\text{газ}}}}} \to {\text{NaO}}{{{\text{H}}}_{{{{{\text{тв}}} \mathord{\left/ {\vphantom {{{\text{тв}}} {{\text{жидк}}}}} \right. \kern-0em} {{\text{жидк}}}}}}} + {\text{H}}{{{\text{F}}}_{{{\text{газ}}}}},$(29)
${\text{Ca}}{{{\text{F}}}_{{{\text{2}}\,{\text{тв}}}}} + {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{{\text{газ}}}}} \to {\text{Ca}}{{{\text{O}}}_{{{\text{тв}}}}} + 2{\text{H}}{{{\text{F}}}_{{{\text{газ}}}}},$были рассчитаны значения изменения энергии Гиббса в зависимости от температуры (рис. 6) и показано, что ΔG > 0 во всем изученном диапазоне изменения температуры. Таким образом, протекание реакций (20) и (21) термодинамически запрещено. Наличие локального максимума на кривой 2 связано с тем, что при температуре 1424 K происходит изменение кристаллической решетки CaF2, а при 1691 K CaF2 плавится [41].
В табл. 7 приведены результаты расчетов теплового эффекта реакций, температур Тad и Trad для процессов восстановления продуктов термического разложения гексафторосиликатов в пламени водородсодержащего топлива и кислорода при соотношении исходных компонентов, соответствующих получению SiO2 и HF при начальной температуре Т0 = 500 К. В случае гексафторосиликата аммония водородсодержащее топливо содержится в самой молекуле гексафторосиликата.
Таблица 7.
Тепловые эффекты (Q) и температуры (Тad) и (Тrad) для реакций взаимодействия продуктов термического разложения гексафторосиликатов с водородсодержащими веществами и кислородом при Т0 = 500 К
| № реакции | Реакция | –Q, кДж | Тad, К | Тrad, К |
|---|---|---|---|---|
| 1 | SiF4 газ + 2NH3 газ + 2HF газ + 1.5O2 газ → N2 газ + SiO2 тв + 6HFгаз + H2O газ | 539 | 2211 | 1643 |
| 2 | 2NaFтв + SiF4 газ + СH4 газ + 2O2 газ → 2NaFтв + SiO2 тв + 4HFгаз + CO2 газ | 708 | 2354 | 1763 |
| 3 | CaF2 тв + SiF4 газ + СH4 газ + 2O2 газ → CaF2 тв + SiO2 тв + 4HFгаз + CO2 газ | 708 | 2687 | 1978 |
Значения Trad в табл. 7 существенно превышают значение Tкр, полученное для SiF4 (рис. 4), и, следовательно, гидролиз SiF4 в процессах №№ 1–3 термодинамически не запрещен. Следует отметить, что фториды натрия и кальция не гидролизуются, поэтому регенерация фтора из гексафторосиликатов этих элементов возможна лишь на 67%.
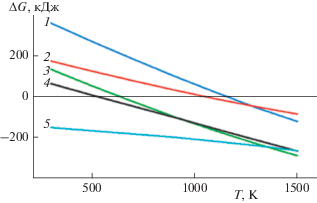
На рис. 7 приведена зависимость изменения энергии Гиббса ΔG от температуры в диапазоне ее значений 300–2000 К для реакций взаимодействия продуктов термического разложения гексафторосиликатов с водородсодержащими веществами и кислородом (реакции №№ 1–3 в табл. 7). Значения изменения энергии Гиббса отрицательны в исследованном диапазоне температуры, следовательно, реакции №№ 1–3 в табл. 7 термодинамически не запрещены.
Рис. 7.
Зависимость ΔG от Т для реакций восстановления в пламени продуктов термического разложения гексафторосиликатов: 1–3 – реакции №№ 1–3 в табл. 7 соответственно.
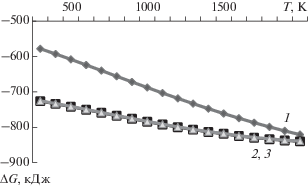
Таким образом, переработка SiF4 или гексафторосиликатов аммония и металлов, или продуктов их термического разложения в пламени водородсодержащего топлива и кислородсодержащего окислителя может стать способом получения фторида водорода из фторсодержащих отходов производства фосфатных удобрений из фторапатита.
ЗАКЛЮЧЕНИЕ
Результаты проведения расчетных и экспериментальных исследований показали, что фторид водорода является высокотермостабильным веществом и его получение из летучих фторидов, являющихся побочными продуктами и отходами современной промышленности, путем обработки этих фторидов в пламени водородсодержащего топлива и кислородсодержащего окислителя может стать основой промышленного метода производства HF. Степень регенерации фтора из исследованных фторидов в виде фторида водорода превышает 90%. Результаты термодинамических расчетов и экспериментов по составу веществ, являющихся продуктами переработки фторидов в пламени водородсодержащего топлива и кислородсодержащего окислителя, хорошо совпадают. Предложенный метод получения фторида водорода может быть распространен и на другие фториды, в том числе конденсированные, за исключением фторидов щелочных и щелочноземельных металлов, для которых гидролиз с образованием фторида водорода запрещен во всем диапазоне изменения температуры.
Работа выполнена при финансовой поддержке Инновационного центра “Сколково” и фонда “Тугра” (проект № Г48/16).
Список литературы
Тураев Н.С., Жерин И.И. Химия и технология урана. М.: Цнииатоминформ, 2005.
Максимов Б.Н., Барабанов В.Г., Серушкин И.Л. и др. Промышленные фторорганические продукты. Справочник. СПб.: Химия, 1996.
Обзор рынка флюорита (плавикового шпата) в СНГ. Издание 8. М.: Исследовательская группа Информайн, 2016.
ГОСТ 14022-88. Водород фтористый безводный. Технические условия. М.: Изд-во стандартов, 1989.
Morel B., Duperret B. // J. Fluorine Chem. 2009. V. 130. P. 7.
Agulyansky A. The chemistry of tantalum and niobium fluoride compounds. Amsterdam: Elsevier, 2004.
Shatalov V., Seredenko V., Kalmakov D. et al. // J. Fluorine Chem. 2009. V. 130. № 1. P. 122.
Dahlke T., Ruffiner O., Cant R. // Procedia Engin. 2016. V. 138. P. 231.
Куликов Б.П., Истомин С.П. Переработка отходов алюминиевого производства. СПб.: Изд-во МАНЭБ, 2004.
Hydrogen fluoride. The Essential Chemical Industry – online. University of York, UK; http://www.essentialchemicalindustry.org/chemicals/ hydrogen-fluoride.html
Глушко В.П. Термодинамические свойства индивидуальных веществ. Справочное издание. 3-е изд. М.: Наука, 1979.
Волоснев А.В., Громов О.Б., Медведев М.В. и др. Способ получения безводного фтороводорода и плавиковой кислоты. Патент РФ 2447013 // Б.И. 2012. № 10; http://www.freepatent.ru/patents/2447013
Eicher J., Rudolph W., Schulte B. Process for working up a hydrogen fluoride phase from a fluorination reaction mixture. Patent US 5300709, 1994; https://patents.google.com/patent/US5300709A/ko
Позин М.Е. Технология минерального сырья. Л.: Химия, 1974.
Зайцев В.А. Производство фтористых соединений при переработке фосфатного сырья. М.: Химия, 1982.
Пашкевич Д.С., Алексеев Ю.И., Петров В.Б. и др. // Хим. пром-сть. 2015. Т. 92. № 15. С. 211.
Капустин В.В., Пашкевич Д.С., Талалов В.А. // Физико-химические аспекты предельных состояний и структурных превращений в сплошных средах, материалах и технических системах. Вып. 2 / Под общ. ред. чл.-корр. РАН Петрова Ю.В. СПб.: Политехника, 2018. С. 81.
Капустин В.В., Пашкевич Д.С., Алексеев Ю.И. и др. // Там же. С. 89.
Шаталов В.В. ОГФУ: Хранение и переработка. Российское атомное сообщество; http://www.atomic-energy.ru/technology/11609
ОГФУ. Хранение, обогащение, переработка. Общественный совет Росатома; http://www.aecc.ru/attachments/article/69/0.ogfu.pdf
Borgard J., Herbelet F., Gwinner B. // J. Fluorine Chem. 2016. V. 185. P. 17.
Souil J.M., Joulain P., Gengembre E. // Combust. Sci. Technol. 1985. № 41. P. 69.
Зимин А.Р., Пашкевич Д.С. Термодинамическое обоснование получения фторида водорода из гексафторида урана в пламени водородсодержащего топлива и кислородсодержащего окислителя. Физико-химические аспекты предельных состояний и структурных превращений в сплошных средах, материалах и технических системах. Вып. 2 / Под общ. ред. чл.-корр. РАН Петрова Ю.В. СПб.: Политехника, 2018. С. 96.
Петухов Б.С., Шиков В.К. Справочник по теплообменникам. М.: Энергоатомиздат, 1987.
Doering R., Nishi Y. Handbook of Semiconductor Manufacturing Technology. BocaRaton, London, New York: CRC Press, 2008.
Пашкевич Д.С., Барабанов В.Г., Максимов Б.Н. // Памяти Б.В. Гидаспова. Научные чтения. СПб.: Теза, 2008. С. 169.
Полак Л.С., Овсянников А.А., Словецкий Д.И., Вурзель Ф.Б. Теоретическая и прикладная плазмохимия. М.: Наука, 1975.
Родин В.И., Харитонов В.П., Середенко В.А. // Хим. пром-сть. 1999. № 12. С. 753.
Рысс И.Г. Химия фтора и его неорганических соединений. М.: Госхимиздат, 1966.
Рябов И.В. Пожарная опасность веществ и материалов, применяемых в химической промышленности. Справочник. М.: Химия, 1979.
Снегирев А.Ю. Основы теории горения. СПб.: Изд-во Политехн. ун-та, 2014.
Файнзильберг А.А., Фурин Г.Г. Фтористый водород как реагент и среда в химических реакциях. М.: Наука, 2008.
Классен П.В., Гришаев И.Г. Основные процессы технологии минеральных удобрений. М.: Химия, 1987.
Маслова А.С., Пашкевич Д.С.// Матер. научн. конф. с междунар. участием “Неделя науки СПбПУ”. Институт прикладной математики и механики. СПб.: Изд-во Политехн. ун-та, 2017. С. 245.
Куколев Г.В. Химия кремния и физическая химия силикатов. М.: Высш. шк., 1966.
Галкин Н.П., Зайцев В.А., Серегин М.Б. Улавливание и переработка фторсодержащих газов. М.: Атомиздат, 1975.
Родин В.И. // Тр. НИУИФ им. Я.В. Самойлова. Получение неорганическихфторидов при переработке фосфатных руд. Вып. 261. М.: ОНТИНИУИФ, 1991.
Левин Б.В., Родин В.И., Громова И.Н. // Тр. НИУИФ. Юбилейный выпуск к 85-летию НИУИФ. М.: МЖ ОНТИ НИУИФ, 2004. С. 262.
Лидин Р.А., Молочко В.А., Андреева Л.Л. Химические свойства неорганических веществ. М.: Химия, 2000.
Некрасов Б.В. Основы общей химии. Т. 1., изд. 3-е., испр. и доп. М.: Химия, 1973.
Люстерник В.Е., Чеховской В.Я., Пелецкий В.Э. // Теплофизика высоких температур. 1999. Т. 37. № 2. С. 226.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика