Химическая физика, 2019, T. 38, № 11, стр. 16-22
Роль водорастворимых форм токсикантов в формировании токсических свойств природных и сточных вод
Е. В. Штамм 1, *, Ю. И. Скурлатов 1, А. В. Рощин 1, В. О. Швыдкий 2, Л. В. Семеняк 3
1 Институт химической физики им. Н.Н. Семёнова Российской академии наук
Москва, Россия
2 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
3 Всероссийский институт рыбного хозяйства и океанографии
Москва, Россия
* E-mail: ekochem@yandex.ru
Поступила в редакцию 29.11.2018
После доработки 21.02.2019
Принята к публикации 20.03.2019
Аннотация
Для раннего распознавания токсических эффектов, возникающих при антропогенном загрязнении объектов окружающей среды, перспективными являются цитогенетические методы, основанные на анализе хромосомных изменений в соматических клетках млекопитающих. Генетические изменения в соматических клетках представляют собой интегральный параметр мутагенного воздействия среды и эффективности иммунной системы организма. В работе метод анализа токсических свойств, основанный на определении частоты и типов хромосомных аберраций при краткосрочном (в течение 2 ч) воздействии тестируемой пробы воды на культуры клеток млекопитающих, использован для изучения токсических свойств природных и сточных вод с различным уровнем антропогеннного загрязнения. Показано, что вклад водорастворимых веществ, которые не извлекаются смесью гексана с этиловым эфиром, в генотоксичность анализируемых нативных проб воды может достигать 50–75%, тогда как вклад органических веществ, экстрагируемых органическими растворителями, может составлять лишь 2–3%. Ключевую роль в формировании токсических свойств природных и сточных вод играют водораствримые соединения восстановленной серы. На примере бенз(а)пирена и 3,3',4,4'-тетрахлорбифенила (РСВ 77) установлено, что генотоксические свойства даже наиболее гидрофобных токсикантов определяются их растворенной формой и могут проявляться, начиная с концентрации в 10 нг/л. Сравнительный анализ с тестом Эймса, широко используемым в практике исследования мутагенной активности различных токсикантов, свидетельствует о гораздо большей информативности и чувствительности цитогенетического метода контроля химической безопасности водных объектов.
ВВЕДЕНИЕ
Литературные данные свидетельствуют [1–19] , что для оценки потенциальной генотоксической опасности, обусловленной присутствием в окружающей среде мутагенных и канцерогенных соединений, наиболее эффективны краткосрочные методы биотестирования in vitro. До последнего времени краткосрочные цитогенетические тесты, основанные на анализе структурных мутаций хромосом, индуцируемых в культурах клеток млекопитающих, использовались лишь для анализа мутагенной и канцерогенной активности индивидуальных химических соединений в стерильной среде. В случае многокомпонентных по своей природе проб природных и сточных вод или водных вытяжек из почв, грунтов, осадков и других источников, анализ которых существен для целей оценки химической безопасности объектов окружающей среды, любая предварительная обработка анализируемой пробы воды, приводящая к изменению ее состава и свойств, крайне нежелательна. В связи с этим одной из задач данного исследования стало изучение возможности цитогенетического анализа нативных (без какой-либо предварительной обработки) проб воды и водных вытяжек.
В работе проведен сравнительный анализ чувствительности и информативности методов определения мутагенной активности проб воды с применением теста Salmonella/микросомы (тест Эймса) и метода цитогенетического анализа с использованием соматических клеток млекопитающих [1] . Тест Эймса широко используется для анализа мутагенной активности индивидуальных загрязняющих веществ [8–11] , а также при биотестировании природных и сточных вод [8, 13, 17] .
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Тест Эймса (сальмонелла/микросомы)
Для тестирования мутагенной активности проб воды и индивидуальных токсикантов в работе использовали два штамма сальмонеллы, имеющие разные мутации в гистидиновом опероне: ТА 98 (hisD-3052) и ТА 100 (hisG-46). Оценку мутагенной активности тестируемых соединений проводили по частоте реверсии к прототрофности в гистидиновом гене (his+). При этом реверсии у штамма ТА 98 возникают при действии агентов, вызывающих мутации типа сдвига рамки считывания генетического кода, тогда как у штамма ТА 100 – типа замены оснований. Оба штамма несут делецию, захватывающую биотиновый оперон и ген uvrB, что повышает их чувствительность к действию мутагенов. Бактерии могут размножаться, пока в культуральной среде присутствует гистидин.
Многие соединения-промутагены – по природе своей не мутагенны, но могут становиться мутагенами и канцерогенами в результате метаболических превращений в организме – в ферментной детоксицирующей системе цитохрома Р-450. У бактерий система метаболической активации ксенобиотиков выражена крайне слабо, поэтому для обнаружения промутагенов в тесте Эймса к суспензии клеток сальмонеллы добавляют метаболическую активирующую смесь (S9-фракцию), содержащую ферментный комплекс цитохрома Р-450 печени крыс. С целью увеличения содержания ферментов в S9-фракции, крыс подвергают воздействию индуктора. Обычно в качестве индуктора используют Arochlor 1254 – смесь полихлорированных бифенилов, фенобарбитала и 5,6-бензофлавона (3-метилхолантрена). Поскольку при активации ферментов печени крыс арохлором отмечается возрастание восстановительной активности цитохрома Р-450, что может сопровождаться появлением в культивируемой среде продуктов активации кислорода, в экспериментах в качестве индуктора мы использовали фенобарбитал, для которого данный эффект не наблюдается.
Если тестируемое вещество или проба воды обладает мутагенностью либо если ферменты фракции S9 воздействуют на данное вещество с образованием метаболитов, обладающих мутагенностью, это выражается в появлении бактерий-мутантов, которые способны синтезировать гистидин из неорганического азота. Вследствие этого каждый мутант со временем образует колонию; количество таких колоний и является учитываемым показателем в тесте Эймса.
В пробирки с верхним агаром (2 мл) вносили 0.1 мл культуры сальмонеллы и 0.1 мл тестируемой пробы. Полученную смесь перемешивали быстрым вращением пробирки и выливали на поверхность рабочего (нижнего) агара. После застывания агара чашку переворачивали вверх дном и инкубировали в темноте при 37 °С в течение 3 сут. В пробы с метаболической активацией помимо культуры и тестируемой пробы вносили по 0.5 мл активирующей смеси.
Схема эксперимента включает в себя анализы с внесением в слой верхнего агара тестируемого соединения в различных концентрациях или пробы воды как в отсутствие добавок микросомальной метаболизирующей смеси, так и в их присутствии. В качестве контроля выступают варианты с внесением в слой верхнего агара с суспензией бактерий дистиллированной воды и микросомальной активирующей смеси. В каждом варианте опыта использовали по 3 чашки Петри.
Чтобы проверить активность S9-фракции, ставили также опыт с “эталонным” промутагеном – аминоантраценом, проявляющим мутагенную активность лишь при метаболической активации S9-фракцией.
Обработка результатов анализа
1. Результаты анализа представляются в виде отношения среднего количества ревертантных his+-колоний сальмонеллы на чашку в опыте к таковому в контроле. Достоверное превышение числа колоний на опытных чашках по сравнению с контрольными свидетельствует о наличии мутагенной активности у исследованных соединений или проб воды.
В зависимости от соотношения этих показателей возможны следующие варианты:
а) если количество колоний на опытных и контрольных чашках различается менее чем в 2 раза, считается, что мутагенной активности не выявлено – проставляется индекс (–);
б) если число колоний на опытных чашках в 2–10 раз больше, чем на контрольных, выявлена слабая мутагенная активность – индекс (+);
в) если число колоний на опытных чашках на один–два порядка превышает таковое на контрольных, выявлена средняя мутагенная активность;
г) если число колоний на опытных чашках более чем в 100 раз превышает количество колоний в контроле, выявлена сильная мутагенная активность.
Данные индексы носят условный характер, так как исследуемая проба воды (токсикант) может обладать острой токсичностью для сальмонеллы.
2. При количественных исследованиях, например при установлении степени мутагенности вещества в зависимости от его концентрации, результаты представляются в виде отношения числа колоний в опыте и контроле.
Модификации стандартной методики теста Эймса
В работе изучена зависимость мутагенной активности штаммов ТА 98 и ТА 100 в отношении бенз(а)пирена (БП, 0.2 мкг на чашку) от концентрации кофакторов – НАДФ и глюкозо-6-фосфата. Из приведенных в табл. 1 данных следует, что мутагенная активность обоих штаммов сохраняется практически неизменной при концентрациях кофакторов, в 10 и 100 раз меньших, чем принято в стандартной методике [1] . В связи с этим в большинстве экспериментов мы брали концентрации кофакторов, в 10 раз меньшие, чем в общепринятой методике.
Таблица 1.
Влияние концентраций кофакторов системы метаболической активации на мутагенную активность бенз(а)пирена
| Концентрации кофакторов | ТА 98 | ТА 100 | ||
|---|---|---|---|---|
| –МА | +МА | –МА | +МА | |
| Согласно стандартной методике | 1.2(–) | 2.27(+) | 0.94(–) | 2.52(+) |
| В 10 раз меньше | 2.29(+) | 2.29(+) | ||
| В 100 раз меньше | 2.67(+) | 2.10(+) | ||
| В 250 раз меньше | 0.79(–) | |||
| В 500 раз меньше | 1.11(–) | |||
| В 1000 раз меньше | 1.08(–) | |||
Согласно литературным данным, при изучении мутагенной активности БП в тесте Эймса в качестве растворителя используется диметилсульфоксид (ДМСО). Сравнительный анализ с использованием в качестве растворителя ДМСО и метанола при концентрации БП 0.2 мкг на чашку показал, что величины отношений числа колоний в опыте и контроле в случае ТА 98 и ТА 100 в пределах ошибок совпадали для обоих растворителей. Поскольку в экспериментах с культурами клеток китайского хомячка ДМСО не применим из-за его токсичности, в качестве растворителя использовали метанол.
Цитогенетический тест на индукцию хромосомных аберраций в культивируемых клетках млекопитающих
При определении мутагенной активности проб объектов окружающей среды в качестве адекватной биологической модели (тест-объекта) были выбраны монослойные перевиваемые культуры клеток китайского хомячка (КХ): фибробласты, выделенные из яичника (СНО), и субклон клеток штамма 237 линии В11diiFAF28, выделенный из соединительной ткани. Преимуществом клеточных культур СНО и клона 237 являются небольшое число хромосом в клетке – 22 и 18, соответственно, и короткий клеточный цикл, расписание которого было четко установлено с помощью введения метки Н3-тимидина [14, 20] . Клетки линии СНО были получены из банка клеточных культур Института медицинской генетики РАМН, клона 237 – из банка культур Института молекулярной генетики РАН. В обоих случаях после размораживания клеточную культуру проверяли на отсутствие микоплазмы. В генотоксических анализах необходимо использовать лишь культуры клеток со стабильным кариотипом, прошедших не более 10 пассажей (циклов деления) после клонирования.
В качестве модельных химических соединений использовались: нитрит натрия, пероксид водорода, БП, 3,3',4,4'-тетрахлорбифенила (PCB 77). Эти вещества сильно различаются по физико-химическим и токсикологическим характеристикам. Натрия нитрит и пероксид водорода – растворимые в воде гидрофильные соединения, которые являются мутагенами прямого действия в разной степени выраженности эффекта генотоксичности; БП и РСВ 77 – практически нерастворимые в воде гидрофобные органические соединения, отнесенные к первому классу опасности. При этом БП известен как промутаген [1, 5–13] , тогда как РСВ 77 – как канцероген прямого действия [15, 16] .
Наиболее чувствительной стадией клеточного цикла является пик репликативного синтеза ДНК (S-фаза) [21]. При использовании клеток КХ эта стадия соответствует их фиксации приблизительно через 10 ч после воздействия тестируемой пробой, причем как гидрофильными, так и гидрофобными химическими соединениями, а выход хромосомных аберраций в клеточной тест-культуре КХ максимален при выдерживании ее в тестируемой среде в течение 2 ч. Этого времени оказывается достаточно для проявления цитотоксического воздействия тестируемой пробы. Возможное при этом биологическое загрязнение клеточной культуры КХ не успевает повлиять на результаты тестирования, что обуславливает возможность анализа нестерилизованных проб воды. Доведение тестируемой пробы воды по осмотическим показателям до параметров физиологического раствора с помощью добавки хлорида натрия позволяет поддерживать условия жизнеспособности в ней клеточной культуры и использовать физиологический раствор в качестве контроля.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ, ПОЛУЧЕННЫХ С ИСПОЛЬЗОВАНИЕМ МОДЕЛЬНЫХ ХИМИЧЕСКИХ СОЕДИНЕНИЙ
В работе проведены исследования по выявлению порога чувствительности методики цитогенетического тестирования по отношению к химическим агентам с различными физико-химическими характеристиками и сравнение полученных данных с результатами тестирования этих же соединений с помощью других методов in vitro [21, 22]. Полученные результаты свидетельствуют, что при воздействии химических соединений на клетки китайского хомячка, находящиеся в S-фазе клеточного цикла, можно регистрировать мутагенный эффект генотоксических агентов, содержащихся в тестируемой водной среде в концентрациях на уровне и даже ниже санитарно-гигиенических требований.
Водорастворимые токсиканты
Нитрит-ион. С помощью предложенной методики цитогенетического тестирования достоверный мутагенный эффект NaNO2 обнаружен при его концентрации в 0.1 мг/дм3, тогда как в экспериментах, поставленных по традиционным схемам, в том числе и с помощью теста Эймса, генотоксичность этого соединения проявляется, начиная с концентрации 100–500 мг/дм3.
Пероксид водорода. При исследовании мутагенной активности пероксида водорода в тесте Эймса в диапазоне его концентраций 10–5–3 · 10–4 М ни при одном значении последних не проявляется мутагенной активности по отношению к штаммам сальмонеллы ТА 98 и ТА 100.
Цитогенетический эффект при воздействии различных концентраций H2O2 на обе линии клеток КХ приведен на рис. 1. Как видно из графиков, чувствительность определения генотоксичности на культурах клеток КХ составляет 3 · 10–6 М для клона СНО и 10–5 М для клона 237. При [Н2О2] = = 10–3 М наблюдался цитотоксический эффект (падал митотический индекс).
Рис. 1.
Цитогенетический эффект при воздействии различных концентраций H2O2: 1 – клон 237, 2 – клетки линии СНО.
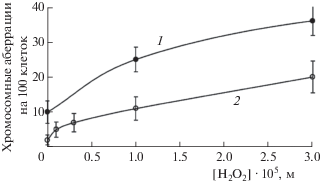
Отсутствие мутагенного эффекта пероксида водорода в тесте Эймса и наличие генотоксического эффекта на клетках КХ, объясняются, по-видимому, наличием в клетках бактерий защитных (регуляторных) ферментных систем (каталаз, пероксидаз) и их отсутствием в перевиваемых культурах клеток. По отсутствию внутриклеточных защитных механизмов от окислительного воздействия пероксида водорода перевиваемые соматические клетки млекопитающих являются аналогами раковых клеток.
Гидрофобные соединения
Бенз(а)пирен. Мутагенная и канцерогенная активность БП хорошо известна [5, 12, 23] . Из табл. 2, в которой приведены собственные и литературные данные по изучению зависимости мутагенной активности штаммов ТА 98 и ТА 100 от концентрации БП, следует, что чувствительность теста Эймса составляет 0.5–1.0 мкг на чашку (200–400 мкг/дм3) для штамма ТА 98 (мутации типа сдвига рамки считывания) и 0.3–0.5 мкг на чашку (120–200 мкг/дм3) для штамма ТА 100 (мутации типа замены оснований).
Таблица 2.
Концентрационная зависимость мутагенной активности бенз(а)пирена в тесте Эймса (штаммы ТА 98 и ТА 100)
| Концентрации БП на чашку | ТА 98 | ТА 100 | ||
|---|---|---|---|---|
| –МА | +МА | –МА | +МА | |
| 0.1 нг (40 нг/л) | 0.64 | 1.37 | 1.22 | 1.09 |
| 1.0 нг (400 нг/л) | 0.89 | 0.95 | 1.23 | 0.80 |
| 10.0 нг (4 мг/л) | 0.86 | 0.90 | 0.71 | 1.30 |
| 0.1 мкг (40 мкг/л) | 0.88 | 1.01 | 0.91 | 1.09 |
| 0.2 мкг (80 мкг/л) | 1.20 | 1.36 (1.08) | 1.00 | 1.50 |
| 0.3 мкг (120 мкг/л) | 0.77 | 1.66 | (1.09) | (2.17) |
| 0.5 мкг (200 мкг/л) | 0.77 | 1.95 (1.73) | 0.84 | 2.31 |
| 1.0 мкг (400 мкг/л) | 0.88 | 2.66 (3.03) | 0.94 (1.07) | 1.09 (6.42) |
| 2.0 мкг (800 мкг/л) | (6.32) | |||
| 3.0 мкг (1.2 мг/л) | 0.79 | 4.26 | (0.93) | (18.77) |
| 5.0 мкг (2 мг/л) | (16.12) | |||
| 6.0 мкг (2.4 мг/л) | (1.03) | (20.77) | ||
| 10.0 мкг (4 мг/л) | 1.09 | 1.56(17.71) | 1.08 | 1.29 |
| 12.0 мкг (4.8 мг/л) | (1.01) | (23.65) | ||
| 18.0 мкг (7.2 мг/л) | (0.99) | (30.51) | ||
| 36 мкг (14.4 мг/л) | (0.95) | (29.90) | ||
Особо следует отметить тот факт, что в тесте Эймса в отсутствие метаболической активации БП мутагенных свойств не проявляет, вследствие чего до сих пор он считался исключительно промутагеном. В то же время при применении модифицированного цитогенетического метода достоверно фиксируется генотоксическое воздействие БП не как промутагена, а как мутагена прямого действия, причем в сверхмалых концентрациях – на уровне 10 нг/дм3 [23].
Тетрахлорбифенил. По нашим данным, в тесте Эймса при концентрациях от 0.01 (4 мкг/дм3) до 0.1 мг на чашку (40 мг/дм3) РСВ 77 не оказывает мутагенного эффекта на штаммы ТА 98 и ТА 100 ни как прямой мутаген, ни при добавлении S-9-фракции. В то же время при использовании в качестве тест-объекта клеток КХ в случае РСВ 77 в диапазоне концентраций от 10 нг/дм3 до 3 мкг/дм3 получена четкая зависимость “доза–эффект” (рис. 2).
Рис. 2.
Зависимость цитогенетического эффекта от концентрации тетрахлорбифенила при фиксации клеток клона 237 через 10 ч.
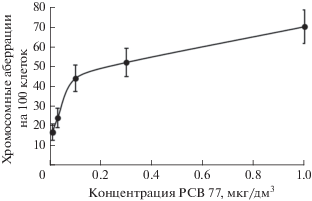
Таким образом, как следует из представленных данных, по сравнению с предложенным методом цитогенетического тестирования тест Эймса оказывается на порядки менее чувствительным и информативным в отношении как гидрофильных, так и гидрофобных токсикантов.
Вклад водорастворимых компонентов в генотоксичность нативных проб природных и сточных вод
С помощью модифицированного нами цитогенетического метода открывается возможность оценки мутагенной активности нативных проб (без какой-либо предварительной обработки) не только природных, но и сточных вод, которые имеют высокий уровень как химического, так и биологического загрязнения. При этом единственным, но обязательным условием анализа тестируемой пробы воды на генотоксичность является доведение ее до параметров изотонического раствора с помощью добавки натрия хлорида из расчета 0.9 г на 100 см3. В этой среде тест-культуру клеток выдерживают в течение 2 ч, а затем вновь возвращают в питательную среду. Для получения цитогенетического эффекта воздействия веществ, содержащихся в анализируемых пробах воды, фиксацию клеток осуществляли, как и в случае с модельными растворами, через 10 ч.
Оценка вклада водорастворимых и извлекаемых с помощью смеси органических растворителей (гексан – диэтиловый эфир) компонентов природных и сточных вод в суммарную генотоксичность нативных проб воды проведена на примере проб воды из р. Протвы и очищенных хозяйственно-бытовых сточных вод г. Обнинска. При изучении мутагенного влияния водорастворимых ингредиентов пробы воды фильтровали через мембранные фильтры ∅ 0.22 и 0.45 мкм, а вклад в суммарную токсичность гидрофобных органических соединений оценивали, тестируя органические экстракты фильтратов – эфирорастворимые вещества (ЭРВ), извлекаемые смесью гексан – диэтиловый эфир.
На основе предварительно проведенных исследований в качестве растворителя для растворения сухих остатков органических экстрактов был выбран метанол при его содержании в тестируемой среде не более 1% по объему. Процедура биотестирования экстрактов ЭРВ включает в себя растворение экстракта в 1 см3 метанола и добавление 0.05 см3 полученного метанольного раствора к 4.95 см3 физиологического раствора.
На рис. 3 приведена зависимость выхода хроматидных аберраций в клетках КХ клона 237 от концентрации экстракта, полученного из воды реки Протвы. На графике четко прослеживается практически пропорциональная зависимость “доза–эффект”. Если бы генотоксический эффект нативной пробы воды был обусловлен только присутствием в ней ЭРВ, то количество сухого остатка последних в тестируемой среде должно было бы находиться на уровне 200 мкг. Однако концентрация ЭРВ в анализируемой пробе речной воды составляет всего 0.6 мг/дм3, и, соответственно, в 5 см3 анализируемой нативной пробы воды содержится лишь 3 мкг ЭРВ. Таким образом, наблюдаемый генотоксический эффект нативной пробы воды не может быть обусловлен присутствием в воде ЭРВ. Относительный вклад ЭРВ в токсичность данной пробы составляет менее 2%. В то же время вклад растворимых веществ, не экстрагируемых смесью гексан – диэтиловый эфир, достигает 75%.
Рис. 3.
Влияние экстракта речной воды на выход хроматидных аберраций в клетках КХ клона 237 после 2 ч выдерживания метанольного раствора в тестируемой среде с последующей фиксацией через 10 ч (р. Протва).
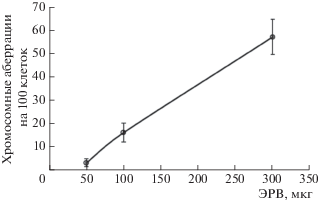
Важность полученного результата трудно переоценить, поскольку вклад водорастворимых веществ, не экстрагируемых органическими растворителями, как правило, вообще не учитывается при оценке качества воды водных объектов – как природных, так и сточных вод. В нормативы качества воды заложено в основном содержание в воде гидрофобных органических соединений, измеряемых методами высокоэффективной жидкостной хроматографии, газо-жидкостной хроматографии или хромато-масс-спектрометрически, и брутто-содержание тяжелых металлов, измеряемых, как правило, методами атомно-абсорбционной спектроскопии. При этом возможный вклад в токсичность растворимых в воде веществ не контролируется (использование методов биотестирования носит лишь рекомендательный характер).
При исследовании цитогенетического воздействия нативных и отфильтрованных через мембранный фильтр проб природных и сточных вод доля хромосомных аберраций, вызванных растворенными в воде анализируемой пробы токсикантами, составляла [23]: р. Протва (весенний паводок) – 90%, р. Протва (летняя межень) – 56–60%, сточная вода (г. Обнинск) – 50%, т.е. вклад неконтролируемых водорастворимых токсикантов в суммарную токсичность как природных, так и сточных вод составляет не менее 50%.
Вопреки узаконенному санитарно-гигиеническими нормативами мнению, что токсичность воды определяется содержанием в воде контролируемых методами аналитического контроля “приоритетных” токсикантов, наш многолетний опыт работы, в том числе в критических экотоксикологических ситуациях, показывает, что ключевую роль в формировании токсических свойств природной водной среды могут играть неконтролируемые водорастворимые соединения, главным образом соединения восстановленной серы, эффективно взаимодействующие с Н2О2 и инертные по отношению к О2 [24–27].
ВЫВОДЫ
1. При токсикологической оценке качества водной среды, включая питьевые, природные и сточные воды, показана высокая чувствительность модифицированного нами метода цитогенетического тестирования, основанного на анализе частоты индуцированных хромосомных аберраций в клетках млекопитающих (in vitro).
2. Предложенная методика позволяет регистрировать мутагенный эффект генотоксического воздействия известных токсикантов в концентрациях на уровне и ниже санитарно-гигиенических требований. Например, достоверный мутагенный эффект воздействия 3,3',4,4'-тетрахлобифенила (РСВ 77) регистрируется на уровне его концентраций 0.01 мкг/дм3.
3. Показано, что гидрофобные, малорастворимые или даже практически нерастворимые в воде органические вещества, обладают мутагенной активностью, находясь в растворенной форме. В частности, обнаружен прямой цитотоксический эффект воздействия сверхнизких концентраций бенз(а)пирена (~10 нг/л), ранее известного в литературе как промутагенное соединение.
4. Предложенная в работе процедура цитогенетического анализа может использоваться для определения мутагенной активности нативных (без предварительной обработки) проб воды.
5. Показано, что наиболее существенный вклад в генотоксичность водных объектов (до 75%) вносят водорастворимые компоненты природной водной среды, тогда как вклад органических соединений, которые извлекаются с помощью органических растворителей, может составлять лишь 2–3%. Тем не менее приоритет в системе контроля качества воды отдан гидрофобным органическим соединениям, что обесценивает информативность используемых в системе экологического мониторинга методов контроля качества воды.
6. Среди водорастворимых соединений ключевую роль в формировании токсических свойств природных и сточных вод играют неконтролируемые органами контроля соединения восстановленной серы, эффективно взаимодействующие с Н2О2 и инертные по отношению к О2.
Работа выполнена в рамках Программы фундаментальных исследований ИХФ РАН № 46.15 государственного задания № 0082-2014-0005. Номер государственной регистрации ЦИТИС: АААА-А17-117091220076-4.
Список литературы
Руководство по краткосрочным тестам для выявления мутагенных и канцерогенных химических веществ. Сер. “Гигиенические критерии состояния окружающей среды 51”. Женева: ВОЗ, 1989.
Scott D., Galloway S.M., Marshall R.R. et al. // Mutat. Res. 1991. V. 257. № 2. P. 147.
Ishidate M.J., Harnois M.C., Sofuni T. // Ibid. 1988. V. 195. № 2. P. 151.
Dean B.J., Danford N.D. // Mutagenicity testing: a practical approach / Eds. Venitt S., Parry J.M. Oxford: IRL Press, 1985. P. 187.
Ishidate M.J. Chromosomal aberration test in vitro. Tokyo: L.I.C. Inc., 1987.
Matsuoka A., Ozaki M., Takeshita K. et al. // Mutagenesis. 1997. V. 12. № 5. P. 365.
Whitehead F.W., San R.H., Stich H.F. // Mutat. Res. 1983. V. 111. № 2. P. 209.
Ames B.N., Mccann J., Yamasaki E. // Ibid. 1975. V. 31. P. 347.
Balimandawa M., De Meester C., Leonard A. // Ibid. 1994. V. 321. P. 7.
Maron D.M., Ames B.N. // Ibid. 1983. V. 113. P. 173.
Levin D.E., Marnett L.J., Ames B.N. // Proc. Natl Acad. Sci. USA. 1984. V. 81. P. 4457.
Pagano D.A., Zeiger E. // Evaluation of short term tests for carcinogens. Report of the international programme on chemical safety’s collaborative study on in vitro assays. WHO / Ed. Ashby J. V. 1. UNBP ILO, 1988. P. 2.332.
Waters L.C., Schenley R.L., Owen B.A. et al. // Environ. Mol. Mutagen. 1989. V. 14. № 4. P. 254.
Christian L.B., Galloway S.M. // Mutat. Res. 1993. V. 292. P. 3.
Silberhorn E.M., Glauert H.P., Robertson L.W. // Crit. Rev. Toxicol. 1990. V. 20. P. 440.
Hsia M.T.S., Lin F.S.D., Allen J.R. // Res. Commun. Chem. Pathol. Pharmacol. 1978. V. 21. P. 485.
Vartiainen T., Liimatainen A. // Mutat. Res. 1986. V. 169. P. 29.
Wigilius B., Boren H., Grimvall A. et al. // Total Environ. 1988. V. 74. P. 75.
Galloway S.M., Aardema M.J.A., Ishidate M.J. et al. // Mutat. Res. 1994. V. 312. P. 241.
Захаров Н.Ф., Какпакова Е.С., Еголина Н.А. // Цитология. 1966. Т. 8. С. 193.
Skurlatov Yu.I., Ernestova L.S., Shtamm E.V., Yaske-vich G.F., Sevan’kaev A.V. // Proc. Conf. ConSoil 2000. V. 2. London: Thomas Telford Ltd., 2000. P. 418.
Callander R.D., Ashby J. // Evaluation of short term tests for carcinogens. Report of the international programme on chemical safety’s collaborative study on in vitro assays. WHO / Ed. Ashby J. V. 1. UNBP ILO, 1988. P. 2.329.
Штамм Е.В., Скурлатов Ю.И., Эрнестова Л.С. и др. // Хим. физика. 2017. Т. 36. № 8. С. 14.
Shtamm E.V., Frog B.N., Skurlatov Yu.I. et al. // Acta Hydrochim. et Hydrobiol. 2002. V. 30. № 5–6. P. 256.
Штамм Е.В., Скурлатов Ю.И., Козлова Н.Б. и др. // Водные ресурсы. 2011. Т. 38. № 1. С. 237.
Фрог Б.Н., Скурлатов Ю.И., Штамм Е.В., Вичутинская Е.В. // Вестн. МГСУ. 2012. № 6. С. 105.
Штамм Е.В., Скурлатов Ю.И., Швыдкий В.О. и др. // Хим. физика. 2015. Т. 34. № 6. С. 22.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


