Химическая физика, 2019, T. 38, № 12, стр. 48-53
Комплексы наноразмерных алмазов с кумарином: спектрально-люминесцентные свойства и взаимодействие с макрофагами
Н. Г. Бердникова 1, 2, А. Е. Донцов 1, М. В. Ерохина 3, П. П. Зак 1, В. А. Лапина 4, А. Г. Масютин 3, В. А. Меньшов 1, В. В. Наумов 1, Г. Е. Онищенко 3, Т. А. Павич 4, П. П. Першукевич 4, Н. Л. Сакина 1, А. В. Трофимов 1, 5, *, Н. Н. Трофимова 1, Ю. Б. Цаплев 1, О. И. Яблонская 1
1 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
2 Первый Московский государственный медицинский университет им. И.М. Сеченова
Министерства здравоохранения Российской Федерации
Москва, Россия
3 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
4 Институт физики им. Б.И. Степанова Национальной академии наук Беларуси
Минск, Беларусь
5 Московский физико-технический институт
Долгопрудный, Московской обл., Россия
* E-mail: avt_2003@mail.ru
Поступила в редакцию 05.06.2019
После доработки 05.06.2019
Принята к публикации 20.06.2019
Аннотация
Представлены модельные исследования комплексов Кумарина 343 с наноразмерными алмазами детонационного синтеза. Образование комплексов молекул кумарина с алмазными наночастицами за счет ковалентных связей приводит к заметному изменению их спектрально-люминесцентных свойств, позволяющему различать поведение свободного красителя и связанного люминофора в изучаемых объектах, в том числе в клеточных культурах. Эксперименты с культурой острой моноцитарной лейкемии человека показали, что изученные алмазные нанокомплексы легко захватываются клетками и визуализируются в них, и, таким образом, подобные комплексы можно применять для переноса фотоуправляемых реагентов, а в перспективе – новых лекарств.
ВВЕДЕНИЕ
Развитие нанотехнологий дало новый импульс к созданию высокотехнологичных материалов с уникальными свойствами и поиску сфер их эффективного применения. Одна из таких сфер – биомедицинская оптика со стоящими перед ней задачами диагностики и лечения целого ряда социально значимых заболеваний. Среди материалов, разрабатываемых для этой области, следует выделить материалы с оптически управляемыми свойствами на основе углеродных наночастиц, в том числе наночастиц алмазов, прежде всего детонационного синтеза [1, 2]. Свойства наноразмерных алмазов детонационного происхождения представляют значительный интерес во многих аспектах [3] из-за их разнообразных применений. Алмазные наночастицы малотоксичны, имеют относительно большую поверхность и сравнительно легко функционализируются, что позволяет рассматривать их в качестве перспективных материалов для биомедицинских приложений. В настоящей работе представлены модельные исследования нанокомплексов алмазов с Кумарином 343, применяемым в качестве люминесцирующего красителя. Современные области исследования, в которых используется данный люминофор, отличаются большим разнообразием – от создания биоаналитических и биосенсорных методов и технологий [4] до разработки новых люминесцентных спектральных преобразователей для современных источников света [5, 6]. Кумарин 343 оказался удобен для настоящего исследования не в последнюю очередь благодаря наличию в нем карбоксильной группы, способствующей конъюгированию с алмазными наночастицами, обладающими аминогруппами.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приготовление образцов. Синтез алмазных нанокомплексов Кумарина 343 осуществлялся по отработанным ранее методикам [7–10] c использованием ультрадисперсных синтетических алмазов марки “УДА-СП” НП ЗАО “Синта” (Минск, Беларусь).
Спектральные измерения. Спектры люминесценции измеряли на спектрофлуориметре Lambda 55, электронные спектры поглощения – с помощью спектрофотометра Lambda 25 (оба спектрометра производства фирмы “PerkinElmer Inc.”, США). Регистрацию спектров ЭПР экспериментальных образцов проводили на ЭПР-спектрометре Bruker EMX (Германия).
Работа с клетками. В работе использовались клетки острой моноцитарной лейкемии человека линии ТНР-1 (Российская коллекция клеточных культур). Для культивирования THP-1 использовали среду RPMI-1640 с добавлением 2 мМ L-глутамина, 10%-ной эмбриональной телячьей сыворотки (HyClone, США). Флаконы с клеточной суспензией инкубировали в СО2-инкубаторе при температуре 37 °С и 5% СО2. При высокой численности клетки склонны образовывать агрегаты, которые легко распадаются при встряхивании флакона. Активно пролиферирующие клетки нуждаются в частичной смене среды каждые 2–3 дня.
Макрофагальную дифференцировку клеток культуры THP-1 индуцировали путем добавления форболового эфира (Sigma-Aldrich, США). Принцип действия последнего до конца не известен, но предполагается, что он имитирует сигнальные молекулы, которые взаимодействуют с внутренним слоем плазматической мембраны и запускают каскад протеинкиназы С. В процессе необратимой дифференцировки клетки из суспензии оседают на субстрат, прикрепляются к нему и приобретают веретеновидную форму. В данной работе использовался форболовый эфир с концентрацией 10–4 М в исходном растворе и 10–7 М – в экспериментальных образцах.
Электронная и световая микроскопия. Для получения клеточного лизата, содержащего алмазные нанокомплексы, клетки рассаживали в культуральные флаконы в количестве 5 ⋅ 105 клеток на 1 мл (2.5 ⋅ 106 клеток на флакон) в присутствии форболового эфира с концентрацией 10–7 М. На 3-й день дифференцировки во флаконы добавляли суспензию алмазных наночастиц для получения концентрации в 250 мкг/мл. Спустя 10 сут культивирования ростовую среду, содержащую непоглощенные наночастицы, отбирали, клетки открепляли от субстрата, добавляя раствор трипсина на буфере Версена в соотношении (1 : 3) по 1 мл на флакон. Полученную суспензию клеток центрифугировали при 2750 об/мин в течение 30 мин для осаждения клеток. После удаления супернатанта преципитат переносили в микропробирку, к осадку прибавляли 500 мкл дистиллированной воды и встряхивали на вортексе в течение 5 мин для разрушения клеток осмотическим шоком. Клеточный лизат затем центрифугировали при 104 об/мин и удаляли супернатант. Далее нагревали в термостате до 85 °С в течение получаса для разрушения остатков клеточных компонентов и несколько раз отмывали дистиллятом с последующим центрифугированием и отбором супернатанта.
Суспензию наночастиц объемом 10 мкл помещали на медную сетку, покрытую формваровой пленкой и высушивали при комнатной температуре в течение суток. Полученные препараты исследовали (в том числе методом дифракции электронов) с помощью аналитического электронного микроскопа JEM 2100 (Jeol, Япония).
Исследование ультраструктуры клеток THP-1, содержащих поглощенные алмазные нанокомплексы, проводили по стандартной методике. Клетки рассаживали в чашки Петри со стеклами в количестве 5 ⋅ 105 клеток на 1 мл (106 клеток на чашку) в присутствии форболового эфира в концентрации 10–7 М. На 3-й день дифференцировки во флаконы добавляли суспензию алмазных наночастиц для получения концентрации 250 мкг на 1 мл. Спустя десять суток культивирования ростовую среду, содержащую непоглощенные наночастицы, отбирали, промывали клетки 0.1 М фосфатным буфером (pH 7.2–7.4) и фиксировали глутаровым 2.5%-ным альдегидом (Ted Pella, INC) на 0.1 М фосфатном буфере в течение 2 ч. Далее отмывали от фиксатора и дофиксировали 1%-ным раствором тетраоксида осмия (OsO4) в течение 2 ч при 4 °С. Обезвоживание образцов проводили в спиртах восходящей концентрации и ацетоне, после чего заключали в эпоксидную смолу. Срезы с полученных блоков получали на ультрамикротоме (Leica, Германия) и окрашивали по Рейнольдсу. Полученные препараты исследовали с помощью трансмиссионного электронного микроскопа (ТЭМ) JEM 2100. Для получения ТЭМ-изображений использовали программное обеспечение Gatan. Изображения клеточной культуры были получены путем световой микроскопии с помощью DIC-микроскопа компании Leica (объектив с увеличением 40×, апертура – 0.5 HI plan).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Спектральные свойства комплексов Кумарина 343 с наноразмерными алмазами
На рис. 1 приведены спектры поглощения образцов Кумарина 343 и его комплексов с наноразмерными алмазами, а также спектры возбуждения флуоресценции тех же образцов. Спектры флуоресценции Кумарина 343 и его алмазных нанокомплексов показаны на рис. 2.
Рис. 1.
a – Спектры поглощения: 1 и 2 – Кумарин 343 в фосфатном буфере (рН 7.4) в присутствии 5% ДМСО и в этаноле соответственно; 3 – конъюгат Кумарина 343 с наноразмерным алмазом в фосфатном буфере (рН 7.4) в присутствии 5% ДМСО; 4 – наноразмерный алмаз в фосфатном буфере (рН 7.4 ) в присутствии 5% ДМСО; б – спектры возбуждения флуоресценции: 1 и 2 – Кумарин 343 в фосфатном буфере (рН 7.4) в присутствии 5% ДМСО и в этаноле соответственно (при длине волны регистрации λрег = 525 нм); 3 – конъюгат Кумарина 343 с наноалмазом в фосфатном буфере (рН 7.4) в присутствии 5% ДМСО, λрег = 500 нм.
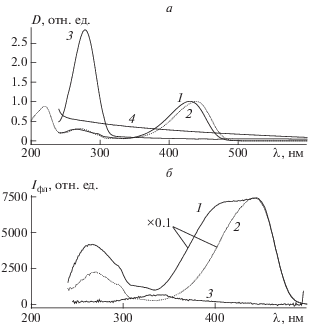
Рис. 2.
a – Спектры флуоресценции: 1 и 2 – Кумарин 343 в фосфатном буфере (рН 7.4) в присутствии 5% ДМСО и в этаноле соответственно; 3 – конъюгат Кумарина 343 с наноразмерным алмазом в фосфатном буфере (рН 7.4) в присутствии 5% ДМСО (при длине волны возбуждения λвозб = 310 нм); б – спектры флуоресценции: 1 – Кумарин 343 в этаноле, 2 – конъюгат Кумарина 343 с наноразмерным алмазом в фосфатном буфере (рН 7.4) в присутствии 5% ДМСО (λвозб = = 370 нм).
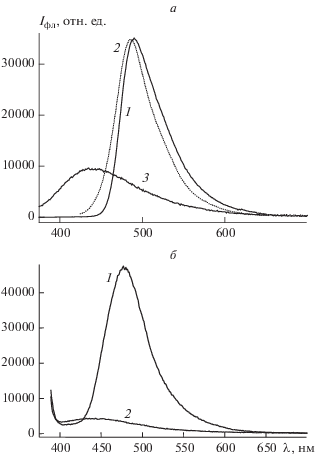
Из приведенных на рис. 1а спектров поглощения видно, что произошли существенные изменения в системе при комплексообразовании: наблюдаются сдвиги спектральных полос и исчезновение пика поглощения в области 420 нм, что свидетельствует об образовании новых оптических центров в изучаемых образцах. Приведенные спектры возбуждения (рис. 1б) и испускания (рис. 2) флуоресценции также указывают на существенные изменения в природе излучающих центров при комплексообразовании.
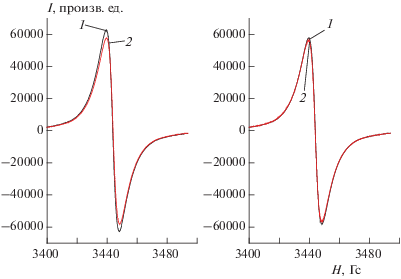
На рис. 3 показаны спектры ЭПР исследовавшихся в настоящей работе алмазных нанокомплексов с Кумарином 343 без освещения и при освещении ртутно-кварцевой лампой ДРШ-1000 через светофильтры УФС-5 (250–380 нм) и БС-6 (>320 нм) в течение 8 мин, и, как видно, существенного различия в этих спектрах не наблюдается. Таким образом, облучение алмазных нанокомплексов не влияет на сигналы ЭПР (последние связывают с наличием дефектов в структуре синтетических алмазных частиц детонационного происхождения [11]) и, следовательно, не приводит к появлению новых парамагнитных центров.
Характеристика наноразмерных алмазов и клеточной культуры по данным электронной микроскопии
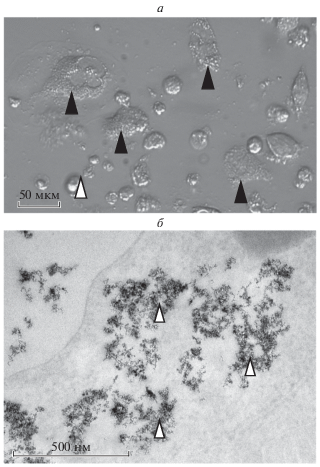
Образцы алмазных наночастиц представляют собой порошки серого цвета. Диаметры отдельных наночастиц составляют от 4 до 25 нм. В воде наночастицы формируют неустойчивую суспензию и оседают примерно через 5 мин после суспендирования. Также алмазные наночастицы могут образовывать агрегаты, как видно из рис. 4а. Кристаллическая решетка наноразмерных алмазов хорошо видна на рис. 4б.
Рис. 4.
a – Внешний вид алмазных наночастиц, б – кристаллическая решетка наноразмерных алмазов (слева) с кольцами электронограммы (справа). Трансмиссионная аналитическая электронная микроскопия.

Клеточная культура ТНР-1 – суспензионная культура, использующаяся для моделирования процессов фагоцитоза. Клетки в суспензии размерами 10–20 мкм имеют шарообразную форму (не показаны). В суспензии присутствуют преимущественно одиночные клетки, способные, тем не менее, агрегироваться в кластеры. Добавление форболового эфира к суспензии клеток в итоговой концентрации (10–7 М) индуцирует макрофагальную дифференцировку, клетки прикрепляются к субстрату, распластываются и формируют отростки. На третьи сутки после добавления форболового эфира в культуральную среду наблюдаются многочисленные адгезировавшие клетки. Также часть клеток может приобретать вытянутую, часто веретеновидную форму и иметь длинные отростки либо распластанную округлую форму без отростков. Часть клеток сохраняет моноцитоподобную форму.
Внутриклеточная локализация алмазных наночастиц
На десятые сутки после инкубации клеток с алмазными наночастицами стало видно, что клетки имеют морфологию, несколько отличающуюся от морфологии контрольных макрофагов – большая часть клеток имеет сильно зернистую цитоплазму, клетки приобретают более округлую форму. Также наблюдались крупные агрегаты непоглощенных наночастиц (рис. 5а). На снимках срезов клеток, полученных с помощью ТЭМ, видны поглощенные макрофагами алмазные наночастицы (рис. 5б).
Рис. 5.
а – Клетки линии ТНР-1 на десятые сутки инкубации с суспензией алмазных нанокомплексов с Кумарином 343 (темными стрелками показаны клетки, светлой – агрегат наночастиц); б – интернализированные наночастицы (стрелками показаны кластеры алмазных нанокомплексов с Кумарином 343. Трансмиссионная электронная микроскопия.
Итак, в работе установлено, что алмазные наночастицы эффективно фагоцитируются макрофагами и легко детектируются внутри клеток.
ЗАКЛЮЧЕНИЕ
Комплексообразование наноразмерных алмазов с Кумарином 343 приводит к существенному изменению спектрально-люминесцентных свойств люминофора, позволяющему различать его свободные и связанные молекулы в разнообразных системах, включая живые клетки. Эффективное фагоцитирование изученных в настоящей работе нанокомплексов клетками и их легкая визуализация внутри клеток говорят о том, что такие комплексы можно использовать для переноса в клетки фотоуправляемых агентов, включая терапевтические.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (грант № 18-53-00038 Бел_а) и Белорусского республиканского фонда фундаментальных исследований (грант № Ф18Р-206).
Список литературы
Пепекин В.И. // Хим. физика. 2010. Т. 29. № 9. С. 52.
Анисичкин В.Ф. // Хим. физика. 2016. Т. 35. № 6. С. 30.
Гурьев Д.Л. // Хим. физика. 2018. Т. 37. № 11. С. 57.
Olszyna M., Debrassi A., Üzum C. et al. // Adv. Funct. Mater. 2019. V. 29. 1805998.
Lapina V.A., Pavich T.A., Pershukevich P.P. et al. // J. Phys. Org. Chem. 2017. V. 30. № 9. e3731.
Зак П.П., Лапина В.А., Павич Т.А. и др. // Успехи химии. 2017. Т. 86. № 9. С. 831.
Hannstein I., Mkandawire M., Rodel G. et al. // Materialpruefung. 2009. V. 51. № 10. P. 659.
Лапина В.А., Воробей А.В., Павич Т.А. и др. // ЖПС. 2013. Т. 80. № 3. С. 427.
Лапина В.А., Бушук С.Б., Павич Т.А. и др. // Там же. 2016. V. 83. № 3. С. 347.
Лапина В.А., Павич Т.А., Першукевич П.П. // Оптика и спектроскопия. 2017. Т. 122. № 2. С. 76.
Самсоненко Ч.Д., Соболев Е.В. // Письма в ЖЭТФ. 1967. Т. 5. Вып. 6. С. 304.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика