Химическая физика, 2019, T. 38, № 12, стр. 44-47
Новые метки и зонды для решения задач бионанофотоники
О. В. Демина 1, Н. Е. Беликов 1, И. А. Мельникова 1, А. Ю. Лукин 2, С. Д. Варфоломеев 1, А. А. Ходонов 1, *
1 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
2 МИРЭА – Российский технологический университет
Москва, Россия
* E-mail: khodonov@gmail.com
Поступила в редакцию 05.06.2019
После доработки 05.06.2019
Принята к публикации 20.06.2019
Аннотация
Кратко рассмотрены перспективы и принципы создания новых типов меток и зондов для бионанофотоники, их методы получения и процедуры маркирования мишеней различной природы.
При исследованиях механизмов действия небольших биологически активных молекул-лигандов (как природного, так и синтетического происхождения) центральное место занимает природа процесса взаимодействия низкомолекулярного лиганда со своим специфичным рецептором-мишенью (ферментом, GPCR, ядерным рецепторами или определенными сайтами последовательностей нуклеиновых кислот). Неоценимую помощь при определении как места связывания, так и степени его эффективности оказывает ставший на сегодняшний день стандартным прием – введение в молекулу лиганда меток или маркеров различного рода и анализ процесса связывания с генерированием определенного физического сигнала, пропорционального количеству связанного меченого лиганда.
Основные типы меток и маркеров, применяемых для проведения биомедицинских исследований, можно разделить на две большие группы: радиоактивные (3Н-, 14С- и 32Р-изотопы) и нерадиоактивные. Среди последней группы можно также выделить следующие типы меток: стабильные (нерадиоактивные) изотопы (2Н-, 13С-, 15N-, 19F-изотопы и др.); хромогенные, флуоресцентные, спиновые, электроноплотные и фотохромные.
В настоящее время метки второй группы постепенно вытесняют радиоизотопные по ряду следующих причин: безопасность использования, высокая стоимость и проблемы с хранением и стабильностью меток первой группы. Различают также метки и зонды. Метки пассивно измеряют содержание или месторасположение в объекте исследования той молекулы, к которой они прикреплены. Зонды предназначены для тестирования свойств ближнего окружения, конформационных изменений, полярности мембранных систем, присутствия ионов металлов или других агентов и веществ.
Разработан целый ряд физических и спектральных методов для измерения и анализа уровня аналитического сигнала. Для первой группы меток – это измерение уровня радиоактивности, а для других типов – измерение поглощения в определенном спектральном диапазоне, индукция или гашение флуоресценции или хемилюминесценции, измерение вида и параметров ЭПР- и ЯМР-спектров. Развитие и совершенствование существующих аналитических систем с использованием меченых субстратов позволяют на сегодняшний день проводить надежное определение содержания метки в системе в диапазонах концентраций от 10–6–до 10–15 моля. Термин “фотохромные метки” был впервые предложен проф. Г. Лихтенштейном в 80-х годах [1].
Дизайн и разработка эффективных методов получения новых гибридных молекулярных структур и систем, содержащих фрагменты фотохромов в качестве активного рабочего элемента, характеристики которых существенно изменяются под действием света, представляют особый интерес для бионанофотоники и наномедицины. Перспективный способ разработки таких гибридных фотоактивных и фотоуправляемых систем и материалов заключается в ковалентном связывании фотохромных меток с помощью ковалентной “иммобилизации” на различных субстратах, например полимерах, липидах, белках и квантовых точках. Для реализации этой процедуры необходима разработка нового поколения фотохромных меток и зондов, содержащих заместители с соответствующими типами функциональных групп.
В качестве исходных соединений для синтеза фотохромных меток и зондов нами были выбраны производные спиропиранов, молекулы которых было необходимо модифицировать для придания им способности к ковалентному или нековалентному (лиганд-специфичному) взаимодействию с различными типами мишеней путем введения в определенное положение разнообразных реакционноспособных терминальных групп или молекулярных адресов. Дополнительным преимуществом фотохромных меток на основе спиропиранов является то обстоятельство, что они обладают бинарным набором двух разных типов аналитических сигналов (поглощение в области 560–600 нм и индукция флуоресценции у фотоиндуцированной мероцианиновой формы). Индолиновые спиробензопираны – один из наиболее изученных и перспективных классов фотохромных соединений. Спектральные свойства и параметры их фотопревращений сильно зависят от имеющихся в молекуле заместителей таким образом, что направленное изменение их природы позволяет проводить поиск новых фотохромов с заданными свойствами и различными стимул-реагирующими структурными элементами. Структура потенциальных целевых мишеней определяет природу реакционноспособной якорной группы. В настоящее время достигнут существенный прогресс в синтезе и изучении свойств полифункциональных фотохромных органических соединений из класса спиропиранов [2–8]. Для последних ранее были известны работы по модификации уже готового исходного фотохромного звена, но структурное разнообразие молекул было ограничено и создавалось в основном путем введения соответствующего амфифильного спейсера по атому азота индолинового фрагмента кватернизацией галогенпроизводным с различной структурой. Для создания молекул фотохромных меток с заданными спектральными и фотохимическими параметрами также необходимо введение дополнительного электроноакцепторного заместителя (EWG), например нитрогруппы по 6-положению молекулы.
В 2019 г. исполнилось 14 лет с начала “эры оптогенетики” (нейробиофотоники) – использования генетически кодируемых фоточувствительных белков для регуляции активности клеток человека и животных. Особенности этой технологии открывают новое направление для получения фотопереключаемых фотоактивных компонентов для оптогенетики на основе микробных родопсинов и других фоточувствительных белков с заданными и/или прогнозируемыми спектрально-кинетическими параметрами. Особые перспективы подобные системы маркирования имеют при замене пока еще широко применяемых радиоактивных меток на более безопасные фотохромные; при разработке целого ряда прототипов технических смарт-устройств на основе меченых белков в бионанофотонике и сенсорных технологиях; при использовании в качестве средств визуализации различных бионанообъектов в реальном времени и в многопараметрических (многоцветных) системах, а также в качестве фотоуправляемых средств контроля строения и функции бионанообъектов (фотохромные сшивки, многопараметрические протоколы гибридизации нуклеиновых кислот, фотоуправляемые средства доставки биологически активных соединений и др.) [см. 2, 5, 6, 9–11].
Нами впервые был проведен достаточно широкий поиск оригинальных фотохромных систем с новыми функциональными возможностями и были разработаны оригинальные эффективные методы синтеза и модификации компонентов для получения целевых фотоактивных меток. Ранее нами были изучены процесс формилирования спиробензопиранов в условиях реакции Даффа и влияние различных заместителей в пирановом цикле на ее региоселективность. Было обнаружено, что формилирование по Даффу фотохромных спиропиранов, обладающих электроноакцепторными заместителями в пирановой части молекулы (R: 6-NO2, 8-NO2, 6-CHO, 6-CO2Et, 6-CO2H), проходит в основном по C5'-положению индольного фрагмента. Таким образом, нами был разработан новый метод синтеза серии ключевых карбонильных предшественников прямым формилированием 6-нитроспиропирана или его производных в одну стадию в условиях реакции Даффа [12, 13]. Далее нами был исследован и существенно расширен потенциал синтетического применения 6-нитро-5'-формилспиропирана для направленной модификации молекулы фотохрома по С5'-положению с использованием набора хорошо известных реакций: олефинирования по Виттигу и Хорнеру–Эммонсу; нуклеофильного присоединения по карбонильной группе реагентами, обладающими активной метильной или метиленовой группами; восстановительного аминирования; реакции [3+2]-циклоприсоединения, восстановления и последующей этерификации и других [12–17] (см. рис. 1).
Рис. 1.
a – Схема фотопревращений индолиновых спиропиранов (SP); б – основные направления дизайна молекул фотохромных зондов и меток.
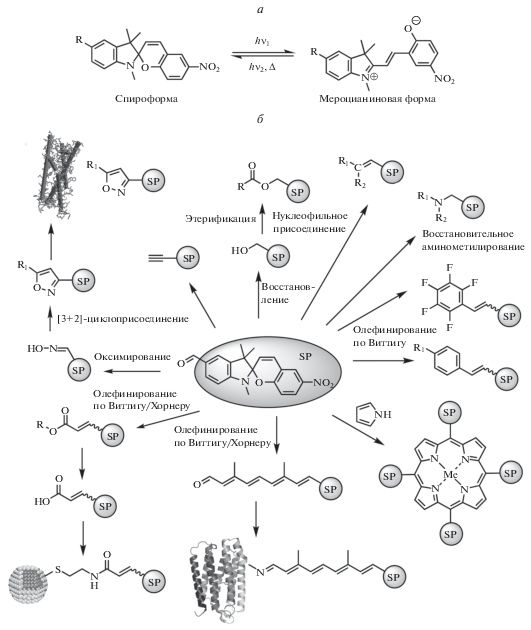
В результате данного исследования нами был разработан ряд методов синтеза новых производных 5'-замещенных спиробензопиранов, содержащих заданные целевые реакционноспособные якорные группы с помощью прямых процедур введения заместителей [12–24]. Выбор целевой реакционноспособной группы определялся типом и природой целевой мишени. Были использованы следующие варианты процедуры конъюгации:
a) для белков-мишеней: ковалентное связывание молекулы зонда с целевым сайтом связывания по принципу самораспознавания (бактериородопсин): нами в работах [9, 18–24] впервые были использованы фотохромные производные ряда спиропиранов и дитиенилэтенов в качестве фотохромномеченых аналогов хромофорных групп фоточувствительного ретинального белка – светозависимой протонной транслоказы бактериородопсина;
б) для белков-мишеней: нековалентное аффинное связывание молекулы зонда с мишенью с помощью “молекулярного адреса”, введенного в молекулу зонда (ингибиторы рецептора тромбоксана A2): ранее нами был открыт новый класс ингибиторов агрегации тромбоцитов – 5-замещенные 3-пиридилизоксазолы и разработаны методы их синтеза; была получена библиотека из более 120 соединений классов 3,5-замещенных изоксазолов и их 4,5-дигидропроизводных, содержащих 2-, 3- и 4‑пиридиновый фрагменты в С3-положении и заместители различной природы в С5-положении изоксазольного кольца. Для исследования механизма действия этого класса ингибиторов агрегации тромбоцитов человека были синтезированы три соединения, содержащие “молекулярный адрес” в различной пространственной ориентации к фрагменту фотохромной метки из ряда спиропиранов и было проведено изучение процесса их связывания с рецепторами мембраны тромбоцитов человека [25–27];
в) ковалентное связывание молекулы метки с неорганической наноразмерной мишенью с помощью селективной терминальной реакционноспособной группы: для специфичного связывания с мишенью – квантовыми точками CdSe были использованы различные производные терминальных моно- и дитиолов и изучены различные варианты линкеров для их введения в молекулы целевых фотохромов;
г) ковалентное связывание молекулы метки с мишенью с помощью селективной терминальной реакционноспособной группы: для специфичного связывания с мишенью – сульфгидрильными группами остатков Cys белков была синтезирована серия фотохромных спиропиранов с малеинимидным фрагментом в молекуле [16];
д) ковалентное связывание молекулы зонда с мишенью с помощью терминальной реакционноспособной группы: для маркирования разнообразных органических молекул нами был разработан и использован целый набор оригинальных синтетических методов и подходов [14, 15, 17].
Работа была частично поддержана грантами Российского фонда фундаментальных исследований № 16-03-00571a и № 17-04-01326а.
Список литературы
Likhtenshtein G.I. // Biophysical Labeling Methods in Molecular Biology. Cambridge University Press, 1993.
Звездин К.В., Беликов Н.Е., Лаптев А.В. и др. // Рос. нанотехнологии. 2012. Т. 7. № 5–6. С. 112.
Photochromism. Molecules and Systems / Eds. Dürr H., Bouas-Laurent H. London: Elsevier Science, 2003.
Organic photochromic and thermochromic compounds / Eds. Crano J.C., Guglielmetti R.J. New York: Kluwer Acad. Publ., 2002.
Photosensitive Molecules for Controlling Biological Function (Neuromethods. V. 55) / Eds. Chambers J.J., Kramer R.H. Humana Press, 2011.
Papazoglou E.S., Parthasarathy A. // Bionanotechnology. San Rafael, USA: Morgan&Claypool Publishers, 2007.
Попов Л.Д., Щербаков И.Н., Коган В.А. и др. // Хим. физика. 2011. Т. 30. № 6. С. 18.
Винтер О.А., Венидиктова О.В., Кольцова Л.С. и др. // Хим. физика. 2009. Т. 28. № 12. С. 3.
Properties of artificial bacteriorhodopsin analogs / Eds. Khodonov A.A., Belikov N.E., Demina O.V., Chupin V.V. Database ver. 1.0, 2017; https://cmmmipt.ru/bacteriorhodopsin-analogs.html
Belikov N.E., Demina O.V., Melnikova I.A. et al. // Mendeleev Commun. 2018. V. 28. № 4. P. 406.
Belikov N.E., Melnikova I.A., Demina O.V. et al. // J. Bioenerg. Biomembr. 2018. P. 60.
Лаптев А.В., Лукин А.Ю., Беликов Н.Е. и др. 5-Формил-замещенные индолиновые спиробензопираны и способ их получения. Патент РФ 2358977 // Б.И. 2009. № 17.
Лаптев А.В., Лукин А.Ю., Беликов Н.Е. и др. Фотохромные производные 5'-винил-6-нитроспиробензопирана и способы их получения. Патент РФ 2458927 // Б.И. 2012. № 23.
Laptev A.V., Pugachev D.E., Lukin A.Yu. et al. // Mendeleev Commun. 2013. V. 23. № 4. P. 199.
Laptev A.V., Lukin A.Yu., Belikov N.E. et al. // Ibid. 2013. V. 23. № 3. P. 145.
Laptev A.V., Lukin A.Yu., Belikov N.E. et al. // Ibid. 2014. V. 24. № 4. P. 245.
Лаптев А.В., Лукин А.Ю., Беликов Н.Е. и др. // Изв. АН. Сер. хим. 2014. № 9. С. 2026.
Лаптев А.В., Беликов Н.Е., Лукин А.Ю. и др. // Биоорган. химия. 2008. Т. 34. № 2. С. 276.
Лаптев А.В., Беликов Н.Е., Лукин А.Ю. и др. // Химия высоких энергий. 2008. Т. 42. № 7. С. 102.
Belikov N., Lukin A., Laptev A. et al. // J. Photochem. Photobiol., A. 2008. V. 196. № 2–3. P. 262.
Ходонов А.А., Лаптев А.В., Лукин А.Ю. и др. // Вестн. МИТХТ. 2011. Т. 6. № 2. С. 15.
Laptev A., Lukin A., Belikov N.et al. // J. Photochem. Photobiol., A. 2011. V. 222. № 1. P. 16.
Barachevsky V.A., Khodonov A.A., Belikov N.E. et al. // Dyes Pigm. 2012. V. 92. P. 831.
Levin P.P., Tatikolov A.S., Laptev A.V. et al. // J. Photochem. Photobiol., A. 2012. V. 231. P. 41.
Демина О.В., Беликов Н.Е., Варфоломеев С.Д., Ходонов А.А. // Изв. АН. Сер. хим. 2018. № 5. С. 866.
Демина О.В., Ходонов А.А., Синауридзе Е.И., Швец В.И., Варфоломеев С.Д. // Там же. 2014. № 9. С. 2092.
Демина О.В., Беликов Н.Е., Варфоломеев С.Д., Швец В.И., Ходонов А.А. 5-Алкил-3-(пирид-3-ил)изоксазолы и их 4,5-дигидропроизводные, обладающие антиагрегационной активностью. Патент РФ № 2565754 // Б.И. 2015. № 29.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


