Химическая физика, 2019, T. 38, № 12, стр. 54-58
Антиоксидантные и антигликирующие свойства N-ацетилцистеината 6-гидрокси-2-аминобензотиазола
А. Е. Донцов 1, Н. Л. Сакина 1, *, Ю. В. Кузнецов 1, М. А. Островский 1, 2
1 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: nsakina@mail.ru
Поступила в редакцию 05.06.2019
После доработки 05.06.2019
Принята к публикации 20.06.2019
Аннотация
Исследована антиоксидантная и антигликирующая активность водорастворимого гетероциклического антиоксиданта N-ацетилцистеината 6-гидрокси-2-аминобензотиазола (АЦЦ ГАБТИ). Хемилюминесцентным методом установлена высокая антирадикальная активность этого вещества. Показано, что АЦЦ ГАБТИ проявляет высокую антиоксидантную активность в отношении процесса пероксидации фоторецепторных клеток, индуцированного ультрафиолетовым облучением, ионами двухвалентного железа, а также видимым светом в присутствии “пигмента старости” липофусцина или его флуорофора А2Е. Установлено, что АЦЦ ГАБТИ эффективно тормозит процессы фруктозилирования сывороточного альбумина и белков фоторецепторных клеток. Ингибирующая способность АЦЦ ГАБТИ в отношении процесса модификации альбумина фруктозой сопоставима с активностью известных антигликирующих препаратов аминогуанидина и пиридоксамина и значительно превышает таковую для мексидола. Делается предположение о перспективности использования этого соединения в фармакологической практике для предотвращения и лечения метаболического синдрома.
ВВЕДЕНИЕ
Работа по синтезу и изучению физико-химических свойств гетероциклических фенолов как перспективных антиоксидантов была предложена и осуществлена Л.Д. Смирновым, К.М. Дюмаевым и их коллегами [1, 2]. При поиске эффективных ингибиторов свободнорадикальных процессов биогенного типа ими были выбраны производные 3‑оксипиридина, ингибирующие свойства которых могли быть связаны с наличием гидроксила фенольного типа при сопряженной циклической системе связей. Структура этих веществ близка к структуре соединений группы витамина В6 (пиридоксол, пиридоксамин и пиридоксаль), играющих важную роль в жизнедеятельности организма. Кроме того, присутствие в цикле наряду с оксигруппой атома азота позволяло получать водорастворимые соединения за счет образования солей, что сделало возможным создание инъекционных лекарственных форм. Основой для медико-биологического применения указанных соединений исходно послужила развитая акад. Η.М. Эмануэлем концепция о возможности подавления нетоксичными ингибиторами нежелательных свободнорадикальных реакций, возникающих в организме при патологических состояниях [3, 4]. На сегодняшний день в медицинской практике широко применяются такие синтетические препараты, относящиеся к антиоксидантам гетероциклического ряда [5–7], как мексидол (3-окси-6-метил-2-этилпиридина сукцинат), эмоксипин (3-окси-6-метил-2-этилпиридина хлорид) и мексикор (гидрохлорид и сукцинат 2-этил-6-метил-3-оксипиридина).
Ранее нами были исследованы антирадикальные свойства различных производных аминобензотиазола [8–10], в том числе ацетилцистеината 6-гидрокси-2-аминобензотиазола (АЦЦ ГАБТИ) [11]. Цель настоящей работы – исследование ингибирующего действия АЦЦ ГАБТИ в отношении процесса модификации белков при гликировании, а также сравнение антиоксидантной, антирадикальной и фотопротекторной активности АЦЦ ГАБТИ и мексидола, который является эффективным антиоксидантом и обладает уникальным многофакторным механизмом действия [12, 13].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез ацетилцистеината 6-гидрокси-2-аминобензотиазола
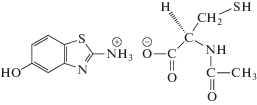
Синтез АЦЦ ГАБТИ (Схема 1) основан на взаимодействии эквимолярных количеств 6-гидрокси-2-аминобензо-тиазола и N-ацетил-L-цистеина в растворе низшего спирта при кипячении с последующими частичной отгонкой растворителя, охлаждением реакционной массы, отделением выпавших кристаллов и перекристаллизацией полученного продукта из этилового спирта с добавкой активированного угля [11].
Схема 1 . Структурная формула АЦЦ ГАБТИ
Выделение наружных сегментов фоторецепторов из сетчатки глаз быка
Наружные сегменты фоторецепторов (НСФ) были выделены из сетчатки глаз быка по модифицированной методике [14].
Выделение липофусциновых гранул из РПЭ глаз человека
Липофусциновые гранулы были изолированы из клеток ретинального пигментного эпителия с помощью модифицированной методики, предложенной Boulton и Marshall [15].
Измерение антирадикальной активности АЦЦ ГАБТИ и мексидола
Антирадикальную активность изучаемых веществ оценивали с помощью хемилюминесцентной модельной системы окисления, состоящей из гемоглобина, пероксида водорода и люминола [16]. В качестве измеряемого параметра была взята максимальная интенсивность свечения (амплитуда хемилюминесценции).
Измерение кинетики пероксидации липидов наружных сегментов фоторецепторов
Кинетику пероксидации липидов наружных сегментов фоторецепторов определяли по накоплению продуктов реакции с тиобарбитуровой кислотой (ТБК-активные продукты), содержание которых измеряли по поглощению при длине волны 532 нм [17].
Облучение образцов видимым и УФ-светом
Для облучения образцов полным белым светом в видимом диапазоне (390–700 нм) использовали галогенную лампу накаливания КГМ24–150 мощностью 150 Вт (энергия облучения – 100 мВт/см2) с оптической системой фокусирования и тепловым фильтром при непрерывном перемешивании. Для облучения образцов УФ-светом использовали сфокусированный полный белый свет дуговой ртутно-кварцевой лампы ДРК-120 (мощность – 120 Вт, световой поток – 3900 Лм) на расстоянии 15 см от объекта при постоянном перемешивании. Свет этого источника включает как УФ-полосы, начиная со 190 нм, так и видимую область спектра.
Устойчивость к действию видимого и УФ-облучения
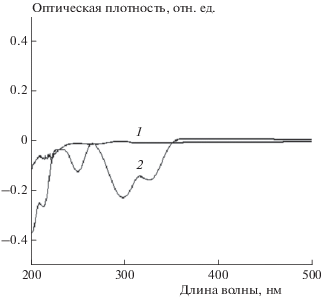
Принципиально важной характеристикой антиоксидантов, особенно применяемых в офтальмологии, является их устойчивость к действию света. На рис. 1 представлены дифференциальные спектры поглощения этих соединений через 10 мин (мексидол – кривая 2) и через 30 мин облучения (АЦЦ ГАБТИ – кривая 1). Видно, что мексидол уже через 10 мин претерпевает фотодеструкцию, распадаясь на неактивные компоненты, в то время как АЦЦ ГАБТИ в тех же условиях облучения и через 30 мин остается стабильным и не претерпевает каких-либо существенных спектральных изменений. Даже экспозиция АЦЦ ГАБТИ в течение 1 ч не приводила к значительным изменениям его состава (на рис. 1 не показано), что свидетельствует о его высокой устойчивости к действию УФ- и видимого облучения.
Сравнение антирадикальной активности АЦЦ ГАБТИ и мексидола
Антирадикальная активность АЦЦ ГАБТИ, измеренная в наших опытах в хемилюминесцентной модельной системе окисления люминола, оказалась в несколько раз выше, чем у мексидола. Из значений констант тушения для АЦЦ ГАБТИ – (2.4 ± 0.4) ∙ 105 М–1 и мексидола – (3.6 ± 0.5) ∙ 104 М–1 следует, что антирадикальная активность АЦЦ ГАБТИ более чем в 6 раз превышает таковую для мексидола.
Ингибирующее действие АЦЦ ГАБТИ на процесс пероксидации липидов в сравнении с мексидолом
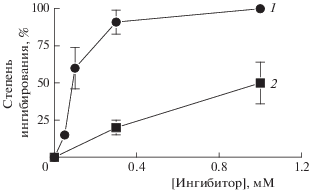
Как продемонстрировано в экспериментах с суспензией наружных сегментов фоторецепторных клеток (НСФ) в темновых условиях в присутствии окислительной системы “Fe2+ + аскорбиновая кислота”, степень ингибирования процессов пероксидации липидов у АЦЦ ГАБТИ существенно выше, чем у мексидола (рис. 2). Так, уже в концентрации 0.3 мМ (кривая 1) АЦЦ ГА-БТИ практически на 100% подавляет процесс пероксидации липидов, в то время как мексидол даже в концентрации 1.0 мМ (кривая 2) ингибирует этот процесс примерно на 50%. Полученные результаты свидетельствуют о более высокой антиоксидантной активности АЦЦ ГАБТИ в отношении темновых свободнорадикальных процессов по сравнению с мексидолом.
Рис. 2.
Ингибирующее действие АЦЦ ГАБТИ (1) и мексидола (2) на индуцированную системой Fe2+ + + аскорбат пероксидацию фоторецепторных клеток в зависимости от концентрации. Реакционная среда содержала 0.1 М калий-фосфатный буфер (рН 7.4), 250 мкг ∙ мл–1 белка суспензии НСФ, 10 мкМ FeSO4(NH4)2SO4 ∙ 6H2O, 0.5 мМ аскорбат и АЦЦ ГАБТИ или мексидол в различных концентрациях. Приведены средние значения по пяти опытам.
Сравнение фотопротекторных свойств АЦЦ ГАБТИ и мексидола
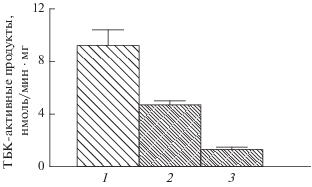
Влияние антиоксидантов на процесс пероксидации липидов в суспензии НСФ изучали при облучении их УФ- и видимым светом. На рис. 3 представлена скорость накопления ТБК-активных продуктов в образцах НСФ при облучении светом. Видно, что АЦЦ ГАБТИ (столбик 3) намного эффективнее действует как фотопротектор в этой модельной системе, чем мексидол (столбик 2). Так, ингибирующее действие мексидола при его концентрации 1.5 мМ примерно в 5 раз меньше, чем в случае АЦЦ ГАБТИ, концентрация которого составляет всего лишь 0.3 мМ. Таким образом, полученные результаты свидетельствуют об эффективных фотопротекторных свойствах АЦЦ ГАБТИ.
Рис. 3.
Ингибирующее действие мексидола (2) и АЦЦ ГАБТИ (3) на индуцированную ультрафиолетом пероксидацию НСФ: 1 – контроль (без ингибиторов), 2 – в присутствии 1.5 ммоль ∙ л–1мексидола, 3 – в присутствии 0.3 ммоль ∙ л–1 АЦЦ ГАБТИ. Реакционная среда содержала 0.1 М калий фосфатный буфер (рН 7.4), 300 мкг ∙ мл–1 белка суспензии наружных сегментов фоторецепторных клеток и АЦЦ ГАБТИ или мексидол. По оси ординат – средняя скорость накопления ТБК-активных продуктов в нмоль/мг белка за 1 мин облучения.
Та же тенденция сохраняется и в отношении фотосенсибилизированной видимым светом в присутствии липофусцина или его флуорофора А2Е пероксидации липидов суспензии НСФ (на рис. 3 не показано). Ингибирующая активность мексидола в этой системе даже при больших его концентрациях существенно ниже, чем у АЦЦ ГАБТИ. Эти результаты свидетельствуют о высоком защитном эффекте АЦЦ ГАБТИ в отношении фототоксического действия “старческого пигмента” липофусцина.
Исследование влияния АЦЦ ГАБТИ на образование поздних продуктов гликирования
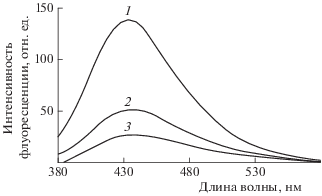
Известно, что поздние продукты гликирования (ППГ), как и поздние продукты пероксидации липидов, представляющие собой в основном поперечно сшитые белковые молекулы, чрезвычайно токсичны для клеток. Формирование и накопление ППГ в различных клетках и тканях ведет к повреждению внеклеточных и внутриклеточных структур и нарушению их функций. Известно, что накопление ППГ – одна из основных причин развития диабетических осложнений. На начальных стадиях процесса гликирования белков происходит формирование флуоресцирующих оснований Шиффа. Ингибирующее действие АЦЦ ГАБТИ в отношении процесса фруктозилирования сывороточного альбумина и белков наружных сегментов фоторецепторных клеток было исследовано в сравнении с мексидолом и известными ингибиторами этого процесса – аминогуанидином и пиридоксамином. Как видно из рис. 4, АЦЦ ГАБТИ в той же концентрации, что и аминогуанидин, приводит к более выраженному замедлению процесса накопления флуоресцирующих продуктов в альбумине. В этих же условиях мексидол практически не оказывал никакого ингибирующего действия на процесс модификации альбумина при фруктозилировании. Одинаковую эффективность с аминогуанидином АЦЦ ГАБТИ показал также и при ингибировании накопления продуктов модификации белков в процессе фруктозилирования наружных сегментов фоторецепторных клеток (на рис. 4 не показано).
Рис. 4.
Влияние АЦЦ ГАБТИ (3) и аминогуанидина (2) на образование флуоресцирующих продуктов в альбумине при его взаимодействии с фруктозой; 1 – без добавления ингибиторов. Среда инкубации содержала 0.1 М калий-фосфатный буфер, рН 7.4, концентрация альбумина – 4 мг/мл, концентрация фруктозы – 50 мМ, концентрация ингибиторов – 5 мМ. Смесь инкубировали в течении 4 сут при температуре 37°С и постоянном перемешивании. Для устранения микробного заражения использовали 3 мМ азид натрия. После окончания реакции смесь диализировали против фосфатного буфера в течение 1 сут.
Обнаруженное свойство антиоксиданта АЦЦ ГАБТИ, заключающееся в его способности тормозить накопление ППГ в белках крови и фоторецепторных клетках, может быть использовано в фармакологической практике при лечении заболеваний, связанных со старением и диабетом, таких как артриты, атеросклероз, хроническая почечная недостаточность, нефропатия, нейропатия, болезнь Альцгеймера, катаракта, возрастная макулярная дегенерация, диабетическая ретинопатия. Три последних заболевания являются самыми распространенными глазными заболеваниями, которыми страдают миллионы людей в мире.
ЗАКЛЮЧЕНИЕ
Таким образом, изученные нами свойства водорастворимого антиоксиданта АЦЦ ГАБТИ из класса азотистых гетероциклов свидетельствуют о нем как о соединении с выраженной антирадикальной и антиоксидантной активностью в темновых и индуцированных УФ- и видимым светом (в том числе и в присутствии фотосенсибилизатора – липофусцина) процессах, со способностью эффективно тормозить накопление ППГ и с высокой устойчивостью к действию УФ- и видимого света. Эти характеристики АЦЦ ГАБТИ (оксибиола) позволяют рассматривать его как перспективное соединение с целью разработки нового препарата для профилактики и лечения дегенеративных заболеваний сетчатки, сахарного диабета 2-го типа и ряда других возрастных заболеваний.
Список литературы
Дюмаев К.М., Смирнов Л.Д. // Успехи химии. 1975. Т. 44. С. 1788.
Смирнов Л.Д. Химическая и биологическая кинетика. Новые горизонты. Т. 2. М.: Химия, 2005. С. 102.
Эммануэль H.M. Пути синтеза и изыскания противоопухолевых препаратов. М.: Медгиз, 1962.
Бурлакова Е.Б., Заиков Г.Е. // Хим. физика. 2005. Т. 24. С. 67.
Воронина Т.А. // Журн. неврологии и психиатрии им. С.С. Корсакова. 2012. Т. 112. № 12. С. 86.
Дюмаев К.М., Воронина Т.А., Смирнов Л.Д. Антиоксиданты в профилактике и терапии патологий ЦНС. М.: Изд-во НИИ биомедицинской химии, 1995.
Жигачева И.В., Русина И.Ф., Генерозова И.П. и др. // Хим. физика. 2018. Т. 37. № 11. С. 68.
Сакина Н.Л., Голубков А.М., Смирнов Л.Д. и др. // БЭБиМ. 2009. Т. 147. С. 152.
Сакина Н.Л., Голубков А.М., Смирнов Л.Д. и др. // Молекуляр. медицина. 2009. № 6. С. 33.
Смирнов Л.Д., Кузнецов Ю.В., Проскуряков С.Я. и др. // Биофизика. 2011. Т. 56. С. 316.
Донцов А.Е., Сакина Н.Л., Кузнецов Ю.В. и др. // Патент РФ № 2458714 // Б.И. 2012. № 22.
Воронина Т.А. // Фарматека. 2009. № 6. С. 35.
Щулькин А.В. // Там же. 2016. № S4. С. 65.
McDowell J.H. // Methods in Neurosciences V. 15. N.Y.: Academ. Press., 1993. P. 123.
Boulton M., Marshall J. // Exp. Eye Res. 1985. V. 1. P. 209.
Теселкин Ю.О., Бабенкова И.В., Любицкий О.Б. и др. // Вопросы мед. химии. 1997. Т. 43. С. 87.
Buege J.A., Aust S.D. // Methods Enzymol. 1978. V. 52. P. 302.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика