Химическая физика, 2019, T. 38, № 12, стр. 64-73
Металлополиакрилаты – новый класс потенциальных противоопухолевых препаратов
Л. А. Островская 1, *, Д. Б. Корман 1, Н. В. Блюхтерова 1, М. М. Фомина 1, В. А. Рыкова 1, А. К. Грехова 1, К. А. Абзаева 2
1 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
2 Иркутский институт химии им. А.Е. Фаворского Сибирского отделения
Российской академии наук
Москва, Россия
* E-mail: larros@list.ru
Поступила в редакцию 05.06.2019
После доработки 05.06.2019
Принята к публикации 20.06.2019
Аннотация
Представлены результаты доклинического исследования оригинального противоопухолевого препарата аурумакрил (полиакрилат золота), относящегося к новому для онкологии классу соединений – металлополиакрилатов впервые изученных в качестве цитостатиков в ИБХФ РАН. Показана значительная противоопухолевая и цитотоксическая активность аурумакрила in vivo на экспериментальных моделях солидных опухолей мышей и in vitro на модели культуры клеток опухоли человека. Установлено, что аурумакрил вызывает сущеcтвенные изменения в кинетике пpолифеpации выжившей фpакции опуxолевыx клеток, приводя к значительному уменьшению доли делящиxcя клеток. Приводятся результаты исследования фармакокинетики аурумакрила в организме животных-опухоленосителей. Результаты собственных исследований обсуждаются в контексте современных представлений о противоопухолевом эффекте и механизме действия золотосодержащих соединений.
ВВЕДЕНИЕ
Прогресс в лечении онкологических заболеваний в значительной мере определяется дальнейшим совершенствованием методов лекарственной терапии опухолей. Арсенал используемых в настоящее время противоопухолевых средств насчитывает ~170 препаратов. Значительную часть из них составляют так называемые мишень-ориентированные таргетные препараты, разработка которых активно ведется в последние годы [1].
Вместе с тем очевидно, что несмотря на определенные успехи, достигнутые в химиотерапии опухолей, задача поиска новых классов соединений, обладающих противоопухолевой активностью, сохраняет свою актуальность и является одной из важнейших в медицинской химии и онкобиологии. Как известно из истории развития противоопухолевой химиотерапии, появление каждого нового соединения с оригинальным механизмом действия поднимает лекарственное лечение рака на новую ступень, как за счет расширения спектра опухолей, чувствительных к лекарственной терапии, так и за счет появления новых возможностей для преодоления исходной и приобретенной резистентности к уже имеющимся препаратам [1].
Одним из весьма перспективных направлений исследований в области биомедицинской химии, экспериментальной и клинической онкологии признано изучение металлорганических соединений в качестве потенциальных противоопухолевых препаратов [2]. Интерес к таким соединениям, особенно к структурам, содержащим благородные металлы, в значительной мере обусловлен открытием высокой противоопухолевой активности в ряду комплексных соединений платины, широко применяющихся в современной химиотерапии опухолей [1].
Исследования последних лет выявили значительную противоопухолевую активность металлорганических соединений, содержащих другой металл платиновой группы – золото. Особый интерес золотосодержащие вещества вызывают в связи с тем, что эти соединения, предположительно, обладают оригинальным механизмом действия, не свойственным известным, клинически апробированным лекарственным средствам [3]. По результатам экспериментальных исследований золотосодержащие комплексы рассматриваются как потенциальные многообещающие противоопухолевые агенты. Для целого ряда подобных соединений показана высокая цитотоксическая активность in vitro на многих линиях клеток опухолей человека, а также значимая противоопухолевая активность на опухолевых моделях in vivo. Характерные химические свойства этих соединений, обусловленные наличием иона золота, определяют их особый фармакологический профиль и механизмы действия [3, 4].
Среди значительного многообразия изученных в последние годы металлоценов определенный интерес представляют металлопроизводные полиакриловой кислоты (МПА), относящиеся к новой для онкологии группе соединений, ранее в этом направлении не изучавшихся. Нами в качестве потенциальных цитостатиков были исследованы металлополиакрилаты, разработанные под руководством академика М.Г. Воронкова в Иркутском институте химии им. А.Е. Фаворского СО РАН. Известно, что эти препараты обладают разносторонней биологической активностью и составляют группу локальных гемостатиков нового поколения, сочетающих кровоостанавливающее действие с высокой бактерицидной активностью [5].
При экспериментальном исследовании зависимости “структура–эффект” в ряду более чем 20 металлополиакрилатов, нами была впервые обнаружена значительная противоопухолевая активность соединений, содержащих благородные металлы [6–8]. Наиболее эффективным среди препаратов этого ряда оказался полиакрилат золота (аурумакрил), проявивший значительную противоопухолевую активность в отношении перевиваемых опухолей животных in vivo и стабильных клеточных линий опухолей человека in vitro [9–11]. В данной статье представлены результаты экспериментального доклинического исследования аурумакрила в качестве потенциального противоопухолевого агента, включающие оценку противоопухолевой и цитотоксической активности полиакрилата золота в условиях in vivo и in vitro, изучение определенных аспектов механизма действия препарата и определение его фармакокинетики в организме животных-опухоленосителей.
МАТЕРИАЛЫ И МЕТОДЫ
Препарат. Исследуемый препарат с условным названием “Аурумакрил” представляет собой неполную металлическую соль полиакриловой кислоты, содержащую ионы трехвалентного золота (массовая доля металла 8.03 мас.%). Общая формула (–CH2–CHCOOH–)n(–CH2CHCOOAuCl3H–)m, где n = 1263; m = 124. Молекулярная масса лежит в диапазоне 100–300 кДа. ИК-спектры препарата содержат полосы поглощения карбоксильной, карбоксилатной групп при частотах, равных 1720, 1570 см–1. Субстанция аурумакрила – стекловидные пластинки желтого цвета, хорошо растворимые в воде. В условиях in vivo аурумакрил вводили животным в водном растворе внутрибрюшинно (в/б) в суточной дозе 20 мг/кг, ежедневно, пятикратно, начиная со следующих суток после перевивки опухоли. Действие аурумакрила in vitro исследовано в концентрациях 0.001, 0.01, 0.1, 1.0 мг/мл, применявшихся в виде водных растворов объемом 0.2 мл.
Лабораторные животные. Эксперименты проведены на линейных мышах BDF1 – гибридах первого поколения F1(C57Bl/6 × DBA2), а также мышах линии Balb/c массой 18–20 г, полученных из питомника РАМН “Столбовая”.
Опухолевые модели животных. В качестве опухолевых тест-систем служили солидные опухоли – карцинома легких Льюис, аденокарцинома Са-755 (мыши BDF1 (F1(C57Bl/6 × DBA2)), аденокарцинома Акатол (мыши Balb/c). Перевивку опухолей осуществляли в соответствии со стандартными методиками [12].
Оценка противоопухолевого эффекта in vivo. Показателями ростингибирующего эффекта препаратов служили различия в кинетике роста опухолей и средней продолжительности жизни у леченных (индекс “Т”) и контрольных (индекс “С”) животных. Показатели противоопухолевого эффекта – изменение средней продолжительности жизни (Δτ, %) и коэффициент торможения роста опухоли (ТРО, %), характеризующие изменение соответствующего показателя под влиянием испытуемого препарата у леченных животных по сравнению с контролем, определялись как Δτ = (τС – τТ)/τС, % и ТРО = (РС – РТ)/РС, %, соответственно, где τС и τТ – средняя продолжительность жизни мышей, а РС и РТ – средняя масса опухоли мышей в группах контрольных и леченных животных [11, 12].
Культура клеток. Эксперименты in vitro проведены с использованием культуры клеток карциномы молочной железы человека линии MCF-7. Экспериментальное изучение цитотоксичности аурумакрила проведено на клетках, находящихся в фазе экспоненциального роста (плотность клеточной популяции ~80%). Действие аурумакрила изучено при инкубации клеток с препаратом в различных концентрациях при 37 °С в течение 1, 6 и 24 ч, при параллельном инкубировании интактных клеток в качестве контроля [11]. Цитотоксический эффект препарата оценивался in vitro по его влиянию на жизнеспособность клеток, показателем которой служила восприимчивость клеток к окраске 0.4% раствором трипанового синего [11].
Изучение влияния аурумакрила на клеточную пролиферацию проведено иммуноцитохимическим методом с использованием маркера клеточного деления – белка Ki-67. Этот белок присутствует в ядрах делящихся клеток, но отсутствует в покоящихся клетках [11, 13].
Фармакокинетика. Распределение аурумакрила в организме животных опухоленосителей (карцинома легких Льюис) определяли путем измерения содержания золота в тканях опухоли и органов (кровь, печень, почки, легкие, селезенка, мозг) мышей с помощью масс-спектрометрии с индуктивно связанной плазмой (МС-ИСП). Образцы биологического материала отбирались через 0.5, 1, 3, 4, 24, 48 ч после введения аурумакрила на седьмые сутки после перевивки опухоли. Проводили определение массы извлеченных для исследования тканей, а также разделение крови на плазму и сыворотку центрифугированием в течение 10 мин при скорости 3000 об/мин. Аналогичные процедуры осуществляли при исследовании контрольных животных, не получавших препарат. Процедуру МС-ИСП определения золота в биологических материалах проводили в соответствии с описанной ранее методикой [14, 15].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Противоопухолевая активность аурумакрила in vivo
Противоопухолевая активность аурумакрила установлена на моделях солидных опухолей мышей – карцинома легких Льюис, аденокарцинома Акатол, аденокарцинома Са-755 при ежедневном введении препарата в суточной дозе 20 мг/кг, в/б, пятикратно, начиная со следующих суток после перевивки опухоли. Отметим, что применявшаяся суточная доза препарата в пять раз меньше максимально переносимой дозы (МПД) аурумакрила, равной при его однократном в/б введении 100 мг/кг, в то время как срединная полулетальная доза (LD50) аурумакрила для мышей составляет 150 мг/кг.
Как видно из представленных данных аурумакрил тормозит развитие всех трех изученных солидных опухолей мышей – карциномы легких Льюис, аденокарциномы Са-755 и аденокарциномы Акатол – на 80–90%. При этом средняя продолжительность жизни животных с аденокарциномой Са-755 увеличивается на 31% по сравнению с контролем (рис. 1, табл. 1).
Рис. 1.
Противоопухолевая активность аурумакрила на моделях карциномы легких Льюис (а), аденокарциномы Акатол (б), аденокарциномы Са-755 (в): 1 – контроль, 2 – аурумакрил, 20 мг/кг/сут, в/б, с первых по пятые сутки после перевивки опухоли.
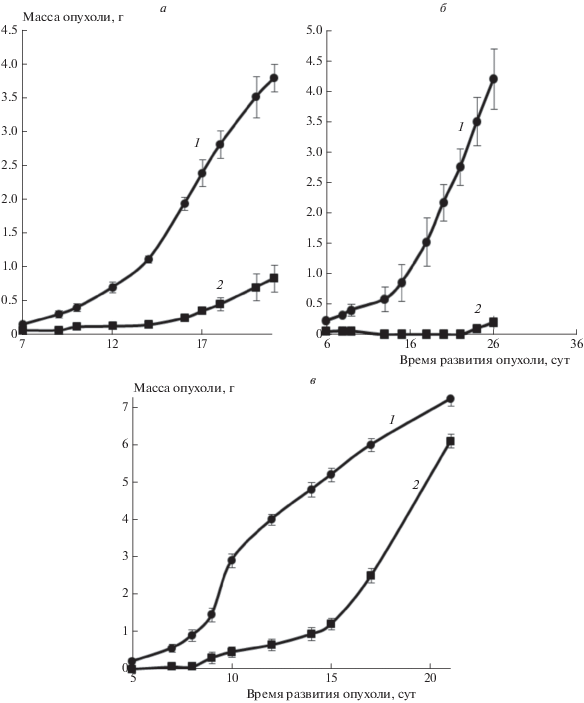
Таблица 1.
Противоопухолевая активность аурумакрила на моделях солидных опухолей животных (введение препарата в/б, с 1 по 5 сутки развития опухоли)
| Штамм опухоли |
Доза, мг/кг в сут | Время оценки эффекта, сут | Средняя масса опухоли, г | Торможение роста опухоли (ТРО), % | |
|---|---|---|---|---|---|
| леченные мыши |
контрольные мыши |
||||
| Карцинома легких Льюис | 20 | 21 | 0.8 ± 0.1 | 3.8 ± 0.5 | 80 |
| Аденокарцинома Акатол | 20 | 27 | 0.5 ± 0.1 | 4.7 ± 0.6 | 90 |
| Аденокарци-нома Са-755 | 20 | 15 | 1.2 ± 0.2 | 5.2 ± 0.5 | 77* |
Противоопухолевая активность аурумакрила in vitro
Исследование эффектов аурумакрила в условиях in vitro включало оценку выживаемости клеток карциномы молочной железы человека линии MCF-7 после воздействия препарата, а также изучение его влияния на кинетику клеточной пролиферации выжившей фракции опухолевых клеток. Установлено, что аурумакрил обладает цитотоксическим действием на опухолевые клетки, вызывая их гибель, выраженность которой зависит от времени воздействия препарата и его концентрации (рис. 2).
Рис. 2.
Влияние препарата аурумакрил в ряде концентраций на кинетику гибели клеток MCF-7: 1 – контроль, 2 – 0.001 мг/мл, 3 – 0.01 мг/мл, 4 – 0.1 мг/мл, 5 – 1.0 мг/мл.
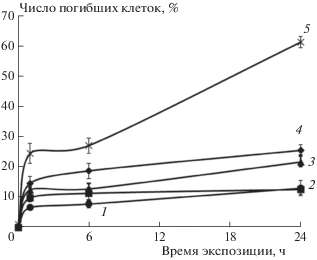
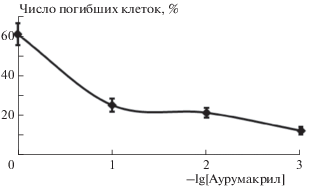
Цитотоксический эффект аурумакрила имеет отчетливый дозозависимый характер. Максимальный эффект – гибель 60% опухолевых клеток – наблюдается при воздействии препарата в наибольшей из изученных доз, равной 1 мг/мл (рис. 3). Отметим, что расчетная доза препарата, летальная для 50% опухолевых клеток, составляет для аурумакрила 0.5 мг/мл (рис. 3).
Рис. 3.
Изменение доли погибших клеток культуры MCF-7 в зависимости от дозы аурумакрила (экспозиция – 24 ч).
Интенсивность пролиферации выжившей фракции опухолевых клеток претерпевает под влиянием аурумакрила значительные изменения по сравнению с контролем, наиболее выраженные при применении препарата в самой высокой из изученных доз, равной 1 мг/мл (рис. 4 и 5). Показано, что препарат вызывает накопление клеток, находящихся в фазе пролиферативного покоя G0. Доля покоящихся клеток через 24 ч инкубации возрастает с 40%, наблюдающихся в контроле, до 93%, регистрируемых на этот срок при воздействии препарата в дозе, равной 1 мг/мл (рис. 4).
Рис. 4.
Влияние аурумакрила на кинетику изменения доли покоящихся (в фазе G0) клеток MCF-7: 1 – контроль, 2 – аурумакрил, 1 мг/мл.
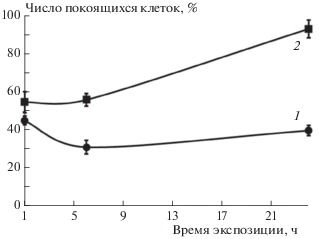
Рис. 5.
Влияние аурумакрила на кинетику изменения доли делящихся клеток MCF-7: 1 – контроль, 2 – аурумакрил, 1 мг/мл.
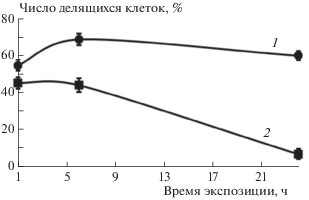
Наряду с этим, среди выживших клеток наблюдается уменьшение доли делящихся клеток под влиянием аурумакрила. Так, после инкубации опухолевых клеток с препаратом в дозе 1 мг/мл на протяжении 24 ч доля делящихся клеток уменьшается с 60%, регистрируемых в это время в контроле, до 7% (рис. 5). Приведенные данные свидетельствуют о том, что аурумакрил обладает выраженным цитотоксическим и цитостатическим действием, вызывая как гибель клеток (60%), так и значительные изменения интенсивности клеточной пролиферации выжившей фракции опухолевых клеток, о чем свидетельствует снижение доли делящихся клеток.
Фармакокинетика аурумакрила
Исследование фармакокинетики новых лекарственных средств является обязательным этапом их изучения, имеющим важное значение для разработки оптимальных схем и режимов применения препаратов, а также для понимания механизмов их действия. Фармакокинетические кривые, характеризующие распределение аурумакрила в организме животных с карциномой Льюис, представлены на рис. 6.
Рис. 6.
Кинетические кривые изменения содержания золота в крови (а), опухоли (б), печени (в), почках (г), легких (д), селезенке (е) и мозге (ж) мышей после однократного введения аурумакрила в дозе 100 мг/кг, в/б, на 7-е сутки развития опухоли (карцинома легких Льюис).
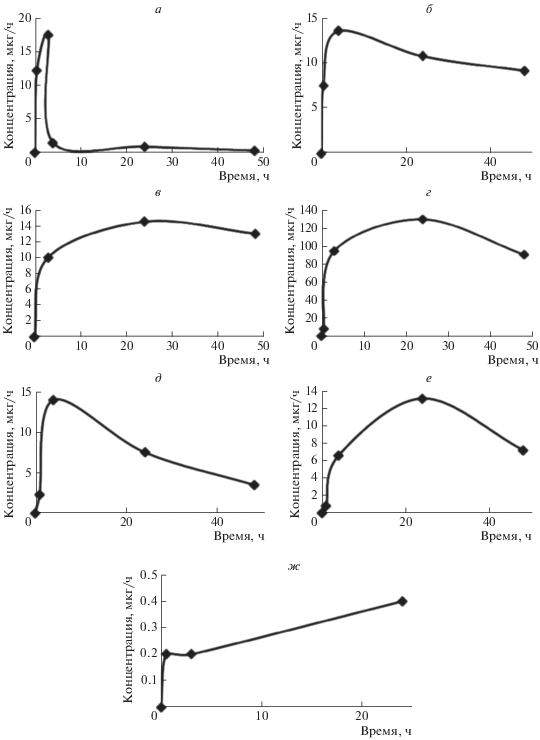
Анализ приведенных зависимостей свидетельствует о том, что препарат после в/б, внесосудистого введения обнаруживается через 30 мин в кровяном русле, в опухоли и в исследуемых органах (печень, почки, легкие, селезенка) животных, где детектируется на протяжении всего периода наблюдения в течение 48 ч. Отметим, что концентрация золота в исследовавшихся тканях у контрольных мышей, не получавших аурумакрил, менее 0.006 мкг/г.
Максимальная концентрация золота (Сmax), как видно из представленных данных (рис. 6, табл. 2), наблюдается в плазме крови через 3 часа после в/б введения аурумакрила (рис. 6а), в опухоли и в легких – через 4 ч (рис. 6б и д соответственно), в печени, почках, селезенке и в мозге – через 24 ч после применения препарата (рис. 6в, г, е, ж соответственно). Значения минимальной концентрации золота (Сmin), регистрируемые спустя 48 ч после введения препарата, дают представление о длительности пребывания аурумакрила в исследуемых тканях и позволяют качественно сопоставить скорости выведения из них препарата. Как видно, показатель Сmin для различных органов и опухоли возрастает в следующей последовательности: плазма крови – легкие – селезенка – опухоль – печень – почки, что свидетельствует об увеличении в указанной последовательности времени нахождения препарата в исследовавшихся тканях (рис. 6, табл. 2).
Таблица 2.
Фармакокинетические параметры распределения аурумакрила в организме животных с карциномой легких Льюис (введение препарата в/б в дозе 100 мг/кг)
| Пробы тканей | Сmax, мкг/г | Tmax, ч | Сmin*, мкг/г | S, мкг/г ∙ ч | Коэффициент ОБ ОБ = Sо/Sк |
|---|---|---|---|---|---|
| Плазма крови | 15.6 | 3 | 0.9 | 88.1 | – |
| Опухоль | 13.6 | 4 | 9.2 | 522.8 | 5.93 |
| Печень | 14.5 | 24 | 13 | 602.2 | 6.83 |
| Почки | 129.0 | 24 | 90 | 5099 | 57.87 |
| Легкие | 14.0 | 4 | 3.5 | 372.6 | 4.23 |
| Селезенка | 13.1 | 24 | 7.2 | 452.1 | 5.13 |
| Мозг | 0.36 | 24 | – | 6.8 | 0.08 |
Кумулятивный фармакокинетический показатель – площадь под фармакокинетической кривой (S), позволяющий оценить биодоступность тканей различных органов и опухоли для аурумакрила, охарактеризован данными, представленными в табл. 2. В соответствии со значениями этого интегрального показателя биодоступности органов для аурумакрила возрастание содержания золота в различных тканях происходит в такой последовательности: мозг – плазма крови – легкие – селезенка – опухоль – печень – почки (табл. 2).
Обращает на себя внимание тот факт, что в ткани мозга аурумакрил обнаруживается в крайне низких концентрациях – на порядок меньших, чем концентрации препарата, регистрируемые в плазме крови (рис. 6, табл. 2). Столь низкое содержание золота в тканях мозга свидетельствует о неспособности препарата преодолевать гематоэнцефалический барьер. Таким образом, представленные данные свидетельствуют о преимущественном накоплении препарата в почках при относительно равномерном распределении аурумакрила между тканями опухоли, печени, легких и селезенки.
Коэффициент относительной биодоступности (ОБ) тканей различных органов и опухоли для аурумакрила, определяемый из соотношения между показателями площадей под кривыми для исследуемого органа или опухоли (Sо) и крови (Sк), как ОБ = Sо/Sк, также свидетельствует о преимущественном накоплении аурумакрила в почках. Величина коэффициента ОБ для почек на порядок выше, чем значения этого показателя для всех других исследовавшихся органов (печень, легкие, селезенка) и для опухоли (табл. 2). Обнаруженная высокая биодоступность почек к аурумакрилу указывает на определенную тропность препарата к тканям почек и позволяет предположить, что почки, возможно, являются потенциальной мишенью как для противоопухолевого, так и для токсического действия препарата.
При рассмотрении данных, характеризующих биодоступность аурумакрила для опухоли, следует отметить, что препарат после внесосудистого, в/б введения обнаруживается в подкожно развивающейся опухоли практически одновременно с поступлением вещества в кровь, регистрируется в максимальной концентрации через 3 ч и сохраняется в тканях опухоли в концентрации, близкой к максимальной, на протяжении всего периода наблюдения в течение 48 ч (рис. 6, табл. 2).
Как уже упоминалось ранее, показатель относительной биодоступности (ОБ) опухоли к аурумакрилу находится примерно на том же уровне, что и для других исследовавшихся органов (за исключением почек с наиболее высоким индексом ОБ и мозга, имеющего самый низкий коэффициент ОБ). Однако, коэффициент ОБ для опухоли, равный 5.93, несколько превышает значения ОБ, установленные для селезенки (5.13) и легких (4.23), но уступает величине ОБ, регистрируемой для печени (6.83) (табл. 2).
Установленная величина коэффициента ОБ опухоли для аурумакрила, равная 5.93, соответствует известным значениям этого показателя для ряда других противоопухолевых препаратов, которые изменяются в пределах от 1.6 до 10.5 [14, 16]. Таким образом, проведенное изучение распределения потенциального противоопухолевого препарата аурумакрил в организме животных – опухоленосителей (карцинома легких Льюис) позволило доказать, что аурумакрил после в/б введения поступает в кровяное русло, исследуемые органы (печень, почки, легкие, селезенка) и опухоль, где обнаруживается на протяжении всего периода наблюдения в течение 48 ч.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Проведенные исследования позволили установить, что аурумакрил эффективно, на 80–90%, ингибирует развитие солидных опухолей мышей (карцинома легких Льюис, аденокарцинома Са-755 и аденокарцинома Акатол) in vivo, а также вызывает гибель 60% клеток карциномы молочной железы человека линии MCF-7 in vitro. Обнаруженные в работе клеточные эффекты препарата свидетельствуют не только о весьма значительном цитотоксическом эффекте аурумакрила, но демонстрируют также угнетающее влияние его на пролиферативную активность выжившей фракции опухолевых клеток, что указывает на выраженное цитостатическое действие препарата. Кинетика пpолифеpации выжившей фpакции опуxолевыx клеток пpетеpпевает cущеcтвенные изменения, выpажающиеcя в пpеимущеcтвенном накоплении клеток (93%) в фазе пpолифеpативного покоя G0 и в значительном уменьшении доли (7%) делящиxcя клеток. Полученные данные могут быть pаcценены как cвидетельcтво утpаты выжившими клетками pепpодуктивной cпоcобноcти поcле воздейcтвия ауpумакpила.
Исследование фармакокинетики аурумакрила позволило установить, что препарат всасывается из брюшной полости и попадает в кровяное русло. В исследовавшихся органах (печень, почки, легкие, селезенка) и в опухоли золото детектируется через 30 мин после в/б введения и продолжает определяться в течение 48 ч. Анализ полученных данных показывает, что обнаружено примерно равномерное распределение золота между тканями опухоли, печени, селезенки и легких. Можно отметить, что элиминация золота из легких происходит быстрее, чем из опухоли и других органов. Обращает на себя внимание существенно большее накопление золота в ткани почек, что можно интерпретировать, как указание на выделение препарата из организма преимущественно с мочой. Очень низкое содержание золота в ткани мозга, очевидно, указывает на невозможность проникновения полимерного препарата через гематоэнцефалический барьер.
Важное значение для понимания механизмов действия лекарственных средств имеет исследование их метаболизма в организме, выявление активных метаболитов и путей их взаимодействия с биомакромолекулами. Известно, что полиакрилат золота, будучи эффективным гемостатиком, обладает высокой специфичностью взаимодействия с молекулой альбумина, образуя при этом интерполимерный комплекс [5]. Можно полагать, что и в организме животных-опухоленосителей аурумакрил после поступления в кровяное русло связывается с альбуминами сыворотки крови и в виде комплекса с альбумином попадает в ткани, где происходит дальнейшее взаимодействие этого комплекса с внутриклеточными макромолекулами. Очевидно, что процессы биодеградации и метаболизма аурумакрила должны быть предметом специальных исследований.
Оcтаютcя пока невыясненными возможные молекулярные мишени и механизмы пpотивоопуxолевого действия ауpумакpила, что необходимо для позиционирования пpепаpата в cоответcтвии c cовpеменными подxодами к пpотивоопуxолевой xимиотеpапии. Cоглаcно cущеcтвующим пpедcтавлениям, биомишенями для золотоcодеpжащиx пpепаpатов могут cлужить белки, учаcтвующие в pегуляции клеточной пpолифеpации опуxолевыx клеток, в pазвитии пpоцеccов апоптоза и ангиогенеза.
Показано, в чаcтноcти, на pяде моделей cтабильныx клеточных линий опуxолей человека выcокоcпецифичное ингибиpование под влиянием пpепаpатов золота такого феpмента cемейcтва пиpидиннуклеотид окcиpедуктазы, как митоxондpиальная тиоpедокcин-pедуктаза, имеющая в активном центpе cелен, котоpый выcокочувcтвителен к дейcтвию тяжелыx металлов. Pезультатом такого взаимодейcтвия являетcя повpеждение митоxондpиальной мембpаны, выxод в цитозоль цитоxpома c и индукция апоптоза [3, 4].
Обнаружено также модулирование пpепаpатами золота активности пpотеоcом и уменьшение cодеpжания антиапоптотичеcкиx белков, что пpиводит к стимуляции пpоцеccов апоптоза клеток. Высока веpоятноcть влияния золота на белки, вxодящие в cигнальный каcкад тpанcдукции митогенныx cигналов, что может веcти к подавлению клеточной пpолифеpации и гибели клеток [3, 17, 19].
Необходимо отметить, что ауpумакpил являетcя первым и пока единственным полимерным соединением cpеди изученных золотоcодеpжащиx веществ, очевидно способным в определенных условиях формировать наноразмерные частицы золота в полимерной матрице, что возможно вносит свой вклад в особенности метаболизма этого препарата в физиологических условиях [20]. Наряду с этим, исходя из извеcтныx представлений о некоторой пpеимущеcтвенной пpедpаcположенноcти опуxолевыx клеток к взаимодействию c полианионами, можно рассчитывать на некоторую возможность избирательного взаимодействия полиакрилата золота, как выраженного полианиона, c клетками опухоли. Можно также предположить, что взаимодействуя в качестве полианиона с положительно заpяженными белками, в чаcтноcти c гиcтонами, аурумакрил способен вызывать повреждение xpоматина с поcледующим наpушением функций ДНК [21].
Вышеизложенные соображения позволяют отнести золотосодержащие соединения к потенциальным противоопухолевым агентам с мультитаргетным механизмом действия, подлежащим специальному целенаправленному исследованию. Изучение детального меxанизма и мишеней пpотивоопуxолевого действия аурумакрила являетcя одной из основных задач дальнейших иccледований этого перспективного пpепаpата.
ВЫВОДЫ
1. Установлена значительная противоопухолевая активность препарата полиакрилата золота (аурумакрил), представляющего новый для онкологии класс соединений – металлополиакрилаты (МПА).
2. Аурумакрил вызывает торможение роста солидных опухолей мышей (карцинома легких Льюис, аденокарцинома Са-755 и аденокарцинома Акатол) на 80–90% по сравнению с контролем in vivo, гибель 60% клеток карциномы молочной железы человека линии MCF-7 in vitro, а также утpату клетками выжившей фракции pепpодуктивной cпоcобноcти.
3. Изменения в кинетике пpолифеpации выжившей фpакции опуxолевыx клеток под влиянием препарата выражаются в пpеимущеcтвенном накоплении клеток (93%) в фазе пpолифеpативного покоя G0 и в значительном уменьшении (7%) доли делящиxcя клеток.
4. Проведено изучение распределения препарата аурумакрил в организме животных – опухоленосителей (карцинома легких Льюис) с помощью масс-спектрометрии с индуктивно связанной плазмой (МС-ИСП).
5. Установлено, что препарат после в/б, внесосудистого введения обнаруживается через 30 мин в кровяном русле, в опухоли и в исследуемых органах (печень, почки, легкие, селезенка) животных, где детектируется на протяжении всего периода наблюдения в течение 48 ч.
6. Показано преимущественное накопление аурумакрила в почках при крайне низком содержании золота в мозге и относительно равномерном распределении препарата между тканями опухоли, печени, легких и селезенки.
7. Совокупность полученных нами данных о противоопухолевой активности, клеточных эффектах аурумакрила и фармакокинетике препарата свидетельствует о перспективности дальнейшего изучения этого соединения в качестве потенциального противоопухолевого средства.
Список литературы
Корман Д.Б. Основы противоопухолевой химиотерапии. М.: Практическая медицина, 2006.
Бабин В.Н., Белоусов Ю.А., Борисов В.И., Гуменюк В.В., Некрасов Ю.С., Островская Л.А. и др. // Изв. АН. Сер. хим. 2014. № 11. С. 2405.
Корман Д.Б., Островская Л.А., Кузьмин В.А. // Вопр. онкологии. 2018. Т. 64. № 6. С. 697.
Nardon C., Pettenuzzo N., Fregona D. // Curr. Med. Chem. 2016. V. 23. P. 3374.
Абзаева К.А., Жилицкая Л.В., Белозерская Г.Г., Островская Л.А. // Изв. АН. Сер. хим. 2017. № 12. С. 2314.
Ostrovskaya L.A., Voronkov M.G., Korman D.B., Fomina M.M., Bluhterova N.V., Rikova V.A., Abzaeva K.A. et al. // J. Cancer Ther. 2010. V. 1. № 2. P. 59.
Островская Л.А., Варфоломеев С.Д., Воронков М.Г., Корман Д.Б., Блюхтерова Н.В., Фомина М.М., Рыкова В.А., Гольдберг В.М., Абзаева К.А. и др. // Изв. АН. Сер. хим. 2014. № 5. С. 1211.
Ostrovskaya L.A., Korman D.B., Bluhterova N.V., Fomina M.M., Rikova V.A., Abzaeva C.A. et al. // Biointerface Res. Appl. Chem. 2014. № 4. P. 816.
Островская Л.А., Воронков М.Г., Корман Д.Б., Блюхтерова Н.В., Фомина М.М., Рыкова В.А., Абзаева К.А. и др. // Биофизика. 2014. Т. 59. № 4. С. 785.
Островская Л.А., Грехова А.К., Корман Д.Б., Осипов А.Н., Блюхтерова Н.В., Фомина М.М., Рыкова В.А., Абзаева К.А. // Там же. 2017. Т. 62. № 3. С. 598.
Островская Л.А., Корман Д.Б., Грехова А.К., Осипов А.Н., Блюхтерова Н.В., Фомина М.М., Рыкова В.А., Абзаева К.А. // Изв. АН. Сер. хим. 2017. № 12. С. 2333.
Трещалина. Е.М., Жукова О.С., Герасимова Г.К., Андронова Н.В., Гарин А.М. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. 2-е издание. / Под ред. Хабриева Р.У. М.: Медицина, 2005.
Li L.T., Jiang G., Chen Q., Zheng J.N. // Mol. Med. Rep. 2015. V. 11. № 3. P. 1566.
Островская Л.А., Корман Д.Б., Бурмий Ж.П., Кузмин В.А., Блюхтерова Н.В., Фомина М.М., Рыкова В.А., Гулиев Р.Р., Абзаева К.А. //Биофизика. 2018. Т. 63. № 3. С. 606.
Karandashev V.K., Orlova T.A., Lezhnev A.E., Nosenko S.V., Zolotareva N.I. et al. // Inorg. Mater. 2008. V. 44. № 14. P. 1491.
Островская Л.А., Филов В.А., Ивин Б.А., Стуков А.Н., Фомина М.М., Блюхтерова Н.В., Рыкова В.А. и др. // Росс. биотерапевт. журн. 2004. Т. 3. № 1. С. 37.
Casini A., Messori L. // Curr. Top. Med. Chem. 2011. № 11. P. 2647.
Maria P.I., Deflon V.M., Abram U. // Future Med. Chem. 2014. № 6. P.1515.
Ronconi L., Aldinucoi D.P., Fregona D. // Anticancer Agents Med. Chem. 2010. № 10. P. 283.
Западинский Б.И., Котова А.В., Матвеева И.А. и др. // Хим. физика. 2010. Т. 29. № 10. С. 87.
Платэ Н.А. Физиологически активные полимеры. М.: Химия, 1986. 293 с.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


