Химическая физика, 2019, T. 38, № 2, стр. 76-82
Термопластичные поликомплексы алюмоборофосфатов с анилином
А. Ю. Шаулов 1, *, Е. М. Нечволодова 1, Р. А. Сакович 1, Л. В. Владимиров 1, А. В. Грачев 1, Л. А. Ткаченко 1
1 Институт химической физики им. Н.Н. Семёнова Российской академии наук
Москва, Россия
* E-mail: ajushaulov@yandex.ru
Поступила в редакцию 20.06.2018
После доработки 20.08.2018
Принята к публикации 20.06.2018
Аннотация
Получены продукты взаимодействия олигомерного алюмоборофосфата (АФС) с анилином, представляющие собой комплексы на основе водородных связей, что подтверждено даннами ИК-спектроскопии и квантовохимическими расчетами. Показано, что атомы азота и водорода аминогруппы анилина образуют водородные связи соответственно с атомами водорода и кислорода фосфатной группы АФС с суммарной энергией в 14.2 ккал/моль. Анилин при добавлении к АФС, окруженному оболочкой из молекул воды, анилин вытесняет две молекулы воды с “поверхности” цепи. Выигрыш в энергии составляет 9.1 ккал/моль. Методом ИК-спектроскопии в твердотельном образце поликомплекса обнаружены сильные донорно-акцепторные взаимодействия молекул воды с атомами алюминия и фосфора алюмоборофосфата. Образование термопластичных олигомерных комплексов сопровождается увеличением температуры размягчения и текучести с ростом содержания анилина. Это означает, что в “мягких” условиях возможна модификация монофункциональным амином полиоксидного неорганического полимера – металлофосфата. Показано, что водостойкость поликомплекса выше, чем у алюмоборофосфата.
Металлофосфаты и их композиции находят широкое применение при производстве высокотемпературных материалов [1–3], огнезащитных покрытий [4–6] и неорганических клеев [7]. В качестве составляющих этих композиций используются, в частности, смеси азотсодержащих органических соединений (аминов, аминоспиртов, амидов), которые рассматриваются как компоненты, повышающие рН среды, способствуя тем самым отверждению смесей [8]. Учитывая практическую значимость этих полимеров, представляет интерес рассмотреть возможный механизм влияния аминов на свойства металлофосфатов, используемых в виде водных растворов с целью расширения области их применения.
Ранее при исследовании совместной полимеризации борной кислоты и капролактама было обнаружено образование водородных связей между оксидами бора и атомами азота мономерных звеньев синтезируемого полиамида [9]. Кроме того, показано, что физические взаимодействия атомов азота органических соединений с полиоксидами бора настолько эффективны, что ингибируют процесс поликонденсации борной кислоты [10, 11]. Исходя из этого, рассмотрена возможность физической модификации олигомерного алюмоборофосфата анилином как монофункциональным соединением.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В экспериментах использовали 55%-ный водный раствор алюмоборофосфата в соотношении Al/P, равном 2 (торговый дом ВЗХР, г. Воскресенск, Россия), и анилин марки “ч” (ГОСТ 5819-78, Россия). Термическую обработку образцов проводили в интервале температур 110–150 °С при подъеме температуры со скоростью 10°/мин и последующей выдержке при заданном значении. Термомеханический анализ был проведен на приборе Netzsch–TMA 402/2/G (Netzsch, Германия), для термогравиметрического анализа (ТГА) использовали прибор Netzsch-DSK Jupiter STA 449 F3 (Netzsch, Германия). ИК-спектры регистрировали с помощью фурье-спектрометра Vertex-70 (Bruker, Германия) с разрешением 4 см−1. Для измерения спектров нарушенного полного внутреннего отражения (НПВО) использовали горизонтальную приставку GladiATR (Pike Technologies, США) с элементом внутреннего отражения из алмаза (однократное отражение при угле падения излучения 45°). Регистрацию и обработку спектров проводили с помощью пакета программ Opus 7.0 (Bruker, Германия). Квантовохимические расчеты выполнены с использованием ресурсов суперкомпьютерного комплекса МГУ им. М.В. Ломоносова методом теории функционала плотности DFT [12] с функционалом bh-lyp [13] при помощи квантовохимического пакета Turbomole [14]. Оптимизация геометрии проводилась в тройномдзета-базисе TZVP [15], а для расчета энергий взаимодействия использовались абсолютные электронные энергии комплексов, рассчитанные в четверномдзета-базисе QZVP [15]. При использовании четверногодзета-базиса ошибка при вычислении энергий взаимодействия комплексов BSSE резко уменьшается и ею можно пренебречь [16].
С целью изучения свойств композиций алюмоборофосфата и анилина измерены термомеханические характеристики продуктов термической обработки гомогенных водных растворов алюмоборофосфата и анилина. Обнаружено, что увеличение температуры, времени термической обработки и концентрации анилина сопровождается ростом температур размягчения и текучести образцов.
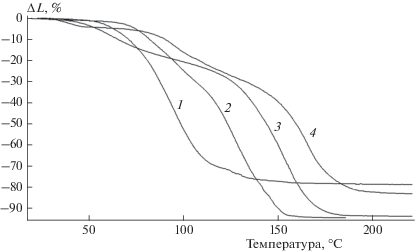
В качестве примера приведены термомеханические кривые продуктов термической обработки водных растворов АФС с анилином при Т = 110 °С в течение 1.5 ч (рис. 1). Характер кривых указывает на термопластичный характер исследованных продуктов взаимодействия компонентов и существенное влияние содержания анилина не только на температуры размягчения (Тр) и текучести (Ттек), но и на состав продуктов, отражающийся на форме кривых.
Рис. 1.
Термомеханические характеристики композиций алюмоборофосфата с анилином при различных соотношениях АФС/анилин (синтез проведен в течение 1.5 ч при 110 °С: 1 – чистый АФС, 2 – 90/10, 3 – 75/25, 4 – 70/30 мас. %.
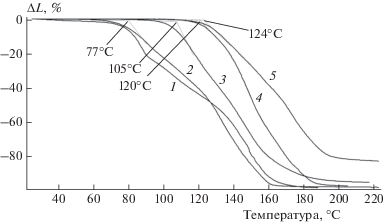
Количественный анализ влияния времени термической обработки растворов АФС/анилин на термомеханические характеристики продуктов взаимодействия компонентов и сравнение с характеристиками термообработанного АФС также показали рост значений Тр и Ттек с увеличением времени взаимодействия (рис. 2). Показано, что при увеличении времени термической обработки растворов АФС/анилин значения Тр и Ттек растут по сравнению с аналогичными характеристиками для термообработанного АФС (рис. 2). Интересно отметить, что измеренные температуры размягчения и текучести, являющиеся важными параметрами переработки термопластов, близки к аналогичным величинам для широкого круга органических полимеров, что указывает на возможность использования полученных соединений при разработке новых материалов с применением традиционных методов переработки пластмасс.
Рис. 2.
Термомеханические характеристики продуктов взаимодействия алюмоборофосфата с анилином при соотношении АФС/анилин 80/20 мас. % и различных временах синтеза при 130 °С: (1) АФС, 2 – 30, 3 – 60, 4 – 90, 5 – 120 мин.
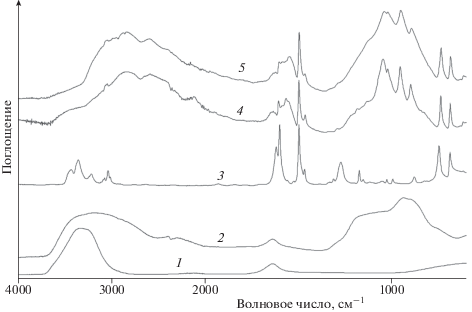
С целью определения природы полученных продуктов проведен анализ ИК-спектров водных растворов алюмоборофосфата и их смесей с анилином. По частотам полос при 3430 и 3350 см−1, относящихся соответственно к асимметричным и симметричным валентным колебаниям связей N–H анилина, можно сделать вывод об их ассоциации (рис. 3, кривая 3). Анализ ИК-спектров водных растворов АФС, содержащих анилин, показал значительные спектральные изменения, наиболее заметно проявляющиеся в области валентных колебаний NH-групп: резкий низкочастотный сдвиг и уменьшение интенсивности полос валентных колебаний NH-групп, которые становятся практически незаметными за счет включения в общую систему взаимодействий (рис. 3, кривая 4). Показано также, что полоса валентных колебаний ОН-групп в растворах сильно смещена в область низких частот и значительно уширена по сравнению с полосой спектра воды при 3400 см−1, что свидетельствует об образовании прочных водородных связей воды с АФС (рис. 3, кривые 4, 5).
Рис. 3.
ИК-спектры исходных соединений и продуктов взаимодействия алюмоборофосфата с анилином: 1 – вода, 2 – АФС, 3 – анилин, 4 – АФС/50 мас. % анилина (25 °С), 5 – АФС/50 мас. % анилина (150 °С).
В широком диапазоне частот (3650–1850 см−1) наблюдается так называемое непрерывное поглощение, характерное для водных растворов смесей солей металлов, способных в твердом состоянии образовывать несколько форм кристаллогидратов [17, 18]. Появление непрерывного поглощения в водных растворах АФС свидетельствует о различном числе молекул воды в сольватной оболочке АФС. Каждой из этих форм соответствует смещенная в область низких частот уширенная (250–300 см−1) полоса валентных колебаний воды.
Как было показано ранее, образование Н-связей приводит к низкочастотному смещению полос валентных колебаний протонодонорных групп, однако известно, что при этом полосы деформационных колебаний смещаются в область более высоких частот (на 5–30 см−1), что характерно в основном для органических соединений [19]. Следует отметить, что введение анилина в водный раствор АФС сильно меняет положение отдельных максимумов и полуширину полос валентных колебаний воды, что свидетельствует о “встраивании” анилина в общую систему водородных связей (рис. 3, кривые 4, 5).
Наряду с этим в ИК-спектрах композиций наблюдается сильное ослабление интенсивности полосы деформационных колебаний NH2-групп анилина (полоса при 1618 см−1). Кроме того, появляется новая полоса при 1580 см−1, которая смещается к 1567 см−1 после прогрева образа при 160 °С. Эти факты можно объяснить взаимодействием NH2-групп анилина с атомами алюминия или фосфора. Дополнительным аргументом в пользу такого взаимодействия является значительный сдвиг полосы валентных колебаний CN-связи анилина от 1274 см−1 в область низких частот до ∼1200 см−1, где она перекрывается группой полос валентных колебаний ${\text{PO}}_{4}^{{ - 3}}$-групп.
Возможность образования комплексов АФС с анилином и энергия взаимодействия молекул воды и анилина с макромолекулой АФС, а также структура комплексов изучены с помощью квантовохимических расчетов. Найдены минимумы на поверхности потенциальной энергии основного электронного состояния изолированных молекул алюмоборофосфата и анилина в вакууме, а также их комплекса. В таком комплексе атом азота аминогруппы соединен с атомом водорода фосфатной группы АФС связью длиной 0.174 нм, а атом водорода с кислородом АФС – связью длиной 0.233 нм (рис. 4).
Рис. 4.
Структура бимолекулярного комплекса мономерного звена АФС с анилином в вакууме, отвечающая минимуму на поверхности потенциальной энергии.
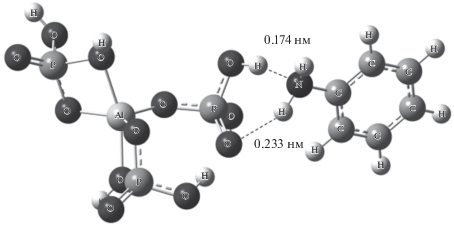
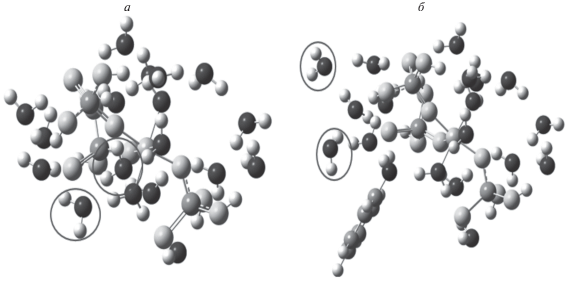
Общая энергия водородных связей была определена как разность электронной энергии комплекса и суммарной электронной энергии его компонентов и составляет 14.2 ккал/моль. Аналогично было исследовано взаимодействие анилина с АФС, находящимся в водном окружении, и показано, что добавление одной молекулы анилина приводит к вытеснению двух молекул воды с цепи алюмоборофосфата (на рис. 5 эти молекулы выделены овалом); при этом суммарный выигрыш энергии составляет 9.1 ккал/моль. Это означает, что энергия водородной связи молекулы воды с алюмоборофосфатом составляет 4.5 ккал/моль, что близко к экспериментальным значениям [20].
Рис. 5.
Структура АФС в водном окружении до (а) и после (б) добавления молекулы анилина (атомы кислорода АФС на рисунке светлые, а атомы кислорода воды темные).
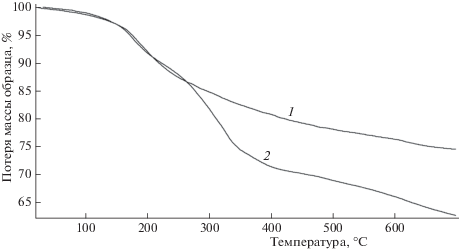
Алюмоборофосфат и полученные поликомплексы, термически обработанные в одинаковых условиях (130 °С, 1.5 ч), были исследованы методом ТГА (рис. 6). При анализе материального баланса образцов АФС и продуктов его взаимодействия с анилином (0–50 мас. % от АФС, 130 °С, 1.5 ч) показано, что содержание воды в АФС составляет 32.3 мас. % и не зависит от концентрации анилина. На примере композиции с 20 мас. % анилина показано, что начальные потери массы в процессе термогравиметрических измерений образцов при температуре до 250 °С не зависят от содержания анилина и составляют 13 мас. %. Учитывая, что максимальная потеря массы АФС при 700 °С составляет 25.1 мас. %, а исходная концентрация воды равна 32.3 мас. %, можно заключить, что остаточной воды в данном образце содержится не менее 32.3–25.1 = 7.2 мас. %.
Иная картина наблюдается в смесевых композициях с анилином при Т > 250 °С: потеря массы образца возрастает до максимального значения, составляющего 37.5 мас. %. Следовательно, если принять за основу конечный состав АФС после его термообработки до 700 °С, можно заключить, что концентрация продуктов деструкции анилина составляет 37.5 – 25.1 – 7.2 = 5.2 мас. %.
Более детальная картина происходящих процессов может быть получена при сопоставлении термогравиметрических и калориметрических данных (рис. 7) в исследуемом интервале температур. Производная кривой потери массы позволяет связать между собой области изменения массы и тепловых эффектов.
Рис. 7.
Термогравиметрические измерения и тепловые эффекты образцов АФС и смеси АФС/20 мас. % анилина при сканировании температуры: 1а – калориметрическая кривая АФС, 2а – калориметрическая кривая смеси АФС/20 мас. % анилина, 1б – термогравиметрическая кривая АФС, 2б – термогравиметрическая кривая смеси АФС/20 мас. % анилина, 1в – производная термогравиметрической кривой смеси АФС/20 мас. % анилина.
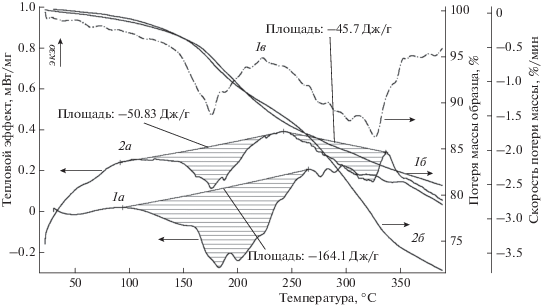
Как следует из представленных данных, температурные области потери массы обоих образцов идентичны (250–260 °С), что может быть связано с потерей воды. При более высоких температурах на фоне монотонной потери массы АФС не обнаружено заметного теплового эффекта, в то время как для АФС в смеси с анилином наблюдается эндотермический эффект, связанный, вероятнее всего, с потерей анилина.
Следует отметить, что нужно проявлять определенную осторожность при количественном сопоставлении тепловых эффектов потери воды для АФС и его смеси с анилином в области 250–260 °С в связи с довольно большим разбросом данных в этой области, зависящим, по-видимому, от термической предыстории образца. При анализе калориметрических данных следует также обратить внимание на неявно выраженный экзотермический тепловой эффект в области 330–350 °С, который может объясняться окислением анилина.
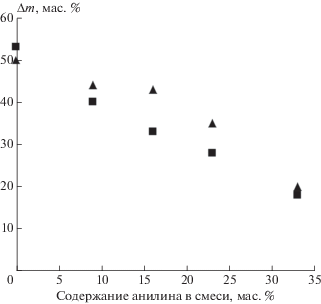
С учетом значительной гигроскопичности образцов АФС, термически обработанных при температуре до 300 °С, было определено влагопоглощение смесевых композиций из атмосферы с 98%-ной влажностью в течение 48 ч в широком диапазоне концентраций анилина. Показано, что с увеличением концентрации анилина до 35 мас. % влагопоглощение образцов линейно уменьшается (рис. 8).
Рис. 8.
Зависимость привеса двух серий образцов АФС и композиций с анилином за 48 ч при 98%-ной влажности атмосферы от содержания анилина в смеси.
В заключение можно сделать вывод, что органические амины могут быть использованы для регулирования релаксационных свойств и водоустойчивости металлофосфата, а образующиеся термопластичные поликомплексы подвергнуты переработке с применением традиционных технологий переработки пластмасс.
Работа выполнена в рамках госзадания ФАНО России (тема 45.11, 0082-2014-0009, № АААА-А17-117040610309-0).
Список литературы
Голынко-Вольфсон С.Л., Сычев М.М., Судакас Л.Г., Скобло Л.И. Химические основы технологии и применения фосфатных связок и покрытий. Л.: Химия, 1968.
Копейкин В.А., Петрова А.П., Рашкован И.Л. Материалы на основе металлофосфатов. М.: Химия, 1976.
Копейкин В.А., Клементьева B.C., Красный Б.Л. Огнеупорные растворы на фосфатных связующих. М.: Металлургия, 1986.
Огнезащитный состав для металлоконструкций: Патент 2422489. РФ // Б.И. 2011. № 18.
Афанасьев С.В., Махлай В.Н., Михайлин М.П., Коротков Р.В. Способ получения огнезащитного состава: Патент 2277046. РФ // Б.И. 2006. № 15.
Махлай В.Н., Афанасьев С.В., Рощенко О.С., Кузьмин И.В. Холоднотвердеющая смесь для изготовления литейных форм и стержней: Патент 2354489. РФ // Б.И. 2009. № 13.
Сычев М.М. Неорганические клеи. Л.: Химия, 1986.
Афанасьев С.В., Кузьмин И.В. // Башк. хим. журн. 2012. Т. 119. № 5. С. 46.
Шаулов А.Ю., Скачкова В.К., Саламатина О.Б. и др. // Высокомолекуляр. соединения. А. 2006. Т. 48. С. 397.
Нечволодова Е.М., Сакович Р.А., Грачев А.В., Глаголев Н.Н., Мотякин М.В., Шаулов А.Ю., Берлин А.А. // Хим. физика. 2017. Т. 36. № 5. С. 82.
Нечволодова Е.М., Грачев А.В., Сакович Р.А., Владимиров Л.В., Шашкин Д.П., Ткаченко Л.А., Шаулов А.Ю., Берлин А.А. // Хим. физика. 2017. Т. 36. № 9. С. 66.
Gross E.K.U., Kohn W. // Adv. Quantum Chem. 1990. V. 21. P. 255.
Becke A.D. // J. Chem. Phys. 1993. V. 98. P. 1372.
Furche F., Ahlrichs R., Hattig C. et al. // Comput. Mol. Sci. 2014. V. 4. P. 91.
Weigend F., Ahlrichs R. // Phys. Chem. Chem. Phys. 2005. V. 7. P. 3297.
Mentel L.M., Baerends E.J. // J. Chem. Theory Comput. 2014. V. 10. № 1. P. 252.
Jastrzebski M., Sitarz M., Rokita M., Bulat K. // Spectrochim. Acta. A. 2011. V. 49. № 4. P. 722.
Huminick D., Hawthorne F.C. // Rev. Miner. Geochem. 2002. V. 48. № 1. P. 123.
Беллами Л. Инфракрасная спектроскопия сложных молекул. М: Мир, 1963.
Luck W.A.P. // A Comprehensive Treatise. V. 2. New York: Plenum, 1973. Ch. 4. P. 320.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика