Химическая физика, 2019, T. 38, № 2, стр. 63-70
Кинетика полимеризации изопрена в присутствии каталитической системы NdCl3 ⋅ nCH3CH(OH)CH3–Al(i-C4H9)3–пиперилен
К. А. Терещенко 1, Н. В. Улитин 1, *, Д. А. Шиян 1, Г. Ф. Альметова 1, Е. М. Захарова 2, И. Ш. Насыров 3, В. П. Захаров 4
1 Казанский национальный исследовательский технологический университет
Казань, Россия
2 Уфимский институт химии Уфимского федерального исследовательского центра
Российской академии наук
Уфа, Россия
3 ОАО “Синтез-Каучук”
Стерлитамак, Россия
4 Башкирский государственный университет
Уфа, Россия
* E-mail: n.v.ulitin@mail.ru
Поступила в редакцию 20.04.2018
После доработки 20.08.2018
Принята к публикации 13.07.2018
Аннотация
Разработана модель кинетики образования комплекса NdCl3 ⋅ nROH (ROH – изопропиловый спирт, n – степень вхождения спирта в комплекс), связывающая исходный диаметр частиц NdCl3 с кинетикой образования комплекса NdCl3 ⋅ nROH и значением n. Разработана также модель кинетики полимеризации изопрена в присутствии каталитической системы NdCl3 ⋅ nROH–Al(i-C4H9)3–пиперилен, описывающая кинетику полимеризации и молекулярно-массовые характеристики изопренового каучука. По результатам моделирования показано, что: 1) наблюдаемое экспериментально возрастание скорости полимеризации с увеличением n от 0.75 до 2.43 вызвано увеличением концентрации центров роста цепей; 2) наблюдаемая экспериментально зависимость молекулярно-массовых характеристик изопренового каучука от n объясняется функционированием различных типов центров роста цепей при различных значениях n и наличием распределения концентрации изопрена по радиусу полимер-катализаторной частицы (частицы каталитической системы с адсорбированными на ее поверхности цепями изопренового каучука).
ВВЕДЕНИЕ
Изопреновый каучук (полиизопрен) с самым высоким содержанием цис-1,4-звеньев (до 99%) получают в присутствии неодимовых каталитических систем Циглера–Натта [1, 2]. Активность таких неодимовых каталитических систем увеличивается с ростом числа электронодонорных лигандов в связи с тем, что они понижают положительный заряд на атоме неодима и увеличивают степень алкилирования катализатора сокатализатором [1]. В работах [3, 4] на примере каталитической системы NdCl3 ⋅ nROH–Al(i-C4H9)3–пиперилен (ROH – изопропиловый спирт, n – степень его вхождения в комплекс NdCl3 ⋅ nROH) установили, что увеличения количества электронодонорных лигандов ROH можно добиться за счет уменьшения размеров частиц NdCl3 (этот эффект обнаружили в результате однократного кратковременного пропускания смеси NdCl3 и изопропилового спирта в среде жидкого парафина через трубчатый турбулентный аппарат диффузор-конфузорной конструкции). Уменьшение размеров частиц NdCl3 привело также к изменению молекулярно-массовых характеристик изопренового каучука [2]. В работе [2] по итогам решения обратной задачи молекулярно-массового распределения изопренового каучука установили, что если n ≤ 1.71, то в процессе полимеризации участвуют центры роста цепей (активные центры полимеризации) двух типов (тип 1 и тип 2), а если n > 1.71 – одного типа (тип 3). Центры роста цепей различных типов отличаются друг от друга величиной молекулярной массы получаемых на них макромолекул. Настоящая работа посвящена экспериментальному и теоретическому исследованию влияния степени n вхождения ROH в комплекс NdCl3 ⋅ nROH после диспергирования частиц NdCl3 · в турбулентных потоках на скорость полимеризации изопрена (М) в присутствии каталитической системы NdCl3 ⋅ nROH–Al(i-C4H9)3–пиперилен и на молекулярно-массовые характеристики изопренового каучука.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использовали изопрен с содержанием основного продукта 98–99.5%. Пиперилен с содержанием 65% транс- и 35% цис-изомеров перегоняли над Al(i-C4H9)3. Трихлорид неодима NdCl3 получили осушкой гексагидрата хлорида неодима.
Полимеризацию изопрена проводили двумя способами.
Способ 1. Каталитический комплекс NdCl3 ⋅ nROH получили в результате комплексообразования NdCl3 ([NdCl3]0 = 0.7 ммоль/л; здесь и далее […] – концентрация вещества, индекс “0” – концентрация в начальный момент времени) с ROH ([ROH]0 = 2.1 ммоль/л), проводимого при 298 K в среде жидкого парафина в круглодонной колбе объемом 500 см3 при перемешивании магнитной мешалкой. Каталитическую систему готовили в такой же колбе в атмосфере аргона при непрерывном перемешивании: в смесь толуола, Al(i-C4H9)3 и пиперилена ([Al(i-C4H9)3]0 = 8.4 ммоль/л; [пиперилен]0 = 0.7 ммоль/л), охлажденную до 258 K, добавляли комплекс NdCl3 ⋅ nROH; полученную смесь выдерживали сначала 40 мин при 268 K, а затем 24 ч при 298 K. Полимеризацию вели при непрерывном перемешивании магнитной мешалкой раствора изопрена ([M]0 = 1.5 моль/л) и каталитической системы в толуоле при 298 K в круглодонной колбе объемом 500 см3.
Способ 2. Процесс осуществляли аналогично способу 1. Однако перед комплексообразованием пропустили смесь NdCl3 и ROH в среде жидкого парафина со скоростью 0.9 м/c через трубчатый турбулентный аппарат диффузор-конфузорной конструкции. Последний состоял из шести диффузор-конфузорных секций длиной по 0.048 м каждая с диаметрами диффузора и конфузора, равными соответственно 0.024 и 0.015 м. Угол раскрытия диффузора составлял 45°.
Конверсию изопрена в процессе полимеризации определяли гравиметрическим методом. Молекулярно-массовые характеристики изопренового каучука определяли методом гель-проникающей хроматографии на хроматографе фирмы Waters, откалиброванном по полистирольному стандарту с коэффициентом полидисперсности 1.1.
Размеры частиц каталитического комплекса NdCl3 ⋅ nROH определяли методом лазерной дифракции/рассеяния на приборе Sald-7101 (Shimadzu). Содержание спирта в жидкой фазе определяли методом высокоэффективной жидкостной хроматографии на приборе LC-20 (Shimadzu).
РАЗРАБОТКА МОДЕЛЕЙ КИНЕТИКИ ОБРАЗОВАНИЯ КОМПЛЕКСА NdCl3 ⋅ nROH И КИНЕТИКИ ПОЛИМЕРИЗАЦИИ ИЗОПРЕНА
Сначала теоретически описали кинетику образования комплекса NdCl3 ⋅ nROH. Полагали, что данный процесс состоит из трех стадий: 1) адсорбция молекул ROH на поверхности частиц NdCl3; 2) абсорбция молекул ROH внутренними слоями частиц NdCl3; 3) выделение из частиц NdCl3 частиц NdCl3 ⋅ nROH. В качестве допущения приняли, что размеры всех частиц NdCl3 одинаковы. Таким образом, в модель кинетики образования комплекса NdCl3 ⋅ nROH вошли следующие уравнения:
1) уравнение скорости изменения концентрации ROH, адсорбированного на поверхности частиц NdCl3, –
где S – концентрация ROH, адсорбированного на поверхности частиц NdCl3; S ' и I ' – концентрации вакантных мест для молекул ROH на поверхности и во внутренних слоях частиц NdCl3, соответственно; k1 и k2 – константы скоростей адсорбции и абсорбции ROH, соответственно; t – время;2) уравнение скорости изменения концентрации ROH, абсорбированного внутренними слоями частиц NdCl3, –
где I – концентрация ROH, абсорбированного внутренними слоями частиц NdCl3; k3 – константа скорости выделения частиц NdCl3 ⋅ nROH из частиц NdCl3 под действием уменьшения прочности частиц NdCl3 из-за абсорбированных молекул ROH;3) уравнение скорости изменения концентрации NdCl3 –
4) уравнение скорости изменения концентрации ROH в реакционной массе (не в частицах NdCl3 и NdCl3 ⋅ nROH) –
5) уравнение для диаметра D частиц NdCl3 –
Концентрации S ' и I ' задавали из условия, что S ' + S и I ' + I будут равны предельной для данного значения [NdCl3] концентрации адсорбированных и абсорбированных молекул ROH, соответственно. Это предельное количество должно быть пропорционально суммарной поверхности частиц NdCl3, т.е. отношению суммарного объема частиц NdCl3 к их диаметру. Суммарный объем частиц NdCl3, в свою очередь, пропорционален [NdCl3]. Поэтому задали
Аналогичным образом задали зависимость n' от диаметра частиц NdCl3:
где B и b – константы.Частоту диспергирования частиц NdCl3, g, задали таким образом:
Чтобы найти неизвестные константы модели, решили обратную кинетическую задачу по методу Хука–Дживса [5]. При этом расхождение рассчитанных по модели временны́х зависимостей [ROH]/[ROH]0, конверсии NdCl3, диаметра D частиц NdCl3, средней степени вхождения ROH в комплекс NdCl3 ⋅ nROH
Рис. 1.
Изменение конверсии NdCl3 (1, 2, ⚫, ⚪) и отношения [ROH]/[ROH]0 (3, ◼) в процессе образования комплекса NdCl3 ⋅ nROH: 1, 3, ⚫, ◼ – способ 1; 2, ⚪ – способ 2; точки – эксперимент, линии – расчет по модели кинетики образования комплекса NdCl3 ⋅ nROH.
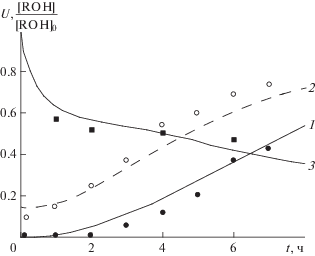
Рис. 2.
Изменение диаметра (D) частиц NdCl3 (1, 2, ⚫, ⚪) и степени вхождения ROH (n) в комплекс NdCl3 ⋅ ⋅ nROH (3, 4, ◼, ◻) в процессе его образования: 1, 3, ⚫, ◼ – способ 1; 2, 4, ⚪, ◻ – способ 2; точки – эксперимент, линии – расчет по модели кинетики образования комплекса NdCl3 ⋅ nROH.
Модель кинетики образования комплекса NdCl3 ⋅ nROH позволяет рассчитать степень n вхождения ROH в комплекс NdCl3 ⋅ nROH, чтобы связать ее с активностью каталитической системы. Для моделирования кинетики полимеризации изопрена использовали две кинетические схемы: 1) при n ≤ 1.71 и 2) при n > 1.71. Помимо большего количества типов центров роста цепей, в схеме 1 присутствует также реакция перехода центров роста цепей типа 1 в центры роста цепей типа 2. Центры роста цепей, способные совершать такие переходы, отмечали индексом “1”. Таким образом, в полимеризации по схеме 1 участвуют центры роста цепей типов 1, 1' и 2, а в полимеризации по схеме 2 – центры роста цепей типа 3. В схемы 1 и 2 вошли следующие реакции:
1) рост цепи –
2) передача цепи на триизобутилалюминий –
3) передача цепи на изопрен –
4) переход центров роста цепей типа 1' в центры роста цепей типа 2 (только для схемы 1 ) –
5) гибель центров роста цепей –
где j – тип центров роста цепей, j = 1, 1', 2, 3; Rj(0) – исходные центры роста цепей; М – изопрен; A – триизобутилалюминий; Rj(i) – активные полимерные цепи, содержащие i звеньев изопрена и растущие на центрах роста j-го типа; P(i) – неактивная полимерная цепь, содержащая i звеньев изопрена; kpj, kAlj, kMj, kc12, ktj – константы скоростей соответствующих реакций.В работе [6] показали, что коэффициент полидисперсности изопренового каучука, синтезируемого в присутствии каталитической системы на основе комплекса NdCl3 ⋅ nROH с n = 1.90–2.91, лежит в пределах 2.1–4.6. При этом в реакционной массе имеются центры роста цепей только одного типа – типа 3, а значит, теоретическое значение коэффициента полидисперсности должно быть равно 2. Причиной такого расхождения является диффузионная ограничиваемость роста цепи. Диффузионные ограничения объяснили формированием полимер-катализаторных частиц (частиц каталитической системы радиусом r с адсорбированными на их поверхности цепями изопренового каучука [7]). По мере приближения к центру полимер-катализаторной частицы в ней уменьшается концентрация изопрена, которая может быть описана следующим уравнением [8]:
(1)
$\xi \frac{{\partial [{{{\text{M}}}_{r}}]}}{{\partial t}} = {{K}_{D}}\frac{1}{{{{r}^{2}}}}\frac{\partial }{{\partial r}}\left( {{{r}^{2}}\frac{{\partial [{{{\text{M}}}_{r}}]}}{{\partial r}}} \right) - {{S}_{{act}}}[{{{\text{M}}}_{r}}],$Данное уравнение решили относительно [Mr] при условии $\xi {{\partial [{{{\text{M}}}_{r}}]} \mathord{\left/ {\vphantom {{\partial [{{{\text{M}}}_{r}}]} {\partial t}}} \right. \kern-0em} {\partial t}} \approx 0.$ Полученное решение подставили в системы дифференциальных уравнений, записанных для схем 1 и 2 с применением закона действующих масс и метода производящих функций [9]. Так как концентрация изопрена изменяется по радиусу полимер-катализаторной частицы, все пространство полимер-катализаторной частицы разбили на 10 концентрических слоев с порядковым номером $z = 10{r \mathord{\left/ {\vphantom {r {{{r}_{{max}}}}}} \right. \kern-0em} {{{r}_{{max}}}}} = 1,...,10;$ при этом величинам, относящимся к определенному слою, присвоили в модели индекс “z”. В итоге получили следующий общий вид модели кинетики для схем 1 и 2 :
– статистические моменты молекулярно-массового распределения (c = 0, 1, 2 для неактивных цепей и c = 1, 2 для активных цепей); для концентраций активных цепей используются обозначения
Y – концентрация полимер-катализаторных частиц; [A] – концентрация триизобутилалюминия, находящегося внутри полимер-катализаторных частиц; NA – число Авогадро; ${{4\pi r_{{max}}^{3}} \mathord{\left/ {\vphantom {{4\pi r_{{max}}^{3}} 3}} \right. \kern-0em} 3}Y{{N}_{A}}$ – отношение объема полимер-катализаторных частиц к объему реакционной массы;Таблица 1.
Значения констант скоростей реакций полимеризации изопрена в присутствии каталитической системы NdCl3 ⋅ nROH-Al(i-C4H9)3–пиперилен при температуре 298 K
| Константы скоростей реакций |
Значения констант скоростей для реакций, в которых участвуют центры роста цепей j-го типа |
||
|---|---|---|---|
| j = 1, j = 1' | j = 2 | j = 3 | |
| kpj, л/моль ⋅ мин | 1246 | 8007 | 2561 |
| kAlj, л/моль ⋅ мин | 0.0364 | 0.0115 | 0.281 |
| kMj, л/моль ⋅ мин | 0.254 | 0.16 | 0.223 |
| kc12, мин–1 | 0.08 | – | |
| ktj, мин–1 | 0.05 | 0.05 | 0.07 |
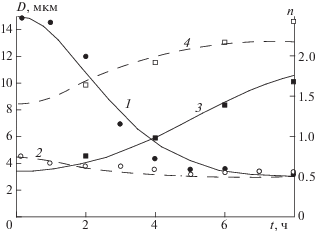
Рис. 3.
Зависимости конверсии изопрена (а), среднечисленной (б) и среднемассовой (в) молекулярных масс изопренового каучука и относительных активностей центров роста цепей различных типов (г, цифры без штриха – активности центров роста цепей типов 1 и 1 ', цифры со штрихом – активности центров роста цепей типа 2) от времени полимеризации; 1–3 – способ 1; 4–6 – способ 2; n = 0.75 (1, ⚫), 1.45 (2, ▲), 1.63 (3, ◼), 1.71 (4, ⚪), 1.95 (5, △), 2.43 (6, ◻); точки – эксперимент [2], линии – расчет по модели кинетики полимеризации.
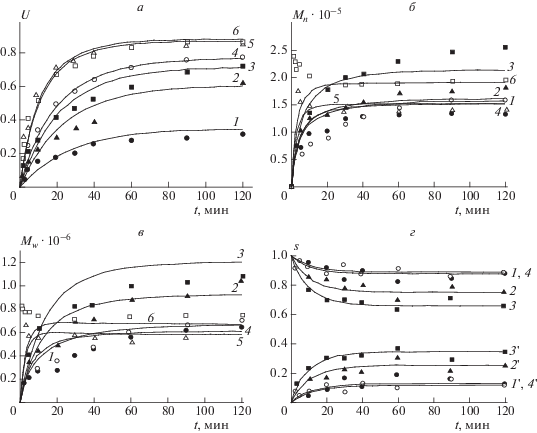
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Найденные в результате решения обратной кинетической задачи значения начальных концентраций центров роста цепей, начальной концентрации тринзоэтилалюминия Al(i-C4H9)3, на который идет передача цепи, и радиуса полимер-катализаторных частиц приведены на рис. 4.
Рис. 4.
Зависимости начальных концентраций $C_{a}^{0}$ центров роста цепей (1, ⚫, при n ≤ 1.71 – тип 1, при n > 1.71 – тип 3), начальной концентрации триизоэтилалюминия Al(i-C4H9)3 (2, ▲), на который идет передача цепи, и радиуса полимер-катализаторных частиц (3, ◼) от степени вхождения ROH (n) в комплекс NdCl3 ⋅ nROH; точки – расчет по модели кинетики полимеризации, линии – аппроксимация.
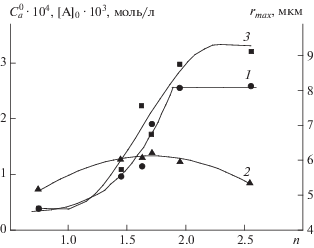
Результаты решения обратной кинетической задачи показывают, что с возрастанием степени n вхождения ROH в комплекс NdCl3 ⋅ nROH от 0.75 до 2.43 происходит увеличение концентрации центров роста цепей (рис. 4, кривая 1) – как уже было сказано ранее, это связано с тем, что ROH понижает положительный заряд на атоме неодима, причем увеличивается степень алкилирования хлорида неодима алюминийорганическим соединением. Как следствие, увеличивается скорость полимеризации (рис. 3а). При этом на зависимости начальной концентрации триизоэтилалюминия, вступающего в передачу цепи, от n наблюдается максимум (рис. 4, кривая 2). Этот максимум соответствует n = 1.7 (рис. 4, кривая 2). Поэтому при возрастании n > 1.7 должно наблюдаться увеличение молекулярных масс изопренового каучука. Тем не менее наибольшей молекулярной массой обладает изопреновый каучук при n = 1.63 (рис. 3б и 3в). Это связано с тем, что центры роста цепей типа 3, существующие при n > 1.7, производят более низкомолекулярные цепи, чем центры роста цепей типа 2 (см. табл. 1).
Функции x(r), представленные на рис. 5, являются решением уравнения (1). Согласно этому уравнению концентрация изопрена в каждом слое частицы определяется равенством скорости увеличения концентрации изопрена вследствие диффузии его молекул из внешних слоев полимер-катализаторной частицы во внутренние и скорости уменьшения концентрации изопрена из-за роста цепи. С возрастанием n увеличивается концентрация центров роста цепей, а значит, увеличивается скорость роста цепи и, как следствие, уменьшается равновесная концентрация изопрена (рис. 5). При этом уменьшается отношение скорости роста цепи к скорости передачи цепи на триизобутилалюминий. Этот фактор также способствует снижению молекулярной массы изопренового каучука с увеличением n.
Рис. 5.
Зависимость отношения концентрации изопрена в слое полимер-катализаторной частицы к концентрации изопрена на поверхности частицы от радиуса слоя частицы r на начальном этапе полимеризации изопрена; 1–3 – способ 1; 4–6 – способ 2; n = 0.75 (1), 1.45 (2), 1.63 (3), 1.71 (4), 1.95 (5), 2.43 (6).
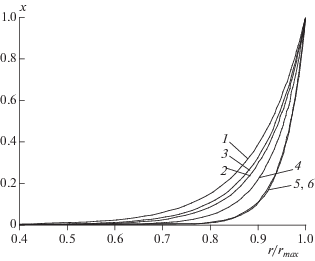
Увеличение концентрации центров роста цепей с возрастанием n (рис. 4, кривая 1) приводит к увеличению радиуса полимер-катализаторных частиц (рис. 4, кривая 3), что дополнительно усиливает диффузионные ограничения и способствует более неравномерному распределению изопрена по радиусу полимер-катализаторных частиц, а также снижению молекулярных масс изопренового каучука.
ЗАКЛЮЧЕНИЕ
Таким образом, в настоящей работе экспериментально показано, что возрастание степени n вхождения ROH в комплекс NdCl3 ⋅ nROH от 0.75 до 2.43 приводит к увеличению скорости полимеризации изопрена в присутствии каталитической системы NdCl3 ⋅ nROH–Al(i-C4H9)3–пиперилен от 0.019 до 0.125 моль/л ⋅ мин. С помощью моделей кинетики образования комплекса NdCl3 ⋅ nROH и кинетики полимеризации установлено, что это вызвано возрастанием концентрации центров роста цепей c 0.5 ⋅ 10–4 до 2.5 ⋅ 10–4 моль/л. Кроме того, экспериментально показано, что при увеличении n от 0.75 до 1.63 значения среднечисленной, Mn, и среднемассовой, Mw, молекулярных масс изопренового каучука возрастают с 1.2 ⋅ 105 и 6 ⋅ 105 до 2.5 ⋅ 105 и 1.1 ⋅ 106, соответственно, а при дальнейшем увеличении n до 2.43 они снижаются до 1.2 ⋅ 105 и 5 ⋅ 105 соответственно. Такую зависимость удалось объяснить в рамках модели кинетики полимеризации, во-первых, влиянием n на диффузионные ограничения реакции роста цепи, вызванные адсорбцией полимерных цепей на поверхности частиц каталитической системы и формированием полимер-катализаторных частиц, и, во-вторых, функционированием различных типов центров роста цепей при различных значениях n.
Работа выполнена в рамках государственного задания на 2017–2019 гг. (инициативный научный проект № 10.5548.2017/8.9).
Список литературы
Friebe L., Nuyken O., Obrecht W. // Adv. Polym. Sci. 2006. V. 204. P. 1.
Захаров В.П., Мингалеев В.З., Берлин А.А., Насыров И.Ш., Жаворонков Д.А., Захарова Е.М. // Хим. физика. 2015. Т. 34. № 3. С. 69.
Морозов Ю.В., Мингалеев В.З., Насыров И.Ш., Захаров В.П., Монаков Ю.Б. // Докл. АН. 2011. Т. 440. № 5. С. 643.
Захаров В.П., Мингалеев В.З., Морозов Ю.В., Насыров И.Ш., Захарова Е.М. // ЖПХ. 2012. Т. 85. № 6. С. 965.
Hooke R., Jeeves T.A. // J. ACM. 1961. V. 8. № 2. P. 212.
Захаров В.П., Мингалеев В.З., Захарова Е.М., Насыров И.Ш., Жаворонков Д.А. // ЖПХ. 2013. Т. 86. № 6. С. 967.
Бодрова В.С., Пискарева Е.П., Шелохнева Л.Ф., Полетаева И.А. // Высокомолекуляр. соединения. А. 1998. Т. 40(А). № 11. С. 1741.
Floyd S., Heiskanen T., Taylor T.W., Mann G.E., Ray W.H. // J. Appl. Polym. Sci. 1987. V. 33. № 4. P. 1021.
Терещенко К.А., Зиганшина А.С., Захаров В.П., Улитин Н.В. // Хим. физика. 2017. Т. 36. № 5. С. 87.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


