Химическая физика, 2019, T. 38, № 2, стр. 3-8
Термическое разложение N-[2,2-бис(метокси-NNO-азокси)этил]-4-нитропиразола
В. В. Захаров 1, *, Н. В. Чуканов 1, И. Н. Зюзин 1, В. В. Неделько 1, Б. Л. Корсунский 1
1 Институт проблем химической физики Российской академии наук
Черноголовка, Россия
* E-mail: vzakh@icp.ac.ru
Поступила в редакцию 03.11.2017
После доработки 20.09.2018
Принята к публикации 05.09.2018
Аннотация
С использованием методов дифференциальной сканирующей калориметрии, термогравиметрии, масс-спектрометрии и ИК-спектроскопии изучено термическое разложение энергоемкого N-[2,2-бис(метокси-NNO-азокси)этил]-4-нитропиразола и определен состав образующихся продуктов. Найдены его теплота плавления, теплота и энергия активации термического разложения, а также предэкспоненциальный фактор. Обсужден механизм процесса. Показано, что введение нитропиразольного фрагмента в молекулу диазеноксида не приводит к уменьшению его термической стабильности.
ВВЕДЕНИЕ
В последние годы возрос интерес к нитропиразолам [1, 2] как потенциальным компонентам перспективных энергетических материалов (взрывчатые вещества, твердые ракетные топлива, пороха). Однако с ростом числа нитрогрупп в цикле растет не только энергетика нитропиразолов, но и их кислотность, которая отрицательно влияет на стабильность и другие эксплуатационные свойства. Основной путь решения этой проблемы состоит в замене кислого NH-протона в пиразольном цикле C-заместителем с энергетическими группами (NO2, NNO2, ONO2, N3 и др.). В качестве такого заместителя предложена 2,2-бис(метокси-NNO-азокси)этильная группа [3–7]. Эта группа принадлежат к относительно малоизвестному классу алкокси-NNO-азоксисоединений [8–10]. Алкоксиазоксисоединения имеют одинаковый с нитраминами элементный состав, но превосходят их по энтальпии образования [11], а также по термической [12] и химической стабильности [13–17]. Недавно эта идея была реализована. Синтезированы N-[2,2-бис(метокси-NNO-азокси)этил]-4-нитропиразол (I) и его аналоги с другим числом и положением нитрогрупп [1].
Настоящая работа посвящена изучению термического разложения N-[2,2-бис(метокси-NNO-азокси)этил]-4-нитропиразола (I) как модельного соединения, сочетающего в одной молекуле 2,2-бис(метокси-NNO-азокси)этильную группу и нитропиразольный фрагмент:
I
При выборе объекта исследования мы учитывали тот факт, что введение в молекулу 4-нитропиразола в качестве N-заместителя 2,2-бис(метокси-NNO-азокси)этильной группы позволяет иметь в составе смесевого энергоемкого материала высокое содержание водорода при сохранении положительной энтальпии образования, что важно в случае его использования в качестве компонента пороха или твердого ракетного топлива.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Соединение I синтезировано по известной методике [1]. Его температуры плавления, ИК-спектры и ЯМР-(1Н, 13С и 15N)-спектры соответствовали литературным данным [1]. Перед началом работ I перекристаллизовывали из этанола. Чистота I подтверждена данными элементного анализа. Найдено, %: C 29.03; H 3.78; N 33.52. C7H11N7O6. Вычислено, %: C 29.07; H 3.83; N 33.90.
Термическое разложение I изучено в неизотермическом режиме методами ДСК и ТГ с использованием синхронного термического анализатора STA 409C Luxx (Netzsch, Германия), сопряженного с квадрупольным масс-спектрометром QMS 403C Aeolos (Netzsch, Германия), в диапазоне температур 30–350°С, при продувке аргоном со скоростью 40 мл/мин, скоростях нагрева от 2 до 10 °С/мин и массе навесок 5.2–9.5 мг.
Масс-спектрометрический анализ газообразных продуктов термического разложения I проводился при энергии ионизирующих электронов, равной 70 эВ. ИК-спектры I и конденсированных продуктов его разложения получены с помощью ИК-фурье-спектрометра ALPHA II (Bruker Optics, Германия) в диапазоне 360–3800 см–1, при разрешающей способности 4 см–1 и количестве сканирований, равном 16. Образцы для съемки ИК-спектров готовили в виде таблеток с KBr. В каждом случае из общего спектра вычитался спектр аналогичной таблетки, приготовленной из чистого KBr.
Отдельные термогравиметрические опыты проведены в открытой реакционной системе (кварцевый стаканчик, подвешенный к коромыслу термовесов АТВ-14М, (Россия) [18] на платиновой нити) в среде сухого аргона (1 атм) при скорости нагрева образцов 4 °С/мин.
ЭКСПЕРИМЕНТАЛЬНЫЕ РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На рис. 1 представлены кривые дифференциальной сканирующей калориметрии (ДСК), термогравиметрии (ТГ) и дифференциальной (ДТГ), полученные для соединения I при скорости нагрева 4.0 град/мин. Эндотермический пик, наблюдающийся на кривой ДСК при 149.6 °C, отвечает плавлению I; теплота плавления составляет (30.0 ± 2.3) кДж/моль. Разложение I проявляется в виде асимметричного экзотермического пика в температурном диапазоне 220–270 °C; теплота разложения найдена равной (295.8 ± 16.9) кДж/моль. Конечная потеря массы вещества в изученных условиях достигает 95%.
Для определения кинетических параметров (энергии активации и предэкспоненциального множителя) термического разложения I были использованы уравнения Киссинджера [19] (1) и Озавы [20] (2):
(1)
$\ln \left( {\frac{v}{{T_{{max}}^{2}}}} \right) = - \frac{E}{{R{{T}_{{max}}}}} + \ln \left( {\frac{{AR}}{E}} \right),$Таблица 1.
Значения температур $T_{{max}}^{Q}$ и $T_{{max}}^{m}$, при которых соответственно скорости тепловыделения и уменьшения массы I имеют максимальные значения при различных скоростях нагрева образцов
| $v,$ град/мин | $T_{{max}}^{Q},$ °С | $T_{{max}}^{m},$ °С |
|---|---|---|
| 2 | 246.1 | 246.5 |
| 4 | 256.4 | 256.0 |
| 5 | 259.1 | 259.4 |
| 10 | 267.1 | 266.9 |
Величины энергии активации и предэкспоненциального множителя процесса разложения I, определенные по уравнению (1), равны соответственно (168.7 ± 11.5) кДж/моль и 10(13.1 ± 1.3) с–1 (r = = 0.9913) по тепловыделению и (173.2 ± 11.0) кДж/моль и 10(13.6 ± 1.2) с–1 (r = 0.9927) по убыли массы. Обработка этих же экспериментальных данных по уравнению (2), дает для энергии активации значения (168.8 ± 10.9) кДж/моль (r = 0.9918) и (173.1 ± 10.9) кДж/моль, соответственно (r = = 0.9927), хорошо согласующиеся с результатами расчета по уравнению Киссинджера.
Масс-спектрометрическое изучение газообразных продуктов разложения I, проведенное синхронно с исследованием тепловых эффектов и потери массы образца I, показало, что при скорости нагрева 2 град/мин основными газообразными продуктами являются N2O, H2O, NO2, и N2 (рис. 2). При бóльших скоростях нагрева фиксируется также пик при m/e = 31, относящийся к катион-радикалу ${\text{OCH}}_{3}^{ + }$ (рис. 3).
Рис. 2.
Зависимости ионных токов (I, усл. ед.) от температуры, наблюдаемые при нагреве соединения I со скоростью 2.0 град/мин: m/e = 46, ${\text{NO}}_{2}^{ + }$ (1); m/e = 31, m/e = 44, N2O+· (2); m/e = 28, ${\text{N}}_{2}^{ + }$ · (3); m/e = 18, H2O+· (4). На вставке интенсивность ионного тока с m/e = 46 (кривая 1) увеличена в 600 раз.

Рис. 3.
Зависимости ионных токов (I, усл. ед.) от температуры, наблюдаемые для m/e = 31 (${\text{OCH}}_{3}^{ + }$·) при нагреве соединения I со скоростями 2.0 (1) и 4.0 град/мин (2).
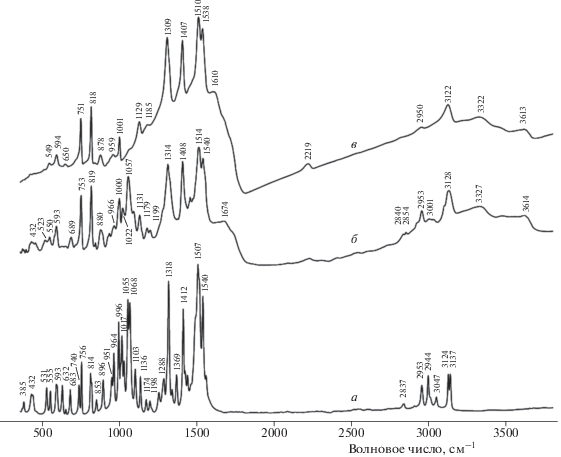
Для ИК-спектроскопических исследований два образца продуктов разложения I были приготовлены с использованием термовесов АТВ-14М. Образец 1, представляющий собой вязкую смолу темно-коричневого цвета, получили в результате частичного разложения при 222 °С в течение 30 мин. При этом потеря массы составила 50%. Образец 2 (хрупкое твердое вещество черного цвета) получили в результате предварительного термостатирования при 222 °С в течение 30 мин и последующего разложения при 245 °С в течение 2 ч; потеря массы составила 93–95%.
В ИК-спектре I (рис. 4, кривая a) присутствуют полосы, относящиеся к C–H-валентным колебаниям пиразольного цикла (при 3137, 3124 и 3047 см–1) и метоксигрупп (в интервале 2800–3000 см–1). Дублет (1540 + 1507) см–1 отвечает резонансу колебаний пиразольного цикла и антисимметричных N–O-валентных колебаний нитрогрупп. Другие полосы нитрогрупп наблюдаются при 1318 см–1 (симметричные N–O-валентные колебания) и в диапазоне 700–900 см–1 (C–N-валентные и ONO-деформационные колебания). В последнем диапазоне проявляются также полосы с существенным вкладом валентных колебаний групп N → О и смешанных мод пиразольного цикла, поэтому точное отнесение этих полос затруднительно. Еще одна полоса пиразольного цикла наблюдается при 1412 см–1. Сильные полосы при 1068 и 1055 см–1 отвечают валентным колебаниям одинарных (или очень слабо сопряженных) связей C–N. Отнесение спектральных полос произведено в соответствии с данными работ [21, 22].
Частичное разложение I (образец 1, рис. 4, кривая б) сопровождается появлением полос О–Н–, N–H– и C≡N-групп при 3614, 3473 и ∼2220 см–1 соответственно. В ИК-спектре продукта полного разложения I (образец 2, рис. 4, кривая в) сохраняются полосы нитрогрупп и пиразольного цикла (при 1538, 1510, 1407, 1309, 818 и 751 см–1), наблюдающиеся на фоне широкого гало в области 1100–1700 см–1, отвечающего системе полисопряженных связей, тогда как полосы несопряженных связей C–N (в интервале 1020 – 1100 см–1) отсутствуют. Наличие системы полисопряженных связей в образце 2 подтверждается его сильным рассеянием в области высоких частот, а также черным цветом. Полосы при 3513, 3322, 3122, 2950 и 2219 см–1 относятся к связям О–Н, N–H, C–H (пиразольный цикл) C–H (метоксигруппа) и C≡N, соответственно, причем полоса метоксигруппы значительно ослаблена по сравнению с аналогичной полосой исходного I.
Таким образом, на основании данных ИК-спектроскопии можно сделать вывод о том, что при термическом разложении в данных условиях нитропиразольный фрагмент сохраняется, а 2,2-бис(метокси-NNO-азокси)этильный фрагмент полимеризуется с образованием системы полисопряженных связей, а также нитрильных, гидроксильных и аминогрупп.
В методах Киссинджера и Озавы, использованных для определения активационных параметров распада I, априорно предполагается, что кинетика процесса описывается уравнением первого порядка. Исследование термического разложения близких по структуре алкоксидиазен-N-оксидов [23] показало, что эти вещества действительно распадаются в соответствии с кинетическим уравнением первого порядка.
В той же работе высказано логичное предположение, что слабейшей связью в молекуле I является связь N–O. Разрыв этой связи и является лимитирующей стадией процесса. Образующийся при этом метоксильный радикал, отрывая атом водорода от молекулы I, превращается в метанол, являющийся одним из продуктов реакции. Если считать лимитирующую стадию рассматриваемой реакции мономолекулярной, то приведенное выше значение энергии активации является одновременно энергией диссоциации связи N–O. Что касается предэкспоненциального фактора 1013.4 ± 1.8 с–1, то его величина типична для мономолекулярных реакций.
Полученные значения активационных параметров термического разложения I близки к соответствующим значениям, найденным для жидкофазного разложения алкоксидиазен-N-оксидов, не содержащих нитропиразольного заместителя [23]. Таким образом, введение в молекулу алкоксидиазен-N-оксида нитропиразольной группы практически не сказывается на термической стабильности. Оценка, сделанная путем экстраполяции аррениусовских зависимостей в область низких температур, показывает, что глубина разложения I при 25 °C в течение одного года составляет около 10–5.
Радикалы, образующиеся при разрыве связи N–O в I, вступают в дальнейшие, весьма сложные превращения. Характер этих превращений рассмотрен в работе [23]. На основании приведенных выше данных ИК-спектроскопии, эта схема может быть дополнена процессом полимеризации. В пользу этого механизма говорит нормальная для мономолекулярных процессов разрыва химической связи величина предэкспоненциального множителя.
Альтернативный возможный механизм разложения I предполагает образование циклического переходного состояния в соответствии со следующей схемой:
В настоящее время трудно сказать, какой из двух возможных механизмов распада (гомолитический разрыв связи N–O или циклическое переходное состояние) более предпочтителен.
Весьма специфической чертой термического разложения I является большое количество газа, выделяющегося в ходе реакции. Выше отмечалось, что при разложении I теряется до 95% массы. Количественный состав образующихся газов неизвестен. Однако если принять, что средний молекулярный вес газообразных продуктов разложения приблизительно равен 40, то легко рассчитать, что из одного моля I выделяется около семь молей газообразных продуктов. Это в два раза больше, чем для типичных взрывчатых нитросоединений, и свидетельствует о том, что диазеноксиды в большей степени, чем нитросоединения, склонны к газообразованию.
Работа выполнена на средства ИПХФ РАН (тема “Создание высокоэнергетических материалов”) при частичной финансовой поддержке программой № 31 Президиума РАН “Фундаментальные основы технологий двойного назначения” (тема “Исследование новых подходов к созданию высокоэнергетических соединений повышенной эффективности”) и Министерством образования и науки РФ (Федеральная целевая программа по соглашению № 14.613.21.0043 от 10.11.2015).
Список литературы
Зюзин И.Н., Супоницкий К.Ю., Далингер И.Л. // Химия гетероцикл. соединений. 2017. Т. 53. № 6/7. С. 702.
Зайцев А.А., Далингер И.Л., Шевелев С.А. // Успехи химии. 2009. Т. 78. № 7. С. 643.
Зюзин И.Н., Головина Н.И., Лемперт Д.Б. и др. // Изв. АН. Сер. хим. 2008. № 3. С. 619.
Зюзин И.Н., Лемперт Д.Б. // Изв. АН. Сер. хим. 2009. № 10. С. 2108.
Зюзин И.Н., Головина Н.И., Лемперт Д.Б., Шилов Г.В. // Изв. АН. Сер. хим. 2010. № 10. С. 1875.
Zyuzin I.N., Suponitsky K.Yu., Sheremetev A.B. // J. Heterocyclic. Chem. 2012. V. 49. № 3. P. 561; doi: 10.1002/jhet.811
Зюзин И.Н. // Журн. орган. химии. 2015. Т. 51. № 2. С. 187.
Зюзин И.Н., Лемперт Д.Б. // Изв. АН СССР. Сер. хим. 1985. № 4. С. 831.
Зюзин И.Н., Нечипоренко Г.Н., Головина Н.И. и др. // Там же. 1997. № 8. С. 1486.
Зюзин И.Н., Головина Н.И., Федоров Б.С. и др. // Там же. 2003. № 3. С. 726.
Кирпичев Е.П., Зюзин И.Н., Авдонин В.В. и др. // ЖФХ. 2006. Т. 80. № 9. С. 1543.
Зюзин И.Н., Лемперт Д.Б., Нечипоренко Г.Н. // Изв. АН СССР. Сер. хим. 1988. № 7. С. 1506.
Зюзин И.Н., Лемперт Д.Б. // Журн. общ. химии. 2010. Т. 80. № 9. С. 1473.
Зюзин И.Н., Лемперт Д.Б. // Кинетика и катализ. 2011. Т. 52. № 1. С. 19.
Зюзин И.Н., Лемперт Д.Б. // Журн. общ. химии. 2012. Т. 82. № 6. С. 947.
Зюзин И.Н., Лемперт Д.Б. // Там же. № 11. С. 1928.
Зюзин И.Н., Лемперт Д.Б. // Там же. 2014. Т. 84. № 5. С. 738.
Гальперин Л.Н., Колесов Ю.Р., Зеленов Н.А. // Измер. техника. 1981. № 4. С. 23.
Kissinger H.E. // Anal. Chem. 1957. V. 29. № 11. P. 1702.
Ozawa T. // Bull. Chem. Soc. Jpn. 1965. V. 38. P. 1881.
Smith A.L. Applied infrared spectroscopy. New York: John Wiley and Sons, 1979.
Rezchikova K.I., Churakov A.M., Shlyapochnikov V.A. et al. // Russ. Chem. Bull. 1995. V. 44. № 11. P. 2093.
Zyuzin I., Lempert D., Prokudin V. et al. // Proc. 36th Intern. Annu. Conf. of ICT. Karlsruhe, FRG, 2005. P. 162/1.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика