Химическая физика, 2019, T. 38, № 3, стр. 9-23
Изучение механизма низкотемпературного окисления микроразмерного порошка алюминия водой
Н. С. Шайтура 1, *, О. О. Ларичева 1, М. Н. Ларичев 1
1 Институт энергетических проблем химической физики им. В.Л. Тальрозе
Российской академии наук
Москва, Россия
* E-mail: tesh-s@yandex.ru
Поступила в редакцию 26.07.2018
После доработки 05.09.2018
Принята к публикации 20.09.2018
Аннотация
Исследован механизм окисления дисперсного алюминия (порошок марки АСД-4) жидкой водой, в том числе при использовании различных способов активации процесса (термическая, ультразвуковая, химическая – в присутствии малых количеств CaO). С этой целью было проведено комплексное изучение процесса окисления алюминия на его различных стадиях посредством анализа кинетических зависимостей скорости образования водорода и изменения pH реакционной среды, а также с использованием инструментальных методов растровой электронной микроскопии и рентгено-фазового анализа. Показано, что форма кинетических кривых выделения водорода, полнота процесса окисления и структура образующихся гидроксидов взаимосвязаны. Существенную роль играет массоперенос образующихся твердых продуктов окисления от поверхности частиц к центрам кристаллизации гидроксида алюминия, а также локализация областей кристаллизации. Работа представляется актуальной в связи с широким интересом к использованию металлического алюминия в качестве энергоаккумулирующего вещества.
1. ВВЕДЕНИЕ
Металлический алюминий является высоко реакционно-способным металлом, при окислении которого выделяется значительное удельное количество тепловой энергии, сравнимое с величиной теплотворной способности лучших сортов каменного угля. Благодаря этому в последнее десятилетие широко исследуется [1–5] возможность использования металлического алюминия в качестве высокоэффективного энергоаккумулирующего материала, в котором накопление энергии происходит путем восстановления металла из его оксида (наиболее распространенной формы существования элемента алюминия в Земной коре), а высвобождение энергии – путем окисления алюминия. Поскольку восстановление металлического алюминия из его оксида является энергопотребляющим процессом, то предполагается, что производство алюминия будет организовано в местах наибольшего скопления возобновляемых источников энергии. Алюминий может легко и безопасно транспортироваться в места его использования, храниться длительное время. При этом применение алюминия в качестве энергоносителя является процессом экологически чистым и предполагается к использованию в наиболее энергетически нагруженных регионах (мегаполисах), в местах, не охваченных централизованным энергоснабжением, и др.
Благодаря высокой химической активности алюминий может реагировать с выделением тепла с различными окислителями (O2, N2, CO2, H2O) с образованием соответствующих твердых продуктов и соответствующими тепловыми эффектами, а также образовывать другие химические соединения, которые, в свою очередь, могут быть использованы как энергоносители. Примером последних является образующийся в реакции алюминия с водой водород, который может использоваться для нужд водородной энергетики. Использование алюминия для производства водорода представляется перспективным, особенно в мобильных энергетических установках.
Продуктами реакции алюминия с водой являются водород, тепло и твердые продукты окисления. Тепловые эффекты и состав твердых продуктов окисления зависят от условий проведения процесса, а количество выделяющегося водорода одинаково для всех каналов реакции:
и составляет около 11% от массы реагирующего алюминия или 3.7% для низкотемпературного окисления (последняя реакция) от суммарной массы металла и воды. Такой процент является достаточно высоким, чтобы всерьез рассматривать алюминий как перспективное водородаккумулирующее соединение. Твердые продукты окисления (оксиды и гидроксиды алюминия) могут быть использованы как вторичное сырье для воспроизводства металлического алюминия. Однако экономическая эффективность процесса получения газообразного водорода из алюминия может быть повышена в случае, если твердым продуктам окисления удастся придать повышенные потребительские свойства, обеспечивающие их использование в других индустриальных отраслях. Этому, в частности, посвящены работы [6, 7] по изучению процесса переработки оксигидроксида алюминия, полученного методом гидротермального окисления алюминия, в ценный высокочистый оксид алюминия и исследованию его свойств. В работах [8–12] авторами настоящей работы предложена ультразвуковая (УЗ) активация процесса окисления алюминия, позволяющая полностью окислять порошки алюминия с частицами микроразмера водой без использования химических активаторов, загрязняющих продукты окисления, а также получать гидроксид алюминия с различной (в том числе наноразмерной) структурой.
Поскольку реакция окисления алюминия является гетерогенной, существенное влияние на кинетику процесса окисления оказывают размер и форма частиц алюминиевых порошков [13], а также состав и состояние пассивирующего оксидного покрытия (ПОП) на поверхности алюминиевых частиц [13–15]. Такое покрытие образуется в результате окисления поверхностного слоя металла кислородом воздуха и молекулами атмосферной влаги, достигает толщины, обеспечивающей его газонепроницаемость, и предохраняет металл от дальнейшего окисления. Его толщина, как правило, составляет несколько нанометров [16].
Наиболее простой и безопасной реализацией процесса окисления алюминия водой представляется его низкотемпературное окисление. Известно, что низкотемпературное окисление алюминия дистиллированной водой в отсутствие активации характеризуется наличием очень продолжительного периода индукции (до нескольких суток при комнатной температуре) и низкой степенью окисления металла. Поэтому задачами активационных методик являются:
– разрушение существующего на поверхности металлического алюминия ПОП;
– преодоление пассивирующего эффекта, создаваемого твердыми продуктами реакции окисления, непрерывно образующимися на окисляющейся поверхности металла.
В настоящее время для активации процесса окисления алюминия предложен ряд активационных методик, подробно изложенных в работах [2–5]. Нами при выборе перспективных методов активации учитывалась их экологическая чистота, т.е. возможность проводить процесс окисления алюминия без загрязнения образующихся продуктов окисления и окружающей среды. Как упоминалось выше, этому полностью удовлетворят УЗ-активация и, как показано в работе [9], использование CaO в качестве химического активатора. В последнем случае загрязнение образующегося гидроксида алюминия будет определяться количеством применяющегося активирующего реагента. По этой причине описываемые исследования были сосредоточены на возможности использования добавок активатора СаО, в количествах, не превышавших, как правило, 5% от массы окисляемого Al.
Изучение механизма окисления алюминия проводилось рядом авторов в работах [15, 17–20]. Несмотря на полученные ранее результаты, многие аспекты и закономерности окисления остаются не понятыми. В частности, при изучении активации процесса небольшими добавками CаО или/и ультразвуком авторами данной работы были получены кинетические кривые образования водорода с одним, двумя, а в некоторых случаях и тремя максимумами. Кроме того, как было установлено в [9], увеличение температуры проведения процесса окисления приводит к нелинейному изменению таких параметров, как средняя скорость и степень окисления алюминия. Доступные авторам литературные данные не позволяют объяснить эти особенности, поэтому задачей данной работы стало изучение механизма процесса и, в частности, объяснение полученных ранее закономерностей.
2. ИСПОЛЬЗУЕМЫЕ МАТЕРИАЛЫ И МЕТОДИКИ
В работе исследовалось окисление алюминиевого порошка марки АСД-4 (ТУ 48-5-226-87) со средним размером сферических частиц около 4 мкм, серийно производимого российской промышленностью [9]. Поверхность частиц была покрыта ПОП. Выбор данного порошка для исследования был обусловлен его перспективностью для практического применения при производстве водорода: относительной дешевизной, доступностью, удобством хранения и транспортировки. Содержание активного алюминия в частицах порошка в соответствии с ТУ 48-5-226-87 составляет 99.1%, что подтверждается данными проводившегося волюметрическим методом анализа.
Согласно паспортным данным основными примесями являются Fe (100 ppm), Si (80 ppm), Mg (8 ppm). Реальный состав примесей, определенный методом искровой масс-спектрометрии на приборе JEOL JMS-01 BM-2, может несколько отличаться от паспортного [21]. Отсутствие заметных различий в результатах кинетических измерений при окислении жидкой дистиллированной водой порошков разных партий позволяет утверждать, что для изучаемого процесса окисления различие в составе примесей не является существенным.
В качестве окислителя в данной работе использовалась дистиллированная вода. Соотношение реагентов Al : H2O в проводимых экспериментах изменялось от 1 : 2 до 1 : 25 (мас. %). Для химической активации процесса окисления применялся CaO марки “ХЧ” (содержание не менее 99 мас. %).
Окисление алюминия изучалось при давлениях, близких к атмосферному, и температурах, не превышавших 100 °С. Для изучения окисления порошка алюминия марки АСД-4 водой использовались установки, подробно описанные в работе [9]. При этом окисление изучалось как в режиме, близком к изотермическому, когда температура внешних стенок химического реактора поддерживалась на заданном уровне (“квазиизотермический режим”), так и в режиме накопления тепла, при котором внешние стенки реактора были термоизолированы (подробно о реализации режимов см. [9]).
Исходный порошок алюминия и твердые продукты его окисления водой исследовались методами растровой электронной микроскопии (РЭМ) на микроскопе JSM-7401F. Рентгено-фазовый анализ (РФА) образцов проводился на дифрактометре D8 ADVANCE (Bruker). Уточнение рентгенограмм проводилось с использованием программы полнопрофильного анализа TOPAS-4.2. Размер микрокристаллитов определялся по величине области когерентного рассеяния. Расчет кристалличности образца проводился из сравнения интегральных интенсивностей пиков кристаллической и аморфных составляющих.
Отбор пробы для РЭМ и РФА на различных стадиях протекания реакции осуществлялся путем забора из реактора небольшого количества (несколько мг) реакционной смеси, которая быстро (в течение 20–30 с) высушивалась потоком сухого воздуха. Это позволяло остановить процесс окисления на той стадии, которой он достиг в реакторе.
Измерение pH среды осуществлялось на приборе 692Ion/pH meter (Metrohm) с использованием Pt-электрода, позволяющего проводить измерения pH в диапазоне 0–14 при температуре 0–80 °С.
3. РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Процесс окисления алюминия водой можно условно разделить на несколько последовательных, накладывающихся друг на друга и при некоторых условиях окисления чередующихся стадий, среди которых следует выделить [1, 4] (рис. 1):
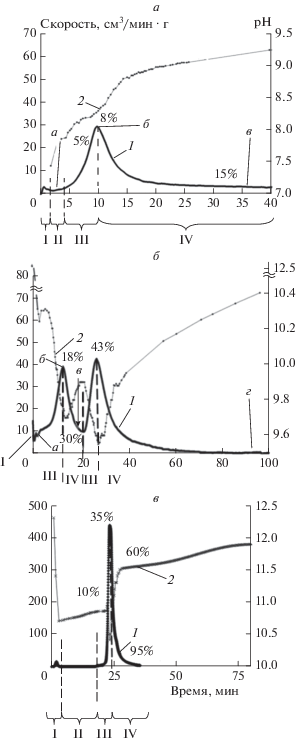
Рис. 1.
Кинетические кривые скорости выделения водорода (кривая 1) и pH среды (кривая 2), характерные для изотермического режима окисления (а) при стартовом значении рН = 7; изотермического режима окисления (б) при стартовом значении рН = 12.5; режима накопления тепла (в) при стартовом значении рН = 12.5 (буквами обозначены точки отбора пробы для электронной микроскопии рис. 2, 5). Степень превращения алюминия отмечена в % по мере протекания процесса. Римскими цифрами обозначены стадии процесса окисления: I – стадия начального окисления, II – стадия индукции, III – стадия интенсивного окисления, IV – стадия затухания окисления.
– стадию начального окисления – быстрозатухающую реакцию, протекающую с небольшим выделением Н2, регистрируемую в течение первых минут контакта алюминиевого порошка с водой и приводящую к окислению до нескольких процентов металла и к кратковременному повышению температуры (до несколько градусов) смеси реагентов;
– стадию индукции (продолжительностью от нескольких минут до нескольких суток в зависимости от состава и структуры ПОП частиц порошка, стартовой температуры реакции, pH реакционной среды), в процессе которой происходит гидролиз ПОП, обеспечивающий нарушение сплошности ПОП и увеличивающий его проницаемость для молекул воды. Окончание периода индукции характеризуется началом роста скорости выделения водорода и возрастанием температуры реакционной смеси, свидетельствующими о начале стадии интенсивного окисления металла;
– стадию интенсивного окисления, во время которой происходит быстрое нарастание скорости выделения водорода, связанное с интенсивным разрушением ПОП, а также с увеличением температуры реакционной смеси. Одновременно вместе с водородом происходит образование и наработка твердых продуктов окисления алюминия;
– стадию затухания процесса окисления, обусловленную тем, что по мере протекания процесса окисления контактирующая с окислителем геометрическая поверхность неокисленного алюминия в системе сокращается. Кроме того, образовавшиеся нерастворимые продукты окисления затрудняют перенос воды к зоне реакции. Благодаря совокупности этих факторов скорость окисления металла с некоторого момента начинает уменьшаться, одновременно вызывая понижение температуры реакционной смеси и уменьшение количества выделяющегося водорода.
Экспериментальные данные показывают, что в зависимости от условий проведения процесса окисления кинетическая кривая скорости газовыделения может иметь один (рис. 1а, 1в), два (рис. 1б) и даже три максимума газовыделения. В случае нескольких таких максимумов стадия затухания процесса снова переходит в стадию интенсивного окисления. Рассмотрим более подробно процессы, протекающие на каждой из стадий.
Стадии начального окисления и индукции
Как было показано в работе [4], в течение нескольких первых минут контакта алюминиевого порошка с водой наблюдается стадия начального окисления, которая объяснялась наличием в ПОП некоторого количества структурных дефектов, непроницаемых для кислорода воздуха, но раскрывающихся при контакте с жидкой водой, например за счет эффекта Ребиндера [22]. Суть эффекта состоит в том, что в результате физико-химического взаимодействия адсорбционно-активной среды с поверхностью твердых тел могут сильно изменяться механические свойства кристаллов и аморфных материалов различной природы, т.е. ПОП разрушается в дефектных местах при контакте с водой. Другой возможной причиной разрушения ПОП является его растворение, которое будет происходить локально в наиболее дефектных местах покрытия. При pH среды >7 растворение оксида алюминия происходит в основном с образованием ионов [Al(OH)4]– [23] и включает в себя две стадии: 1) гидратацию оксида; 2) растворение образовавшегося гидроксида алюминия.
Рассмотрим возможную природу структурных дефектов ПОП. Согласно данным РФА алюминиевая частица имеет микрокристаллическую структуру c размером зерна около 0.1–0.2 мкм. Это означает, что она представляет собой различным образом ориентированные микрокристаллиты, соединенные между собой участками аморфного металла. По этой причине поверхность частицы имеет “лоскутную” структуру, которую составляют различным образом ориентированные, выходящие на поверхность кристаллические грани и связывающие их тонкие области аморфного алюминия. Последние будут представлять собой наиболее дефектные области металла. Средняя толщина ПОП, сформированного при контакте Al-поверхности с атмосферой, составляет 2–4 нм [16]. При такой толщине покрытия над поверхностью металла находится примерно от 5 до 10 слоев оксида алюминия. Это означает, что в большинстве случаев наблюдаемый поверхностный рельеф и строение ПОП должны в значительной мере передавать их находящейся под ним поверхности металлической частицы алюминия. При этом наиболее дефектной структурой будет обладать ПОП, локализованное над аморфными спайками на границах кристаллических зерен. Именно с этих областей начнется разрушение ПОП при контакте частицы с водой.
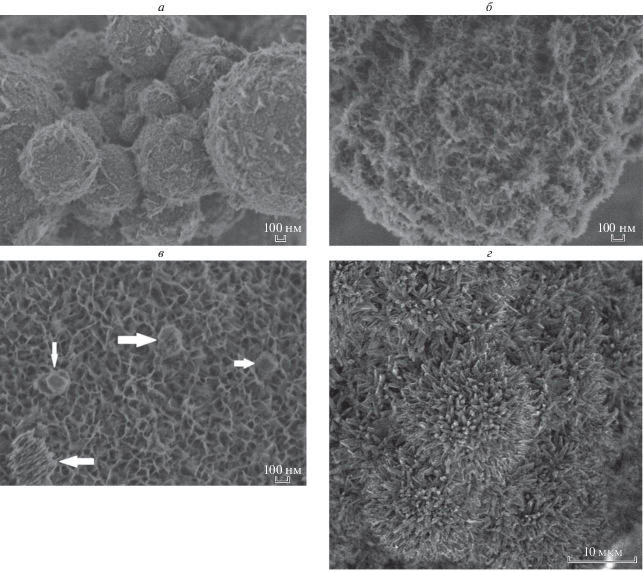
Подтверждением данного вывода являются представленные на РЭМ-микрофотографии рис. 2а поверхности частиц алюминиевого порошка, окислявшиеся водой и изъятые из реактора после прохождения стадии начального окисления. Выносы продуктов реакции (“бугорки” и “валики”), свидетельствующие о наличии сквозных дефектов ПОП (пор и микротрещин), наблюдаются по границам площадок с размером 100–200 нм, что соответствует размерам микрокристаллитов алюминия, образующих, согласно данным РФА, частицу.
Рис. 2.
Микрофотографии РЭМ продуктов реакции окисления алюминия водой, отобранных из реактора в моменты, указанные на рис. 1а. Степень окисления: а –1.1, б – 8, в – 17%; Al : H2O – 1 : 4, T – 40 °C.

Таким образом, в процессе начального окисления в местах образовавшихся сквозных дефектов оксидного покрытия накапливается продукт реакции окисления – гидроксид алюминия. Согласно работе [20], при контакте гидроксида алюминия с металлическим алюминием происходит реакция между ним и алюминием с образованием водорода и оксида алюминия (т.е. “регидролиз” гидроксида алюминия). Образовавшийся оксид алюминия значительно менее проницаем для воды, чем гидроксид. По-видимому, этим обусловлен переход стадии начального окисления в стадию индукции: раскрывшиеся при контакте с водой дефекты закрываются вновь сформировавшимся оксидом, а для образования новых дефектов необходимо время (время гидратации и последующего локального растворения покрытия).
При использовании химической активации оксидами и гидроксидами щелочных и щелочно-земельных металлов стадия начального окисления наблюдается особенно отчетливо (рис. 1в). В данной работе мы продемонстрируем механизм этого эффекта на примере активатора CaO. Высокое значение (12.5) pH среды, обусловленное растворением гидроокиси кальция, обеспечивает растворение образовавшегося продукта окисления алюминия − гидроксида алюминия по реакции
(1)
${\text{Al}}{{\left( {{\text{OH}}} \right)}_{3}} + {\text{О }}{{{\text{Н }}}^{--}} \to {{\left[ {{\text{Al}}{{{\left( {{\text{OH}}} \right)}}_{4}}} \right]}^{--}}.$Растворившийся гидроксид алюминия реагирует с гидроксидом кальция с образованием гидроксоалюминатов кальция 3CaO ∙ Al2O3 ∙ 6H2O (${\text{2Al}}\left( {{\text{OH}}} \right)_{{\text{4}}}^{ - }$ + 3Ca2+ + 4OH– → 3CaO ∙ Al2O3 ∙ ∙ 6H2O), наличие которых на начальных стадиях процесса окисления регистрируется РФА. Количество алюминия, окислившегося на стадии начального окисления, коррелирует с количеством внесенного в систему активатора CaO (табл. 1). Так, например, при окислении 2 г Al-порошка в 8 мл воды при внесении CaO в количестве 5% от массы алюминия (0.1 г) согласно стехиометрии образуется 0.13 г гидроксида кальция. Этому количеству гидроксида кальция соответствует 0.09 г гидроксида алюминия (согласно уравнению 3Ca(OH)2 + 2Al(OH)3 → 3CaO ∙ Al2O3 ∙ 6H2O); 0.09 г гидроксида алюминия получается при окислении 0.03 г Al, что составляет 1.5% от исходной массы алюминия. Согласно экспериментальным данным именно такое количество алюминия окисляется на стадии начального окисления в рассматриваемом опыте. Снимки РЭМ, полученные для образца окисляющегося алюминиевого порошка, отобранного сразу после протекания стадии начального окисления, показывают наличие пластинчатых кристаллов с линейными размерами в несколько микрон (рис. 3). Сопоставление результатов, полученных методами РЭМ с РФА, позволяет предположить, что видимые на снимках РЭМ пластинчатые кристаллы представляют собой гидроксоалюминаты кальция. Необходимо отметить, что кристаллы расположены вне окисляющихся частиц, что не позволяет им экранировать поверхность алюминия, вследствие чего начальное окисление в присутствии активатора протекает интенсивнее, чем без активации. Когда значительная часть вносимого активатора преобразуется в гидроксоалюминаты кальция (в твердом и частично растворенном состояниях), образующийся алюминиевый гель закрывает дефекты оксидного покрытия. При этом стадия начального окисления останавливается и переходит в стадию индукции.
Таблица 1.
Корреляция между количеством вносимого активатора и количеством алюминия, окислившегося на стадии начального окисления
| Количество вносимого активатора, % от общей массы Al | Количество Al, связанного в 3CaO ∙ Al2O3 ∙ 6H2O при данном количестве активатора, если весь активатор израсходовался на образование алюмината, % от общей массы Al | Количество алюминия, окислившегося на стадии начального окисления, % от общей массы Al (найдено путем интегрирования экспериментальных кривых скорости выделения водорода) |
|---|---|---|
| 5 | 1.5 | 1.5 ± 0.8 |
| 8 | 2.4 | 2.7 |
| 20 | 6 | 4.8 |
Рис. 3.
Микрофотографии РЭМ продуктов, полученных после протекания начального окисления в присутствии CaO в количестве, составившем 5% от массы Al.

Стадию индукции практически все исследователи связывают с гидролизом ПОП [1, 4, 17–20]. В течение этой стадии происходит разрушение структурных мостиков Al–O–Al с образованием связей Al–OH; одновременно наблюдается рост pH реакционной среды, значение которого стабилизируется в диапазоне от 7 до 9.5 (зависит от условий проведения процесса). Замечено, что это значение при постоянном количестве используемой дистиллированной воды пропорционально количеству Al-порошка, смешиваемого с водой и формирующего дисперсию [4], т.е. пропорционально площади контактирующей с водой поверхности частиц. В работе [4] было показано, что алюминиевые порошки марки АСД, содержащие в составе ПОП наибольшее количество хемосорбированных OH-групп (получено при использовании дериватографии совместно с методом термодесорбционной масс-спектрометрии), имеют наименьший период индукции, и значение pH в смесях таких порошков с водой достигает больших значений.
Согласно работе [20], ОH-группы, образовавшиеся на внешней поверхности частицы в результате ее взаимодействия с водой, диффундируют от поверхности раздела вода – оксидное покрытие к поверхности раздела оксидное покрытие – алюминий, образуя в объеме покрытия структурные гидроксиды. В данной работе предполагается, что диффузия ОH-групп существенно ускоряется с увеличением количества дефектов в оксиде алюминия. Когда ОН-группы достигают металлического алюминия, происходит “регидролиз” гидроксида алюминия. Образовавшийся оксид алюминия будет увеличивать толщину ПОП и может вновь гидролизоваться. Процесс роста оксидного покрытия под исходным ПОП, которое присутствует на алюминиевых порошках в состоянии поставки, крайне медленный (при комнатной температуре толщина оксидного покрытия увеличивается с 4.5 до 5 нм после 5 ч контакта с водой [20]). Интенсификации процесса будет способствовать разрушение оксидного покрытия. Согласно работе [15], в случае, если скорость образования водорода больше скорости его диффузии, образующийся водород, накапливаясь под оксидным покрытием, может приводить к его разрушению. Однако накопление пузырьков водорода, по нашему мнению, маловероятно, поскольку, хотя оксидное покрытие и является существенным препятствием для образующегося водорода (из анализа результатов работ [24, 25] следует, что коэффициент диффузии водорода в оксиде составляет 10–13−10–14 см2/с), тем не менее эффективный коэффициент диффузии ОН-групп в оксиде значительно меньше (согласно [20] он составляет ~10–17 см2/с). По-видимому, окончание периода индукции связано с тем, что гидролизированное ПОП локально растворяется в наиболее дефектных местах.
Использование активатора CaO позволяет сократить период индукции, поскольку растворимость и скорость растворения гидроксида алюминия по реакции (1) при более высоких pH существенно увеличиваются. Период индукции переходит в стадию интенсивного окисления, когда количество сквозных деффектов накапливается и скорость их образования превышает скорость “залечивания” (в результате “регидролиза”).
Использование УЗ-активации также позволяет сократить период индукции за счет механического воздействия на ПОП микропотоков, возникающих при схлопывании кавитационных пузырьков, образующихся под действием ультразвука, а также за счет нагревания смеси УЗ-полем [9].
Стадии интенсивного окисления и затухания окисления
В отсутствие активации зависимость скорости газовыделения от времени имеет один максимум (рис. 1а). Анализ микрофотографий частиц, отобранных из реактора в начале стадии интенсивного окисления, показывает, что отдельные “валики”, наблюдавшиеся на поверхности (рис. 2а), объединяются в густую сетку “валиков” – выносов на поверхность продуктов окисления алюминия (рис. 2б). Это свидетельствует о том, что по мере протекания процесса окисления точечные сквозные дефекты превращаются в трещины, которые увеличиваются в длину, и их количество на единицу поверхности возрастает. Образовавшиеся “валики” (гидроксид алюминия) закрывают бóльшую часть поверхности алюминиевых частиц (рис. 2б). Рентгено-фазовый анализ продуктов окисления показывает, что в отсутствие активации на этой стадии процесса формируется только аморфный гидроксид алюминия. По-видимому, в процессе окисления в зонах сквозных дефектов образуются мицеллы гидроксида алюминия, не препятствующие переносу воды к окисляющемуся металлу, заполняющие объем дефекта, со временем выходящие на поверхность частицы и образующие “валики”. Далее рост “валиков” приводит к образованию обволакивающего поверхность частицы водонасыщенного геля.
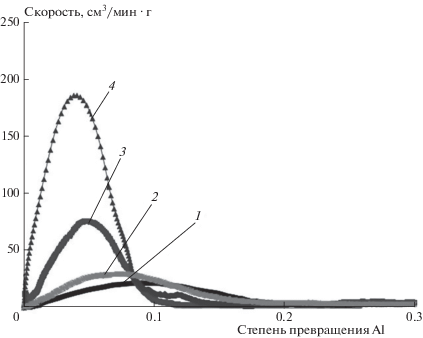
С течением времени гель теряет молекулы избыточной воды, структурируется, т.е. стареет (рис. 2в), теряет способность пропускать воду к поверхности окисляемого металла. Отметим, что с ростом температуры реакционной среды происходит увеличение скорости окисления алюминия водой (наработка алюминиевого геля), однако одновременно ускоряется структурирование геля, приводящее, соответственно, к уменьшению доступа воды к неокисленному металлу, уменьшению скорости окисления металла и остановке процесса окисления. Как результат, с увеличением температуры протекания процесса окисления максимум газовыделения образующегося водорода сдвигается в сторону меньших степеней окисления металла (рис. 4). Похожее замедление скорости окисления алюминия с течением времени наблюдалось в работе [17] при исследовании механохимически активированных порошков алюминия и объяснялось авторами уплотнением гидроксидного слоя, о котором свидетельствовали снимки РЭМ для поперечного разреза гидроксидной оболочки.
Рис. 4.
Зависимости скорости образования водорода от степени превращения металлического алюминия; Al : H2O – 1 : 4. Процесс окисления проводился в изотермическом режиме при следующих температурах: 1 – 55, 2 – 60 , 3 – 70, 4 – 100 °С.
Механизм процесса окисления алюминия на различных его стадиях для наноразмерных частиц изучался в работе [18]. Согласно этой работе, продукты окисления алюминия образуются в дефектных местах ПОП и являются аморфными, что соответствует выводам, полученным в данной работе. Однако по мере протекания процесса окисления в случае наноразмерных частиц алюминия [18] вокруг алюминиевого ядра формируется бемитная оболочка, и, поскольку для таких частиц удается достичь полного окисления алюминия, эта оболочка является полой. Таким образом, продукты окисления наноразмерных частиц алюминия представляют собой полые наносферы [18]. В случае микронных частиц алюминия, изучаемых в настоящей работе, предельная степень окисления металла в отсутствие активации, фиксируемая за разумное время наблюдения (до нескольких суток) не превышает 30%, а продуктом реакции являются частицы с металлическим ядром и оболочкой из аморфного гидроксида алюминия, образующегося при высыхании геля гидроксида алюминия.
Предложенный выше в настоящей работе механизм образования слоя гидроксида, обволакивающего алюминиевую частицу, реализуется при всех тепловых режимах в отсутствие активации. Для этих условий кинетическая зависимость газовыделения имеет один максимум. При использовании УЗ- или химической активации (малые добавки CaO) в квазиизотермическом режиме окисления кинетическая кривая скорости образования водорода имеет несколько максимумов (обычно два). Чтобы объяснить природу появления второго максимума, нами было проведено постадийное изучение методами РЭМ и РФА продуктов окисления по методике, описанной в разд. 2.
Микрофотографии РЭМ продуктов окисления, полученных в “квазиизотермическом” режиме с использованием химической активации, (рис. 5, моменты отбора пробы для электронной микроскопии обозначены буквами на рис. 1б), показывают, что в первом максимуме процесс окисления протекает по механизму, аналогичному наблюдавшемуся для случая окисления при отсутствии активации: в начале стадии интенсивного окисления продукты высаживаются в местах сквозных дефектов (рис. 5а), затем образующийся гидроксид алюминия полностью обволакивает поверхность окисляемых частиц, что затрудняет доступ воды к неокисленному металлу (рис. 5б). Начиная с некоторого момента (обозначенного на рис. 1б буквой в), на электронно-микроскопических снимках фиксируются ламмелярные структуры гидроксида алюминия – прекурсоры кристаллов гидроксида алюминия. Рисунок 5г показывает, что рост кристаллов гидроксида алюминия происходит в радиальном направлении от поверхности окисляемой частицы, покрытой слоем геля гидроксида алюминия. Очевидно, что гидроксид алюминия переносится от окисляемой поверхности алюминия к растущим кристаллам на расстояния, соответствующие размерам кристаллов (около 10 мкм). Перенос гидроксида алюминия осуществляется главным образом ионами ${\text{Al}}({\text{OH}})_{{\text{4}}}^{ - },$ так как при pH > 7 растворенный гидроксид алюминия в основном представлен этими ионами [23]. Массоперенос гидроксида Al будет препятствовать накоплению продуктов окисления на поверхности алюминиевых частиц и, соответственно, способствовать увеличению скорости окисления. Следует отметить, что если в экспериментах на кривой газовыделения фиксируется второй максимум, то на микрофотографиях РЭМ всегда наблюдаются кристаллы гидроксида алюминия. Это позволяет предположить, что повторное возрастание скорости выделения водорода (второй максимум) связано с преобразованием гелеобразного состояния гидроксида алюминия (обволакивающего поверхность металлического алюминия) в кристаллическое (на удалении от поверхности).
Рис. 5.
Микрофотографии РЭМ продуктов реакции окисления алюминия водой в присутствии СaO; Al : H2O – 1 : 11, T – 70 °C. Пробы отобраны из реактора при степени конверсии: а – 0.8% (аморфный Al(OH)3, б – 15% (аморфный Al(OH)3), в – 23% (начало образования кристаллического Al(OH)3, стрелками показаны прекурсоры кристаллов), г – 85% (кристаллический Al(OH)3). Моменты отбора пробы для электронной микроскопии показаны на рис. 1б буквами.
Необходимой предпосылкой образования зародышей кристаллизации и их последующего роста до кристаллических форм гидроксида алюминия является формирование областей перенасыщения растворенного гидроксида Al. По-видимому, перенасыщение раствора на удалении от окисляющихся частиц обеспечивается температурным фактором. Благодаря интенсивному выделению тепла, происходящему при окислении алюминия водой, локальная температура жидкости вблизи окисляющейся алюминиевой поверхности оказывается более высокой, чем на удалении от нее. При рН среды >7 (основные условия) с увеличением температуры реагентов растворимость гидроксида алюминия увеличивается [26, 27]1)1). Раствор вблизи окисляющейся поверхности будет иметь максимальную концентрацию и температуру. Перемещение микрообъемов реакционной смеси выделяющимся водородом и/или за счет возникающей в температурном поле конвекции будет приводить к попаданию теплого насыщенного раствора из приповерхностной зоны в периферийные области с более низкой температурой. Это приведет к его охлаждению до данной локальной температуры и переходу в перенасыщенную форму. Таким образом, вдали от окисляемой поверхности алюминия возникают области перенасыщенного раствора, в которых происходят зародышеобразование и последующий рост кристаллов гидроксида алюминия. Отметим, что с увеличением pH среды концентрационный градиент растворенного гидроксида алюминия, возникающий вследствие температурного градиента, возрастает2)2). Увеличение концентрационного градиента между окисляемой поверхностью алюминия и в областях на удалении от нее обеспечивает более интенсивное зародышеобразование и рост кристаллов на стадии интенсивного окисления.
Как показывают данные РЭМ, на заключительной стадии процесса окисления (рис. 5г) кристаллы гидроксида алюминия, окружающие частицу, имеют близкие размеры (средняя длина частиц составляет несколько микрон). Это свидетельствует о том, что зародышеобразование кристаллов происходит в некоторый ограниченный период времени, по истечению которого дальнейшее зародышеобразование прекращается, а наблюдается только рост уже образовавшихся кристаллов. Образование зародышей кристаллов, по-видимому, происходит на стадии интенсивного окисления, когда скорость и температура вблизи поверхности достигают достаточно высоких значений и за счет этого устанавливается градиент температуры и концентрации растворенного гидроксида. На этой стадии образовавшиеся зародыши кристаллов гидроксида алюминия имеют еще малую площадь поверхности и не обеспечивают заметный отток гидроксида алюминия от поверхности алюминиевых частиц к центрам кристаллизации. Соответственно, накапливаясь на окисляемой поверхности алюминия, гелеобразные продукты окисления тормозят реакцию, скорость окисления падает, что приводит к уменьшению локальной температуры вблизи окисляемой поверхности и уменьшению градиента концентраций растворенного гидроксида. Это приводит к тому, что перенасыщение раствора вдали от частиц уменьшается и новые зародыши гидроксида алюминия не образуются. Стадия интенсивного окисления переходит в стадию затухания процесса. Однако на этой стадии происходит рост уже образовавшихся зародышей кристаллов, их поверхность увеличивается, увеличивая массоперенос гидроксида Al от поверхности алюминиевых частиц к центрам кристаллизации. В результате может происходить “реактивация” процесса окисления алюминия, т.е. повторное возрастание скорости газовыделения. Отметим, что после “реактивации” (т.е. во время прохождения второго максимума) зародышеобразования уже не происходит, поскольку перенасыщение раствора снижается за счет роста уже образовавшихся кристаллов.
Рост кристаллов гидроксида алюминия на стадии затухания процесса может происходить достаточно интенсивно только при активации. Действительно, поскольку возле поверхности растущих кристаллов концентрация растворенного гидроксида алюминия ниже (стремится к нулю), чем на удалении от него, то образуется направленный поток растворенного гидроксида Al к поверхности кристаллов. Величина этого потока определяется разностью концентраций растворенного гидроксида алюминия возле алюминиевой поверхности (которая близка к концентрации насыщенного раствора) и возле поверхности растущих кристаллов гидроксида Al. Поскольку растворимость последнего существенно увеличивается с ростом pH [26, 27], то и поток растворенного гидроксида алюминия к растущим кристаллам увеличивается даже на стадии затухания процесса, когда температуры возле поверхности алюминия и в объеме смеси становятся близки. Массоперенос растворенного гидроксида алюминия к растущим кристаллам происходит за счет диффузии, термодиффузии, а также за счет конвекции и движения образующихся пузырьков водорода.
Изучение механизма процесса окисления алюминия при активации его гидроксидом кальция проводилось также в работе [19]. Отличием настоящей работы от работы [19] является относительно малое количество используемого гидроксида кальция в настоящей работе (менее 6.5% от массы Al (5% для CaO)) по сравнению с используемым в работе [19] (более 20%). Первый максимум на кинетической кривой газовыделения из работы [19], по-видимому, соответствует наблюдаемому нами начальному окислению, описанному в предыдущем разделе. Авторы связывают этот максимум с образованием алюмината кальция. В данной работе предполагается, что водород во время прохождения первого максимума выделяется вследствие образования гидроксоалюминатов кальция по реакции 3Ca3+ + ${\text{2Al}}({\text{OH}})_{{\text{4}}}^{ - }$ + 8H2O ↔ ↔ Ca3Al2(OH)12 + 6H2. Однако, согласно современным представлениям [28, 29], образование гидроксоалюминатов не сопровождается образованием водорода. Второй максимум в работе [19] связан с ростом кристаллов гидроксида алюминия, что не противоречит предлагаемому нами механизму окисления алюминия при небольшом количестве активатора.
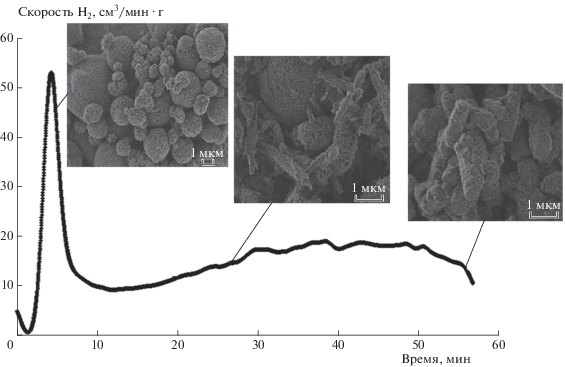
Необходимо отметить, что при окислении алюминия с использованием УЗ-активации в изотермическом режиме в интервале температур 20–70 °C кинетическая кривая газовыделения также имеет два максимума (рис. 6). Исследование процесса окисления с помощью РЭМ на его различных стадиях показывает, что по мере прохождения второго максимума газовыделения на снимках РЭМ, как и в случае химической активации, наблюдаются кристаллы гидроксида алюминия. По-видимому, УЗ способствует образованию зародышей кристаллов гидроксида Al и дальнейшему их росту за счет интенсификации массопереноса. Способность УЗ-поля ускорять зародышеобразование [30] и рост кристаллов [31] даже при небольших пересыщениях раствора широко известна. Процесс кристаллизации в УЗ-поле (сонокристаллизация) интенсивно изучается [30, 31]. Ультразвуковая активация зародышеобразования и роста кристаллов обусловлена схлопыванием кавитационных пузырьков, возникающих при прохождении УЗ-волны через раствор [32].
Рис. 6.
Кинетическая кривая скорости выделения водорода и продукты окисления алюминиевого порошка водой. Процесс проводился с использованием активации УЗ-полем при температуре 70 °C.
При окислении алюминия с использованием химической активации (добавление CaO) в режиме накопления тепла (т.е. совместно с тепловой активацией) или при одновременном использовании УЗ- и химической активации в квазиизотермическом режиме кривая зависимости скорости выделения H2 от времени имеет один максимум, и практически полное окисление металла достигается всего за несколько минут (рис. 1в). Исследования, проведенные методом РЭМ, показывают, что продуктами окисления в этих случаях являются наноразмерные кристаллы гидроксида алюминия (рис. 7). Наблюдаемое формирование большого числа мелких кристаллов свидетельствует о более интенсивном зародышеобразовании, чем в процессе окисления, протекающем с использованием только химической или только УЗ-активации. По-видимому, в случае применения химической активации совместно с тепловой или с УЗ-активацией удается достигать более высоких степеней перенасыщения растворов, в которых происходит кристаллизация гидроксида алюминия. Действительно, одновременное использование двух методов активации обеспечивает наиболее быстрое и интенсивное разрушение ПОП, приводящее в свою очередь, к росту скорости газовыделения и сопутствующему ему росту скорости тепловыделения. Таким образом, на стадии интенсивного окисления создается более высокий градиент температуры между поверхностью частицы и окружающей средой, чем при раздельном применении методов активации. Как показано выше, высокий температурный градиент совместно с высоким значением pH среды обеспечивают более высокое перенасыщение раствора на удалении от окисляемой частицы и, следовательно, образуется большее число зародышей кристаллизации. Одновременное образование большого количества зародышей и повышенная возможность транспорта растворенного гидроксида (за счет используемых методов активации) приводят к образованию и росту большого количества наноразмерных кристаллов гидроксида. По-видимому, в данном случае массоперенос гидроксида алюминия от поверхности частиц к центрам кристаллизации, ведущий к преобразованию аморфной фазы гидроксида в кристаллическую, начинает играть существенную роль еще до того, как оболочка из аморфного гидроксида алюминия достигнет толщины, при которой она становится заметным препятствием для доступа воды к поверхности металлического алюминия. В результате на кинетической кривой газовыделения два максимума сливаются в один, где один из них может наблюдаться в виде более или менее явно выраженного плеча.
Рис. 7.
Микрофотографии РЭМ продуктов реакции окисления алюминия водой при одновременном использовании УЗ- и химической (CaO) активации.

Предложенный механизм процесса окисления позволяет понять, почему для активации процесса УЗ-полем в присутствии активатора CaO достаточно кратковременного воздействия УЗ на начальном этапе стадии интенсивного окисления [9]. В этом случае УЗ-поле способствует формированию зародышей кристаллов гидроксида алюминия, а дальнейшая высокая скорость массопереноса обеспечивается за счет повышения растворимости гидроксида алюминия в присутствии СaO.
Таким образом, из изложенного в данном разделе материала следует, что быстрое и полное окисление металла реализуется, если одновременно соблюдается нижеследующее.
1. Созданы условия для быстрого разрушения ПОП. Этому способствует как химическая активация (CaO), так и УЗ-активация [1, 8–12]. При этом сокращается период индукции.
2. На стадии интенсивного окисления скорость процесса достаточно велика, чтобы обеспечить необходимый градиент температур между поверхностью окисляемой частицы и средой на удалении от нее и, соответственно, создание перенасыщенной концентрации растворенных форм гидроксида алюминия в областях, расположенных на удалении от окисляющейся поверхности металла.
3. Скорость массопереноса растворенного гидроксида алюминия от окисляемой поверхности алюминиевых частиц к центрам кристаллизации выше скорости уменьшения водопроницаемости гидроксидной оболочки вокруг окисляемых частиц. Уменьшение водопроницаемости происходит за счет увеличения толщины оболочки и за счет структурирования свежеобразовавшегося гидроксида (т.е. его старения по цепочке мицеллы > водонасыщенный гель > структурированный гидрогель).
Из рассмотренных в настоящей статье данных следует, что вне зависимости от метода активации (например, УЗ- или химическая активация) процесса окисления порошков алюминия с частицами микроразмера по полученным зависимостям скорости выделения водорода от времени (их форме и найденным из них степени превращения алюминия) с высокой степенью точности можно предсказать структуру образовавшихся продуктов окисления (при этом все кривые газовыделения можно разделить на три группы):
– первая группа кинетических кривых выделения водорода характеризуется единственный максимумом газовыделения; при этом после прохождения максимума и окисления относительно небольшого (до 30%) количества Al процесс практически останавливается и далее протекает с крайне низкой, уменьшающейся со временем скоростью в несколько см3/мин ⋅ г и менее (рис. 1а). Достигаемая в процессе окисления максимальная скорость может быть как крайне низкой – в несколько десятков см3/мин ⋅ г, так и достаточно высокой – около 500 см3/мин ⋅ г и даже более. При таком протекании процесса образуются частицы, имеющие металлическое ядро со структурой металла, соответствующей структуре исходной частицы, и оболочку, состоящую из аморфного Al(OH)3 толщиной до нескольких сот нанометров. Значение удельной поверхности продуктов окисления превышает 60 м2/г для окисленного образца (металл + гидроксид Al), а в пересчете только на образующийся гидроксид – 110 м2/г;
– вторая группа характеризуется высокой степенью переработки металлического алюминия и наличием двух (а в некоторых случаях и трех) максимумов на кинетической кривой скорости выделения водорода (рис. 1б). Скорость окисления алюминия обычно составляет несколько десятков см3/мин ⋅ г. Продуктами окисления в этом случае являются кристаллы гидроксида алюминия размером в несколько микрон (рис. 5г) с удельной поверхностью около 15 м2/г;
– для третьей группы характерен быстрый процесс окисления и полное окисление металлического алюминия (скорость окисления возрастает на 1–3 порядка по сравнению со второй группой). Кинетические кривые имеют только один максимум газовыделения (рис. 1в). При этом образуются наноразмерные кристаллы гидроксида алюминия с размером частиц 20–150 нм и удельной поверхностью более 40 м2/г (рис. 7).
Изменение pH среды в процессе окисления алюминия
Проведенные в настоящей работе измерения pH среды позволили подтвердить и уточнить описанный выше механизм процесса окисления алюминия. При этом следует учитывать, что измеренные в процессе окисления алюминия зависимости pH от времени носят качественный, а не количественный характер, поскольку стационарное значение pH за время измерения не достигалось.
При контакте алюминиевого порошка с водой pH среды в зависимости от своего стартового значения может как расти (рис. 1а), так и падать (рис. 1б, 1в). Известно [33], что в процессе гидратации на поверхности оксида алюминия, контактирующей с водой, образуются гидроксил-ионы, имеющие различное строение и различным образом связанные с поверхностью. Механизм установления поверхностного заряда основан на явлении адсорбции и десорбции протонов активными центрами [33]. Поверхность гидроксида алюминия является амфотерной и в зависимости от pH среды может выступать в качестве как кислоты, так и основания Бренстеда. При значении pH, меньшем значения, соответствующего точке нулевого заряда (ТНЗ), поверхность заряжается положительно, при большем значении pH – отрицательно. В зависимости от типа оксида алюминия значение ТНЗ может изменяться от ~7 до ~10 [33].
Кинетические характеристики процесса установления поверхностного заряда наблюдаются при исследовании кинетики установления рН среды в смеси порошка алюминия с водой. На рис. 1а показана кинетическая кривая изменения значения pH среды в процессе окисления алюминия при стартовом нейтральном pH (кривая 2). Как указывалось выше, в этом случае поверхность заряжается положительно, что сопровождается ростом pH среды. На рис. 1а кривая 2 для pH имеет прогиб в момент времени, соответствующий ~10 мин, во время наиболее интенсивного газовыделения. Этот прогиб, вероятно, связан с растворением свежеобразовавшегося гидроксида алюминия по реакции (1). На рис. 1б, 1в показаны кинетические кривые окисления алюминия и изменение pH среды при стартовом значении pH = 12.5. В этих условиях поверхность оксидного покрытия заряжается отрицательно, а значение pH среды в начальный момент времени падает.
Кроме указанного выше процесса изменения pH среды вследствие заряда поверхности оксидного покрытия на алюминии, падение значения pH на стадии начального окисления при стартовом щелочном значении pH обусловлено растворением образовавшегося гидроксида по реакции (1), а также образованием алюминатов кальция:
(2)
$\begin{gathered} {\text{2Al}}\left( {{\text{OH}}} \right)_{{\text{4}}}^{ - } + {\text{3C}}{{{\text{a}}}^{{{\text{2}} + }}} + {\text{4O}}{{{\text{H}}}^{ - }} \leftrightarrow \\ \leftrightarrow \,\,{\text{3CaO}} \cdot {\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}} \cdot {\text{6}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}{\text{.}} \\ \end{gathered} $В случае стартового значения pH = 12.5 зависимость pH среды от времени на стадиях интенсивного окисления и затухания реакции представляет собой “инвертируемую” зависимость скорости окисления от времени (рис. 1б, 1в). Если падение pH среды на стадии интенсивного окисления связано с растворением гидроксида алюминия по реакции (1), то возрастание, напротив, – с его объединением в цепочки [23], сопровождающимся потерей ионов OH– по реакции
(3)
$n{\text{Al}}\left( {{\text{OH}}} \right)_{{\text{4}}}^{--} \leftrightarrow {\text{A}}{{{\text{l}}}_{n}}\left( {{\text{OH}}} \right)_{{{\text{3}}n + {\text{1}}}}^{--} + \left( {n - {\text{1}}} \right){\text{O}}{{{\text{H}}}^{--}},$и последующей кристаллизацией, а также, вероятно, с частичным растворением образовавшихся на стадии начального окисления алюминатов. Процессы (1)–(3) протекают одновременно в течение всей продолжительности окисления алюминия. Результирующее действие процессов со временем приводит к стационарному значению pH, определяемому термодинамическим равновесием в системе Al(OH)3–H2O–CaO–алюминаты кальция. Отклонение pH от стационарного значения максимально в моменты наибольшей скорости реакции, когда образуется наибольшее количество активного свежеобразовавшегося гидроксида алюминия. По-видимому, скорость растворения последнего по реакции (1) превышает скорость его структурирования по реакции (3) и, соответственно, pH среды отклоняется от стационарного значения в область меньших значений pH (рис. 1б, 1в). После окончания процесса окисления pH среды со временем достигает стационарного значения. Отметим, что рост pH среды на стадии индукции в присутствии алюминатов кальция (рис. 1в), по-видимому, также связан со стремлением pH к стационарному значению для системы Al(OH)3–H2O–CaO–алюминаты кальция [28].
Таким образом, pH среды при использовании активатора CaO отклоняется от стационарного значения для данной системы во время интенсивного окисления и стремится к нему после окончания интенсивного окисления. Поскольку активационный эффект CaO на стадиях индукции и интенсивного окисления определяется повышением растворимости гидроксида алюминия в присутствии активатора, в большинстве случаев для активации процесса достаточное количество СaO составляет 5% от массы Al, а его увеличение >5% не приводит к изменению кинетики окисления (за исключением стадии начального окисления, как показано выше). Однако, как показали наши исследования, использование меньшего чем 5% количества активатора приводит к уменьшению скорости окисления на стадии интенсивного окисления. По-видимому, это связано с тем, что образовавшиеся на стадии начального окисления алюминаты кальция могут частично растворяться по реакции (2), повышая pH. Таким образом, образующиеся алюминаты кальция служат буфером ионов OH–, что обеспечивает активацию.
4. ЗАКЛЮЧЕНИЕ
Применение комплексного подхода к изучению процесса окисления дисперсного алюминия водой с использованием методов электронной микроскопии, рентгенофазового анализа, а также изучения кинетики окисления алюминия и изменения pH среды в процессе окисления дало возможность детализировать механизм протекания процесса окисления при различных режимах его протекания (в том числе при использовании химической (добавление CaO)) и ультразвуковой активации). Показано, что
1) стадия начального окисления обусловлена наличием непроницаемых для кислорода воздуха дефектов ПОП, раскрывающихся при контакте с водой. Области таких дефектов расположены над аморфным алюминием, соединяющим микрокристаллиты Al в единую частицу;
2) стадия индукции обусловлена гидролизом оксидного покрытия;
3) на стадии интенсивного окисления образуется гидроксид алюминия в виде водонасыщенного геля. В случае использования активации стадия интенсивного окисления одновременно является стадией зародышеобразования кристаллов гидроксида алюминия;
4) на стадии затухания окисления происходит конкуренция двух процессов: 1) увеличение толщины гелевого слоя с одновременным уменьшением его водопроницаемости и 2) рост кристаллов гидроксида алюминия и увеличение по мере роста кристаллов массопереноса гидроксида алюминия от окисляемой поверхности в область кристаллизации. В случае, если второй процесс оказывается эффективнее первого, то стадия затухания вновь переходит в стадию интенсивного окисления. Чередование стадий может происходить вплоть до полного окисления алюминия.
Выявленная взаимосвязь структуры образующихся продуктов окисления и кинетики протекания процесса, по всей видимости, имеет место не только при использовании указанных методов активации, но может быть обобщена и на другие активационные методики и условия проведения процесса окисления дисперсного алюминия водой.
Список литературы
Nikolaevich L.M. (Larichev M.N.) Metal Nanopowders: Production, Characterization, and Energetic Applications. Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA. W., 2014. P. 163; doi: 10.1002/9783527680696.ch8
Wang H.Z., Leung D.Y.C., Leung M.K.H. et al. // Renewable and Sustainable Energy Reviews. 2009. V. 13. P. 845; doi: 10.1016/j.rser.2008.02.009
Shkolnikov E.I., Zhuk A.Z., Vlaskin M.S. // Ibid. 2009. V. 15. P. 4611; doi: 10.1016/j.rser.2011.07.091
Ларичев М.Н., Ларичева О.О., Лейпунский И.О. и др. // Изв. РАН. Энергетика. 2007. № 5. С. 125.
Bergthorson J.M., Yavor Y., Palecka J. et al. // Appl. Energy. 2017. V. 186 P. 13; doi: 10.1016/j.apenergy. 2016.10.033
Zhuk A.Z., Vlaskin M.S., Grigorenko A.V. et al. // J. Ceram. Proc. Res. 2016. V. 17. № 9. P. 910.
Kislenko S.A., Vlaskin M.S., Zhuk A.Z. // Solid State Ionics. 2016. V. 293. P. 1.
Ларичев М.Н., Шайтура Н.С., Ларичева О.О. // Хим. физика. 2008. Т. 27. № 9. С. 95; doi: 10.1134/ S1990793108050175
Ларичев М.Н., Шайтура Н.С., Колокольников В.Н. и др. // Изв. РАН. Энергетика. 2010. № 2. С. 85.
Shaytura N.S., Laritchev M.N., Laritcheva O.O. et al. // Current Appl. Phys. 2010. V. 10. Suppl. 2. P. S66; doi: 10.1016/j.cap.2009.11.044
Ларичев М.Н., Шайтура Н.С., Колокольников В.Н. и др. // Перспективные матер. 2010. № 9. С. 289.
Ларичев М.Н., Ларичева О.О., Шайтура Н.С. и др. // Изв. РАН. Энергетика. 2012. № 3. С. 66.
Gromov A.A., Il’in A.P., Foerter-Barth U. et al. // Combust., Explosion, and Shock Waves. 2006. V. 42. № 2. P. 177.
Ларичев М.Н., Ларичева О.О., Лейпунский И.О. и др. // Хим. физика. 2006. Т. 25. № 10. С. 72.
Deng Z.Y., Ferreira J.M.F., Tanaka Y., Ye J. // J. Amer. Ceram. Soc. 2007. V. 90. № 5. P. 1521; doi: 10.1111/ j.1551-2916.2007.01546.x
Fernandez A., Sanchez-Lopez J.C., Caballero A. et al. // J. Microscopy. 1998. V. 191. P. 212; doi: 10.1046./ j.1365-2818.1998.00355.x
Razavi-Tousi S.s., Szpunar J.A. // Electrochim. Acta. 2014. V. 127. P. 95; doi: 10.1016/j.electacta.2014.02.024
Lozhkomoev A.S., Glazkova E.A., Bakina O.V. et al. // Nanotechnology. 2016. V. 27. Issue 20. № 205603; doi: 10.1088/0957-4484/2720/205603
Kanehira S., Kanamori S., Nagashima K. et al. // J. Asian Ceram. Soc. 2013. V. 1. P. 296; doi: 10.1016/ j.jascer.2013.08.001
Bunker B.C., Nelson G.C., Zavadil K.R. et al. // J. Phys. Chem. B. 2002. V. 18. № 106. P. 4705; doi: 10.1021/jp013246e
Shkolnikov E.I., Shaitura N.S., Vlaskin M.S. // J. Supercrit. Fluids. 2013. V. 73. P. 10; doi: 10.1016./j.supflu. 2012.10.011
Ребиндер П.А., Щукин Е.Д. // Успехи физ. наук. 1972. Т. 108. № 9. С. 3; doi: 10.3367/UFNr.0108. 197209а.0003
Zang J., Klasky M., Letellier B.C. // J. Nucl. Mater. 2009. V. 384. P. 175; doi: 10.1016/j.jnucmat.2008.11.009
Song W.H., Du J.J., Xu Y.L. et al. // Ibid. 1997. V. 246. № 2–3. P. 139; doi: 10.1016/S0022-3115(97)00146-3
Ulanovskiy I.B. Hydrogen diffusion and porosity formation in aluminium M.: Izdatelskiy Dom “MISIS”, 2015; ISBN 978-5-87623-939-6
Ходаковский И.Л., Каторча Л.В., Куюнко Н.С. // Геохимия. 1980. № 11. С. 1606.
Feng X., Baojie Z., Chery L. // J. Environ. Sci. 2008. № 20. P. 907; doi: 10.1016/S1001-0742(08)62185-3
Румянцев П.Ф., Хотимченко В.С., Никущенко В.Ш. Гидратация алюминатов кальция. Л.: Наука, 1974.
Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. 3-е изд., испр. М.: Химия, 2000; ISBN 5-7245-1163-0
Luque de Castro M.D., Priego-Capete F. // Ultrason. Sonochem. 2007. V. 14. P. 717.
Nalajala V.S., Moholkar V.S. // Ibid. 2011. V. 18. P. 345.
Margulis M.A. // Ultrasonics. 1985. V. 23. P. 157; doi: 10.1016/0041-624X(85)90024-1
Kaspzyk-Hordern B. // Advances in Colloid and Interface Science. 2004. V. 110. P. 19; doi: 10.1016/ j.cis.2004.02002
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


