Химическая физика, 2019, T. 38, № 4, стр. 84-90
Оптимизация синтеза порошковых наноразмерных материалов диоксида титана из пероксотитанового комплекса
Е. М. Баян 1, *, Т. Г. Лупейко 1, Л. Е. Пустовая 2
1 Южный федеральный университет
Ростов-на-Дону, Россия
2 Донской государственный технический университет
Ростов-на-Дону, Россия
* E-mail: ekbayan@sfedu.ru
Поступила в редакцию 13.07.2018
После доработки 21.11.2018
Принята к публикации 20.12.2018
Аннотация
Оптимизирован отвечающий принципам зеленой химии способ золь–гель синтеза наноразмерных порошковых материалов диоксида титана с использованием стадии образования пероксотитанового комплекса. Разработанный способ позволяет снизить энергоемкость, расход реактивов, исключить образование токсичных сточных вод, загрязненных органическими веществами, а также повысить экологичность процесса в целом. При этом полученные порошковые материалы наноразмерны и имеют фотокаталитическую активность выше, чем у аналогичных материалов.
ВВЕДЕНИЕ
Порошковые материалы диоксида титана с частицами наноразмера (далее – наноразмерный порошок) активно исследуются в связи с их уникальными физико-химическими свойствами, в первую очередь такими, как фотокаталитические, полупроводниковые и т.д. [1, 2]. При этом разработано множество вариантов синтеза как чистого, так и модифицированного диоксида титана [3–7]. В этих исследованиях показано, что, варьируя методику синтеза, природу прекурсоров и среды, способы термообработки и другие параметры, можно целенаправленно синтезировать материал с заранее заданными свойствами. Накопленные экспериментальные данные в настоящее время позволяют рассмотреть экологичность основных предлагаемых приемов синтеза, их ресурсо- и энергоемкость и определить наиболее оптимальный метод получения наноразмерных материалов на основе диоксида титана.
В связи с этим предлагаем на примере широко применяемой золь–гель технологии оптимизировать способ получения фотокаталитически активного диоксида титана из пероксотитанового комплекса (ПТК) в соответствии с основными принципами зеленой химии [8]. Этот комплекс активно используется в качестве предшественника, так как он позволяет получать высокодисперсный наноразмерный порошок диоксида титана за счет электростатического отталкивания одноименно заряженных пероксидных групп, сорбированных на поверхности геля, которые препятствуют агломерации в растворе в более крупные мицеллы [9, 10]. Из ПТК получены не только классические наноразмерные порошковые материалы сферической морфологии анатазной модификации [11], но также полупроводниковые наноразмерные пленки [12–15] и композиты [16–19], а также порошковые материалы в виде полых сфер [20], додекаэдров [21] и наноразмерных эллипсоидов [9, 22].
Известно, что для синтеза наноразмерного диоксида титана из ПТК в качестве исходных реактивов могут быть использованы как органические [23, 24], так и неорганические [25] производные Ti(IV) с последующей обработкой гидроксида титана перекисью водорода. Показано, что высокодисперсные материалы получаются при низких температурах осаждения из разбавленных растворов производных Ti(IV) [26]. Кислотность среды во многом определяет структуру материала. Так, установлено, что анатазная модификация образуется при рН = 6–7, рутильная – при рН = 0 и брукитная – при рН = 1 [26, 27]. При этом наноразмерный порошок диоксида титана исследователи чаще всего получают путем гидротермальной и термической обработки [12–27]. Анализируя этот путь синтеза с точки зрения соответствия его основным принципам зеленой химии [8], можно отметить, что он является энергозатратным, связан с образованием сточных вод, содержащих большое количество разнообразных токсичных загрязняющих веществ органической природы.
В настоящей статье приводятся результаты оптимизации метода синтеза фотокаталитически активных наноразмерных порошковых материалов диоксида титана, полученных золь–гель синтезом, в котором органические предшественники заменены на неорганические и исключен энергоемкий этап синтеза без потери характеристик конечного продукта.
СИНТЕЗ МАТЕРИАЛОВ
В качестве исходных реактивов в золь–гель синтезе использовали титансодержащий предшественник неорганической природы – четыреххлористый титан (“х. ч.”), так как в работе [27] показано, что природа аниона прекурсора не оказывает существенного влияния на фазообразование диоксида титанав случае его синтеза через ПТК. Выбор неорганического предшественника позволяет исключить из процесса синтеза токсичные органические вещества, повышая экологичность процесса. Также в настоящей работе для синтеза традиционно применяли в качестве реагента-осадителя 25%-ный раствор аммиака (“ч. д. а.”), а также 30%-ный водный раствор Н2О2 (“х. ч.”) и дистиллированную воду.
Предварительно из четыреххлористого титана при температуре 0–5 °C получали раствор с содержанием [Ti4+] = 0.1 М. Путем усиления гидролиза водного раствора, содержащего ионы Ti4+, счет добавления раствора аммиака синтезировали белый аморфный гель оксо-гидроксосоединений титана, который условно называют гидроксидом титана. Поскольку ранее [26, 27] детально исследовано влияние кислотности среды на свойства геля в области значений рН от 0 до 7, в настоящей работе мы ограничили изучение влияния этого фактора диапазоном рН среды осаждения 7–14. Полученный гель отфильтровывали и промывали от примесных катионов аммония и хлорид-ионов дистиллированной водой. Остаточное содержание Cl– в фильтровальных водах на начальной стадии контролировали по качественной реакции с раствором нитрата серебра. При отсутствии помутнения проводили количественное цветометрическое определение хлоридов [28]. Данная стадия синтеза позволяет максимально устранить примесные ионы, что гарантирует чистоту получаемого продукта.
Далее, добавляя к гидроксиду титана 30%-ный водный раствор пероксида водорода при перемешивании, получали ПТК. Процесс протекал во времени: в начальный момент образовывался коллоидный раствор желтого цвета, а по истечении часа раствор стал прозрачным и принял желто-оранжевую окраску.
Известно [29], что ионы пероксида ${\text{O}}_{2}^{{2 - }}$ при взаимодействии с растворами солей титанила образуют различные пероксотитановые комплексы, имеющие характерную окраску, цвет и интенсивность которой зависит от кислотности среды. Цвет растворов может изменятся от оранжево-красного в сильнокислой среде до желтого при переходе к нейтральной среде.
Синтезированный нами ПТК выдерживали несколько часов при температуре 20 °С для завершения процесса разложения избытка пероксида водорода. Далее раствор с ПТК выдерживали на водяной бане до получения прозрачного ксерогеля желтого цвета, устойчивого на воздухе более 10 сут.
Большинство исследователей при использовании в качестве предшественника ПТК в дальнейшем для синтеза диоксида титана применяют различные варианты гидротермальной обработки [12–27], что является крайне энергозатратным и малопроизводительным этапом и может быть обусловлено только необходимостью получения частиц строго определенной морфологии. Существенного влияния на фотокаталитические свойства гидротермальная обработка не оказывает. В связи с этим для увеличения энергоэффективности технологии получения диоксида титана нами было предложено проводить его в две менее энергоемкие стадии. На первой стадии применялась изотермическая выдержка в течение 12 ч при 100 °C, в ходе которой происходит разрушение ксерогеля с образованием белого порошка. На второй стадии полученный промежуточный продукт измельчали, а затем прокаливали в течение 2 ч при заданной температуре. Для сравнения синтезировали материалы диоксида титана без стадии получения ПТК. Основные параметры синтеза и свойства полученных материалов представлены в табл. 1.
Таблица 1.
Параметры синтеза и материалов
| Номер образца | Тип комплексного иона | рН осаждения | Термическая обработка | Средний размер частиц порошка, нм | ||
|---|---|---|---|---|---|---|
| Т, °С | время, ч | ОКР | ПЭМ | |||
| 1 | аква | 7 | 100 | 24 | 15 | 17 |
| 2 | аква | 7 | 500 | 2 | 20 | 19 |
| 3 | аква | 7 | 600 | 2 | 22 | 21 |
| 4 | аква | 14 | 600 | 2 | 31 | 28 |
| 5 | аква | 7 | 700 | 2 | 26 | 26 |
| 6 | пероксо | 7 | 100 | 24 | 10 | 9 |
| 7 | пероксо | 7 | 400 | 2 | 11 | 10 |
| 8 | пероксо | 7 | 500 | 2 | 14 | 12 |
| 9 | пероксо | 7 | 600 | 2 | 22 | 20 |
| 10 | пероксо | 7 | 700 | 2 | 25 | 23 |
| 11 | пероксо | 14 | 500 | 2 | 13 | 11 |
| 12 | пероксо | 14 | 600 | 2 | 14 | 13 |
МЕТОДЫ ИССЛЕДОВАНИЯ
Фазообразование при синтезе наноматериалов на основе TiO2 изучали методами дифференциальной сканирующей калориметрии и термогравиметрического анализа с помощью прибора синхронного термического анализа ТГ-ДТА/ДСК STA 449 °С/4 G Jupiter Jupted (Германия) с нагревом на воздухе от 293 до 1173 K со скоростью 10 град/мин.
Рентгенофазовый анализ (РФА) проводили на порошковом дифрактометре ARLX’TRA, Thermo ARL (Швейцария) с использованием Cu(Kα)-излучения. Размеры областей когерентного рассеяния рассчитывали по изменению формы профиля дифракционного отражения в соответствии с уравнением Дебая–Шеррера [30]. Морфологию образцов наблюдали с использованием метода просвечивающей электронной микроскопии (ПЭМ) на микроскопе TEM Tecnai G2 Spirit Bio TWIN. Твердофазные образцы наноразмерных материалов исследовали методом ИК-спектроскопии на ИК-фурье-спектрометре ФСМ 1202 в интервале 500–4000 см–1.
Фотокаталитическая активность (ФКА) полученных образцов была изучена на модельной реакции фотодеградации органического красителя метиленового синего (МС, C16H18CIN3S) в водных суспензиях диоксида титана под действием УФ-излучения (при длине волны более 380 нм). Данное органическое вещество было выбрано в качестве модельного загрязнителя, так как оно имеет в своем составе циклы, которые достаточно сложно разрушить, а также серу, азот и хлор. Это органическое соединение катионного типа. Процесс каталитического разложения используемого реагента можно представить в виде уравнения
Остаточную концентрацию МС определяли спектрофотометрическим методом по градуировочной кривой с помощью спектрофотометра ЮНИКО 1201. Для оценки ФКА по полученным данным рассчитывали долю оставшегося МС в растворе (С/С0).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Методом ИК-спектроскопии контролировали наличие остатков перекисных групп в аморфных порошках диоксида титана, синтезированных из геля ПТК и высушенных при 100 °C. Отметим, что характерные валентные колебания пероксигруппы при 894 см–1 отсутствуют. Широкая полоса поглощения в районе 3200–3500 см–1 указывает на наличие ОН–-групп во всех исследуемых образцах. Гидроксильные группы могут принадлежать молекулам воды, а могут быть координированы титаном. Кроме того, при частотах 500–700 см–1 наблюдаются колебания связей титан–кислород в октаэдрах [TiO6].
Данные, полученные термическим и термогравиметрическим анализом образцов, имеют традиционный для этого типа материалов вид, представленный на рис. 1. По виду кривой термогравиметрического анализа могут быть выделены несколько стадий. Эндотермический пик при 100 °C связан с фазовым превращением воды в пар и его удалением из системы. В температурном диапазоне от 20 до 400 °C происходит общая потеря массы образца (26%), связанная с разложением титансодержащего соединения до диоксида титана. Размытый экзотермический пик в интервале 200–370 °C связан с образованием поликристаллической наноразмерной фазы анатаза, что согласуется с результатами РФА (рис. 2). При температуре выше 400 °C масса исследуемого образца стабилизируется, тепловых эффектов, связанных с образованием новых фаз, не наблюдается. Исходя из полученных данных, для исследования температуры прокаливания были выбраны равными 500 и 600 °C.
Рис. 1.
Данные термогравиметрического дериватографического анализа материала, полученного через стадию образования ПТК.
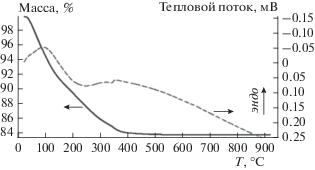
Рис. 2.
Рентгенограммы анатаза из базы данных (1), наноразмерных материалов, полученных золь–гель методом через стадию образования ПТК (2–5) и без нее (6–8), прокаленных при 500 °С (3, 6), 600 °С (4, 7) и 700 °С (5, 8).
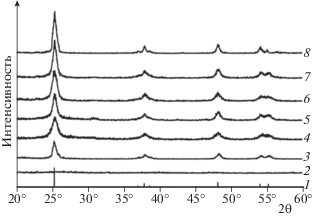
Рентгенограммы наноразмерных материалов диоксида титана изображены на рис. 2. Исходные (непрокаленные) образцы традиционноявляются рентгеноаморфными (рис. 2, кривая 1). При прокаливании все материалы кристаллизуются в анатазной модификации диоксида титана вплоть до 700 °С. Пиков фаз рутила или брукита не обнаружено, что указывает на высокую чистоту продуктов. Отметим, что при включении стадии предварительного кипячения геля ПТК уже при 600 °C образуется примесная фаза диоксида титана рутильной модификации, снижающая фотокаталитические свойства материала [23]. При повышении температуры термообработки наблюдается рост частиц, что приводит к увеличению интенсивности пиков и уменьшению их ширины на полувысоте. При сравнении рентгенограмм материалов, полученных без стадии образовании ПТК и через образование ПТК и обработанных при таких же температурах, видно, что размеры частиц порошковых материалов, полученных по предлагаемому оптимизированному золь–гель методу, меньше (рис. 2).
Во многих работах установлена важность контроля рН среды осаждения гидроксида титана [26, 27, 31]. Известно, что в кислой и слабокислой средах происходит неполное осаждение оксо-гидроксотитанатов. Нами показано, что рН среды осаждения, равное 7, обеспечивает оптимальное соотношение таких факторов, как полнота осаждения, монофазность, наноразмерность, высокая каталитическая активность и экономичный расход реактива-осадителя.
Средние размеры синтезированных из ПТК кристаллитов наноразмерных материалов (табл. 1), вычисленные по уравнению Дебая–Шеррера на пике анатаза (101), варьируются от 13 до 22 нм. Контрольные образцы синтеза без стадии образования ПТК имеют несколько большие размеры частиц: от 22 до 31 нм.
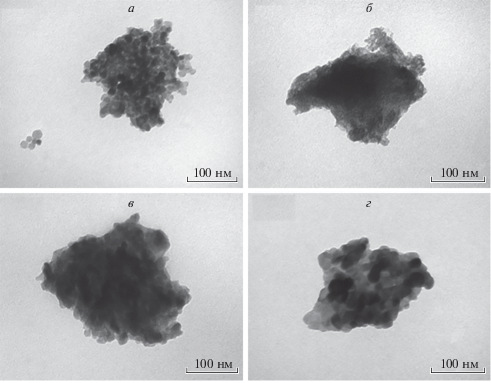
Размер и морфология наноразмерных материалов были также проанализированы с использованием просвечивающей электронной микроскопии. Показано, что для материалов, синтезированных из ПТК, характерна форма частиц, близкая к сферической. Материалы достаточно однородны, со средним размером 15–20 нм (рис. 3). Этот результат совпадает с данными, полученными расчетным путем по результатам РФА.
Рис. 3.
Фотографии ПЭМ материалов, синтезированных из ПТК: а – при рН = 7, Т = 500 °C; б – при рН = 7, Т = 600 °C; в – при рН = 14, Т = 500 °C; г – при рН = 14, Т = 600 °C.
На рис. 4 показана фотодеградация метиленового синего на синтезированных материалах. Отмечено, что материал № 9 (см. табл. 1), полученный из ПТК и прокаленный при 600 °C, обладает наибольшей фотокаталитической активностью, превышающей ФКА коммерческого образца Degussa P25, который представляет собой смесь двух фаз TiO2: анатаза и рутила. Из рис. 4 также следует, что контрольные образцы № 1–3 практически не обладают ФКА.
Рис. 4.
Фотодеградация МС на Degussa P25 (кривая 1) и на материалах, полученных из контрольного образца диоксида титана (кривая 4; образец № 3) и пероксотитанового комплекса (кривая2, образец № 9 и кривая 3, образец № 8) при pH = 7, прокаленных при 600 °C (кривая 2, образец 9 и кривая 4, образец № 3) и 500 °C (кривая 3, образец № 8).
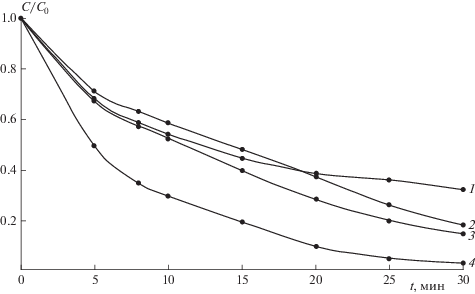
При изучении влияния рН среды осаждения на фотокаталитические свойства полученных материалов было установлено, что наилучшие результаты по ФКА показали материалы № 8–10 (табл. 1), полученные при pH = 7 (рис. 4). Материалы №№ 4, 11 и 12, полученные при pH = 14, обладают низкой фотокаталитической активностью, которая может быть связана с блокированием поверхности гетерогенного катализатора неактивными примесями за счет высокой сорбционной активности материала.
Таким образом, синтезированные из ПТК наноразмерные материалы на основе TiO2 обладают высокой ФКА, что позволяет рекомендовать их в качестве эффективных катализаторов для очистки воды от органических загрязнителей. При этом способ синтеза отвечает основным требования зеленой химии, характеризуется высоким выходом продукта вследствие полноты осаждения и низкой энергоемкостью за счет отказа от гидротермальной обработки. В качестве реагентов не используются токсичные органические реагенты. Таким образом, предлагаемый способ синтеза является простым, экономичным и экологичным.
Выражаем благодарность центру коллективного пользования научным оборудованием “Современная микроскопия” ЮФУ за исследования микроструктуры образцов.
Список литературы
Thompson R.C. // Phys. Inorg. Chem. 1984. V. 15. № 38. P. 1; doi: https://doi.org/10.1002/chin.198438031
Shankar M.V., Kako T., Wang D., Ye J. // J. Colloid Interface Sci. 2009. V. 331. P. 132.
Bayan E.M., Lupeiko T.G., Kolupaeva E.V. et al. // Advanced Materials – Techniques, Physics, Mechanics and Applications. Springer Proceedings in Physics / Eds. Parinov I.A., Shun-Hsyung Chang, Jani M.A. V. 193. Heidelberg, New York, Dordrecht, London: Springer, 2017. P. 17; doi: https://doi.org/10.1007/978-3-319-56062-5_2
Zhang Y., Bai J., Zhou L. et al. // J. Colloid Interface Sci. 2019. V. 536. P. 215.
Баян Е.М., Лупейко Т.Г., Пустовая Л.Е. и др. // Хим. физика. 2017. Т. 36. № 7. С. 68; https://doi.org/doi: 10.1134/ S1990793117040042
Hamadanian M., Karimzadeh S., Jabbari V., Villagrán D. // Mater. Sci. Semicond. Process. 2016. V. 41. P. 168; https://doi.org/doi: 10.1016/j.mssp.2015.06.085
Crişan M., Drăgan N., Crişan D., Ianculescu A. et al. // Ceram. Intern. 2016. V. 42. № 2. P. 3088; https://doi.org/doi: 10.1016/j.ceramint.2015.10.097
Anastas P.T., Warner J.C. Green Chemistry: Theory and Practice. Oxford University Press: New York, 1998.
Захарова Г.С., Андрейков E.И. // Inorg. Mater. 2012. T. 48. № 7. С. 727.
Wang S., Yu H., Yuan Sh., Shi L. // Res. Chem. Intermed. 2016. V. 42. № 4. P. 3775; https://doi.org/doi: 10.1007/s11164-015-2244-6
Баян Е.М., Лупейко Т.Г., Пустовая Л.Е., Федоренко А.Г. // Рос. нанотехнол. 2017. Т. 12. № 5–6. С. 37; https://doi.org/doi: 10.1134/S199507801703003X
Miao Y., Gao J. // J. Sol. St. Chem. 2012. V. 196. P. 372.
Shabanov N.S., Asvarov A.Sh., Chioleriod A. et al. // J. Colloid Interface Sci. 2017. V. 498. P. 306; https://doi.org/doi: 10.1016/j.jcis.2017.03.075
Li Y., Yu Y., Wu L., Zhi J. // Appl. Surf. Sci. 2013. V. 273. P. 135; https://doi.org/https://doi.org/10.1016/j.apsusc.2013.01.213.
Zhang R., Zhang Y., Xu C. et al. // Proc. SPIE 8409. Third Intern. Conf. on Smart Materials and Nanotechnology in Engineering, 84092 K. Shenzhen, China 2012; https://doi.org/doi: 10.1117/12.922192
Morozov R., Krivtsova I., Avdin V. et al. // J. Non-Cryst. Solids. 2016. V. 435. P. 8; http://dx.doi.org/10.1016/ j.jnoncrysol.2015.12.024.
Zhao Q., Wen W., Xia Y., Wu J. // Thin Solid Films. 2018. V. 648. P. 103; https://doi.org/10.1016/j.tsf. 2018.01.004.
Low W., Boonamnuayvitaya V. // Mater. Res. Bull. 2013. V. 48. P. 2809; http://dx.doi.org/10.1016/j.materresbull. 2013.04.020.
Ilkaeva M., Krivtsov I., Avdin V. et al. // Colloids Surf., A. 2014. V. 456. P. 120.
Wu D., Zhu F., Li J., Xu D. // J. Mater. Chem. 2012. V. 22. № 23. P. 11665; https://doi.org/doi: 10.1039/C2JM30786C
Murakami N.,Kawakami S., Tsubota T., Ohno T. // J. Mol. Catal. A: Chem. 2012. V. 358. P. 106; https://doi.org/doi: 10.1016/j.molcata.2012.03.003
Zhang Y., Wu L., Zeng Q., Zhi J. // Mater. Chem. Phys. 2010. V. 121. № 1. P. 235; https://doi.org/doi: 10.1016/ j.matchemphys.2010.01.024
Liu Y., Aizawa M., Wang Z. et al. // J. Colloid Interface Sci. 2008. V. 322. № 2. P. 497; https://doi.org/https://doi.org/10.1016/ j.jcis.2008.03.034.
Bao X., Yan S., Chen F., Zhang J. // Mater. Lett. 2005. V. 59. P. 412.
Nguyen D., Wang W., Long H., Ru H. // Front. Mater. Sci. 2016. V. 10. № 1. P. 23; https://doi.org/doi: 10.1007/s11706-016-0322-3
Zhang Y., Wu L., Zeng Q., Zhi J. // J. Phys. Chem. C. 2008. V. 112. № 42. P. 16457; https://doi.org/doi: 10.1021/jp804524y
Seok S.I., Vithal M., Chang J.A. // J. Colloid Interface Sci. 2010. V. 346. № 1. P. 66; https://doi.org/doi: 10.1016/ j.jcis.2010.02.049
Горбунова М.О., Баян Е.М., Шевченко А.В., Кулягинова М.С. // Аналитика и контроль. 2017. Т. 21. № 3. С. 274; https://doi.org/doi: 10.15826/analitika.2017.21.3.007
Третьяков Ю.Д. Неорганическая химия. T. 3. М.: Академия, 2007.
Stengl V., Bakardjieva S., Murafa N. // Mater. Chem. Phys. 2009. V. 114. № 1. P. 217; https://doi.org/doi: 10.1016/ j.matchemphys.2008.09.025
Bayan E.M., Lupeiko T.G., Pustovaya L.E., Fedorenko A.G. // Advanced Materials Manufacturing, Physics, Mechanics and Applications. Springer Proceedings in Physics / Eds. Parinov I.A., Shun-Hsyung Chang, Topolov V.Yu. V. 175. Heidelberg, New York, Dordrecht, London: Springer, 2016. P. 51; doi: https://doi.org/10.1007/978-3-319-26324-3_4
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


