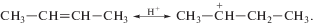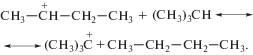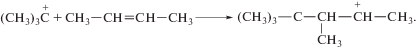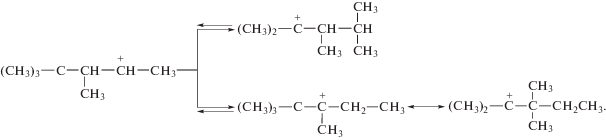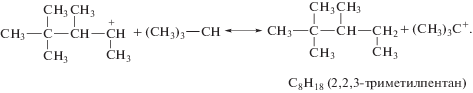Химическая физика, 2019, T. 38, № 4, стр. 12-15
Возможные преимущества диффузионных режимов в химической технологии
А. А. Берлин 1, *, К. Ю. Прочухан 2, Д. Ю. Прочухан 2, Ю. А. Прочухан 2
1 Институт химической физики им. Н.Н. Cемёнова Российской академии наук
Москва, Россия
2 Башкирский государственный университет
Уфа, Россия
* E-mail: berlin@chph.ras.ru
Поступила в редакцию 13.06.2018
После доработки 13.06.2018
Принята к публикации 20.06.2018
Аннотация
Принято считать, что при организации промышленных процессов следует стремиться к проведению химических реакций в кинетическом режиме. Приведены примеры, когда диффузионный режим с точки зрения улучшения качества продукта и технологических параметров процесса выгоднее. При полимеризации формальдегида диффузионный режим позволяет повысить молекулярную массу продукта. При сернокислотном алкилировании изобутана бутиленами в диффузионном режиме повышается выход продукта, октановое число и уменьшается расход катализатора.
Рассмотрим процесс полимеризации газообразного формальдегида в открытой системе [1–3]. Газообразный формальдегид подается в реактор с раствором катализатора, растворяется и полимеризуется в растворе (рис. 1). В зависимости от условий (скорость подачи, скорость растворения, концентрация катализатора и пр.) возможны различные режимы химического процесса. Предельными режимами являются кинетический, когда скорость лимитируется скоростью самой химической реакции полимеризации, или диффузионный, когда процесс лимитируется скоростью подвода мономера, т.е. либо подачей мономера в реактор, либо скоростью его растворения в жидкой фазе. Заметим, что критическим, т.е. определяющим качество полимера, в данном случае является его молекулярный вес. В свою очередь, молекулярный вес определяется реакцией передачи цепи на примеси воды и метанола в формальдегиде. Поэтому необходимой и важной стадией производства полиформальдегида является его очистка от примесей. Рассмотрим два предельных случая.
1. Кинетический режим. В этом случае концентраций формальдегида, [Ф]ж, и примеси, [Пр]ж, равны их растворимости в растворителе, а средняя степень полимеризации (и молекулярный вес, соответственно) равна отношению скоростей роста и передачи цепи:
2. Диффузионный режим, когда в реакцию полностью вступают поступающие в раствор из газовой фазы формальдегид и примесь. Тогда ${\text{DP}} = {{{{\beta }_{{\text{Ф }}}}{{{\left[ {\text{Ф }} \right]}}_{{\text{г }}}}} \mathord{\left/ {\vphantom {{{{\beta }_{{\text{Ф }}}}{{{\left[ {\text{Ф }} \right]}}_{{\text{г }}}}} {{{\beta }_{{{\text{П р }}}}}{{{\left[ {{\text{П р }}} \right]}}_{{\text{г }}}}}}} \right. \kern-0em} {{{\beta }_{{{\text{П р }}}}}{{{\left[ {{\text{П р }}} \right]}}_{{\text{г }}}}}}.$ Отношения ${{{{K}_{{\text{Ф }}}}} \mathord{\left/ {\vphantom {{{{K}_{{\text{Ф }}}}} {{{K}_{{{\text{П р }}}}}}}} \right. \kern-0em} {{{K}_{{{\text{П р }}}}}}}$ и ${{{{\beta }_{{\text{Ф }}}}} \mathord{\left/ {\vphantom {{{{\beta }_{{\text{Ф }}}}} {{{\beta }_{{{\text{П р }}}}}}}} \right. \kern-0em} {{{\beta }_{{{\text{П р }}}}}}}$ не существенно отличаются от единицы, в то время как отношение ${{{{k}_{{\text{р }}}}} \mathord{\left/ {\vphantom {{{{k}_{{\text{р }}}}} {{{k}_{{\text{п }}}}}}} \right. \kern-0em} {{{k}_{{\text{п }}}}}} \ll 1$ для катионной полимеризации формальдегида. Именно поэтому его молекулярный вес выше при проведении реакции в диффузионном режиме.
Еще один интересный и неожиданный результат – молекулярный вес полимера возрастает при увеличении концентрации катализатора, поскольку при этом происходит переход от кинетического к диффузионному режиму. Количественным критерием перехода служит следующее соотношение: при $\quad\left[ {{\text{A*}}} \right] \ll \frac{{{{\beta }_{{\text{Ф }}}}S}}{{{{k}_{p}}V{{K}_{{\text{Ф }}}}}}$ $\left( {\left[ {{\text{A*}}} \right] \ll \frac{{{{\beta }_{{{\text{П р }}}}}S}}{{{{k}_{p}}V{{K}_{{{\text{П р }}}}}}}} \right)$ имеет место кинетический режим, а при $\left( {\left[ {{\text{A*}}} \right] \gg \frac{{{{\beta }_{{\text{Ф }}}}S}}{{{{k}_{p}}V{{K}_{{\text{Ф }}}}}}} \right)$ $\left( {\left[ {{\text{A*}}} \right] \gg \frac{{{{\beta }_{{{\text{П р }}}}}S}}{{{{k}_{p}}V{{K}_{{{\text{П р }}}}}}}} \right)$ – диффузионный. Здесь V – объем жидкости в реакторе, а S – площадь поверхности, через которую идет растворение газов. Предполагается, что концентрации реагентов в жидкости постоянны по объему, т.е. жидкость перемешивается достаточно эффективно.
И в случае промышленного крупнотоннажного производства – при получении высокооктанового бензина, сернокислотном алкилировании изобутилена бутиленами диффузионный режим оказывается полезным [4, 5]. Схема реакции представлена ниже.
Общепринято, что каталитическое алкилирование изоалканов идет через промежуточное образование ионов карбония:
Вторичный ион карбония менее устойчив, чем третичный, вследствие чего происходит быстрый обмен гидрид-ионом с изопарафином:
Образующийся третичный карбоний-катион реагирует с исходным олефином:
Получившийся ион карбония склонен к внутримолекулярным перегруппировкам, сопровождающимся миграцией водорода и метильных групп:
Ионы карбония взаимодействуют с изобутаном, в результате чего получаются С8Н18 и третичный бутил-катион:
Таким образом, получаются изомерные углеводороды C8H18, представляющие собой основной и наиболее ценный продукт.1 Кроме того, идут побочные реакции:
В результате побочных реакций получаются ненасыщенные полимеры, ухудшающие качество алкилата и ведущие к повышенному расходу катализатора [6–8].
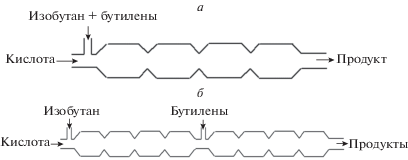
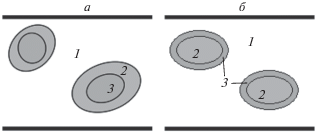
Применение избытка изоалканов подавляет все побочные реакции, положительно влияет на выход и качество алкилата, повышает его октановое число, снижает расход катализатора и себестоимость продукта. Оказалось, однако, что если подавать сначала серную кислоту с изобутаном, создавая эмульсию, в которой кислота диспергирована в изобутане либо изобутан в кислоте, а только потом – бутилены, как это показано на рис. 2б, то существенно уменьшается количество побочных продуктов, уменьшается расход кислоты (меньше получается кислого гудрона) и улучшается качество продукта (значительно повышается октановое число продукта). В чем же тут дело? После смешения серной кислоты с изобутаном получается либо эмульсия кислота–изобутан (рис. 3а), либо эмульсия изобутан–кислота (рис. 3б). Эта эмульсия попадает в среду бутиленов и они начинают растворяться в изобутане и/или в кислоте. Диффузия в первом случае идет с поверхности мицеллы, и концентрация бутиленов у поверхности кислоты мала. Тогда реакция идет в избытке изобутана, что и требуется для получения качественного продукта (алкилата) и снижения расхода кислоты (уменьшения количества кислого гудрона). При таких условиях нет потребности создавать большой переизбыток изобутана. Необходимым критерием осуществления такой картины процесса, т.е. низкой концентрации бутиленов в зоне химической реакции, является сравнительно медленная диффузия бутиленов в изобутане по сравнению со скоростью самой реакции алкилирования:
Итак, на примерах полимеризации формальдегида и сернокислотного алкилирования показано, какие преимущества может дать переход от кинетического режима проведения химического процесса к диффузионному.
Научно-исследовательская работа выполнена за счет субсидии, выделенной ИХФ РАН на выполнение государственного задания по теме 0082-2014-0009 (№ АААА-А17-117040610309-0).
Список литературы
Ениколопян Н.С., Вольфсон С.А. Химия и технология полиформальдегида. М.: Химия, 1968.
Берлин Ал.Ал., Вольфсон С.А. Кинетический метод в синтезе полимеров. М.: Химия, 1973.
Берлин Ал.Ал., Вольфсон С.А., Ениколопян Н.С. Кинетика полимеризационных процессов. М.: Химия, 1978.
Прочухан К.Ю., Исламов Э.Р., Нефедова И.В. и др. // Химия и технол. топлив и масел. 1999. № 2. С. 16.
Islamov E.R., Prochukhan K.Y., Nefedova I.V. et al. // Chem. and Technol. Fuels and Oils. 1999. V. 35. № 4. P. 195.
Исламов Э.Р., Прочухан К.Ю., Нефедова И.В. и др. // Вестн. Баш. ун-та. 1998. № 3. С. 35.
Исламов Э.Р., Прочухан К.Ю., Нефедова И.В. и др. // Там же. 1999. № 3. С. 40.
Прочухан К.Ю., Берлин Ал.Ал., Прочухан Ю.А. // Вестн. технол. ун-та. 2018. Т. 21. № 4. С. 19.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика