Химическая физика, 2019, T. 38, № 4, стр. 39-44
Влияние окисления фторуглеводородов и фторуглеродов на их характеристики как средств подавления горения газов
С. Н. Копылов 1, 2, *, Т. В. Губина 2
1 Всероссийский научно-исследовательский институт противопожарной обороны
Московская обл., Балашиха, Россия
2 Национальный исследовательский ядерный университет “МИФИ”
Москва, Россия
* E-mail: firetest@mail.ru
Поступила в редакцию 16.05.2018
После доработки 19.11.2018
Принята к публикации 20.12.2018
Аннотация
Горение некоторых фторуглеводородов и фторуглеродов в кислороде было исследовано в закрытом сосуде при комнатной начальной температуре и атмосферном начальном давлении. В статье обсуждаются особенности химического механизма окисления этих соединений. Для улучшения характеристик фторированных соединений как средств подавления горения газов необходимо ввести в них ингибитор их окисления. Было получено, что при добавление C3H8, C4H10 и C3H6 к фторированному соединению его минимальная флегматизирующая концентрация для метановоздушных смесей существенно снижается.
ВВЕДЕНИЕ
Некоторые фторированные соединения (например, C4F10, C3F7H, C2F5H и т.д.) широко применяются как озонобезопасный заменитель бромированных хладонов в пожаротушении и взрывопредупреждении. Они менее эффективны, чем бромированные агенты [1–3], и, согласно выводам некоторых авторов [4, 5], это является следствием низкой химической активности фторуглеводородов (ГФУ) и фторуглеродов (ФУ). Однако в работах [1, 3] было показано, что фторированные углеводороды снижают нижний концентрационный предел для углеводородов или водорода в воздухе и что они могут перевести негорючую смесь в разряд горючих. В работах [6, 7] установлено, что добавление некоторых фторированных газов вызывает рост давления ударной волны при детонации в смесях C2H4–воздух–фторированный углеводород вследствие увеличения тепловыделения при химической конверсии фторированного соединения. Промотирование воспламенения метана CF3H отмечено в работе [8]. Дополнительное тепловыделение в диффузионных пламенах, ингибированных фторированными агентами, было установлено в работе [9]. Эффект тепловыделения, вызванный химическим превращением фторированных углеводородов в бедных перемешанных метановоздушных и водородовоздушных пламенах, был обнаружен в работе [1]. Этот эффект проявляется как значительное увеличение максимального давления взрыва и максимальной скорости нарастания давления взрыва газовых смесей, содержащих ГФУ или ФУ [1, 10] и как увеличение нормальной скорости горения бедных метановоздушных смесей в присутствии гептафторпропана [11]. Подобные результаты также получены в работе [12] для C3F7COC2F5.
Таким образом, экспериментальные результаты показывают, что ГФУ и ФУ не являются инертными разбавителями, они играют активную роль в химическом превращении во фронте пламени. Поскольку все наблюдаемые явления имеют место в бедных горючих смесях, можно заключить, что ГФУ и ФУ способны окисляться в смесях с водородом или углеводородом и воздухом, и это свойство важно для их характеристик как средств подавления газофазного горения. В то же время экспериментальные данные по окислению фторированных углеводородов, которые используются как заменители бромсодержащих хладонов, практически отсутствуют. Следует отметить статьи [13–15], в которых были определены концентрационные пределы распространения пламени и другие характеристики горения некоторых ГФУ и ФУ в воздухе и кислороде. В работе [16] расчетным путем показано, что фторированные углеводороды, применяемые в пожаротушении, в частности, CF3H, C2F5H, C3F7H, в смесях с воздухом при атмосферном давлении смеси и начальной температуре смеси 400 K обладают достаточным запасом энергии для самостоятельного горения (для стехиометрических смесей расчетное значение нормальной скорости горения составляет 0.37–2.5 см/с).
Таким образом, представляет интерес продолжение исследований особенностей окисления фторированных соединений, поскольку, если механизм окисления известен, можно попытаться влиять на процесс посредством введения ингибитора окисления во фторированное соединение. Этот подход может быть продуктивен для улучшения характеристик ГФУ и ФУ как агентов для взрывопредупреждения. Данная работа имеет целью экспериментальное исследование упомянутых выше проблем.
ЭКСПЕРИМЕНТАЛЬНОЕ ОБОРУДОВАНИЕ
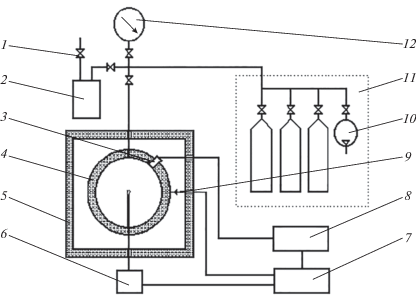
Эксперименты проводились на установке “Вариант”, схема которой представлена на рис. 1. Данная установка предназначена для измерения концентрационных пределов распространения пламени, максимального давления взрыва и максимальной скорости нарастания давления взрыва в диапазоне давлений 0.1–4.0 MПa. Реакционный сосуд установки имеет сферическую форму и изготовлен из нержавеющей стали. Его диаметр составляет 20 см, объем – 4.2 л. Установка имеет систему приготовления газовых смесей по парциальным давлениям и систему вакуумирования. Требуемая газовая смесь формируется по парциальным давлениям в реакционном сосуде, предварительно вакуумированнном до 0.5 кПa. Газовые смеси зажигались в центре реакционного сосуда посредством взрываемой нихромовой проволочки, имеющей диаметр 0.2 и длину 3 мм (энергия зажигания приблизительно 10 Дж). Регистрация распространения пламени проводилась при помощи датчика давления “Сапфир-22” с постоянной времени около $3 \cdot {{10}^{{ - 3}}}$ с и записью на цифровом осциллографе. Принималось, что распространение пламени имеет место, если рост давления превышает 30 кПa. Относительная погрешность определения пределов распространения пламени и максимального давления взрыва не превышала 10%; для максимальной скорости нарастания давления взрыва она составляла 20%. Более детальное описание установки и экспериментальной процедуры приведено в работах [17, 18]. Следующие фторированные вещества использовались в экспериментах: CF4, C2F6, C3F8, C4F10; CF3H, C2F5H, C3F7H. В некоторых опытах использовался метан.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В данной статье представлены результаты двух экспериментальных серий. В первой изучалось горение некоторых ГФУ и ФУ в кислороде. Во второй исследовалось влияние смесевого агента (фторированное соединение – смесь алканов и алкенов) на горение метана в воздухе. Все эксперименты проводились при начальном атмосферном давлении и комнатной начальной температуре.
В табл. 1 показаны концентрационные пределы распространения пламени смеси ГФУ и ФУ с кислородом. На рис. 2, 3 представлены зависимости максимального давления взрыва ΔPmax и максимальной скорости нарастания давления взрыва от концентрации фторированного вещества в смеси с кислородом.
Таблица 1.
Концентрационные пределы распространения пламени фторированных соединений в кислороде
| ФУ | Нижний предел, об.% | Верхний предел, об.% | ГФУ | Нижний предел, об.% | Верхний предел, об.% |
|---|---|---|---|---|---|
| CF4 | – | – | CF3H | – | – |
| C2F6 | – | – | C2F5H | 22.0 | 38.0 |
| C3F8 | – | – | C3F7H | 9.0 | 81.0 |
| C4F10 | 36.0 | 52.0 |
Рис. 2.
Зависимости максимального давления взрыва от концентрации ГФУ и ФУ в смесях с кислородом: 1 – C2F5H; 2 – C4F10; 3 – C3F7H.
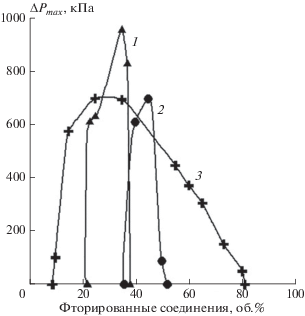
Рис. 3.
Зависимости максимальной скорости нарастания давления взрыва от концентрации ГФУ и ФУ в смесях с кислородом: 1 – C2F5H; 2 – C4F10; 3 – C3F7H.
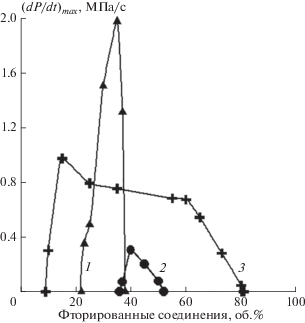
Из приведенных данных в табл. 1 следует, что три из насыщенных фторуглеродов (CF4, C2F6, C3F8) и один фторуглеводород CF3H являются негорючими в присутствии кислорода. Это согласуется с имеющимися литературными данными работы [14, 15]. Однако, в противоречие с результатами работы [14] было обнаружено, что C4F10 способен гореть в кислороде. Вероятно, наблюдаемое противоречие возникает вследствие различия экспериментальных условий в работе [14] и в настоящей работе. В работе [14] с целью определения нормальной скорости распространения пламени использовали микрогорелку, а результаты настоящей работы были получены в бомбе постоянного объема. Большие теплопотери фронта пламени по сравнению с бомбой постоянного объема были обусловлены конструкцией микрогрелки из-за его непосредственного контакта с горелкой.
Для соединений C2F5H, C3F7H и C4F10 наблюдалось их медленное горение (см. рис. 3). Необходимо отметить, что горение C3F7H существенно отличается от горения C2F5H и C4F10. Его концентрационные пределы в кислороде существенно шире, чем для C2F5H и C4F10: от 9.0 до 81.0 об.%. Но основное различие в экспериментальных результатах по горению этих газов в кислороде связано с изменением режима горения в случае C3F7H. В данной работе было обнаружено, что при горении смесей C3F7H с кислородом имеет место интенсивное сажеобразование при концентрациях гептафторпропана от 9.0 до 30.0 об.%. Когда содержание C3F7H в смеси находится в диапазоне от 9.0 до 15.0 об.%, сажа оседает на стенках реакционного сосуда и источнике зажигания в форме хлопьев. При горении C3F7H при концентрациях от 15.0 до 30.0 об.% наблюдалось образование однородного слоя сажи на поверхности “бомбы” и источника зажигания; толщина слоя составляла 0.3–0.4 мм. По-видимому, при горении гептафторпропана в вышеуказанном диапазоне концентраций реализуются исключительно высокие температуры: керамическая изоляция электродов источника зажигания разрушается после нескольких экспериментов. Такой эффект не имеет места при горении водорода или углеводородов. Когда концентрация фторированного вещества превышает 30.0 об.%, имеет место переход к другому режиму горения. Низкая интенсивность сажеобразования и существенно более низкие температуры характеризуют окисление C3F7H при концентрациях от 30.0 до 81.0 об.%. Описанные эффекты не имеют места при горении C2F5H и C4F10. Таким образом, мы можем заключить, что механизм окисления C3F7H отличается от механизма окисления C2F5H и C4F10.
Рассмотрим возможные химические механизмы окисления этих веществ. В случае ГФУ наиболее вероятные начальные стадии их окисления следующие:
(1)
${{{\text{C}}}_{n}}{{{\text{F}}}_{{2n + 1}}}{\text{H}} + {{{\text{O}}}_{2}} \to {{{\text{C}}}_{n}}{{{\text{F}}}_{{2n + 1}}} + {\text{H}}{{{\text{O}}}_{2}},$(2)
${{{\text{C}}}_{n}}{{{\text{F}}}_{{2n + 1}}} + {{{\text{O}}}_{2}} \to {{{\text{C}}}_{n}}{{{\text{F}}}_{{2n + 1}}}{\text{OO}}.$Эта последовательность согласуется с результатами статьи [19], в которой исследовалось превращение CF3H в пламенах. В частности, было обнаружено, что в пламенах, содержащих фторированные агенты, важной является реакция CF3 + O2.
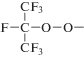
В случае окисления C3F7H реакция (2) дает следующий продукт:
Вследствие особенностей его структуры это промежуточное вещество существенно нестабильно и распадается с разрывом C–C связей и значительным тепловыделением. Для горения C2F5H результатом реакции (2) является соединение F3C–C–O–O–. Радикал C2F5OO существенно более стабилен, чем радикал C3F7OO. Можно предположить, что он расходуется в медленных реакциях. Реализация более высоких температур при горении C3F7H облегчает протекание реакций, сопровождающихся разрывом C–F связей по сравнению с аналогичными реакциями при горении C2F5H. Таким образом, мы получаем интенсивное сажеобразование в случае C3F7H. Однако увеличение концентрации C3F7H в смеси с O2 означает соответствующее увеличение теплопотерь на нагрев компонентов смеси и уменьшение температуры горения. Более низкие температуры горения ведут к уменьшению скоростей реакций, сопровождающихся разрывом связей C–F и увеличению стабильности радикала C3F7OO. Таким образом, интенсивность сажеобразования уменьшается.
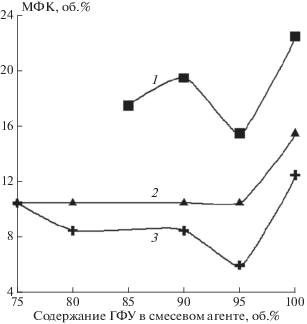
Вышеописанные особенности окисления фторированных углеводородов имеют существенное влияние на их характеристики как агентов для пожаротушения и взрывопредупреждения. На рис. 4 представлены зависимости минимальных флегматизирующих концентраций (МФК) ГФУ и ФУ для горения метана в воздухе от числа атомов С в молекуле фторированного углеводорода. Как следует из рис. 4, МФК C3F7H существенно выше, чем для C2F5H.
Рис. 4.
Зависимость МФК ГФУ и ФУ для горения метана от числа атомов С в молекуле фторированного соединения: 1 – ФУ; 2 – ГФУ.
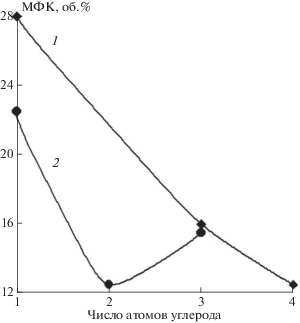
Согласно данным работ [1, 20] основными стадиями ингибирования горения фторированными углеводородами являются следующие реакции:
(3)
${{{\text{C}}}_{n}}{{{\text{F}}}_{{2n + 1}}}{\text{H}} + {\text{H}} \to {{{\text{C}}}_{n}}{{{\text{F}}}_{{2n + 1}}} + {{{\text{H}}}_{2}}$или
(4)
${{{\text{C}}}_{n}}{{{\text{F}}}_{{2n + 2}}} + {\text{H}} \to {{{\text{C}}}_{n}}{{{\text{F}}}_{{2n + 1}}} + {\text{HF}}$и затем
(5)
${{{\text{C}}}_{n}}{{{\text{F}}}_{{2n + 1}}} + {\text{H}} \to {{{\text{C}}}_{n}}{{{\text{F}}}_{{2n + 1}}}{\text{H}}.$Энергия активации реакции (3) при n = 3 Е3 = = 63.0 кДж/моль, значение предэкспоненциального множителя в выражении для константы скорости этой реакции k3 = 7.08 ∙ 10–10 см3/(молекула ⋅ с) [21]; для n = 2 Е3 = 64.6 кДж/моль, k3 = 1.58 ∙ 10–10 см3/ (молекула ⋅ с) [22]. Соответственно, скорость реакции C3F7H + H выше, чем скорость реакции C2F5H + H при температурах горения метана. Таким образом, можно ожидать, что гептафторпропан является более сильным ингибитором горения, чем пентафторэтан. Однако в действительности мы наблюдаем обратную ситуацию из-за особенностей окисления C3F7H.
По нашему мнению, реакции (3) или (4) должны облегчать окисление фторированных углеводородов, т.к. протекают легче, чем реакция (1) между насыщенными молекулами, образуя при этом тот же конечный продукт CnF2n + 1, участвующий в реакции (2). Если данное утверждение верно, то для того чтобы улучшить характеристики фторированных веществ как средств взрывопредупреждения для горючих газовых смесей, необходимо ввести в них ингибитор их окисления, способный эффективно взаимодействовать с атомарным водородом. Такими ингибиторами могут быть, например, алканы или алкены. Известно [23], что за счет взаимодействия с атомарным водородом пропан и пропилен эффективно подавляют горение богатых и стехиометрических водородовоздушных и метановоздушных смесей (в бедных смесях незамещенный углеводород сам способен окисляться, давая дополнительное тепловыделение, и эффект ингибирования не наблюдается). При этом для реакции
(6)
${{{\text{C}}}_{3}}{{{\text{Н }}}_{8}} + {\text{H}} \to {{{\text{C}}}_{3}}{{{\text{Н }}}_{7}} + {{{\text{H}}}_{2}},$энергия активации Е6 = 33.51 кДж/моль, значение предэкспоненциального множителя в выражении для константы скорости этой реакции k6 = = 1.54 ∙ 10–10 см3/(молекула ∙ с) [21], а для реакции
Е7 = 13.64 кДж/моль, k7 = 2.16 ∙ 10–11 см3/(молекула ∙ с) [21], и реакции (6) и (7) будут эффективными конкурентами реакций (3) или (4).
На рис. 5, 6 представлены результаты исследования влияния смесевого агента (фторированное соединение – смесь алканов и алкенов: 40 об.% C3H8–40 об.% C4H10–20 об.% C3H6) на горение метана в воздухе. В экспериментах использовались негорючие смеси ГФУ и ФУ с алканами и алкенами.
Рис. 5.
Концентрационные пределы смеси CH4/воздух/агент для взрывопредупреждения. Агент для взрывопредупреждения: 1 – C4F10; 2 – 41.7 об.% смесь алканов и алкенов (40 об.% C3H8 – 40 об.% C4H10 – 20 об.% C3H6) – 58.3 об.% C4F10.
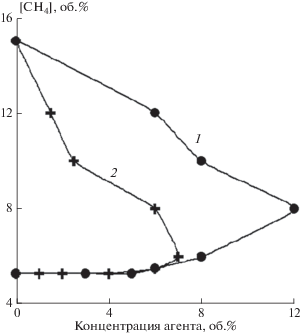
Было показано, что добавка вышеуказанной смеси углеводородов к CF3H, C2F5H и C4F10 приводит к существенному снижению их МФК. В частности, было обнаружено, что минимальная флегматизирующая концентрация смесевого агента: 41.7 об.% (смесь алканов и алкенов)–58.3 об.% C4F10 для горючей системы CH4–воздух составляет 7 об.% (для сравнения: МФК C4F10 для смесей метана с воздухом составляет 12 об.%, см. рис. 5). Аналогичные результаты были получены для CF3H, C3F7H и C2F5H (см. рис. 6). Как следует из рис. 6, эффективность смесевого агента существенно зависит от соотношения между его компонентами. По нашему мнению, наблюдаемый эффект заключается в следующем. Углеводородный ингибитор препятствует превращению фторированного углеводорода в пламени, и, соответственно, отсутствует дополнительное тепловыделение, сопровождающее этот процесс; при этом фторированный агент, разбавляя реагирующую смесь, не позволяет эффективно окисляться самому незамещенному углеводороду. Таким образом, предложен метод повышения эффективности существующих газовых средств взрывопредупреждения.
ВЫВОДЫ
1. Определены концентрационные пределы распространения пламени C2F5H, C3F7H и C4F10 в кислороде.
2. Обнаружено интенсивное сажеобразование при горении бедных смесей C3F7H с O2.
3. Для того чтобы улучшить характеристики фторированных веществ как средств взрывопредупреждения, необходимо ввести в них ингибитор их окисления.
Список литературы
Shebeko Yu.N., Azatyan V.V., Bolodyan I.A. et al. // Combust. Flame. 2000. V. 121. P. 542.
Ohtani H. // Fire Safety Science – Proc. 6 Intern. Sympos. Puatier: International Association for Fire Safety Science (IAFSS), 1999. P. 245.
Saito N., Tsuruda T., Sacurai K. // Ibid. P. 411.
Noto T., Babushok V., Hamins A., Tsang W. // Combust. Flame. 1998. V. 112. P. 147.
Walravens B., Battin-Leclerc F., Come G.M., Baronnet F. // Ibid. 1995. V. 103. P. 339.
Grosshandler W.L., Gmurchzyk G.W. // Fire Safety Science – Proc. 5 Intern. Sympos. Melbourne IAFSS, 1997. P. 853.
Gmurchzyk G.W., Grosshandler W.L., Lowe D.L. // Fire Safety Science – Proc. of the 4 Intern. Sympos. Ottawa: IAFSS, 1995. P. 925.
Holmstedt G., Andersson P., Andersson J. // Fire Safety Science – Proc. 5 Intern. Sympos. Melbourne: IAFSS, 1995. P. 853.
Drakon A., Eremin A. // Combust. Flame. 2015. V. 162. P. 2746.
Pagliaro J.L., Linteris G.T., Sunderland P.B., Baker P.T. // Ibid. 2015. V. 162. P. 41.
Babushok V.I., Linteris G.T., Burgess D.R., Baker P.T. // Ibid. 2015. V. 162. P. 1104.
Linteris G.T., Babushok V.I., Sunderland P.B., Takahashi T., Katta V.R., Meier O. // Proc. Combust. Inst. 2013. V. 34. P. 2683.
Lisochkin Ya.A., Poznyak V.I. // Combust. Explos. Shock Waves. 2001. V. 37. P. 32.
Matula R.A., Orloff D.I., Agnew J.T. // Combust. Flame. 1970. V. 14. P. 97.
Croomes E.F. // Ibid. 1966. V. 10. P. 77.
Babushok V.I., Linteris G.T., Meier O.C. // Ibid. 2012. V. 159. P. 3569.
Цариченко С.Г., Навценя В.Ю., Шебеко Ю.Н., Лашкин С.М. Пожарная опасность веществ и материалов, применяемых в промышленности. Сб. научн. трудов. М.: ВНИИПО, 1987. С. 3.
Shebeko Yu.N. // Combust. Flame. 1995. V. 102. P. 427.
Douglass C.H., Williams B.A., McDonald J.R. // Ibid. 1996. V. 107. P. 475.
Babushok V., Noto T., Burgess D.R.F., Tsang W. // Ibid. 1996. V. 107. P. 351.
Manion J.A., Huie R.E., Levin R.D., Burgess Jr. D.R., Orkin V.L., Tsang W., McGivern W.S., Hudgens J.W., Knyazev V.D., Atkinson D.B, Chai E., Tereza A.M., Lin C.-Y., Allison T.C., Mallard W.G., Westley F., Herron J.T., Hampson R.F., Frizzell D.H. NIST Chemical Kinetics Database. NIST Standard Reference Database 17, Version 7.0 (Web Version), Release 1.6.8, Data version 2015.09, National Institute of Standards and Technology, Gaithersburg, Maryland, 20899-8320; http://kinetics.nist.gov/
Reaction Design. Reaction Workbench 15131. San Diego, 2013; http://reactiondesign.com/products/chemkin/ chemkin-2/
Копылов С.Н. Новые классы эффективных гомогенных ингибиторов газофазного горения и развитие научных основ их использования. Дис. … д-ра технических наук. М.: ВНИИПО, 2001.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика